Method Article
Im lebenden Organismus Bildgebung von mit Leishmania infantum infizierten Hamstern durch gingivale Inokulation von axenischen Amastigoten, die Luciferase exprimieren
In diesem Artikel
Zusammenfassung
In dieser Arbeit präsentieren wir eine longitudinale Auswertung von Goldhamstern, die intraperitoneal (IP) oder intragingival (IG) mit L. infantum-Luc infiziert wurden, mittels biolumineszierender Bildgebung und mittels PCR. Hamster wurden 1 Tag nach der Infektion (1 dpi), 1 Woche nach der Infektion (8 dpi) und 3 Wochen nach der Infektion (22 dpi) untersucht und bei der 50. dpi und 8 Monate nach der Infektion euthanasiert.
Zusammenfassung
Die amerikanische tegumentäre Leishmaniose (ATL) und die viszerale Leishmaniose (VL) werden von der Weltgesundheitsorganisation als vernachlässigt angesehen. VL kann tödlich sein, wenn es nicht behandelt wird; Die zur Behandlung verwendeten Medikamente sind giftig, und es gibt Fälle von Resistenzen. Präklinische Tests können je nach Tiermodell, verwendetem Stamm und Inokulumweg einen Engpass bei der Entdeckung neuer Medikamente für die Behandlung darstellen. Der Goldhamster zeichnet sich durch seine hohe Anfälligkeit für die Untergattungen Viannia und Leishmania aus und zeigt viele der klinischen und immunpathologischen Prozesse, die bei menschlichen Krankheiten beobachtet werden.
Aufgrund der Hamsteranatomie, die einen kurzen Schwanz und kurze Gliedmaßen hat, ist der intrakardiale Weg in der Regel die Wahl für die intravenöse Injektion von Leishmanien. Es handelt sich jedoch um ein Inokulum, das zu Blutungen und schließlich zum Tod von Tieren führen kann. Daher haben wir einen alternativen intravenösen Impfweg für die Infektion an der Zahnfleischvene standardisiert, der minimalinvasiv ist, einen einfachen venösen Zugang ermöglicht und nur wenige lokale und systemische Verletzungen des Tieres verursacht. Daher wurden Hamster, die intraperitoneal (IP) oder intragingival (IG) mit Leishmania Infantum infiziert waren, die Luciferase (Luc) exprimierten, 22 Tage lang mit dem Biolumineszenz-Bildgebungssystem und 50 Tage und 8 Monate nach der Infektion mittels PCR nachbeobachtet.
Nach gingivaler Inokulation sowohl von axenischen Amastigoten als auch von Promastigoten von L. infantum-Luc war die Biolumineszenz an der Injektionsstelle für mindestens 2 Wochen eingeschränkt, was ein Indikator für eine Infektion im Gewebe um den Zahnfleischplexus ist. Hamster, die intraperitoneal mit L. infantum-Luc infiziert waren, zeigten erwartungsgemäß eine über den gesamten Abdomen verteilte Biolumineszenz. Durch das Biolumineszenz-Bildgebungssystem ging die Infektion jedoch bis zum 50. dpi zurück und war nur noch mittels PCR nachweisbar. Axenische Amastigoten zeigten eine bessere Infektion als Promastigoten, wie mittels PCR festgestellt wurde. Tatsächlich wurden 8 Monate nach der Infektion Parasiten mittels PCR in der Leber von Tieren nachgewiesen, die intravenös mit axenischen Amastigoten geimpft worden waren, was ein Merkmal für den Referenzstamm von L. infantum MHOM/BR/1974/PP75 sein kann, dessen Infektion langsam fortschreitet und eine geringe Parasitenlast unterhalb der biolumineszenten Bildgebungsauflösung aufweist. Daher können axenische Amastigoten eine bessere Wahl für die Infektion und Nachsorge sein als Promastigoten, und das gingivale Inokulum ist ein praktikabler Weg für die intravenöse Injektion von Leishmanien und anderen Krankheitserregern.
Einleitung
Die Leishmaniose gilt als vernachlässigte und wieder auftretende Krankheiten, die durch mehr als 20 Leishmanienarten verursacht werden, die in mehreren Ländern in den vier zentralen ökoepidemiologischen Regionen Lateinamerika, Nord- und Ostafrika sowie West- und Südostasien endemisch sind1. Sie können als tegumentäre (TL) und viszerale Leishmaniose (VL) gruppiert werden, die tödlich verläuft, wenn sie nicht behandelt wird. Der ätiologische Erreger von VL in Brasilien ist Leishmania infantum, und die Behandlung wird mit pentavalenten Antimonialen oder Amphotericin B durchgeführt. Diese Arzneimittel werden intravenös verabreicht, haben eine hohe Toxizität, zeigen Nebenwirkungen und es gibt Fälle von Resistenz2.
Daher ist es notwendig, in die Suche nach neuen Chemotherapien zu investieren. Präklinische Tests sind in der Tat ein Engpass bei der Entdeckung neuer Medikamente für die VL-Behandlung, abhängig vom Tiermodell, dem verwendeten Stamm, dem Inokulumweg und anderen logistischen, technischen und betrieblichen Faktoren. Der Goldhamster zeichnet sich durch seine hohe Anfälligkeit für Arten der Untergattungen Viannia und Leishmania aus und zeigt viele der klinischen und immunpathologischen Prozesse, die bei der menschlichen Krankheit beobachtet wurden, wie sie in früheren Studien mit Leishmania braziliensisbeobachtet wurden 3,4. Der mit L. infantum infizierte Hamster entwickelt auch die meisten immunpathologischen Prozesse, die für VL bei Menschen und Hunden charakteristisch sind5, wie Anämie, Leukopenie, Thrombozytopenie und Hepatosplenomegalie. Darüber hinaus ist der Goldhamster ein ausgezüchtetes Tier und zeigt keine einheitliche Reaktion, was die Heterogenität der klinischen Manifestationen reproduziert, wie sie beim Menschen beobachtet wird3.
Ein weiterer Aspekt, der für den Infektionsverlauf zu berücksichtigen ist, ist der Stamm von L. infantum und der Weg der Inokulation. Mehrere Stämme von L. infantum unterscheiden sich im genetischen Hintergrund und in der Anfälligkeit für die Behandlung 2,6,7. Einige Stämme weisen nach einer Promastigoteninfektion eine geringe parasitäre Belastung in Leber und Milz auf8, und axenische Amastigoten können eine Alternative zur Verbesserung der Infektion sein, die noch nicht viel erforscht ist. In der Tat begünstigt der intravenöse Weg die Infektion und erhöht die Häufigkeit von Tieren mit klinischen Symptomen; Die intraperitoneale Inokulation wird jedoch am häufigsten verwendet. Der intrakardiale Weg ist die Wahl für eine intravenöse Infektion mit L. infantum 5,8,9. Bei Hamstern ist die intragingivale Inokulation jedoch ein alternativer Weg zur intravenösen Injektion, der nicht als Infektionsort beschrieben wird. Trotz der Berichterstattung ist die gingivale Venenpunktion minimalinvasiv, ermöglicht einen einfachen venösen Zugang und verursacht nur wenige lokale und systemische Verletzungen10. Die Zahnfleischvenenpunktion stimmt am ehesten mit den Empfehlungen überein, die Qualität und Anwendbarkeit der Ergebnisse bei gleichzeitiger Erhaltung des Wohlbefindens der Tiere zu maximieren11.
Die präklinische Bewertung von Verbindungen für VL mit herkömmlichen Methoden erfordert mehr Tiere, die für die histopathologische Analyse und die Beurteilung der Parasitenlast im Gewebe euthanasiert werden müssen. Im Gegensatz dazu kann das biolumineszierende Bildgebungssystem präklinische Studien beschleunigen und die Anzahl der Tiere reduzieren. Die biolumineszierenden Stellen in den infizierten Geweben können mehrere Wochen lang in Echtzeit am selben Tier nachverfolgt werden. Mehrere Studien zur Standardisierung dieses wichtigen technologischen Werkzeugs haben seine Anwendung in Studien mit Mäusen gezeigt, die mit Trypanosoma cruzi, Leishmania spp. und Toxoplasma gondii infiziert waren 12,13,14,15. Abhängig von der Parasitenbelastung im Gewebe kann die Biolumineszenz jedoch durch das in vivo Bildgebungssystem unterdetektiert werden, was eine quantitative PCR der betroffenen Organe erfordert. Daher schlagen wir vor, eine Methodik zu entwickeln, die auf der intravenösen Injektion von L. infantum, die Luciferase exprimiert, in die Zahnfleischvene von Goldhamstern für die Nachsorge durch das biolumineszierende Bildgebungssystem und die PCR basiert.
Protokoll
Die Protokolle mit Hamstern folgten den Richtlinien der Ethikkommission des Instituto Oswaldo Cruz/IOC (Zulassung: CEUA/IOC L-015/2022).
1. Klonierung des Firefly-Luciferase-Gens in das Leishmania-Expressionsplasmid
- Das Plasmid pLEXSY-hyg2 wird mit BglII (10 U/μL) und NotI (10 U/μL) Endonukompaktase verdaut. Zuerst mit BglII verdauen: 50 μl Plasmid (9 μg DNA), 30 μl Restriktionsenzympuffer, 3 μl Rinderserumalbumin (BSA), 3 μl BglII und nukleasefreies Wasser bis zu einem Endvolumen von 300 μl hinzufügen. 3 h bei 37 °C inkubieren.
- Das TOPOII/LUC-Plasmid wird mit BamHI (10 U/μL) und NotI verdaut, um den offenen Leserahmen der Glühwürmchen-Luciferase mit der Kozak-Sequenz (Kozak-LUC) freizusetzen, der im TOPOII-Vektor16 kloniert wurde. Zuerst mit BamHI verdauen: 100 μl Plasmid (8,5 μg DNA) mit 30 μl Restriktionsenzympuffer mischen; 3 μl BSA, 3 μl BamHI und nukleasefreies Wasser auf 300 μl Endvolumen. 3 h bei 37 °C inkubieren.
- Reinigen Sie jedes Plasmid auf einer Siliziumdioxidmembran und eluieren Sie die DNA zweimal mit 50 μl Wasser, um ein Endvolumen von 100 μl zu erhalten.
- Die zuvor linearisierten pLEXSY-hyg2- und TOPOII/LUC-Plasmide werden mit NotI doppelt verdaut. Mischen Sie 100 μl der von der Kieselmembran eluierten DNA mit 15 μl Puffer D, 2 μl NotI und nukleasefreiem Wasser mit 150 μl Endvolumen. 1 h bei 37 °C inkubieren.
- Gel reinigen Sie den doppelt verdauten Vektor (pLEXSY-hyg2) und das Insert, Kozak-LUC, aus einem 1%igen Agarosegel nach Elektrophorese mit Trisacetat-EDTA (TAE)-Puffer. Schneiden Sie die Banden von ~8 kb und 1,6 kb mit einem Skalpell heraus. Wiegen Sie die Scheiben, fügen Sie drei Volumen Puffer zu 1 Volumen Gel hinzu, inkubieren Sie bei 50 °C, um das Gel aufzulösen, übertragen Sie es auf die Kieselmembran und waschen und eluieren Sie die DNA zweimal mit 20 μl Wasser, mit einem Endvolumen von 40 μl.
- Ligieren Sie den doppelt verdauten Vektor (pLEXSY-hyg2) und das Insert, Kozak-LUC, mit der T4-Ligase: Mischen Sie 2 μL Vektor und Insert, beide bei 55 ng/μL, molares Verhältnis von 1:5; fügen Sie 5 μl Ligationspuffer hinzu; 1 μl T4-DNA-Ligase (1U/ml), Endvolumen von 10 μl. Über Nacht bei 16 °C inkubieren.
- Fügen Sie 40 μl nukleasefreies Wasser zu den 10 μl der Ligationsreaktion hinzu und fällen Sie die DNA mit 10 Volumen Butanol aus. Zentrifugieren Sie 10 Minuten lang bei Höchstgeschwindigkeit in einer Mikrozentrifuge, waschen Sie das Pellet mit 70 % Ethanol, zentrifugieren Sie 10 Minuten lang bei Höchstgeschwindigkeit, lassen Sie das Pellet auf der Bank trocknen und fügen Sie 4 μl Wasser hinzu.
- Mischen Sie 4 μl der Ligationsreaktion mit den elektrokompetenten Bakterien JM109 (40 μL), geben Sie die Mischung in eine Küvette (d = 0,2 cm) und stellen Sie sie auf Eis. Elektroporieren Sie bei 2.500 V, 200 Ω, 25 μF, legen Sie die Küvette in Eis und fügen Sie 1 ml LB-Medium hinzu. Die Mischung wird sofort in ein konisches 15-ml-Röhrchen umgefüllt und bei 37 °C für 60 min und 100 U/min inkubiert.
- Die Mischung auf zwei LB-Agar/Ampicillin-Platten (100 μg/ml) auffüllen: eine mit 200 μl und eine mit den gesamten elektroporierten Bakterien. Konzentrieren Sie das Volumen, indem Sie transformierte Bakterien 10 Minuten lang bei 2.000 × g zentrifugieren, das Pellet in 100 μl resuspendieren und das gesamte Volumen/Pellet plattieren. Inkubieren Sie die Platten 24-30 Stunden bei 30 °C und warten Sie, bis die Klone herangewachsen sind.
- Wählen Sie Klone mit einem Zahnstocher aus und geben Sie sie in konische 50-ml-Röhrchen mit 5 mL LB/Ampicillin-Medium (100 μg/ml). 20-24 Stunden bei 30 °C und 100 U/min inkubieren, damit die Miniprep-Kulturen wachsen können.
- Reinigen Sie das Plasmid mit dem miniprep-Kit und eluieren Sie die DNA mit 30 μl Wasser. Screening-Klone, die das Konstrukt pLESXY-LUC-hyg2 enthalten, durch Verdau mit BamHI.
- Mischen Sie 10 μl DNA aus Miniprep; 2 μl Restriktionsenzympuffer; 0,2 μl BSA: 1 μl BamHI und nukleasefreies Wasser auf 20 μl Endvolumen. Inkubieren Sie 1 h bei 37 °C erwarteter Fragmente positiver Klone in 1 % Agarose-Gelelektrophorese: 3.450 und 6.290 Basenpaare.
- Bereiten Sie eine Maxiprep-Kultur vor, um das Konstrukt pLESXY-LUC-hyg2 in größerem Maßstab aufzureinigen. Fügen Sie einen Erlenmeyer (1 L), 250 mL LB-Medium, ergänzt mit Ampicillin, und 1 mL des transfizierten Miniprep JM109 hinzu und inkubieren Sie es für 18-20 h bei 30 °C und 200 U/min.
2. Herstellung und Selektion von Leishmania infantum , die Luciferase exprimiert
- Um die Leishmania-Integrationskassette freizugeben, wird das Plasmid pLESXY-LUC-hyg2 mit SwaI vollständig verdaut. Geben Sie 40 μl Plasmid (50 μg), 10 μl Schnellverdau-Puffer, 4 μl SwaI und nukleasefreies Wasser in das 100 μl Endvolumen. Über Nacht bei 30 °C inkubieren.
- Mit Ethanol ausfällen, einmal mit 70 % Ethanol waschen, mit 50 μl Wasser resuspendieren und auf Eis halten.
- Zentrifugieren Sie Leishmania MHOM/BR/1974/PP75 Promastigoten bei 1.000 × g für 10 min in der exponentiellen Wachstumsphase in Schneider's Medium. Waschen Sie das Pellet mit Gehirn- und Herzinfusionsmedium (BHI) und zentrifugieren Sie es 10 Minuten lang bei 1.000 × g . Das Pellet wird auf 108 Promastigoten/ml in BHI resuspendiert.
- Mischen Sie die Promastigoten von L. infantum (500 μL) mit pLESXY-LUC-hyg2-Integrationskassette (50 μg) in der Elektroporationsküvette (d = 0,4 cm) auf Eis. Elektroporat mit zwei Impulsen von 1.500 V/25 Mikro F und 10 s Intervallen. Nach dem Puls 10 min auf Eis halten.
- Die transfizierten Promastigoten werden in einen Kolben mit Schneider-Medium, das mit 20 % FCS bei 26 °C versetzt ist, überführt. Nach 24 h Hygromycin zuerst 50 μg/ml hinzufügen, dann nach 48 h auf 100 μg/ml und nach 1 Woche auf 150 μg/ml erhöhen.
- Klonierte transfizierte Promastigoten von L. infantum-Luc durch Begrenzung der Verdünnung in einer 96-Well-Platte mit Schneider-Platte, die mit 20 % FCS und 150 μg/ml Hygromycin ergänzt wurde. Inkubieren Sie bei 26 °C für das Klonwachstum.
- Rasterklone zur Selektion genetisch homogener und hochexprimativer L. infantum-Luc mittels biolumineszierender emissionsrelativer Lumineszenzeinheit (RLU) im Mikroplatten-Reader.
- Mischen Sie kurz gesagt 106 Promastigoten in einer weißen 96-Well-Platte mit den 100 μl Substrat D-Luciferin (300 μg/ml) in einem Puffer, der aus 25 mM HEPES pH 7,8, 15 mM MgCl2, 4 mM EGTA, 1 mM DTT, 1 μg/mL BSA, 2,5 mM ATP, 0,1 % Triton X-100 und 300 μM Coenzym A besteht und sofort im Mikroplatten-Reader ausgewertet wird.
3. PCR zur Bewertung der genomischen Integration in den ribosomalen Locus der 18S rRNA (ssu)
- Reinigung der genomischen DNA von Promastigoten, die Luciferase und Wildtyp exprimieren (10,8). Promastigoten mit 1.000 × g für 10 min in konischen 15-ml-Röhrchen zentrifugieren, phosphatgepufferte Kochsalzlösung (PBS) zum Pellet hinzufügen, mit einer Neubauer-Kammer zählen und 10 min lang bei 1.000 ×g zentrifugieren. Resuspendieren Sie das Pellet mit Lysepuffer: 100 mM NaCl, 10 mM Tris, 25 mM EDTA, 0,5 % SDS und 0,1 mg/ml Proteinase K auf eine Dichte von 108/ml. Über Nacht bei 56 °C inkubieren.
- Führen Sie zwei Zyklen der DNA-Reinigung mit einem Volumen Phenol/Chloroform/Isoamylalkohol, 25:24:1 (v/v) und mit einem Volumen Chloroform durch. Zwischen jedem Extraktionszyklus die wässrige Phase in neue Röhrchen überführen und 10 Minuten lang bei 2.000 × g zentrifugieren.
- Die DNA mit zwei Volumina Ethanol ausfällen und bei 5.000 × g, 10 min, 4 °C zentrifugieren. 1 ml 70%iges Ethanol hinzufügen, in ein Mikroröhrchen umfüllen und 5 Minuten lang bei 15.000 × g zentrifugieren.
- Führen Sie eine zweite Wäsche mit 70 % Ethanol durch. Entsorgen Sie nach dem Zentrifugieren den Überstand und trocknen Sie das Pellet auf der Bank.
- Rehydrieren Sie die genomische DNA mit 50-100 μl Reinstwasser in einem Wasserbad bei 65 °C für 30 Minuten, quantifizieren Sie die DNA und lagern Sie sie bei -20 °C.
- Führen Sie eine diagnostische PCR durch, um die Integration der pLEXSY-Kassette in das Leishmania-Genom zu bewerten, indem Sie die folgende PCR-Reaktion einrichten: 10 μl PCR-Puffer, 0,2 mM dNTP, 1 μg DNA-Polymerase, 1 μg genomische DNA, 0,5 μM jedes Primers und nukleasefreies Wasser auf 50 μl Endvolumen.
- Wählen Sie Primer aus, die im pLEXSY-Vektor und im Leishmania-Genom hybridisieren: (1) aprt reverse primer A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', hybridisiert in der utr1 (aprt) Region; und (2) ssu forward primer F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3' im Leishmania chromosomalen 18SrRNA (ssu) Locus.
- Verwenden Sie das folgende Amplifikationsprotokoll: Ein Denaturierungszyklus bei 94 °C für 2 Minuten; 30 Amplifikationszyklen, 30 s bei 94 °C, 30 s bei 60 °C, 1 min bei 72 °C; Endverlängerung von 10 min bei 72 °C. Die erwartete Größe des PCR-Produkts beträgt 1,1 Kb.
- Verwenden Sie einen zweiten Satz Primer: (1) den Hyg-Forward-Primer A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3 und (2) den ssu-Reverse-Primer F3002 5'-CTGCAGGTTCACCTACAGCTAC-3', die im Resistenzmarker des pLEXSY-Vektors und des 18SrRNA (ssu)-Locus des Leishmania-Genoms hybridisieren. Verwenden Sie das gleiche PCR-Protokoll, das in Schritt 3.6.2 beschrieben wurde, mit Ausnahme der Glühtemperatur von 53 °C anstelle von 60 °C. Das erwartete Produkt ist 1.8 kb (hyg - 3'ssu).
- Analysieren Sie die PCR-Produkte mittels 1%iger Agarose-Gelelektrophorese, um zu überprüfen, ob eine Integration in den ribosomalen 18S rRNA-Locus des L. infantum-Genoms stattgefunden hat.
4. Differenzierung von L. infantum-Luc metacyclischer Promastigote und axenischer Amastigote
- Kultivieren Sie L. infantum-LucMHOM/BR/1974/PP75, konstitutiv exprimierende Luciferase, in BHI-Medium, ergänzt mit 25 mg/l Hämin und 20 % fötalem Kälberserum (FCS).
HINWEIS: Hygromycin wurde aus dem Medium stabiler Transfektantien entfernt. - Um metazyklische Promastigoten von L. infantum-Luc zu erhalten, säen Sie 10 Promastigoten6/ml in 75 cm2 Kolben, fügen Sie 20 ml BHI-Medium, ergänzt mit 20 % FCS, bei 26 °C hinzu und halten Sie es 4 Tage lang in horizontaler Position oder leicht geneigt bis zur stationären Wachstumsphase. Nach 6-8 aufeinanderfolgenden Tagen enthält der Kolben vermehrt metazyklische Promastigoten; Zentrifugieren Sie die Promastigoten bei 1.000 × g für 10 min bei 4 °C.
- Das Pellet der Promastigoten mit 20 ml DMEM niedriger Glukose resuspendieren, mit der Neubauer-Kammer zählen und bei 1.000 × g für 10 min bei 4 °C zentrifugieren.
- Geben Sie DMEM Low Glucose in das Pellet mit einer Dichte von 3-5 × 107 Promastigoten/ml. Gießen Sie 5 mL Promastigoten auf ein 10 mL Ficoll-Kissen, verdünnt in DMEM, 2:1 (v/v). Zentrifugieren Sie das Gefälle bei 100 × g für 15 min bei 4 °C, bei ausgeschalteter Bremse und langsamer Beschleunigung.
- Sammeln Sie metazyklische Promastigoten an der Grenzfläche, auf der Oberseite des Ficoll-Kissens, zählen Sie mit der Neubauer-Kammer und zentrifugieren Sie 10 Minuten lang bei 4 °C bei 1.000 × g. Waschen Sie das Pellet mit PBS, um eventuelle Ficoll-Reste zu entfernen, zählen Sie mit der Neubauer-Kammer und zentrifugieren Sie 10 Minuten lang bei 4 °C bei 1.000 × g.
- Suspendieren Sie das Pellet in PBS wieder auf 2 × 109/ml. Halten Sie Promastigoten vor der Inokulation auf Eis.
- Diferentiate Promastigoten von L. infantum-Luc zu axenischen Amastigoten in vitro, in modifiziertem Medium für axenisch gezüchtete Amastigoten (MAA)17.
- Bereiten Sie MAA vor, indem Sie 9,55 g/l Medium 199 mit Early-Salzen und Glutamin, 0,5 % Trypto-Kasein, 3 mM L-Cystein, 15 mM D-Glucose, 4 mM NaHCO3, 0,33 mM Na2HPO4, 25 mM HEPES auf einen endgültigen pH-Wert von 6,5 hinzufügen und mit 20 % fötalem Kälberserum (FCS) ergänzen.
- Beginnen Sie die Kulturen in mittelgroßen Kolben (75 cm2) mit 9 mL Medium MAA und 1 mL Promastigoten in der stationären Wachstumsphase (7. Tag), 2-3 × 107 Promastigoten/ml. 24-48 h bei 32 °C inkubieren, um eine Amastigotendifferenzierung zu ermöglichen.
- Halten Sie axenisch gewachsene Amastigoten zwei bis drei Passagen pro Woche, bis sie eine Dichte von 2-3 × 107/ml erreichen.
- Skalieren Sie die axenische Amastigotes-Kultur für Hamsterinfektionen. Bereiten Sie 150 cm2 Kolben mit einer hohen Dichte an Amastigoten (5 × 106/ml) in 20 ml MAA-Medium zu, ergänzt mit 20 % FCS.
- Nach 24 h bei 1.000 × g für 10 min bei 4 °C zentrifugieren, mit dem gleichen Volumen PBS waschen, mit der Neubauer-Kammer zählen und bei 1.000 × g für 10 min bei 4 °C zentrifugieren. PBS hinzufügen, um das Inokulum von 108 Amastigoten in 50 μl herzustellen.
5. Tiere
- Beschaffen Sie männliche Goldhamster im Alter von 4-6 Wochen und halten Sie sie 2 Wochen in Quarantäne. Stellen Sie sicher, dass sie 6–8 Wochen alt sind und 80-100 g wiegen, wenn sie mit L. infantum MHOM/BR/1974/PP75 infiziert sind.
HINWEIS: Dieses Protokoll gilt sowohl für männliche als auch für weibliche Hamster. Aufgrund ihrer damaligen Verfügbarkeit wurden in dieser Studie jedoch nur männliche Hamster verwendet. - Teilen Sie die Hamster in vier Gruppen ein: Gruppe 1, intraperitoneal mit Amastigot infiziert (n = 3); Gruppe 2, intraperitoneal mit Promastigoten infiziert (n = 3); Gruppe 3, infiziert in der Zahnfleischvene mit Amastigote (n = 2); Gruppe 4, infiziert in der Zahnfleischvene mit Promastigote (n = 2); Gruppe 5, nicht infizierte Hamster als Kontrolle (n = 2).
- Halten Sie die Tiere in belüfteten Racks, die mit einem kontrollierten Belüftungssystem (10-15 Luftwechsel/h), 12 h Hell-Dunkel-Zyklus, bei 21 ± 2 °C und 40-60 % Luftfeuchtigkeit ausgestattet sind. Bieten Sie eine Bereicherung der Umwelt, wie z. B. Papier, Heu, hydrophobe Baumwolle, Papprollen, autoklaviertes Wasser und Lebensmittel ad libitum.
6. Infektion über den intraperitonealen Weg
- Halten Sie den Hamster physisch auf dem Gitter des Käfigs fest, indem Sie Daumen und Zeigefinger als Pinzette verwenden, um die Haut auf dem Rücken von den Seiten in der Nähe des Kopfes zu kneifen, und die anderen Finger ziehen die Haut entlang des Rückens und versuchen, so viel Haut wie möglich zu bekommen.
- Richten Sie die Inokulumstelle im unteren rechten Quadranten des Bauches an den hinteren Muskeln des Oberschenkels aus.
- Impfen Sie mit einem um 45° geneigten Tierkörper, dem Kopf tiefer als der Bauch und der Nadel in einem Winkel von 15° bis 20°.
- Axenische Amastigoten oder Promastigoten, 50 μl (108) in PBS, mit einer 13 x 0,45 mm Nadel impfen, die an eine 1 ml-Spritze gekoppelt ist. 0,5 cm über die Fase hinaus einsetzen. Nachdem Sie die Nadel in den Bauch eingeführt haben, ziehen Sie am Kolben, um zu bestätigen, dass sie nicht in die Vene eingeführt wurde, und injizieren Sie die Flüssigkeit vorsichtig.
7. Intravenöse Infektion durch gingivale Inokulation
- Halten Sie den Hamster fest, indem Sie Abschnitt 6 befolgen. Intraperitoneal wird ein Gemisch aus 200 mg/kg 10 % Ketaminhydrochlorid und 10 mg/kg 2 % Xylazinhydrochlorid mit einem Endvolumen von 1,3 ml in einer 3 ml-Spritze verabreicht, die mit einer 13 x 0,45 mm Nadel gekoppelt ist.
- Kneifen Sie die Pfote zusammen, indem Sie die Interdigitalbasis des Kissens festklemmen, um sicherzustellen, dass das Tier betäubt wird.
- Halten Sie den betäubten Hamster mit beiden Händen in Rückenlage fest und ziehen Sie die Unterlippe vorsichtig mit den Daumen nach unten, um das Zahnfleisch und die Zahnfleischvene freizulegen
- Positionieren Sie eine dünnere Nadel (8 x 0,30 mm), die mit einer 1-ml-Spritze gekoppelt ist, unterhalb der unteren Schneidezähne entlang der Mittellinie zwischen dem Zahnpaar in einem Winkel von 25º und führen Sie 2-4 mm in die Labialvene des Unterkiefers ein.
- Um zu bestätigen, dass das Inokulum intravenös verabreicht wurde und dass die Nadel in die Labialvene des Unterkiefers eingeführt wurde, aspirieren Sie Blut bis zum Zylinder der Nadel (gelber Teil).
- Injizieren Sie das Inokulum von 50 μl (10,8) Amastigoten oder Promastigoten in PBS langsam und vorsichtig über einen Zeitraum von 1 Minute, bis das gesamte Volumen geimpft wurde, um das Austreten des Inokulums und des Blutes aus der Vene in die äußere Umgebung zu vermeiden und die Dispersion im Blutkreislauf zu ermöglichen.
- Üben Sie vor dem Entfernen der Nadel leichten Druck mit einem Wattestäbchen aus. Entfernen Sie gleichzeitig die Nadel aus dem Gefäß, indem Sie das Wattestäbchen aufbewahren, um die Blutstillung an der Stelle zu fördern, und 1 Minute lang leichten Druck ausüben, um Blutungen und Verlust des Inokulums zu vermeiden
8. Euthanasie durch Herzpunktion, Ausblutung
- Halten Sie das Tier fest, um es zu betäuben, wie in Abschnitt 7 beschrieben. Führen Sie eine Herzpunktion mit einer 20 x 0,55 mm großen Nadel durch, die mit einer 5-ml-Spritze gekoppelt ist, die in einem Winkel von 45º und leicht nach links geneigt direkt unter dem xiphoiden Knorpel eingeführt wird.
- Entnehmen Sie 1 ml Blut. Entfernen Sie nach der Blutentnahme im Endstadium die Spritze, aber lassen Sie die Nadel im Herzen.
- Wenn das Tier bereits atmet und einen Herzschlag zeigt, ist Thiopentalnatrium 5 % (200 mg/kg) mit einer 5-ml-Spritze zu verabreichen und mit der 20 x 0,55 mm Nadel zu koppeln, die sich bereits im Herzen befindet.
- Überprüfen Sie nach 5 Minuten mit einem Stethoskop, ob Atembewegungen und Herzschlag vorhanden sind.
9. DNA-Extraktion aus Organen und Geweben
- Nach der Euthanasie entnehmen Sie die Milz, die mesenterialen Lymphknoten und Fragmente der Leber.
- Schneiden Sie das Taschentuch, indem Sie es auf Trockeneis einfrieren, auftauen und mit zwei Skalpellklingen schneiden. 20 mg zerkleinertes Gewebe in 600 μl Lysepuffer mit 17,5 μl Proteinase K (20 mg/ml) verdauen und über Nacht bei 55 °C inkubieren.
- Zentrifugieren Sie 4 Minuten lang bei 15.000 × g , um Fragmente von Geweben zu entfernen, die nicht lysiert sind.
- 200 μl Proteinfällungslösung zugeben, 20 s kräftig mischen, 5 min auf Eis inkubieren und 4 min bei 15.000 × g zentrifugieren.
- Den Überstand in ein anderes Röhrchen umfüllen, 600 μl Isopropanol hinzufügen und vorsichtig mischen, bis die DNA ausfällt. Zentrifugieren Sie die DNA 2 Minuten lang bei 15.000 × g und waschen Sie das Pellet 30 Minuten lang mit 70 % Ethanol in einem Kippschüttler und einer Zentrifuge.
- Entsorgen Sie das Ethanol und trocknen Sie das Pellet bei Raumtemperatur. Rehydrieren Sie die DNA mit 50-200 μl Reinstwasser bei 65 °C für 30 min, quantifizieren und verdünnen Sie die DNA auf 0,1 μg/mL und lagern Sie sie bei -20 °C.
10. Bewertung von Infektionen in Geweben und Organen mittels PCR
- Bewerten Sie die Parasitenlast in der genomischen DNA von Geweben und Organen mittels konventioneller PCR: 2,5 μl PCR-Puffer, 1,5 mM MgSO4, 0,2 mM dNTP, 1 U DNA-Polymerase, 300 ng genomische DNA, 0,2 μM jedes Primers und nukleasefreies Wasser auf ein Endvolumen von 25 μl.
- Amplifikation nach dem Protokoll von L. infantum kDNA18: Ein Denaturierungszyklus bei 94 °C für 2 Minuten; 39 Amplifikationszyklen, 30 s bei 94 °C, 15 s bei 60 °C, 30 s bei 72 °C, Endverlängerung von 5 min bei 72 °C. Die erwartete Größe des PCR-Produkts beträgt 145 bp. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Amplifizieren Sie Hamster GAPDH, die endogene Kontrolle der PCR3: Ein Denaturierungszyklus bei 94 °C für 2 min, 39 Amplifikationszyklen, 30 s bei 94 °C, 15 s bei 58 °C, 30 s bei 72 °C, abschließende Verlängerung von 5 min bei 72 °C. (1) Fw GAPDH Hamster 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH Hamster 5'- TTCACCTGTTCCACAGCCTTG -3'.
- Analysieren Sie die PCR-Produkte mit 1% Agarose-Gelelektrophorese.
11. Hamster-Nachsorge durch in vivo Biolumineszenz-Bildgebung
- Bewerten Sie das Fortschreiten der Infektion im Laufe der Zeit anhand der Biolumineszenzemission des gesamten Tieres im Biolumineszenz-in-vivo-Bildgebungssystem, das aus einer gekühlten ladungsgekoppelten Kamera (CCD) besteht, die auf einer lichtdichten Kammer montiert ist. Halten Sie das Tier während der Bildaufnahme mit einem Nasenkonus betäubt.
- Vor dem Erwerb der Biolumineszenz und 5 Minuten vor der Einleitung der Anästhesie ist D-Luciferin (150 mg/kg) intraperitoneal in Hamster zu injizieren, indem Sie Abschnitt 6 befolgen. Bereiten Sie eine 15 mg/ml D-Luciferin-Kaliumsalz-Stammlösung in PBS vor, sterilisieren Sie sie und lagern Sie sie bei -80 °C.
- Fünf Minuten nach der Injektion von D-Luciferin betäuben Sie die Tiere mit 2% Isofluran in einer sauerstoffreichen Induktionskammer. Nach weiteren 5 Minuten nehmen Sie Biolumineszenzbilder mit der CCD-Kamera auf. Erhalten Sie Bilder von Hamstern in Bauchlage 2 h und 24 h nach der Infektion, 8 und 22 Tage nach der Infektion (dpi).
HINWEIS: Halten Sie die Anästhesie während des Bildgebungsprozesses mit dem Isofluoran-Sauerstoff-Verabreichungsgerät aufrecht. - Basierend auf dem Grad der Biolumineszenzemission sind folgende Parameter zu verwenden: Belichtungszeit zwischen 30 s und 5 min, Binning mittel oder groß, Blende 1 und Sichtfeld D (12,5 cm).
12. Quantifizierung der Biolumineszenz bei Tieren, die mit L. infantum-Luc infiziert sind
- Verwenden Sie das manuelle Messwerkzeug, um die interessierenden Bereiche (ROI), die Größe und die Fläche im Kopf und Körper des Tieres zu identifizieren. Quantifizieren Sie die von der CCD-Kamera erfasste Biolumineszenz im ausgewählten ROI.
- Messen Sie das Hintergrundsignal mit dem durchschnittlichen Hintergrund-ROI und subtrahieren Sie die erhaltene Biolumineszenz-Emission von der manuellen ROI.
- Drückt die Biolumineszenzemission in der Strahldichte aus, einer Einheit, die durch Zeit und Fläche normiert ist: photons.sec-1.cm-2.sr-1
Ergebnisse
Stabile Expression von Luciferase in L. infantum
Genetisch verändertes L. infantum wurde unter Verwendung des Plasmids der pLEXSY-Linie hergestellt, das sich im ribosomalen Locus der 18S rRNA (ssu) in das Genom von Leishmania integriert, dessen Transkription durch RNA-Polymerase I gesteuert wird. Daher wurden L. infantum-Luc-Klone auf Plasmidintegration in das Genom von Leishmania und auf stabile Expression durch Biolumineszenzemission in vitro untersucht. Der hochexprimierende Klon, der eine Biolumineszenz >120-fach über dem Hintergrund aufweist, wurde für die Bewertung der genomischen Integration mittels PCR ausgewählt. Siehe Abbildung 1 für die Agarose-Gelelektrophorese von PCR-Produkten zur Bewertung der Plasmidintegration in das Genom und der Biolumineszenz-Emission (RLU) von Promastigoten des L. infantum-Luc-Klons. Aus jeder PCR wurden Fragmente der erwarteten Größe erhalten; Ein Produkt von etwa 1,1 kB (5'ssu - UTR1) und ein weiteres von 1,8 kB (Hyg- 3'ssu) wurden aus dem Genom von L. infantum-Luc amplifiziert (Abbildung 1A), was die Integration der Plasmidkassette und des Luciferase-Gens in den SSU-Locus des Genoms von L. infantum bestätigt.
Die Luciferase-Expression von Glühwürmchen wurde auch bei Promastigoten von L. infantum-Luc durch Biolumineszenz-Emission (RLU) im Mikroplatten-Reader untersucht, wie in den Protokollen, Abschnitt 2 beschrieben. Selbst nach mehreren Passagen in Kultur und bei BALB/c-Mäusen für 5 Tage behielt es das Niveau der Biolumineszenz bei; 569,3 ± 19,5 für den Wildtyp-Hintergrund und 59361,9 ± 2673,3 (n = 2) für klonierten L. infantum-Luc (Abbildung 1B). So wurde der L. infantum-Luc-Klon, der stabil Glühwürmchen-Luziferase exprimiert, verwendet, um Hamster über intragingivale oder intraperitoneale Wege zu infizieren.
Intravenöses Inokulum in der Zahnfleischvene
Um die Leishmanien in den Blutkreislauf von Hamstern zu impfen, sollte darauf geachtet werden, dass Venenperforationen, Blutungen und Leckagen des Inokulums minimiert werden. Daher muss die Unterlippe sanft nach unten gezogen werden, um die Zahnfleischvene freizulegen (Abbildung 2A); und es muss eine kleinere 30 G-Nadel verwendet werden, um eine übermäßige Perforation der Vene zu vermeiden. Die Nadel muss mit der Blende nach oben positioniert werden, um sie in einem geeigneten Winkel in die Vene einzuführen (Abbildung 2B). Um sicherzustellen, dass die Nadel in das Gefäß - die Labialvene des Unterkiefers - injiziert wurde, muss der Spritzenkolben nach unten gezogen werden, bis Blut in den Nadelzylinder aspiriert wird (Abbildung 2C). Vor der Nadelentfernung muss mit einem Wattestäbchen leichter Druck ausgeübt werden, um die Blutstillung zu fördern (Abbildung 2D).
Längsschnittauswertung mittels Biolumineszenz-Bildgebung
Hamster, die intraperitoneal (IP) oder intragingival (IG) mit L. infantum-Luc infiziert waren, wurden bis zum 50. dpi nachbeobachtet und mittels Biolumineszenzbildgebung bis 22 dpi ausgewertet (Abbildung 3). Die Bilder wurden 2 Stunden nach einer intraperitonealen Infektion mit 108 Parasiten in der Peritonealhöhle aufgenommen; Die Bilder wurden für ein 30 s oder 1 min Expositions-Binning-Medium aufgenommen. Das Biolumineszenzsignal war bei Amastigoten-infizierten Tieren (4,6 × 105 ± 3,7 × 105) im Abdomen >65-fach intensiver als bei Promastigoten-infizierten Tieren (6,8 × 103 ± 3,8 × 103) (Tabelle 1), was zeigt, dass in vitro differenzierte Amastigoten in der stationären Phase biolumineszierender sind als die metazyklischen Promastigoten und im Ficoll-Kissen gereinigt werden.
Einen Tag nach der Infektion (1 dpi) wurden Biolumineszenzbilder für eine 3-minütige Exposition aufgenommen (Abbildung 3). Bei Promastigoten-infizierten Hamstern gab es eine Abnahme des Biolumineszenzsignals in der Bauchregion um 45 % und bei Amastigoten-infizierten Hamstern einen Rückgang um 70 % (Abbildung 3), was darauf hindeutet, dass Amastigoten in größerem Maße abgebaut wurden als metazyklische Promastigoten (Tabelle 1 und Abbildung 4). Eine Woche nach der Infektion (8 dpi) hielten Promastigoten-infizierte Tiere das Biolumineszenzsignal aufrecht (3,3 × 103 ± 5 × 103). Die Biolumineszenz-Emission bei mit Amastigoten infizierten Hamstern sank jedoch um 95 % von 1,3 × 105 ± 1,1 × 105 auf 6,7 × 103 ± 7,5 × 103 (Tabelle 1) und erreichte das gleiche Niveau bei Promastigoten-infizierten Hamstern. Drei Wochen nach der Infektion (22 dpi) wurde ein Biolumineszenzsignal für 5 Minuten Exposition und Binning groß erfasst (Abbildung 3); das Signal war bei Promastigoten und mit Amastigotes infizierten Tieren deutlich geringer (Tabelle 1 und Abbildung 4).
Eine weitere Gruppe von Hamstern wurde über den intragingivalen Weg mit Amastigoten und Promastigoten von L. infantum-Luc infiziert (10,8); Die Biolumineszenzemission wurde im Oberkieferbereich beobachtet (Abbildung 3). Die Nachbeobachtung begann 1 Tag nach der Infektion, und Hamster, die mit Amastigoten infiziert waren, zeigten mehr Biolumineszenzsignal und Strahldichte (7,3 × 103 ± 4,1 × 103) als Promastigoten-infizierte Hamster (1 × 103 ± 5,7 × 102). Eine Woche nach der Infektion (8 dpi) wurde ein Rückgang des Biolumineszenzsignals um 36 % bei mit Promastigoten infizierten Tieren und um 90 % bei den mit Amastigoten infizierten Hamstern beobachtet; Die Strahldichte variierte von 7,3 × 103 ± 4,1 × 103 bis 7,8 × 102 ± 5,6 × 102 (Tabelle 1). Drei Wochen nach der Infektion (22 dpi) wurde auch ein Biolumineszenzsignal für 5 Minuten Exposition und Binning groß erfasst (Abbildung 3). Das Biolumineszenzsignal war für Promastigoten- und Amastigoten-infizierte Tiere im Kopf von Tieren, die an der Gingiva infiziert wurden, ähnlich und gering (Tabelle 1 und Abbildung 4) und es wurde keine Ausbreitung der Infektion in die Bauchregion durch das Biolumineszenzsignal beobachtet.
Bewertung von Infektionen in Geweben und Organen mittels PCR
Wir führten eine konventionelle PCR durch, um Infektionen in bestimmten Organen wie Leber, Milz und Lymphknoten zu untersuchen, die unterhalb der Nachweisgrenze der in vivo-Bildgebung liegen könnten. Die Zielregion der kDNA war spezifischer für die DNA-Amplifikation von L. infantum in infizierten Geweben und Organen, und die PCR für das Enzym GAPDH aus dem Hamster war eine Kontrolle der DNA-Integrität und der PCR-Reaktion. In der Analyse wurden nur die Proben berücksichtigt, die für GAPDH amplifiziert wurden. So zeigten zwei von drei Hamstern, die über den intraperitonealen Weg mit axenischen Amastigoten infiziert wurden, in der PCR eine Infektion in Geweben und Organen; Tier zwei (A2) in der Milz und Tier drei (A3) in der Leber bei 50 dpi (Abbildung 5A). Ein Hamster war intraperitoneal mit axenischen Promastigoten infiziert; Tier drei (A3) (Abbildung 5B) zeigte eine Amplifikation im Lymphknoten. Hamster, die intragingival mit Promastigoten oder axenischen Amastigoten bei 50 dpi geimpft wurden, konnten keine klare Amplifikation aufweisen - nur eine Bande in der Leber von Tier eins (A1), das mit Promastigoten infiziert war (Abbildung 5C). Bemerkenswert ist, dass wir drei Tiere 8 Monate lang gehalten hatten, deren Inokulum auf intragingivalem Weg mit Amastigoten während der Injektion leicht auslief. Zwei von drei Tieren zeigten eine deutliche Infektion in der Leber, die Tiere eins und zwei (Abbildung 5D).
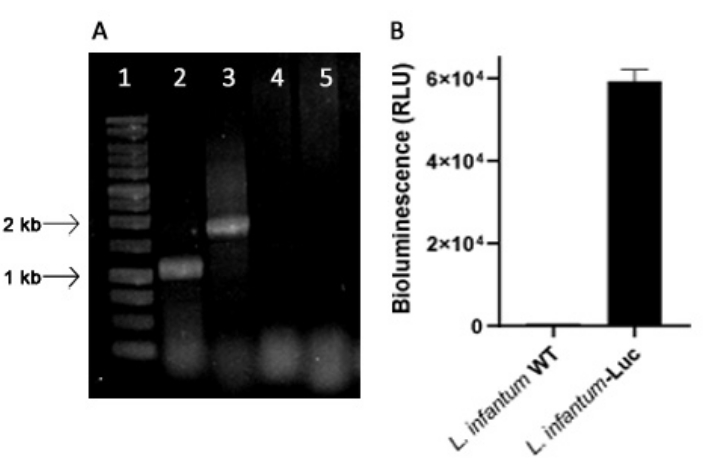
Abbildung 1: Evaluierung des Leishmania infantum-Luc-Klons mittels PCR und Biolumineszenz-Emission. (A) Agarose-Gelelektrophorese von PCR-Produkten zur Bewertung der Plasmidintegration in das Genom: Spur 1 - 1 kb DNA-Leiter; PCR der genomischen DNA von L. infantum-Luc, Spur 2 - 5'ssu - utr1 (1,1 kb) und Spur 3 - hyg- 3'ssu (1,8 kb); PCR der genomischen DNA von L. infantum-wt, Spuren 4 und 5. (B) Biolumineszenz-Emission (RLU) von Promastigoten des L. infantum-Luc-Klons (10,6) im Mikroplatten-Reader. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Intravenöse Injektion von Leishmania infantum-Luc in die Zahnfleischvene. (A) Der Hamster wurde in den dorsalen Dekubitus gelegt und die Unterlippe nach unten gezogen. (B) Eine dünnere Nadel (8 x 0,30 mm), die mit einer 1 ml-Spritze gekoppelt war, wurde unterhalb der unteren Schneidezähne entlang der Mittellinie zwischen dem Zahnpaar in einem Winkel von 25º positioniert und 2-4 mm in die Vena mandibularis labialis eingeführt. (C) Inokulation von 50 μl (10,8) von Amastigoten oder Promastigoten bei PBS. (D) Blutstillung mit einem Wattestäbchen und leichtem Druck auf die Impfstelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
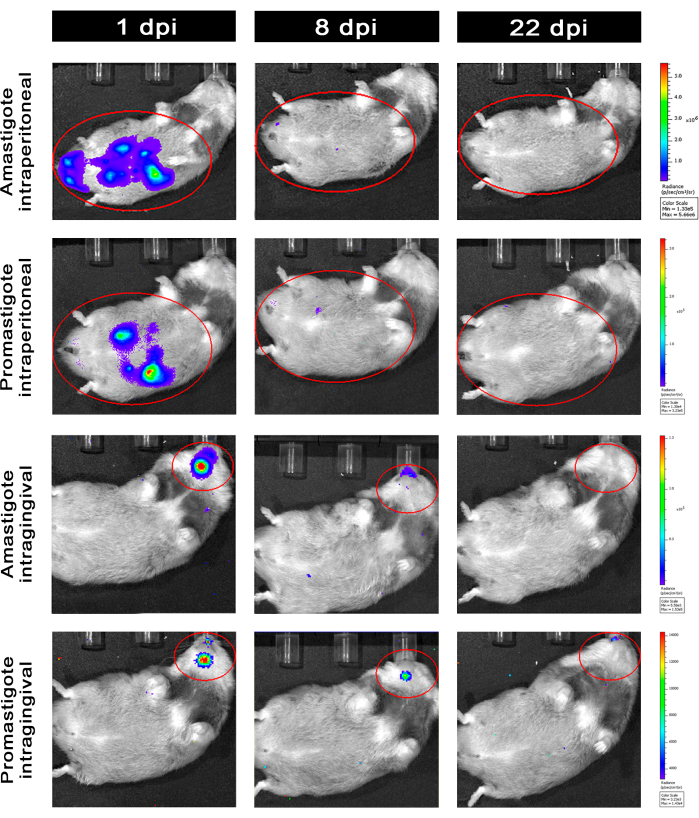
Abbildung 3: Nachsorge durch in vivo Biolumineszenz-Bildgebung. Repräsentative Bilder eines Tieres pro Gruppe: Infiziert über intraperitoneale (obere Felder) oder intragingivale (untere Felder) mit Amastigoten oder Promastigoten von L. infantum-Luc für 1, 8 und 22 dpi. Roter ROI, der die sondierten Regionen am Bauch und am Kopf für eine intraperitoneale bzw. intragingivale Infektion darstellt. Die Daten zeigen, dass alle Tiere bei 1 dpi ein Biolumineszenzsignal im Abdomen oder Unterkiefer zeigten. Das Signal fiel nach 8 dpi ab und war bei 22 dpi in keiner Gruppe mehr nachweisbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
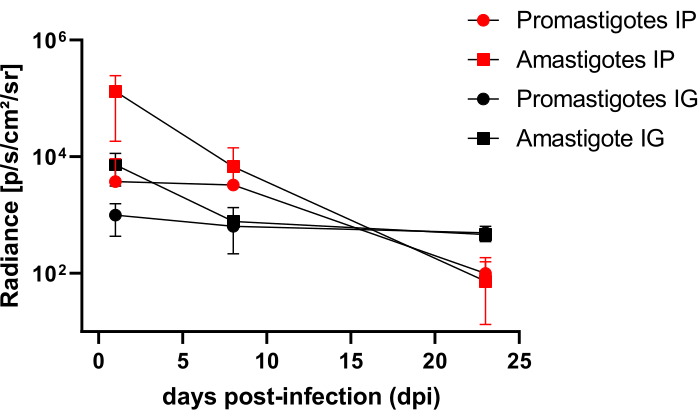
Abbildung 4: Vergleichende Analyse der Strahlung aus Biolumineszenzbildern. Die Quantifizierung der Strahldichte photons.sec-1.cm-2.sr-1 wurde im Bauch oder Kopf von Hamstern mit manuellen ROI-Messwerkzeugen durchgeführt. Der durchschnittliche ROI im Hintergrund wurde vom ROI der Messung abgezogen, um jegliche Fehlsignale zu entfernen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
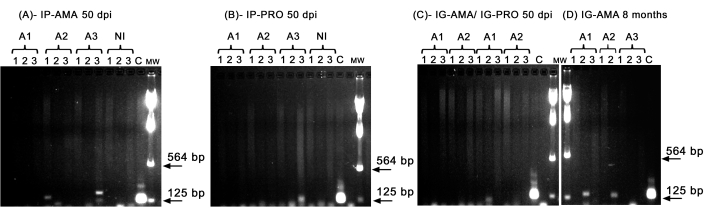
Abbildung 5: PCR-Amplifikation von kDNA. (A) IP-AMA, Hamster, die intraperitoneal mit Amastigot infiziert wurden, 50 dpi (n = 3); (B) IP-PRO, intraperitoneal mit Promastigoten infiziert, 50 dpi (n = 3); (C) IG-AMA, intragingival mit Amastigote infiziert (n = 2), IG-PRO, intragingival mit Promastigot infiziert (n = 2); (D) IG-AMA, intragingival mit Amastigot infiziert, 8 Monate nach der Infektion (n = 3). NI, nicht infizierte Hamster als Negativkontrolle (n = 2); C-genomische DNA von L. infantum-Luc, Positivkontrolle der PCR. Gewebe und Organe: 1- Milz, 2- Leber, 3- Lymphknoten. mw- Molekulargewichtsmarkierung, Pfeile zeigen die unteren Molekulargewichtsbanden an. A1 - Tier eins, A2 - Tier zwei und A3 - Tier drei. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| dpi | Amastigotes IP | Promastigotes IP | Amastigotes IG | Promastigotes IG | ||||||||
| Bedeuten | SD | N | Bedeuten | SD | N | Bedeuten | SD | N | Bedeuten | SD | N | |
| 0 | 4,6 x 105 cm | 3,7 x 105 cm | 3 | 6,8 x 103 cm | 3,8 x 103 cm | 3 | - | - | - | - | - | - |
| 1 | 1,3 x 105 cm | 1,1 x 105 cm | 3 | 3,8 x 103 cm | 5,5 x 103 cm | 3 | 7,3 x 103 cm | 4,1 x 103 cm | 2 | 1,0 x 103 cm | 5,7 x 102 cm | 2 |
| 8 | 6,7 x 103 cm | 7,5 x 103 cm | 3 | 3,3 x 103 cm | 5,0 x 103 cm | 3 | 7,8 x 102 cm | 5,6 x 102 cm | 2 | 6,4 x 102 cm | 8,2 x 101 cm | 2 |
| 22 | 7,3 x 101 cm | 8,5 x 101 cm | 3 | 9,9 x 101 cm | 8,6 x 101 cm | 3 | 4,6 x 102 cm | 7,5 x 101 cm | 2 | 5,0 x 102 cm | 1,5 x 102 cm | 2 |
Tabelle 1: Rohdaten aus der vergleichenden Strahlungsanalyse von Biolumineszenzbildern. Quantifizierung der Strahlung durchschnittlicher Photons.sec-1.cm-2.sr-1 nach Gruppe und Route. Abkürzungen: dpi = Tage nach der Infektion; SD = Standardabweichung; N = Stichprobengröße.
Diskussion
Die Blutentnahme oder intravenöse Injektion von Substanzen in Hamster ist für verschiedene wissenschaftliche Studien notwendig. Es wurden verschiedene Methoden entwickelt, um Zugang zu verschiedenen Entnahme- oder Impfwegen zu erhalten, die in direktem Zusammenhang mit den Forschungszielenstehen 19. Aufgrund der Anatomie des Hamsters - ein kurzer Schwanz und kurze Gliedmaßen - ist der intrakardiale Weg in der Regel die Wahl für die intravenöse Injektion von Leishmanien. Je nach verwendetem Stamm erwies sich der intrakardiale Weg als vorteilhaft, da der Referenzstamm L. infantum MHOM/BR/1974/PP75, dessen Infektion über einen längeren Zeitraum von 6-9 Monaten auftritt5. Es handelt sich jedoch um ein Inokulum, das zu Blutungen und zum Tod des Tieres führen kann. Daher haben wir einen alternativen intravenösen Impfweg für die Infektion am Zahnfleischplexus, der Labialvene unterkiefer, standardisiert, der dem Tier weniger Schaden zufügt. Die Tiere wurden mit dem genetisch veränderten Referenzstamm L. infantum MHOM/BR/1974/PP75 infiziert, der auch nach mehreren Passagen in Kultur und bei Mäusen stabil die Glühwürmchen-Luziferase exprimierte (Abbildung 1), wie dies bei anderen Leishmania-Spezies der Fall ist, die mit demselben integrativen Plasmid transfiziert wurden20.
Die Vena mandibularis labialis oder die Vena gingiva ist ein besserer Weg für die Blutentnahme und für die mehrfache Blutentnahme10,11. Dies ist jedoch der erste Nachweis, dass die Zahnfleischvene eine geeignete Stelle für eine intravenöse Infektion durch Leishmanien bei Hamstern ist. Im Gegensatz zur Blutentnahme, bei der normalerweise eine hohe 26-G-Nadel verwendet wird, um eine Bluthämolyse10 zu vermeiden, war diese Nadelstärke aufgrund von Venenperforation, Blutungen und Leckagen des Inokulums nicht für die Leishmania-Impfung geeignet. Bei einer Leishmaniose-Infektion über die Oberkiefervene war eine kleinere 30G-Nadel unerlässlich. Ein weiterer Aspekt, der die Venenpunktion von einer Infektion über die Zahnfleischvene unterscheidet, ist die Verabreichungsrate von etwa 1 μL/s; und um sicherzustellen, dass es in das Gefäß, die Labialvene des Unterkiefers, injiziert wird und nicht in der Schleimhaut, subkutan oder intradermal, eingelagert wird. Aufgrund des geringen Blutumsatzes des Plexus gingivalis mussten die 50 μl eines Inokulums mit hoher Dichte an axenischen Amastigoten oder Promastigoten von L. infantum-Luc, 2 x 109 Parasiten/ml, langsam (~ 1 min) geimpft und die Nadel entfernt werden, indem der Tupfer 1 min lang gedrückt gehalten wurde, um eine Dispersion des Inokulums im Blutkreislauf zu ermöglichen (Abbildung 2).
Für die longitudinale Bewertung der Infektion wurden Hamster intraperitoneal (IP) oder über den intragingivalen (IG) Weg mit L. infantum-Luc infiziert und mit dem Biolumineszenz-Bildgebungssystem bis zur Euthanasie für 50 dpi nachbeobachtet. In Anbetracht der Tatsache, dass der Referenzstamm PP75 per se weniger virulent sein könnte und dass die Superexpression von Luciferase auch die Wirksamkeit der Infektion beeinträchtigen und die Infektion langfristig aufrechterhalten könnte, wurde ein hohes Inokulum von 108 Parasiten für die Infektion verwendet. Nach gingivaler Inokulation sowohl von Amastigoten als auch von Promastigoten von L. infantum-Luc und Auswertung durch das Biolumineszenz-Bildgebungssystem war die Biolumineszenz 24 h nach der Infektion auf den Oberkieferbereich von Hamstern beschränkt. Tatsächlich zeigten Hamster, die intraperitoneal mit Amastigoten und Promastigoten von L. infantum-Luc infiziert waren, eine Biolumineszenz, die über den gesamten Bauch verteilt war (Abbildung 3, 1 dpi). Die kontinuierliche Abnahme der biolumineszenten Emission über den Zeitraum vom ersten Tag der Infektion bis zum 8. Tag und bis zum 22. dpi bei Hamstern, die mit L. infantum-Luc infiziert waren, war unabhängig vom Inokulationsweg (Tabelle 1 und Abbildung 4).
Wenn die Parasitenlast in den tierischen Geweben jedoch gering ist, kann sie unter der Nachweisgrenze des Biolumineszenz-Bildgebungssystems liegen, aber mittels PCR oder qPCR nachgewiesen und quantifiziert werden. Wie bereits berichtet, ist die durch den Stamm PP75 verursachte Infektion in der Tat geringer als die anderer Stämme5, und nur wenige entwickelten aufgrund der genetischen Variabilität der Tiere klinische Krankheitszeichen. In dieser Studie zeigten die axenischen Amastigoten trotz der geringen Anzahl von Tieren und der geringen Virulenz dieses Stammes einen Vorteil bei 50 dpi und zeigten eine bessere Infektion als Promastigoten, wie die PCR zeigte (Abbildung 5). Acht Monate nach der Infektion mit Amastigoten über den gingivalen Weg konnten Parasiten mittels PCR in der Leber nachgewiesen werden (Abbildung 5) und sie zeigten auch eine mäßige Piloerektion, Orbitaenge und gewölbte Haltung.
Axenische Amastigoten können eine bessere Wahl für die Infektion und Nachsorge sein als Promastigoten21 und haben den Vorteil, dass sie in großem Maßstab leicht zu produzieren sind. Das gingivale Inokulum ist durchführbar und ein besserer Weg für die intravenöse Inokulation von Verbindungen und für die Infektion von Leishmanien und anderen Krankheitserregern, ohne Schädigung oder Schwellung an der Applikationsstelle im Mandibül oder für die Tiergesundheit.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/Decit-MS/CNPq/SES hat diese Forschung finanziell unterstützt. Vielen Dank an Monique Ribeiro de Lima für ihre Ratschläge zu den Impfwegen. Dieses Projekt wurde im Rahmen des Kooperationsabkommens Nr. 258/2017 zwischen FIOCRUZ und der Universidade Federal do Rio de Janeiro - UFRJ entwickelt. Das Team ist den Videoproduzenten Ricardo Baptista Schmidt und Genilton José Vieira vom Science Popularization Center (IOC) herzlich dankbar für ihre unschätzbare Unterstützung und Hilfe beim Filmen der Protokolle und der Durchführung der Interviews.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Referenzen
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten