Method Article
In vivo Imagerie de hamsters infectés par Leishmania infantum par inoculation gingivale d’amastigotes axéniques exprimant la luciférase
Dans cet article
Résumé
Nous présentons ici une évaluation longitudinale de hamsters dorés infectés par voie intrapéritonéale (IP) ou intragingivale (IG) par L. infantum-Luc par imagerie bioluminescente et par PCR. Les hamsters ont été évalués 1 jour après l’infection (1 dpi), 1 semaine après l’infection (8 dpi) et 3 semaines après l’infection (22 dpi) et euthanasiés à la 50e dpi et 8 mois après l’infection.
Résumé
La leishmaniose tégumentaire américaine (ATL) et la leishmaniose viscérale (VL) sont considérées comme négligées par l’Organisation mondiale de la santé. La LV peut être mortelle si elle n’est pas traitée ; Les médicaments utilisés dans le traitement sont toxiques et il existe des cas de résistance. Les tests précliniques peuvent représenter un goulot d’étranglement dans la découverte de nouveaux médicaments pour le traitement, en fonction du modèle animal, de la souche utilisée et de la voie de l’inoculum. Le hamster doré se distingue par sa grande sensibilité aux sous-genres Viannia et Leishmania , présentant de nombreux processus cliniques et immunopathologiques observés dans les maladies humaines.
Selon l’anatomie du hamster, qui a une queue et des membres courts, la voie intracardiaque est généralement le choix pour l’injection intraveineuse de Leishmania. Cependant, il s’agit d’un inoculum qui peut entraîner des saignements et éventuellement la mort de l’animal. Ainsi, nous avons normalisé une voie alternative d’inoculation intraveineuse pour l’infection de la veine gingivale, qui est peu invasive, permet un accès facile aux veines et cause peu de lésions locales et systémiques à l’animal. Par conséquent, les hamsters infectés par la voie intrapéritonéale (IP) ou intragingivale (IG) par Leishmania Infantum exprimant la luciférase (Luc) ont été suivis pendant 22 jours par le système d’imagerie par bioluminescence et 50 jours et 8 mois après l’infection par PCR.
Après l’inoculation gingivale des amastigotes axéniques et des promastigotes de L. infantum-Luc, la bioluminescence a été limitée pendant au moins 2 semaines au site d’injection, ce qui est un indicateur d’infection dans les tissus autour du plexus gingival. Les hamsters infectés par voie intrapéritonéale par L. infantum-Luc ont présenté une bioluminescence dispersée dans tout l’abdomen, comme prévu. Cependant, par le système d’imagerie par bioluminescence, l’infection a diminué jusqu’à 50 dpi et n’était détectable que par PCR. Les amastigotes axéniques ont montré une meilleure infection que les promastigotes, comme évalué par PCR. En effet, 8 mois après l’infection, des parasites ont été détectés par PCR dans le foie d’animaux inoculés avec des amastigotes axéniques par voie intraveineuse, ce qui peut être une caractéristique de la souche de référence de L. infantum MHOM/BR/1974/PP75, dont l’infection progresse lentement et présente une faible charge parasitaire, en dessous de la résolution d’imagerie bioluminescente. Ainsi, les amastigotes axéniques peuvent être un meilleur choix pour l’infection et le suivi que les promastigotes, et l’inoculum gingival est une voie praticable pour l’injection intraveineuse de Leishmania et d’autres agents pathogènes.
Introduction
La leishmaniose est considérée comme une maladie négligée et réémergente causée par plus de 20 espèces de Leishmania, endémique dans plusieurs pays des quatre régions éco-épidémiologiques centrales : Amérique latine, Afrique du Nord et de l’Est, et Asie de l’Ouest et du Sud-Est1. Ils peuvent être regroupés en leishmaniose tégumentaire (TL) et viscérale (VL), qui est mortelle si elle n’est pas traitée. L’agent étiologique de la LV au Brésil est Leishmania infantum, et le traitement est effectué à l’aide d’antimoines pentavalents ou d’amphotéricine B. Ces médicaments sont administrés par voie intraveineuse, ont une toxicité élevée, présentent des effets indésirables et il existe des cas de résistance2.
Ainsi, il est nécessaire d’investir dans la recherche de nouvelles chimiothérapies. Les essais précliniques sont, en fait, un goulot d’étranglement dans la découverte de nouveaux médicaments pour le traitement de la LV, en fonction du modèle animal, de la souche utilisée, de la voie de l’inoculum et d’autres facteurs logistiques, techniques et opérationnels. Le hamster doré se distingue par sa grande sensibilité aux espèces des sous-genres Viannia et Leishmania, présentant de nombreux processus cliniques et immunopathologiques observés dans la maladie humaine, comme observé dans des études antérieures avec Leishmania braziliensis 3,4. Le hamster infecté par L. infantum développe également la plupart des processus immunopathologiques caractéristiques de la LV chez l’homme et le chien5, tels que l’anémie, la leucopénie, la thrombocytopénie et l’hépatosplénomégalie. De plus, le hamster doré est un animal consanguin et ne présente pas une réponse uniforme, reproduisant l’hétérogénéité des manifestations cliniques comme on le voit chez l’homme3.
Un autre aspect à prendre en compte pour l’issue de l’infection est la souche de L. infantum et la voie d’inoculation. Plusieurs souches de L. infantum diffèrent par leur patrimoine génétique et leur sensibilité au traitement 2,6,7. Certaines souches ont une faible charge parasitaire dans le foie et la rate après l’infection par les promastigotes8, et les amastigotes axéniques peuvent être une alternative pour améliorer l’infection qui n’est pas beaucoup explorée. En effet, la voie intraveineuse favorise l’infection et augmente la fréquence des animaux présentant des signes cliniques ; Mais l’inoculation intrapéritonéale est la plus utilisée. La voie intracardiaque est le choix pour l’infection intraveineuse à L. infantum 5,8,9. Cependant, chez les hamsters, l’inoculation intragingivale est une voie alternative pour l’injection intraveineuse, non décrite comme un site d’infection. Bien qu’elle ait été rapportée, la ponction veineuse gingivale est peu invasive, permet un accès veineux facile et cause peu de lésions locales et systémiques10. La ponction de la veine gingivale s’accorde le plus avec les recommandations visant à maximiser la qualité et l’applicabilité des résultats tout en préservant le bien-être de l’animal11.
L’évaluation préclinique des composés pour la LV à l’aide de méthodes traditionnelles nécessite davantage d’animaux, qui doivent être euthanasiés pour l’analyse histopathologique et l’évaluation de la charge parasitaire dans les tissus. En revanche, le système d’imagerie bioluminescente peut accélérer les études précliniques et réduire le nombre d’animaux. Les sites bioluminescents dans les tissus infectés peuvent être suivis en temps réel chez le même animal pendant plusieurs semaines. Plusieurs études sur la standardisation de cet outil technologique crucial ont montré son application dans des études sur des souris infectées par Trypanosoma cruzi, Leishmania spp. et Toxoplasma gondii 12,13,14,15. Cependant, en fonction de la charge parasitaire dans les tissus, la bioluminescence peut être sous-détectée par le système d’imagerie in vivo, ce qui nécessite une évaluation par PCR quantitative des organes affectés. Par conséquent, nous proposons de développer une méthodologie basée sur l’injection intraveineuse de L. infantum exprimant la luciférase dans la veine gingivale de hamsters dorés pour un suivi par le système d’imagerie bioluminescente et la PCR.
Protocole
Les protocoles impliquant des hamsters ont suivi les directives de la Commission d’éthique de la recherche animale de l’Instituto Oswaldo Cruz/IOC (approbation : CEUA/IOC L-015/2022).
1. Clonage du gène de la luciférase Firefly dans le plasmide d’expression de Leishmania
- Digérer le plasmide pLEXSY-hyg2 avec l’endonucléase BglII (10 U/μL) et NotI (10 U/μL). Digestion d’abord avec BglII : ajouter 50 μL de plasmide (9 μg d’ADN), 30 μL de tampon enzymatique de restriction, 3 μL d’albumine sérique bovine (BSA), 3 μL de BglII et de l’eau exempte de nucléases jusqu’à un volume final de 300 μL. Incuber pendant 3 h à 37 °C.
- Digérer le plasmide TOPOII/LUC avec BamHI (10 U/μL) et NotI pour libérer le cadre de lecture ouvert de la luciférase luciole avec la séquence de Kozak (Kozak-LUC), clonée dans le vecteur TOPOII16. Digestion d’abord avec BamHI : mélanger 100 μL de plasmide (8,5 μg d’ADN) avec 30 μL de tampon enzymatique de restriction ; 3 μL de BSA, 3 μL de BamHI et de l’eau sans nucléases jusqu’à 300 μL de volume final. Incuber pendant 3 h à 37 °C.
- Nettoyez chaque plasmide sur une membrane de silice et éluez l’ADN deux fois avec 50 μL d’eau pour un volume final de 100 μL.
- Double digestion des plasmides pLEXSY-hyg2 et TOPOII/LUC précédemment linéarisés avec NotI. Mélangez 100 μL d’ADN élué de la membrane de silice à 15 μL de tampon D, 2 μL de NotI et de l’eau sans nucléase à 150 μL de volume final. Incuber pendant 1 h à 37 °C.
- Le gel purifie le vecteur double digestion (pLEXSY-hyg2) et l’insert, Kozak-LUC, à partir d’un gel d’agarose à 1 % après électrophorèse avec un tampon Tris-acétate EDTA (TAE). Excisez les bandes de ~8 kb et 1,6 kb avec un scalpel. Pesez les tranches, ajoutez trois volumes de tampon à 1 volume de gel, incubez à 50 °C pour dissoudre le gel, transférez-les sur la membrane de silice, puis lavez et éluez l’ADN deux fois avec 20 μL d’eau, avec un volume final de 40 μL.
- Comparez le vecteur double digestion (pLEXSY-hyg2) et l’insert, Kozak-LUC, avec la ligase T4 : mélangez 2 μL de vecteur et d’insert, tous deux à 55 ng/μL, rapport molaire de 1:5 ; ajouter 5 μL de tampon de ligature ; 1 μL d’ADN ligase T4 (1U/mL), volume final de 10 μL. Incuber toute la nuit à 16 °C.
- Ajoutez 40 μL d’eau exempte de nucléases aux 10 μL de réaction de ligature et précipitez l’ADN avec 10 volumes de butanol. Centrifuger à vitesse maximale pendant 10 min dans une microcentrifugeuse, laver la pastille avec de l’éthanol à 70 %, centrifuger à vitesse maximale pendant 10 min, laisser sécher la pastille sur la paillasse et ajouter 4 μL d’eau.
- Mélangez 4 μL de la réaction de ligature avec des bactéries électrocompétentes, JM109 (40 μL), transférez le mélange dans une cuvette (d = 0,2 cm) et conservez-le sur de la glace. Électroporatez à 2 500 V, 200 Ω, 25 μF, mettez la cuvette dans de la glace et ajoutez 1 mL de milieu LB. Transférez immédiatement le mélange dans un tube conique de 15 ml et incubez à 37 °C pendant 60 min et 100 tr/min.
- Déposer le mélange sur deux plaques d’agar-agar/ampicilline LB (100 μg/mL) : l’une avec 200 μL et l’autre avec les bactéries électroporatives entières. Concentrez le volume en centrifugeant les bactéries transformées à 2 000 × g pendant 10 min, remettez le granulé en suspension dans 100 μL et plaquez tout le volume/granulé. Incuber les plaques pendant 24-30 h à 30 °C et attendre que les clones poussent.
- Sélectionnez les clones à l’aide d’un cure-dent et transférez-les dans des tubes coniques de 50 ml contenant 5 ml de milieu LB/ampicilline (100 μg/mL). Incuber pendant 20-24 h à 30 °C et 100 tr/min pour permettre aux cultures miniprep de se développer.
- Purifiez le plasmide avec le kit miniprep et éluez l’ADN avec 30 μL d’eau. Criblage de clones contenant la construction pLESXY-LUC-hyg2 par digestion avec BamHI.
- Mélangez 10 μL d’ADN de miniprep ; 2 μL de tampon d’enzyme de restriction ; 0,2 μL de BSA : 1 μL de BamHI et d’eau sans nucléases jusqu’à 20 μL de volume final. Incuber pendant 1 h à 37 °C de fragments de clones positifs dans une électrophorèse sur gel d’agarose à 1 % : 3 450 et 6 290 paires de bases.
- Préparer une culture maxiprep pour purifier la construction pLESXY-LUC-hyg2 à plus grande échelle. Ajouter un erlenmeyer (1 L), 250 ml de milieu LB complété par de l’ampicilline et 1 ml du miniprep transfected JM109 et incuber pendant 18 à 20 h à 30 °C et 200 tr/min.
2. Production et sélection de Leishmania infantum exprimant la luciférase
- Pour libérer la cassette d’intégration de Leishmania , digérez le plasmide pLESXY-LUC-hyg2 jusqu’à ce qu’il soit complété avec SwaI. Ajoutez 40 μL de plasmide (50 μg), 10 μL de tampon de digestion rapide, 4 μL de SwaI et de l’eau sans nucléases au volume final de 100 μL. Incuber toute la nuit à 30 °C.
- Précipitez avec de l’éthanol, lavez une fois avec de l’éthanol à 70 %, remettez en suspension avec 50 μL d’eau et conservez sur de la glace.
- Centrifugeuse Leishmania MHOM/BR/1974/PP75 promastigotes à 1 000 × g pendant 10 min en phase de croissance exponentielle dans le milieu de Schneider. Lavez la pastille avec un milieu de perfusion de cerveau et de cœur (BHI) et centrifugez-la à 1 000 × g pendant 10 min. Remettre la pastille en suspension à 10à 8 promastigotes/mL dans du BHI.
- Mélanger les promastigotes de L. infantum (500 μL) avec la cassete d’intégration pLESXY-LUC-hyg2 (50 μg) dans la cuvette d’électroporation (d = 0,4 cm), sur de la glace. Électroporate avec deux impulsions de 1 500 V/25 micro F et des intervalles de 10 s. Après l’impulsion, garder sur la glace pendant 10 min.
- Transvaser les promastigotes transfectés dans une fiole avec du milieu de Schneider complété par 20 % de FCS à 26 °C. Après 24 h, ajouter d’abord 50 μg/mL d’hygromycine, puis augmenter à 100 μg/mL après 48 h et à 150 μg/mL après 1 semaine.
- Clonage de promastigotes transfectés de L. infantum-Luc en limitant la dilution dans une plaque de 96 puits avec la maladie de Schneider complétée par 20 % de FCS et 150 μg/mL d’hygromycine. Incuber à 26 °C pour la croissance des clones.
- Des clones d’écran pour sélectionner des L. infantum-Luc génétiquement homogènes et très expressifs par unité de luminescence relative aux émissions bioluminescentes (RLU), dans le lecteur de microplaques.
- Brièvement, mélanger 106 promastigotes dans une plaque blanche à 96 puits avec les 100 μL de substrat D-luciférine (300 μg/mL) dans un tampon composé de 25 mM HEPES pH 7,8, 15 mM MgCl2, 4 mM EGTA, 1 mM DTT, 1 μg/mL BSA, 2,5 mM ATP, 0,1 % Triton X-100 et 300 μM de coenzyme A, immédiatement évalués dans le lecteur de microplaques.
3. PCR pour évaluer l’intégration génomique dans le locus ribosomique de l’ARNr 18S (ssu)
- Purifier l’ADN génomique des promastigotes exprimant la luciférase et le type sauvage (10,8). Centrifugez les promastigotes à 1 000 × g pendant 10 min dans des tubes coniques de 15 ml, ajoutez une solution saline tamponnée au phosphate (PBS) à la pastille, comptez avec une chambre Neubauer et centrifugez à 1 000 ×g pendant 10 min. Remettre la pastille en suspension avec un tampon de lyse : 100 mM de NaCl, 10 mM de Tris, 25 mM d’EDTA, 0,5 % de SDS et 0,1 mg/mL de protéinase K à une densité de 108/mL. Incuber toute la nuit à 56 °C.
- Effectuez deux cycles de nettoyage de l’ADN avec un volume de phénol/chloroforme/alcool isoamylique, 25:24:1 (v/v), et avec un volume de chloroforme. Entre chaque cycle d’extraction, transférer la phase aqueuse dans de nouveaux tubes et centrifuger à 2 000 × g pendant 10 min.
- Précipiter l’ADN avec deux volumes d’éthanol et centrifuger à 5 000 × g, 10 min, 4 °C. Ajouter 1 mL d’éthanol à 70 %, transférer dans un microtube et centrifuger à 15 000 × g pendant 5 min.
- Effectuez un deuxième lavage avec de l’éthanol à 70 %. Après la centrifugation, jetez le surnageant et séchez la pastille sur le banc.
- Réhydratez l’ADN génomique avec 50 à 100 μL d’eau ultrapure dans un bain-marie à 65 °C pendant 30 min, quantifiez l’ADN et stockez-le à -20 °C.
- Réaliser une PCR diagnostique pour évaluer l’intégration de la cassette pLEXSY dans le génome de Leishmania en mettant en place la réaction PCR suivante : 10 μL de tampon PCR, 0,2 mM de dNTP, 1 U d’ADN polymérase, 1 μg d’ADN génomique, 0,5 μM de chaque amorce, et de l’eau sans nucléase jusqu’à 50 μL de volume final.
- Sélectionner des amorces qui s’hybrident dans le vecteur pLEXSY et le génome de Leishmania : (1) amorce inverse aprt A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', hybrider dans la région utr1 (aprt) ; et (2) amorce avant ssu F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3', dans le locus chromosomique 18SrRNA (ssu) de Leishmania.
- Utilisez le protocole d’amplification suivant : Un cycle de dénaturation à 94 °C pendant 2 min ; 30 cycles d’amplification, 30 s à 94 °C, 30 s à 60 °C, 1 min à 72 °C ; extension finale de 10 min à 72 °C. La taille attendue du produit PCR est de 1,1 Ko.
- Utilisez une deuxième série d’amorces : (1) l’amorce directe hyg A3804 5'-CCGATGGCTGTAGAAGTACTCG-3, et (2) l’amorce inverse ssu F3002 5'-CTGCAGGTTCACCTACAGCTAC-3', qui s’hybrident dans le marqueur de résistance du vecteur pLEXSY et le locus 18SrRNA (ssu) du génome de Leishmania . Utilisez le même protocole PCR décrit à l’étape 3.6.2, à l’exception de la température de recuit de 53 °C au lieu de 60 °C. Le produit attendu est de 1,8 kb (hyg - 3'ssu).
- Analyser les produits de PCR par électrophorèse sur gel d’agarose à 1 % pour vérifier s’il y a eu intégration dans le locus ribosomique de l’ARNr 18S du génome de L. infantum .
4. Différenciation du promastigote métacyclique de L. infantum-Luc et de l’amastigote axénique
- Cultiver L. infantum-LucMHOM/BR/1974/PP75, exprimant constitutivement la luciférase, en milieu BHI, complété par 25 mg/L d’hémine et 20 % de sérum de veau fœtal (SCF).
REMARQUE : L’hygromycine a été retirée du milieu des transfectants stables. - Pour obtenir des promastigotes métacycliques de L. infantum-Luc, ensemencer 10 promastigotes de6/mL dans des flaconsde 2 cm de 75 cm, ajouter 20 mL de milieu BHI complété par 20 % de FCS à 26 °C et maintenir en position horizontale pendant 4 jours ou légèrement incliné jusqu’à la phase stationnaire de croissance. Après 6 à 8 jours consécutifs, le ballon contient une augmentation des promastigotes métacycliques ; centrifuger les promastigotes à 1 000 × g pendant 10 min à 4 °C.
- Remettre en suspension la pastille de promastigotes avec 20 ml de DMEM à faible teneur en glucose, compter à l’aide de la chambre Neubauer et centrifuger à 1 000 × g pendant 10 min à 4 °C.
- Ajoutez du DMEM à faible teneur en glucose dans la pastille à une densité de 3 à 5 × de 10 à7 promastigotes/mL. Verser 5 mL de promastigotes sur un coussin de Ficoll de 10 mL, dilué dans du DMEM, 2:1 (v/v). Centrifuger la pente à 100 × g pendant 15 min à 4 °C, avec le frein desserré et l’accélération lente.
- Prélever les promastigotes métacycliques à l’interface, sur le dessus du coussin de Ficoll, compter à l’aide de la chambre de Neubauer et centrifuger à 1 000 × g pendant 10 min à 4 °C. Laver la pastille avec du PBS pour éliminer tout résidu de Ficoll, compter à l’aide de la chambre de Neubauer et centrifuger à 1 000 × g pendant 10 min à 4 °C.
- Remettre la pastille en suspension dans du PBS à 2 × 109/mL. Conservez les promastigotes sur de la glace avant l’inoculation.
- Diférentiés de promastigotes de L. infantum-Luc à des amastigotes axéniques in vitro, en milieu modifié pour des amastigotes cultivés axéniquement (MAA)17.
- Préparez l’AAM en ajoutant 9,55 g/L de milieu 199 avec des sels d’Early et de la glutamine, 0,5 % de tryptocaséine, 3 mM de L-cystéine, 15 mM de D-glucose, 4 mM de NaHCO3, 0,33 mM de Na2HPO4, 25 mM de HEPES à un pH final de 6,5, et complétez avec 20 % de sérum de veau fœtal (SCF).
- Commencer les cultures dans des flacons moyens (75 cm2) avec 9 mL de MAA moyen et 1 mL de promastigotes à la phase stationnaire de croissance (7e jour), 2-3 × 107 promastigotes/mL. Incuber pendant 24-48 h à 32 °C pour permettre la différenciation de l’amastigote.
- Conservez les amastigotes à croissance axémique par deux à trois passages par semaine jusqu’à ce qu’ils atteignent une densité de 2-3 × 107/mL.
- Intensifier la culture d’amastigotes axéniques pour l’infection du hamster. Préparer des flaconsde 2 de 150 cm à haute densité d’amastigotes (5 × 106/mL) dans 20 mL de milieu MAA complété par 20 % de FCS.
- Après 24 h, centrifuger à 1 000 × g pendant 10 min à 4 °C, laver avec le même volume de PBS, compter à l’aide de la chambre Neubauer et centrifuger à 1 000 × g pendant 10 min à 4 °C. Ajouter du PBS pour préparer l’inoculum de 10à 8 amastigotes dans 50 μL.
5. Animaux
- Procurez-vous des hamsters dorés mâles à l’âge de 4 à 6 semaines et gardez-les en quarantaine pendant 2 semaines. Assurez-vous qu’ils ont entre 6 et 8 à 8 semaines et qu’ils pèsent de 80 à 100 g lorsqu’ils sont infectés par L. infantum MHOM/BR/1974/PP75.
REMARQUE : Ce protocole s’applique aux hamsters mâles et femelles. Cependant, en raison de leur disponibilité à l’époque, seuls les hamsters mâles ont été utilisés dans cette étude. - Divisez les hamsters en quatre groupes : groupe 1, infecté par voie intrapéritonéale par l’amastigote (n = 3) ; groupe 2, infecté par voie intrapéritonéale par des promastigotes (n = 3) ; le groupe 3, infecté dans la veine gingivale par l’amastigote (n = 2) ; groupe 4, infecté dans la veine gingivale par le promastigote (n = 2) ; Groupe 5, hamsters non infectés comme témoin (n = 2).
- Garder les animaux dans des étagères ventilées, équipées d’un système de ventilation contrôlé (10-15 renouvellements d’air/h), cycle lumière/obscurité de 12 h, à 21 ± 2 oC et 40-60 % d’humidité. Fournir des enrichissements environnementaux, tels que du papier, du foin, du coton hydrophobe, des rouleaux de carton, de l’eau autoclavée et des aliments à volonté.
6. Infection par voie intrapéritonéale
- Retenez physiquement le hamster sur la grille de la cage, en utilisant le pouce et l’index comme pince à épiler pour pincer la peau du dos sur les côtés près de la tête, et les autres doigts tirent la peau le long du dos, en essayant d’obtenir autant de peau que possible.
- Alignez le site de l’inoculum dans le quadrant inférieur droit de l’abdomen avec les muscles postérieurs de la cuisse.
- Inoculer avec le corps de l’animal incliné à 45º, la tête plus basse que l’abdomen et l’aiguille positionnée à 15° à 20°.
- Inoculer des amastigotes axéniques ou des promastigotes, 50 μL (108) dans du PBS, avec une aiguille de 13 x 0,45 mm couplée à une seringue de 1 mL. Insérez 0,5 cm au-delà du biseau. Après avoir inséré l’aiguille dans l’abdomen, tirez sur le piston pour confirmer qu’il n’a pas été inséré dans la veine et injectez le liquide avec précaution.
7. Infection intraveineuse par inoculation gingivale
- Retenez le hamster en suivant la section 6. Administrer par voie intrapéritonéale un mélange de 200 mg/kg de chlorhydrate de kétamine à 10 % et de 10 mg/kg de chlorhydrate de xylazine à 2 %, volume final de 1,3 mL, dans une seringue de 3 mL couplée à une aiguille de 13 x 0,45 mm.
- Pincez la patte en serrant la base interdigitale du coussin pour vous assurer que l’animal est anesthésié.
- Retenez le hamster anesthésié en position couchée avec les deux mains et tirez doucement la lèvre inférieure vers le bas avec les pouces pour exposer la gencive et la veine gingivale
- Placez une aiguille plus fine (8 x 0,30 mm) couplée à une seringue de 1 ml sous les incisives inférieures le long de la ligne médiane entre la paire de dents à un angle de 25º, et insérez 2 à 4 mm dans la veine labiale mandibulaire.
- Pour confirmer que l’inoculum était intraveineux et que l’aiguille a été insérée dans la veine labiale mandibulaire, aspirez le sang jusqu’au canon de l’aiguille (partie jaune).
- Injecter lentement et soigneusement l’inoculum de 50 μL (10,8) d’amastigotes ou de promastigotes dans du PBS pendant 1 minute jusqu’à ce que tout le volume ait été inoculé pour éviter la fuite de l’inoculum et du sang de la veine vers l’environnement externe et permettre la dispersion dans la circulation sanguine.
- Avant de retirer l’aiguille, appliquez une légère pression à l’aide d’un coton-tige. Simultanément, retirez l’aiguille du vaisseau en gardant le coton-tige pour favoriser l’hémostase sur le site, en appliquant une légère pression pendant 1 minute pour éviter les saignements et la perte de l’inoculum
8. Euthanasie par exsanguination par ponction cardiaque
- Retenir l’animal pour l’anesthésier, comme décrit à l’article 7. Effectuer une ponction cardiaque avec une aiguille de 20 x 0,55 mm couplée à une seringue de 5 ml, insérée à un angle de 45º et légèrement inclinée vers la gauche, juste en dessous du cartilage xiphoïde.
- Prélever 1 mL de sang. Après le prélèvement sanguin terminal, retirez la seringue mais maintenez l’aiguille dans le cœur.
- Si l’animal respire déjà et que son rythme cardiaque bat le cœur, administrez du thiopental sodique à 5 % (200 mg/kg) à l’aide d’une seringue de 5 mL et couplez-le à l’aiguille de 20 x 0,55 mm qui se trouve déjà dans le cœur.
- Après 5 min, à l’aide d’un stéthoscope, vérifiez s’il y a des mouvements respiratoires et des battements cardiaques.
9. Extraction d’ADN à partir d’organes et de tissus
- Après l’euthanasie, prélevez la rate, les ganglions lymphatiques mésentériques et des fragments de foie.
- Coupez les tissus en les congelant sur de la glace sèche, en les décongelant et en les coupant avec deux lames de scalpel. Digérer 20 mg de tissus hachés dans 600 μL de tampon de lyse avec 17,5 μL de protéinase K (20 mg/mL) et incuber à 55 °C pendant la nuit.
- Centrifuger à 15 000 × g pendant 4 min pour éliminer les fragments de tissus qui ne sont pas lysés.
- Ajouter 200 μL de solution de précipitation protéique, mélanger vigoureusement pendant 20 s, incuber pendant 5 min sur de la glace et centrifuger à 15 000 × g pendant 4 min.
- Transférez le surnageant dans un autre tube, ajoutez 600 μL d’isopropanol et mélangez doucement jusqu’à ce que l’ADN soit précipité. Centrifugez l’ADN à 15 000 × g pendant 2 min, et lavez la pastille avec de l’éthanol à 70 % pendant 30 min dans un agitateur basculant et une centrifugeuse.
- Jetez l’éthanol et séchez la pastille à température ambiante. Réhydratez l’ADN avec 50 à 200 μL d’eau ultrapure à 65 °C pendant 30 min, quantifiez et diluez l’ADN à 0,1 μg/mL et stockez-le à -20 °C.
10. Évaluation de l’infection dans les tissus et les organes par PCR
- Évaluer la charge parasitaire dans l’ADN génomique des tissus et des organes par PCR conventionnelle : 2,5 μL de tampon PCR, 1,5 mM de MgSO4, 0,2 mM de dNTP, 1 U d’ADN polymérase, 300 ng d’ADN génomique, 0,2 μM de chaque amorce et de l’eau sans nucléase jusqu’à un volume final de 25 μL.
- Amplifier en utilisant le protocole de L. infantum kDNA 18 : Un cycle de dénaturation à 94 °C pendant 2 min ; 39 cycles d’amplification, 30 s à 94 °C, 15 s à 60 °C, 30 s à 72 °C, extension finale de 5 min à 72 °C. La taille prévue du produit de PCR est de 145 pb. (1) ADNk Fw (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3' ; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Amplification de la GAPDH de hamster, le contrôle endogène de la PCR3 : Un cycle de dénaturation à 94 °C pendant 2 min, 39 cycles d’amplification, 30 s à 94 °C, 15 s à 58 °C, 30 s à 72 °C, extension finale de 5 min à 72 °C. (1) Fw GAPDH hamster 5'- GGTTGCCAAACCTTATCAGAAATG-3' ; (2) Rv GAPDH hamster 5'- TTCACCTGTTCCACAGCCTTG -3'.
- Analyser les produits PCR par électrophorèse sur gel d’agarose à 1 %.
11. Suivi des hamsters par imagerie de bioluminescence in vivo
- Évaluer la progression de l’infection au fil du temps par l’émission de bioluminescence de l’animal entier dans le système d’imagerie in vivo par bioluminescence, qui consiste en une caméra à couplage de charge (CCD) refroidie montée sur une chambre étanche à la lumière. Gardez l’animal anesthésié pendant l’acquisition de l’image avec une livraison de cône nasal.
- Avant l’acquisition de la bioluminescence et 5 min avant d’induire l’anesthésie, injecter de la D-luciférine (150 mg/kg) par voie intrapéritonéale chez les hamsters en suivant la section 6. Préparez une solution mère de sel de potassium de D-luciférine à 15 mg/mL dans du PBS, stérilisez-les par filtre et conservez-les à -80 °C.
- Cinq minutes après avoir injecté de la D-luciférine aux animaux, anesthésiez-les avec de l’isoflurane à 2 % dans une chambre d’induction riche en oxygène. Après 5 minutes supplémentaires, capturez des images de bioluminescence à l’aide de la caméra CCD. Obtenez des images de hamsters en position ventrale 2 h et 24 h après l’infection, 8 et 22 jours après l’infection (dpi).
REMARQUE : Maintenez l’anesthésie pendant le processus d’imagerie avec le dispositif d’administration d’isofluorane-oxygène. - En fonction du niveau d’émission de bioluminescence, utilisez les paramètres suivants : temps d’exposition, allant de 30 s à 5 min, Binning moyen ou grand, f/stop 1 et champ de vision D (12, 5 cm).
12. Quantification de la bioluminescence chez les animaux infectés par L. infantum- Luc
- Utilisez l’outil de mesure manuel pour identifier les régions d’intérêt (ROI), la taille et la surface de la tête et du corps de l’animal. Quantifiez la bioluminescence acquise par la caméra CCD dans le retour d’investissement sélectionné.
- Mesurez le signal de fond avec le retour sur investissement moyen et soustrayez-le de l’émission bioluminescente obtenue à partir du retour sur investissement manuel.
- Exprimer l’émission de bioluminescence en radiance, une unité normalisée par le temps et l’aire : photons.sec-1.cm-2.sr-1
Résultats
Expression stable de la luciférase chez L. infantum
L . infantum génétiquement modifié a été produit à l’aide du plasmide de la lignée pLEXSY, qui s’intègre dans le génome de Leishmania dans le locus ribosomique de l’ARNr 18S (ssu), dont la transcription est pilotée par l’ARN polymérase I. Ainsi, l’intégration plasmidique des clones de L. infantum-Luc ont été évalués pour l’intégration du plasmide dans le génome de Leishmania, et pour l’expression stable par émission de bioluminescence in vitro. Le clone hautement exprimant présentant une bioluminescence >120 fois au-dessus du bruit de fond a été choisi pour l’évaluation de l’intégration génomique par PCR. Voir la figure 1 pour l’électrophorèse sur gel d’agarose des produits de PCR afin d’évaluer l’intégration plasmidique dans le génome et l’émission de bioluminescence (RLU) des promastigotes du clone de L. infantum-Luc. Des fragments de la taille attendue ont été obtenus à partir de chaque PCR ; un produit d’environ 1,1 kB (5'ssu - utr1), et un autre de 1,8 kb (hyg-3'ssu) ont été amplifiés à partir du génome de L. infantum-Luc (Figure 1A), confirmant l’intégration de la cassette plasmidique et du gène de la luciférase dans le locus ssu du génome de L. infantum .
L’expression de la luciférase a également été évaluée chez les promastigotes de L. infantum-Luc par émission de bioluminescence (RLU) dans le lecteur de microplaques, comme décrit dans les protocoles, section 2. Même après plusieurs passages en culture et chez des souris BALB/c pendant 5 jours, il a maintenu le niveau de bioluminescence ; 569.3 ± 19.5 pour le fond de type sauvage, et 59361.9 ± 2673.3 (n = 2) pour L. infantum-Luc cloné (Figure 1B). Ainsi, le clone de L. infantum-Luc, exprimant de manière stable la luciférase de luciole, a été utilisé pour infecter les hamsters par des voies intra-gingivales ou intrapéritonéales.
Inoculum intraveineux dans la veine gingivale
Pour inoculer Leishmania dans la circulation sanguine des hamsters, il faut prendre soin de minimiser la perforation des veines, les saignements et les fuites de l’inoculum. Ainsi, la lèvre inférieure doit être tirée doucement vers le bas pour exposer la veine gingivale (Figure 2A) ; et une aiguille de 30 G de plus petit calibre doit être utilisée pour éviter une perforation excessive de la veine. L’aiguille doit être positionnée avec la lunette vers le haut pour s’insérer dans la veine dans un angle approprié (Figure 2B). En effet, pour s’assurer que l’aiguille a été injectée dans le vaisseau - la veine labiale mandibulaire, le piston de la seringue doit être tiré vers le bas jusqu’à ce que le sang soit aspiré dans le corps de l’aiguille (Figure 2C). Avant de retirer l’aiguille, une légère pression doit être appliquée à l’aide d’un coton-tige pour favoriser l’hémostase (figure 2D).
Évaluation longitudinale par imagerie par bioluminescence
Les hamsters infectés par voie intrapéritonéale (IP) ou intragingivale (IG) avec L. infantum-Luc ont été suivis jusqu’au 50ème dpi et ont été évalués par imagerie de bioluminescence jusqu’à 22 dpi (Figure 3). Les images ont été acquises 2 h après l’infection intrapéritonéale avec 108 parasites dans la cavité péritonéale ; Les images ont été acquises pour un support d’exposition de 30 s ou 1 min. Le signal de bioluminescence était >65 fois plus intense dans l’abdomen chez les animaux infectés par l’amastigote (4,6 × 105 ± 3,7 × 105) que chez les animaux infectés par les promastigotes (6,8 × 103 ± 3,8 × 103) (Tableau 1), ce qui démontre que les amastigotes différenciés in vitro sont plus bioluminescents que les promastigotes métacycliques en phase stationnaire et purifiés dans le coussin de Ficoll.
Un jour après l’infection (1 dpi), des images de bioluminescence ont été acquises pendant 3 min d’exposition (Figure 3). Il y avait une diminution de 45 % du signal de bioluminescence dans la région abdominale chez les hamsters infectés par des promastigotes et une décomposition de 70 % chez les hamsters infectés par des amastigotes (figure 3), ce qui suggère que les amastigotes s’étaient dégradés dans une plus grande mesure que les promastigotes métacycliques (tableau 1 et figure 4). Une semaine après l’infection (8 dpi), les animaux infectés par le promastigote ont subi le signal de bioluminescence (3,3 × 103 ± 5 × 103). Cependant, l’émission de bioluminescence chez les hamsters infectés par l’amastiote a chuté de 95 %, passant de 1,3 ×10 5 ± 1,1 × 105 à 6,7 × 103 ± 7,5 × 103 (tableau 1) et a atteint le même niveau que les hamsters infectés par des promastigote. Trois semaines après l’infection (22 dpi), un signal de bioluminescence a été acquis pendant 5 min d’exposition et de binning large (Figure 3) ; le signal était beaucoup plus faible pour les promastigotes et les animaux infectés par des amastigotes (tableau 1 et figure 4).
Un autre groupe de hamsters a été infecté par voie intragingivale par des amastigotes et des promastigotes de L. infantum-Luc (10,8) ; une émission de bioluminescence a été observée dans la région maxillaire (Figure 3). Le suivi a commencé 1 jour après l’infection, et les hamsters infectés par l’amastigote ont montré plus de signal de bioluminescence et de radiance (7,3 × 103 ± 4,1 × 103) que les hamsters infectés par des promastigotes (1 × 103 ± 5,7 × 102). Une semaine après l’infection (8 dpi), une baisse de 36 % du signal de bioluminescence a été observée chez les animaux infectés par des promastigotes et de 90 % chez les hamsters infectés par des amastigotes ; la luminance variait de 7,3 × 103 ± 4,1 × 103 à 7,8 × 102 ± 5,6 × 102 (tableau 1). Trois semaines après l’infection (22 dpi), un signal de bioluminescence a également été acquis pour 5 min d’exposition et de binning large (Figure 3). Le signal de bioluminescence était similaire et faible pour les animaux infectés par le promastigote et l’amastigote (tableau 1 et figure 4) dans la tête des animaux infectés au niveau de la gencive et n’a pas été observé de dispersion de l’infection dans la région abdominale par le signal de bioluminescence.
Évaluation de l’infection des tissus et des organes par PCR
Nous avons effectué une PCR conventionnelle pour étudier l’infection dans des organes spécifiques, tels que le foie, la rate et les ganglions lymphatiques, qui pourraient être inférieurs à la limite de détection de l’imagerie in vivo . La région cible de l’ADNk était plus spécifique pour l’amplification de l’ADN de L. infantum dans les tissus et les organes infectés, et la PCR pour l’enzyme GAPDH du hamster était un contrôle de l’intégrité de l’ADN et de la réaction PCR. Seuls les échantillons qui ont été amplifiés pour la GAPDH ont été pris en compte dans l’analyse. Ainsi, par PCR, deux des trois hamsters infectés par voie intrapéritonéale avec des amastigotes axéniques présentaient une infection dans les tissus et les organes ; l’animal deux (A2) dans la rate et l’animal trois (A3) dans le foie, à 50 dpi (figure 5A). Un hamster a été infecté par voie intrapéritonéale par des promastigotes axéniques ; le troisième animal (A3) (figure 5B) a montré une amplification dans le ganglion lymphatique. Les hamsters inoculés par voie intragingivale avec des promastigotes ou des amastigotes axéniques à 50 dpi n’ont pas pu présenter une amplification claire, juste une bande dans le foie d’un animal (A1) infecté par des promastigotes (Figure 5C). Notamment, nous avons eu trois animaux maintenus pendant 8 mois dont l’inoculum délivré par voie intragingivale avec des amastigotes a légèrement fui lors de l’injection. Deux des trois animaux présentaient une infection claire du foie, les animaux un et deux (figure 5D).
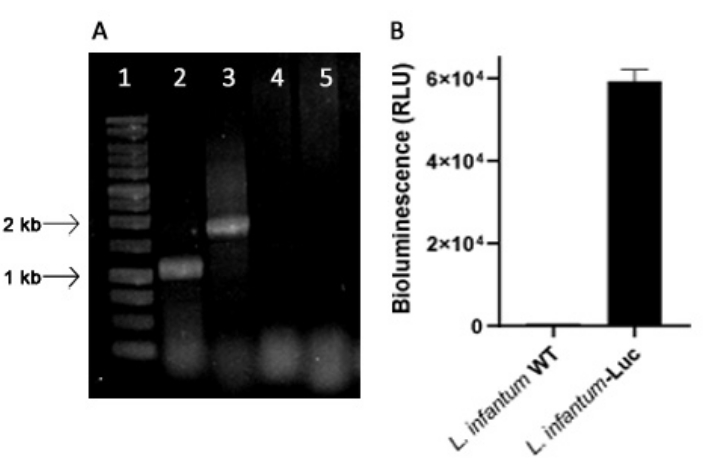
Figure 1 : Évaluation du clone de Leishmania infantum-Luc par PCR et émission de bioluminescence. (A) Électrophorèse sur gel d’agarose des produits PCR pour évaluer l’intégration des plasmides dans le génome : voie 1 - échelle d’ADN de 1 kb ; PCR de l’ADN génomique de L. infantum-Luc, voie 2 - 5'ssu - utr1 (1,1 kb) et voie 3- hyg- 3'ssu (1,8 kb) ; PCR de l’ADN génomique de L. infantum-wt, voies 4 et 5. (B) Émission de bioluminescence (RLU) de promastigotes du clone de L. infantum-Luc (10,6) dans le lecteur de microplaques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Injection intraveineuse de Leishmania infantum-Luc dans la veine gingivale. (A) Le hamster a été placé dans un décubitus dorsal et la lèvre inférieure a été tirée vers le bas. (B) Une aiguille plus fine (8 x 0,30 mm) couplée à une seringue de 1 mL a été placée sous les incisives inférieures le long de la ligne médiane entre la paire de dents à un angle de 25º et insérée de 2 à 4 mm dans la veine mandibulaire labiale. (C) Inoculation de 50 μL (108) d’amastigotes ou de promastigotes dans le PBS. (D) Hémostase à l’aide d’un coton-tige et en appliquant une légère pression sur le site d’inoculation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
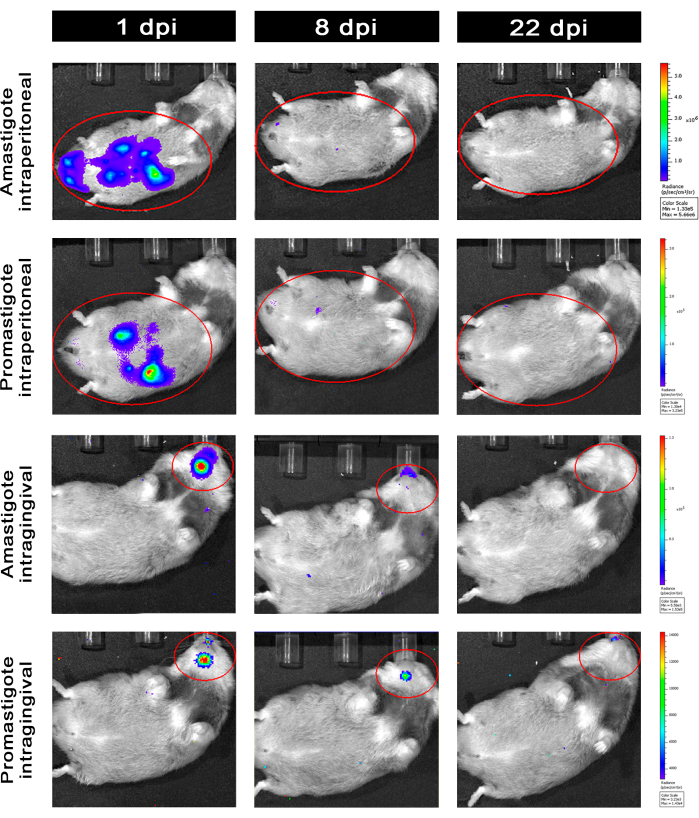
Figure 3 : Suivi par imagerie de bioluminescence in vivo. Images représentatives d’un animal par groupe : Infecté par voie intrapéritonéale (panneaux supérieurs) ou intragingivale (panneaux inférieurs), avec des amastigotes ou des promastigotes de L. infantum-Luc, pour 1, 8 et 22 dpi. ROI rouge représentant les régions sondées au niveau de l’abdomen et de la tête, pour une infection intrapéritonéale ou intragingivale, respectivement. Les données montrent qu’à 1 dpi, tous les animaux présentaient un signal de bioluminescence dans l’abdomen ou la mandibule. Le signal chutait après 8 dpi et était presque indétectable dans n’importe quel groupe à 22 dpi. Veuillez cliquer ici pour voir une version agrandie de cette figure.
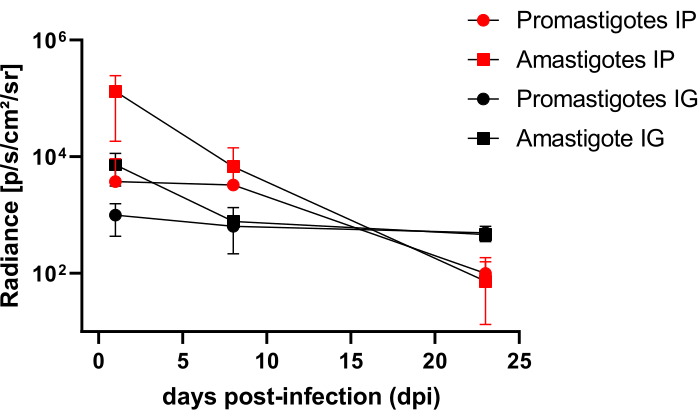
Figure 4 : Analyse comparative de la luminance à partir d’images de bioluminescence. La quantification de la radiance photons.sec-1.cm-2.sr-1 a été réalisée dans l’abdomen ou la tête de hamsters à l’aide d’outils manuels de mesure du retour sur investissement. Le retour sur investissement moyen en arrière-plan a été soustrait du retour sur investissement de la mesure pour supprimer tout signal parasite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
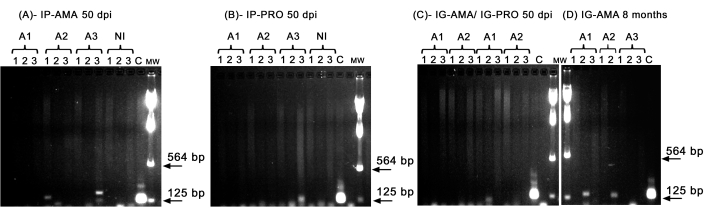
Figure 5 : Amplification de l’ADNk par PCR. (A) IP-AMA, hamsters infectés par voie intrapéritonéale par amastigote, 50 dpi (n = 3) ; (B) IP-PRO, infecté par voie intrapéritonéale par des promastigotes, 50 dpi (n = 3) ; (C) IG-AMA, infecté par voie intragingivale par amastigote (n = 2), IG-PRO, infecté par voie intragingivale par promastigote (n = 2) ; (D) IG-AMA, infecté par voie intragingivale avec de l’amastigote, 8 mois après l’infection (n = 3). NI, hamsters non infectés en tant que témoin négatif (n = 2) ; C- ADN génomique de L. infantum-Luc, contrôle positif de la PCR. Tissus et organes : 1- rate, 2- foie, 3- ganglions lymphatiques. mw- marqueur de poids moléculaire, les flèches indiquent les bandes de poids moléculaire inférieurs. A1 - animal un, A2 - animal deux et A3 - animal trois. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Dpi | Amastigotes IP | Promastigotes IP | Amastigotes IG | Promastigotes IG | ||||||||
| Méchant | SD | N | Méchant | SD | N | Méchant | SD | N | Méchant | SD | N | |
| 0 | 4,6 x 105 | 3,7 x 105 | 3 | 6,8 x 103 | 3,8 x 103 | 3 | - | - | - | - | - | - |
| 1 | 1,3 x 105 | 1,1 x 105 | 3 | 3,8 x 103 | 5,5 x 103 | 3 | 7,3 x 103 | 4,1 x 103 | 2 | 1,0 x 103 | 5,7 x 102 | 2 |
| 8 | 6,7 x 103 | 7,5 x 103 | 3 | 3,3 x 103 | 5,0 x 103 | 3 | 7,8 x 102 | 5,6 x 102 | 2 | 6,4 x 102 | 8,2 x 101 | 2 |
| 22 | 7,3 x 101 | 8,5 x 101 | 3 | 9,9 x 101 | 8,6 x 101 | 3 | 4,6 x 102 | 7,5 x 101 | 2 | 5,0 x 102 | 1,5 x 102 | 2 |
Tableau 1 : Données brutes issues de l’analyse comparative de la radiance des images de bioluminescence. Quantification de la luminance photons moyens.sec-1.cm-2.sr-1 par groupe et par route. Abréviations : dpi = jours après l’infection ; ET = écart-type ; N = taille de l’échantillon.
Discussion
Le prélèvement sanguin ou l’injection intraveineuse de substances chez les hamsters est nécessaire pour diverses études scientifiques. Plusieurs méthodes ont été développées pour accéder à différentes voies de collecte ou d’inoculation directement liées aux objectifs de recherche19. En raison de l’anatomie du hamster - une queue et des membres courts - la voie intracardiaque est généralement le choix pour l’injection intraveineuse de Leishmania. Selon la souche utilisée, la voie intracardiaque s’est avérée avantageuse en tant que souche de référence L. infantum MHOM/BR/1974/PP75, dont l’infection survient à long terme, 6-9 mois5. Cependant, il s’agit d’un inoculum qui peut entraîner une hémorragie et la mort de l’animal. Ainsi, nous avons normalisé une voie alternative d’inoculation intraveineuse pour l’infection du plexus gingival, la veine labiale mandibulaire, qui cause moins de dommages à l’animal. Les animaux ont été infectés par la souche de référence génétiquement modifiée L. infantum MHOM/BR/1974/PP75, qui exprimait de manière stable la luciférase même après plusieurs passages en culture et chez la souris (Figure 1), comme pour d’autres espèces de Leishmania transfectées par le même plasmide intégratif20.
La veine mandibulaire labiale ou veine gingivale est une meilleure voie pour le prélèvement sanguin et pour la collecte de sang multiple 10,11. Cependant, il s’agit de la première démonstration que la veine gingivale est un site praticable pour l’infection intraveineuse par Leishmania chez les hamsters. Contrairement au prélèvement sanguin qui utilise généralement une aiguille de 26 G de haut calibre pour éviter l’hémolyse sanguine10, ce calibre d’aiguille n’était pas approprié pour l’inoculation de Leishmania, en raison de la perforation veineuse, des saignements et de la fuite de l’inoculum. Pour l’infection à Leishmania via la veine mandibulaire maxillaire, une aiguille 30G de plus petit calibre était indispensable. Un autre aspect qui différencie la ponction veineuse de l’infection par la veine gingivale est le taux d’administration, à environ 1 μL/s ; et pour s’assurer qu’il est injecté dans le vaisseau - la veine labiale mandibulaire, et qu’il n’est pas logé dans la muqueuse, sous-cutanée ou intradermique. En raison du faible renouvellement sanguin du plexus gingival, les 50 μL d’un inoculum de haute densité d’amastigotes axéniques ou de promastigotes de L. infantum-Luc, 2 x 109 parasites/mL, ont dû être inoculés lentement (~ 1 min), et l’aiguille a dû être retirée en maintenant l’écouvillon pressé pendant 1 min pour permettre la dispersion de l’inoculum dans la circulation sanguine (Figure 2).
Pour l’évaluation longitudinale de l’infection, les hamsters ont été infectés par voie intrapéritonéale (IP) ou par voie intragingivale (IG) par L. infantum-Luc et ont été suivis pendant 50 dpi par le système d’imagerie par bioluminescence jusqu’à l’euthanasie. Étant donné que la souche de référence PP75 pourrait être moins virulente en soi et que la super-expression de la luciférase pourrait également avoir un impact sur l’efficacité de l’infection et maintenir l’infection à long terme, un inoculum élevé de 10à 8 parasites a été utilisé pour l’infection. Après l’inoculation gingivale des amastigotes et des promastigotes de L. infantum-Luc et l’évaluation par le système d’imagerie par bioluminescence, la bioluminescence a été limitée à la région maxillaire des hamsters 24 h après l’infection. En effet, les hamsters infectés par voie intrapéritonéale par des amastigotes et des promastigotes de L. infantum-Luc présentaient une bioluminescence dispersée dans tout l’abdomen (Figure 3, 1 dpi). La diminution continue de l’émission bioluminescente au cours du temps, du premier jour de l’infection au 8ejour et jusqu’au 22edpi chez les hamsters infectés par L. infantum-Luc, était indépendante de la voie d’inoculation (tableau 1 et figure 4).
Cependant, lorsque la charge parasitaire dans les tissus animaux est faible, elle peut être inférieure à la limite de détection du système d’imagerie par bioluminescence, mais peut être détectée et quantifiée par PCR ou qPCR. Comme nous l’avons déjà signalé, l’infection causée par la souche PP75 est en effet inférieure à celle des autres souches5, et seules quelques-unes ont développé des signes cliniques de la maladie en raison de la variabilité génétique des animaux. Dans cette étude, malgré le petit nombre d’animaux et la faible virulence de cette souche, les amastigotes axéniques ont démontré un avantage à 50 dpi, montrant une meilleure infection que les promastigotes, comme démontré par PCR (Figure 5). Huit mois après l’infection par des amastigotes par la voie gingivale, les parasites ont pu être détectés par PCR dans le foie (Figure 5) et ils ont également présenté une piloérection modérée, une tension orbitaire et une posture arquée.
Les amastigotes axéniques peuvent être un meilleur choix pour l’infection et le suivi que les promastigotes21 et ont l’avantage d’être faciles à produire à grande échelle. L’inoculum gingival est réalisable et constitue une meilleure voie pour l’inoculation intraveineuse de composés et pour l’infection de Leishmania et d’autres agents pathogènes, sans dommage ni gonflement au site d’application dans le mandibule ou à la santé animale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/Decit-MS/CNPq/SES ont apporté un soutien financier à cette recherche. Merci à Monique Ribeiro de Lima pour ses conseils sur les voies d’inoculation. Ce projet a été développé dans le cadre de l’accord de coopération n° 258/2017 entre FIOCRUZ et l’Universidade Federal do Rio de Janeiro - UFRJ. L’équipe est sincèrement reconnaissante envers les producteurs de vidéos Ricardo Baptista Schmidt et Genilton José Vieira du Centre de vulgarisation scientifique (CIO) pour leur soutien et leur aide inestimables dans le tournage des protocoles et la réalisation des interviews.
matériels
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Références
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon