Method Article
В естественных условиях Визуализация хомяков, инфицированных Leishmania infantum, путем инокуляции десны аксенических амастигот, экспрессирующих люциферазу
В этой статье
Резюме
В данной работе мы представляем продольную оценку золотистых хомяков, инфицированных внутрибрюшинным (IP) или внутридесневым (IG) L . infantum-Luc с помощью биолюминесцентной визуализации и ПЦР. Хомяков оценивали через 1 день после заражения (1 dpi), через 1 неделю после заражения (8 dpi) и через 3 недели после заражения (22 dpi) и усыпляли при50-м dpi и через 8 месяцев после заражения.
Аннотация
Всемирная организация здравоохранения считает, что американский тегументарный лейшманиоз (ATL) и висцеральный лейшманиоз (VL) игнорируются. ВЛ может быть смертельной, если ее не лечить; Препараты, используемые при лечении, токсичны, и есть случаи резистентности. Доклинические испытания могут представлять собой узкое место в поиске новых лекарств для лечения, в зависимости от модели животного, используемого штамма и пути введения инокулята. Золотой хомяк выделяется своей высокой восприимчивостью к подродам Viannia и Leishmania , демонстрируя многие клинические и иммунопатологические процессы, наблюдаемые при заболеваниях человека.
По анатомии хомяка, который имеет короткий хвост и конечности, внутрисердечный путь обычно является выбором для внутривенного введения лейшмании. Тем не менее, это инокулюм, который может привести к кровотечению и, в конечном итоге, к смерти животного. Таким образом, мы стандартизировали альтернативный путь внутривенной инокуляции инфекции в десневой вене, который является минимально инвазивным, обеспечивает легкий венозный доступ и вызывает небольшое количество местных и системных травм у животного. Таким образом, хомяки, инфицированные внутрибрюшинным (IP) или интрадесневым (IG) путем заражения Leishmania Infantum , экспрессирующей люциферазу (Luc), наблюдались в течение 22 дней с помощью системы биолюминесцентной визуализации и через 50 дней и 8 месяцев после заражения с помощью ПЦР.
После инокуляции десны как аксенических амастигот, так и промастигот L. infantum-Luc биолюминесценция была ограничена в течение как минимум 2 недель в месте инъекции, что является показателем инфекции в тканях вокруг десневого сплетения. У хомяков, инфицированных внутрибрюшинно L. infantum-Luc, биолюминесценция была рассеяна по всей брюшной полости, как и ожидалось. Однако с помощью системы биолюминесцентной визуализации инфекция снижалась до 50-го dpi и обнаруживалась только с помощью ПЦР. Аксенические амастиготы показали лучшую инфекцию, чем промастиготы, по оценке с помощью ПЦР. Действительно, через 8 месяцев после заражения паразиты были обнаружены методом ПЦР в печени животных, инокулированных аксеническими амастиготами внутривенным путем, что может быть характерно для референсного штамма L. infantum MHOM/BR/1974/PP75, инфекция которого прогрессирует медленно и демонстрирует низкую паразитарную нагрузку, ниже биолюминесцентного разрешения визуализации. Таким образом, аксенические амастиготы могут быть лучшим выбором для инфекции и последующего наблюдения, чем промастиготы, а инокулят десны является возможным путем для внутривенного введения лейшмании и других патогенов.
Введение
Лейшманиоз считается забытым и вновь возникающим заболеванием, вызываемым более чем 20 видами лейшмании, эндемичными в ряде стран четырех центральных экоэпидемиологических регионов: Латинской Америки, Северной и Восточной Африки, а также Западной и Юго-Восточной Азии. Они могут быть сгруппированы как тегументарный (TL) и висцеральный лейшманиоз (VL), который является смертельным, если его не лечить. Этиологическим агентом ВЛ в Бразилии является Leishmania infantum, а лечение проводится с помощью пятивалентных сурьмы или амфотерицина В. Эти препараты вводятся внутривенно, обладают высокой токсичностью, проявляют побочные реакции, имеются случаи резистентности2.
Таким образом, необходимо вкладывать средства в поиск новой химиотерапии. Доклинические испытания, по сути, являются узким местом в открытии новых препаратов для лечения ВЛ, в зависимости от модели животного, используемого штамма, пути инокуляции и других логистических, технических и эксплуатационных факторов. Золотой хомяк выделяется своей высокой восприимчивостью к видам подродов Viannia и Leishmania, демонстрируя многие клинические и иммунопатологические процессы, наблюдаемые при заболевании человека, как это наблюдалось в предыдущих исследованиях с Leishmania braziliensis 3,4. У хомяка, инфицированного L. infantum, развивается также большинство иммунопатологических процессов, характерных для ВЛ у человека и собак5, таких как анемия, лейкопения, тромбоцитопения и гепатоспленомегалия. Кроме того, золотой хомяк является беспородным животным и не проявляет равномерной реакции, воспроизводя гетерогенность клинических проявлений, наблюдаемую у человека3.
Еще одним аспектом, который следует учитывать при определении исхода инфекции, является штамм L. infantum и путь инокуляции. Несколько штаммов L. infantum различаются по генетическому фону и восприимчивости к лечению 2,6,7. Некоторые штаммы имеют низкую паразитарную нагрузку в печени и селезенке после инфекции промастиготами8, и аксенические амастиготы могут быть альтернативой для улучшения инфекции, которая мало изучена. Действительно, внутривенное введение способствует инфицированию и увеличивает частоту появления у животных клинических признаков; Но наиболее часто используется внутрибрюшинная инокуляция. Внутрисердечный путь является выбором при внутривенной инфекции L. infantum 5,8,9. Тем не менее, у хомяков внутридесневые инокуляции являются альтернативным путем внутривенной инъекции, не описываемым как место для инфекции. Несмотря на сообщения, венепункция десен является минимально инвазивной, обеспечивает легкий венозный доступ и вызывает мало местных и системных повреждений10. Пункция десневой вены в наибольшей степени согласуется с рекомендациями по максимальному качеству и применимости результатов при сохранении благополучия животных11.
Доклиническая оценка соединений для ВЛ с использованием традиционных методов требует большего количества животных, которых необходимо усыплять для гистопатологического анализа и оценки паразитарной нагрузки в тканях. В отличие от этого, биолюминесцентная система визуализации может ускорить доклинические исследования и сократить количество животных. Биолюминесцентные участки в инфицированных тканях могут отслеживаться в режиме реального времени на одном и том же животном в течение нескольких недель. Несколько исследований по стандартизации этого важнейшего технологического инструмента показали его применение в исследованиях на мышах, инфицированных Trypanosoma cruzi, Leishmania spp. и Toxoplasma gondii 12,13,14,15. Однако, в зависимости от концентрации паразитов в тканях, биолюминесценция может быть недостаточно обнаружена системой визуализации in vivo, что требует оценки пораженных органов с помощью количественной ПЦР. В связи с этим мы предлагаем разработать методику, основанную на внутривенном введении L. infantum, экспрессирующего люциферазу, в десневую вену золотистых хомяков для последующего наблюдения с помощью биолюминесцентной системы визуализации и ПЦР.
протокол
Протоколы с участием хомяков соответствовали рекомендациям Института Освальдо Круза/Комитета МОК по этике в исследованиях на животных (одобрение: CEUA/IOC L-015/2022).
1. Клонирование гена люциферазы светлячков в экспрессию плазмиды Leishmania
- Расщепляют плазмиду pLEXSY-hyg2 с эндонуклеазой BglII (10 Ед/мкл) и NotI (10 Ед/мкл). Сначала расщепите BglII: добавьте 50 мкл плазмиды (9 г ДНК), 30 мкл буфера фермента рестрикции, 3 мкл бычьего сывороточного альбумина (BSA), 3 мкл BglII и воду, не содержащую нуклеаз, до конечного объема 300 мкл. Выдерживать в течение 3 ч при 37 °C.
- Расщепляйте плазмиду TOPOII/LUC с помощью BamHI (10 Ед/мкл) и NotI для высвобождения открытой рамки считывания люциферазы светлячка с помощью последовательности Козака (Kozak-LUC), клонированной в векторе TOPOII16. Сначала расщепите с помощью BamHI: смешайте 100 мкл плазмиды (8,5 мкг ДНК) с 30 мкл буфера фермента рестрикции; 3 мкл BSA, 3 мкл BamHI и вода без нуклеаз до 300 мкл конечного объема. Выдерживать в течение 3 ч при 37 °C.
- Очистите каждую плазмиду на кварцевой мембране и дважды разбавьте ДНК 50 μл воды, чтобы окончательный объем составил 100 μл.
- Двойное расщепление ранее линеаризованных плазмид pLEXSY-hyg2 и TOPOII/LUC с помощью NotI. Смешайте 100 мкл ДНК, элюированной с диоксидом кремния, с 15 мкл буфера D, 2 мкл NotI и воду без нуклеаз до 150 мкл конечного объема. Выдерживать в течение 1 ч при 37 °C.
- Гель очистите дважды переваренный вектор (pLEXSY-hyg2) и вкладыш Kozak-LUC от 1% агарозного геля после электрофореза с трис-ацетатным буфером ЭДТА (TAE). Вырежьте полосы ~8 кб и 1,6 кб скальпелем. Взвесьте срезы, добавьте три объема буфера к 1 объему геля, инкубируйте при 50 °C для растворения геля, перенесите на кремнеземную мембрану, а затем дважды промойте и элюируйте ДНК 20 μL воды, с конечным объемом 40 μL.
- Лигатировать вектор двойного расщепления (pLEXSY-hyg2) и инсерт Kozak-LUC с лигазой T4: смешать 2 мкл вектора и вставки, оба при концентрации 55 нг/мкл, молярное соотношение 1:5; добавить 5 мкл буфера для лигирования; 1 мкл Т4 ДНК-лигазы (1 ЕД/мл), конечный объем 10 мкл. Инкубировать в течение ночи при температуре 16 °C.
- Добавьте 40 мкл воды, не содержащей нуклеаз, к 10 мкл реакции лигирования и осаждайте ДНК 10 объемами бутанола. Центрифугируйте на максимальной скорости в течение 10 минут в микроцентрифуге, промойте гранулу с 70% этанолом, центрифугируйте на максимальной скорости в течение 10 минут, дайте грануле высохнуть на столе и добавьте 4 μл воды.
- Смешайте 4 мкл реакции лигирования с электрокомпетентными бактериями JM109 (40 мкл), переложите смесь в кювету (d = 0,2 см) и держите на льду. Электропорировать при напряжении 2 500 В, 200 Ω, 25 мкФ, поместить кювету в лед и добавить 1 мл LB среды. Немедленно переложите смесь в коническую пробирку объемом 15 мл и инкубируйте при 37 °C в течение 60 мин и 100 об/мин.
- Нанесите смесь на две пластины LB агар/ампициллин (100 мкг/мл): одну с 200 мкл, а другую с целыми электропорированными бактериями. Сконцентрируйте объем путем центрифугирования трансформированных бактерий при концентрации 2 000 × г в течение 10 минут, повторно суспендируйте гранулу в 100 μл и нанесите на тарелку весь объем/гранулу. Инкубируйте планшеты в течение 24-30 ч при 30 °C и дождитесь роста клонов.
- Выберите клоны с помощью зубочистки и перенесите в конические пробирки объемом 50 мл, содержащие 5 мл среды LB/ампициллин (100 мкг/мл). Инкубируйте в течение 20-24 часов при 30 °C и 100 об/мин, чтобы дать возможность вырасти культурам miniprep.
- Очистите плазмиду с помощью набора miniprep и разбавьте ДНК 30 μл воды. Экранные клоны, содержащие конструкцию pLESXY-LUC-hyg2, путем разложения с помощью BamHI.
- Смешайте 10 μл ДНК из miniprep; 2 мкл буфера фермента рестрикции; 0,2 мкл БСА: 1 мкл BamHI и воды без нуклеаз до 20 мкл конечного объема. Инкубировать в течение 1 ч при 37 °С - ожидаемые фрагменты положительных клонов в 1% электрофорезе в агарозном геле: 3450 и 6290 пар оснований.
- Приготовьте культуру maxiprep для очистки конструкции pLESXY-LUC-hyg2 в более крупном масштабе. Добавьте Эрленмейера (1 л), 250 мл LB среды с добавлением ампициллина и 1 мл miniprep трансфицированного JM109 и инкубируйте в течение 18-20 ч при 30 °C и 200 об/мин.
2. Продукция и селекция Leishmania infantum , экспрессирующей люциферазу
- Чтобы освободить кассету интеграции Leishmania , рестрикцию расщепляют плазмиду pLESXY-LUC-hyg2 до завершения с помощью SwaI. Добавьте 40 мкл плазмиды (50 мкг), 10 мкл быстроусвояемого буфера, 4 мкл SwaI и воду, не содержащую нуклеаз, до конечного объема 100 мкл. Выдерживать в течение ночи при 30 °C.
- Выпасть в осадок с помощью этанола, один раз промыть с 70% этанолом, повторно суспендировать 50 μл воды и держать на льду.
- Центрифуга Leishmania MHOM/BR/1974/PP75 промастиготы при 1000 × г в течение 10 мин в фазе экспоненциального роста в среде Шнайдера. Промойте гранулу средой для инфузии мозга и сердца (BHI) и центрифугируйте при 1000 × г в течение 10 минут. Повторно суспендируйте гранулу до10-8 промастигот/мл в BHI.
- Смешайте промастиготы L. infantum (500 μл) с интеграционной кассетой pLESXY-LUC-hyg2 (50 μг) в электропорационной кювете (d = 0,4 см) на льду. Электропорация с двумя импульсами с интервалом 1 500 В/25 мкФ и 10 с. После пульса держать на льду 10 минут.
- Переложите трансфицированные промастиготы в колбу со средой Шнайдера с добавлением 20% FCS при температуре 26 °C. Через 24 ч добавить гигромицин сначала 50 мкг/мл, затем увеличить до 100 мкг/мл через 48 ч и 150 мкг/мл через 1 неделю.
- Клонировать трансфицированные промастиготы L. infantum-Luc путем ограничения разведения в 96-луночном планшете с добавлением 20% FCS и 150 мкг/мл гигромицина. Инкубировать при температуре 26 °C для выращивания клонов.
- Скрининговые клоны для отбора генетически однородных и высокоэкспрессивных L. infantum-Luc с помощью биолюминесцентного эмиссионного блока люминесценции (RLU) в считывателе микропланшетов.
- Вкратце, смешайте 106 промастиготов в белом 96-луночном планшете со 100 мкл субстрата D-люциферина (300 мкг/мл) в буфере, состоящем из 25 мМ HEPES pH 7,8, 15 мМ MgCl2, 4 мМ EGTA, 1 мМ DTT, 1 мкг/мл BSA, 2,5 мМ АТФ, 0,1% Triton X-100 и 300 мкМ коэнзима А, немедленно оцененных в микропланшетном ридоре.
3. ПЦР для оценки геномной интеграции в рибосомный локус 18S рРНК (ssu)
- Очистка геномной ДНК от промастигот, экспрессирующих люциферазу и дикий тип (10,8). Центрифугируйте промастиготы в дозе 1000 × г в течение 10 мин в конических пробирках объемом 15 мл, добавьте в гранулу фосфатно-солевой буфер (PBS), подсчитайте с помощью камеры Нейбауэра и центрифугируйте при 1000 ×г в течение 10 мин. Повторно суспендируют гранулу с буфером для лизиса: 100 мМ NaCl, 10 мМ Трис, 25 мМ ЭДТА, 0,5% SDS и 0,1 мг/мл протеиназы К до плотности 108/мл. Инкубировать в течение ночи при температуре 56 °C.
- Проведите два цикла очистки ДНК с помощью одного объема фенола/хлороформа/изоамилового спирта, 25:24:1 (v/v), и одного объема хлороформа. Между каждым циклом экстракции переливайте водную фазу в новые пробирки и центрифугируйте при температуре 2 000 × г в течение 10 минут.
- Осадите ДНК двумя объемами этанола и центрифугируйте при 5000 × г, 10 мин, 4 °C. Добавьте 1 мл 70% этанола, переложите в микропробирку и центрифугируйте при 15 000 × г в течение 5 минут.
- Проведите вторую стирку с 70% этанолом. После центрифугирования выбросьте надосадочную жидкость и высушите гранулу на стенде.
- Регидратируйте геномную ДНК 50-100 мкл сверхчистой воды на водяной бане при 65 °C в течение 30 минут, количественно оцените ДНК и храните при -20 °C.
- Проведите диагностическую ПЦР для оценки интеграции кассеты pLEXSY в геном лейшмании путем проведения следующей ПЦР-реакции: 10 мкл ПЦР-буфера, 0,2 мМ дНТФ, 1 ЕД ДНК-полимеразы, 1 мкг геномной ДНК, 0,5 мкМ каждого праймера и безнуклеазная вода до 50 мкл конечного объема.
- Выберите праймеры, которые гибридизуются в векторе pLEXSY и геноме Leishmania: (1) aprt обратный праймер A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', гибридизуются в области utr1 (aprt); и (2) ssu forward primer F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3', в локусе 18SrRNA (ssu) хромосомы Leishmania.
- Используйте следующий протокол амплификации: один цикл денатурации при 94 °C в течение 2 мин; 30 циклов усиления, 30 с при 94 °C, 30 с при 60 °C, 1 мин при 72 °C; окончательное продление на 10 мин при 72 °C. Ожидаемый размер ПЦР-продукта составляет 1,1 Кб.
- Используйте второй набор праймеров: (1) прямой праймер hyg A3804 5'-CCGATGGCTGTAGAAGTACTCG-3 и (2) обратный праймер ssu F3002 5'-CTGCAGGTTCACCTAC-3', которые гибридизуются в маркере резистентности вектора pLEXSY и локусе 18SrRNA (ssu) генома Leishmania . Используйте тот же протокол ПЦР, который описан в шаге 3.6.2, за исключением температуры отжига 53 °C вместо 60 °C. Ожидаемый продукт - 1,8 кб (hyg - 3'ssu).
- Проанализируйте продукты ПЦР с помощью электрофореза в 1% агарозном геле, чтобы проверить, была ли интеграция в рибосомальный локус 18S рРНК генома L. infantum .
4. Дифференцировка метациклических промастиготы и аксенических амастиготов L. infantum-Luc
- Культивируйте L. infantum-LucMHOM/BR/1974/PP75, определяюще экспрессирующий люциферазу, в среде BHI, с добавлением гемина 25 мг/л и 20% эмбриональной телячьей сыворотки (FCS).
Примечание: Гигромицин выводили из среды стабильных трансфектантов. - Для получения метациклических промастигот L. infantum-Luc высейте по 106/мл промастигот в колбы по75 см 2 , добавьте 20 мл среды BHI с добавлением 20% FCS при 26 °С и выдержите в горизонтальном положении 4 дня или слегка наклонив до неподвижной фазы роста. Через 6-8 дней подряд колба содержит повышенное количество метациклических промастигот; центрифугировать промастиготы при 1000 × г в течение 10 мин при 4 °С.
- Повторно суспендируйте гранулу промастигот с 20 мл DMEM с низким содержанием глюкозы, подсчитайте с помощью камеры Нейбауэра и центрифугируйте при 1000 × г в течение 10 минут при 4 °С.
- Добавляйте в гранулу DMEM с низким содержанием глюкозы в концентрации 3-5 × плотности 10-7 промастигот/мл. Налейте 5 мл промастигот на 10 мл подушки Ficoll, разведенные в DMEM, 2:1 (v/v). Центрифугируйте градиент при 100 × g в течение 15 мин при 4 °C, при выключенном тормозе и медленном ускорении.
- Соберите метациклические промастиготы на границе раздела на верхней части подушки Фиколла, подсчитайте с помощью камеры Нейбауэра и центрифугируйте при 1000 × г в течение 10 мин при 4 °С. Промойте гранулу PBS для удаления остатков Фиколла, подсчитайте с помощью камеры Нейбауэра и центрифугируйте при 1000 × г в течение 10 мин при 4 °С.
- Повторно суспендируйте гранулу в PBS до 2 × 109/мл. Перед прививкой держите промастиготы на льду.
- Дифференцировать промастиготы L. infantum-Luc к аксеническим амастиготам in vitro, в модифицированной среде для аксенически выращенных амастиготы (MAA)17.
- Приготовьте МАА, добавив 9,55 г/л среды 199 с солями Эрли и глутамином, 0,5% трипто-казеина, 3 мМ L-цистеина, 15 мМ D-глюкозы, 4 мМ NaHCO3, 0,33 мМ Na2HPO4, 25 мМ HEPES до конечного pH 6,5, и добавьте 20% фетальную сыворотку теленка (FCS).
- Пускают культуры в средние колбы (75 см2) по 9 мл средних МАА и 1 мл промастигот в стационарной фазе роста (7-е сутки), 2-3 × 107 промастигот/мл. Инкубировать в течение 24-48 ч при 32 °C для обеспечения дифференциации амастигота.
- Держите амастиготы, выращенные в аксении, по два-три прохода в неделю до тех пор, пока они не достигнут плотности 2-3 × 107/мл.
- Масштабируйте культуру аксенических амастигот для инфекции хомяка. Приготовьте 150 см2 колбы с высокой плотностью амастигот (5 × 106/мл) в 20 мл среды МАА с добавлением 20% FCS.
- Через 24 ч центрифугируют при 1000 × г в течение 10 мин при 4 °С, промывают тем же объемом PBS, подсчитывают с помощью камеры Нойбауэра и центрифугируют при 1000 × г в течение 10 мин при 4 °С. Добавьте PBS для приготовления инокулята 108 амастиготов в 50 μл.
5. Животные
- Заготавливайте самцов золотистых хомяков в возрасте 4–6 недель и держите их на карантине в течение 2 недель. Убедитесь, что их возраст 6–8 недель и вес которых составляет 80–100 г на момент заражения L. infantum MHOM/BR/1974/PP75.
ПРИМЕЧАНИЕ: Этот протокол относится как к самцам, так и к самкам хомяков. Однако, из-за их доступности в то время, в этом исследовании использовались только самцы хомяков. - Разделите хомяков на четыре группы: группа 1, зараженные внутрибрюшинно амастиготом (n = 3); группа 2, инфицированная внутрибрюшинно промастиготами (n = 3); 3 группа, инфицированная в десневой вене амастиготом (n = 2); 4 группа, инфицированная в десневой вене промастиготой (n = 2); Группа 5, неинфицированные хомяки в качестве контроля (n = 2).
- Животные содержатся в вентилируемых стойлах, оборудованных системой контролируемой вентиляции (10-15 воздухообменов/ч), 12 ч светлый/темный цикл, при 21 ± 2 °C и влажности 40-60%. Обеспечьте обогащение окружающей среды, например, бумагой, сеном, гидрофобным хлопком, картонными рулонами, автоклавной водой и продуктами питания в неограниченном количестве.
6. Заражение внутрибрюшинным путем
- Физически удерживайте хомяка на сетке клетки, используя большой и указательный пальцы в качестве пинцета, чтобы щипать кожу на спине с боков возле головы, а другими пальцами тяните кожу вдоль спины, стараясь получить как можно больше кожи.
- Выровняйте место посева в правом нижнем квадранте брюшной полости с задними мышцами бедра.
- Прививку делают с наклоном тела животного под углом 45°, головой ниже брюшка и иглой под углом от 15° до 20°.
- Инокулировать аксенические амастиготы или промастиготы по 50 мкл (108) в PBS иглой 13 x 0,45 мм, соединенной со шприцем объемом 1 мл. Вставьте на 0,5 см за пределы фаски. После введения иглы в область живота потяните за поршень, чтобы подтвердить, что он не был введен в вену, и осторожно введите жидкость.
7. Внутривенное введение инфекции путем инокуляции десны
- Ограничьте хомяка, следуя разделу 6. Внутрибрюшинно вводят смесь из 200 мг/кг 10% кетамина гидрохлорида и 10 мг/кг 2% ксилазина гидрохлорида, конечный объем 1,3 мл, в шприц объемом 3 мл, соединенный с иглой 13 х 0,45 мм.
- Зажмите лапу, зажав межпальцевое основание подушки, чтобы обеспечить обезболивание животного.
- Удерживайте обезболенного хомяка в лежачем положении обеими руками и осторожно потяните вниз нижнюю губу большими пальцами, чтобы обнажить десну и десневую вену
- Поместите более тонкую иглу (8 x 0,30 мм), соединенную со шприцем объемом 1 мл, ниже нижних резцов по средней линии между парой зубов под углом 25º и введите 2-4 мм в нижнечелюстную лабиальную вену.
- Чтобы подтвердить, что инокулюм был введен внутривенно и что игла была введена в нижнечелюстную лабиальную вену, аспирируйте кровь до ствола иглы (желтая часть).
- Медленно и осторожно вводите инокулюм 50 мкл (10,8) амастиготов или промастигот в PBS в течение 1 мин до тех пор, пока не будет введен весь объем, чтобы избежать утечки инокулюма и крови из вены во внешнюю среду и обеспечить диспергирование в кровотоке.
- Перед извлечением иглы слегка надавите ватным тампоном. Одновременно извлеките иглу из сосуда, удерживая ватный тампон для стимуляции гемостаза в этом месте, слегка надавливая на него в течение 1 минуты, чтобы избежать кровотечения и потери инокулюма
8. Эвтаназия методом обескровливания методом пункции сердца
- Удерживайте животное для обезболивания, как описано в разделе 7. Выполните пункцию сердца иглой 20 x 0,55 мм, соединенной со шприцем объемом 5 мл, введенной под углом 45º и слегка наклоненной влево, чуть ниже мечевидного хряща.
- Извлеките 1 мл крови. После сбора крови в терминале извлеките шприц, но продолжайте удерживать иглу в сердце.
- Если животное уже дышит и у него наблюдается сердцебиение, введите тиопентал натрия 5% (200 мг/кг) с помощью шприца объемом 5 мл и соедините его с иглой 20 x 0,55 мм, которая уже находится в сердце.
- Через 5 минут с помощью стетоскопа проверьте, есть ли какие-либо дыхательные движения и сердцебиение.
9. Экстракция ДНК из органов и тканей
- После эвтаназии соберите селезенку, брыжеечные лимфатические узлы и фрагменты печени.
- Разрежьте ткани, заморозив их на сухом льду, разморозив и разрезав двумя лезвиями скальпеля. Расщепите 20 мг измельченных салфеток в 600 мкл лизисного буфера с 17,5 мкл протеиназы К (20 мг/мл) и инкубируйте при 55 °C в течение ночи.
- Центрифугируйте при 15 000 × г в течение 4 мин для удаления фрагментов тканей, которые не лизируются.
- Добавьте 200 μл раствора для осаждения белка, энергично перемешайте в течение 20 с, инкубируйте в течение 5 минут на льду и центрифугируйте при 15 000 × г в течение 4 минут.
- Перенесите надосадочную жидкость в другую пробирку, добавьте 600 мкл изопропанола и аккуратно перемешайте до осаждения ДНК. Центрифугируйте ДНК при 15 000 × г в течение 2 минут и промойте гранулу с 70% этанолом в течение 30 минут в наклонном вибростенде и центрифуге.
- Выбросьте этанол и высушите гранулы при комнатной температуре. Регидратируйте ДНК 50-200 μл ультрачистой воды при 65 °C в течение 30 минут, количественно определите и разбавьте ДНК до 0,1 μг/мл и храните при -20 °C.
10. Оценка инфекции в тканях и органах методом ПЦР
- Оценивайте паразитарную нагрузку в геномной ДНК тканей и органов методом обычной ПЦР: 2,5 мкл ПЦР-буфера, 1,5 мМ MgSO4, 0,2 мМ дНТФ, 1 Ед ДНК-полимеразы, 300 нг геномной ДНК, 0,2 мкМ каждого праймера и безнуклеазная вода до конечного объема 25 мкл.
- Амплификацию с использованием протокола кДНК L. infantum 18: один цикл денатурации при 94 °C в течение 2 мин; 39 циклов усиления, 30 с при 94 °C, 15 с при 60 °C, 30 с при 72 °C, окончательное продление на 5 мин при 72 °C. Ожидаемый размер продукта ПЦР составляет 145.н. (1) Fw кДНК (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv кДНК (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Амплификация хомяка GAPDH, эндогенный контроль ПЦР3: Один цикл денатурации при 94 °C в течение 2 мин, 39 циклов амплификации, 30 с при 94 °C, 15 с при 58 °C, 30 с при 72 °C, окончательное удлинение 5 мин при 72 °C. (1) Fw GAPDH хомяк 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH хомяк 5'- TTCACCTGTTCCACAGCCTTG -3'.
- Анализ продуктов ПЦР методом электрофореза в агарозном геле 1%.
11. Последующее наблюдение за хомяком с помощью биолюминесцентной визуализации in vivo
- Оцените прогрессирование инфекции с течением времени с помощью биолюминесцентного излучения всего животного в биолюминесцентной системе визуализации in vivo , которая состоит из охлаждаемой камеры с зарядовой связью (ПЗС), установленной на светонепроницаемой камере. Держите животное под наркозом во время получения изображения с помощью носового конуса.
- Перед получением биолюминесценции и за 5 минут до введения анестезии введите D-люциферин (150 мг/кг) внутрибрюшинно хомякам, следуя разделу 6. Приготовьте исходный раствор D-люциферина и калийной соли в PBS с концентрацией 15 мг/мл, профильтруйте-стерилизуйте и храните при температуре -80 °С.
- Через пять минут после введения животным D-люциферина обезболите их 2% изофлураном в богатой кислородом индукционной камере. Еще через 5 минут сделайте биолюминесцентные снимки с помощью ПЗС-камеры. Получите изображения хомяков в вентральном положении через 2 ч и 24 ч после заражения, через 8 и 22 дня после заражения (dpi).
ПРИМЕЧАНИЕ: Поддерживайте анестезию во время процесса визуализации с помощью устройства для доставки изофторан-кислорода. - Исходя из уровня биолюминесцентного излучения, используют следующие параметры: время экспозиции, в пределах от 30 с до 5 мин, биннинг средний или большой, f/stop 1 и поле зрения D (12,5 см).
12. Количественное определение биолюминесценции у животных, инфицированных L. infantum-Luc
- Используйте инструмент ручного измерения для определения областей интереса (ROI), размера и площади головы и тела животного. Количественно оцените биолюминесценцию, полученную ПЗС-камерой в выбранной рентабельности инвестиций.
- Измерьте фоновый сигнал со средним фоновым ROI и вычтите из биолюминесцентного излучения, полученного из ручного ROI.
- Выразите биолюминесцентное излучение в излучении, единицы, нормированные по времени и площади: фотоны.сек-1.см-2.ср-1
Результаты
Стабильная экспрессия люциферазы у L. infantum
Генетически модифицированный L. infantum был получен с использованием плазмиды линии pLEXSY, которая интегрируется в геном Leishmania в рибосомном локусе 18S рРНК (ssu), транскрипция которого управляется РНК-полимеразой I. Таким образом, клоны L. infantum-Luc были оценены на предмет интеграции плазмид в геноме Leishmania, а также на стабильную экспрессию путем биолюминесцентной эмиссии in vitro. Для оценки геномной интеграции методом ПЦР был выбран высокоэкспрессирующий клон, демонстрирующий биолюминесценцию в >120 раз выше фона. На рисунке 1 показан электрофорез продуктов ПЦР в агарозном геле для оценки интеграции плазмид в геноме и биолюминесцентной эмиссии (БЛУ) промастигот клона L. infantum-Luc. Из каждой ПЦР были получены фрагменты ожидаемого размера; Один продукт размером около 1,1 КБ (5'sSU - UTR1), и другой 1,8 КБ (HYG-3'sSU) были амплифицированы из генома L. infantum-Luc (рис. 1A), что подтвердило интеграцию плазмидной кассеты и гена люциферазы в локус ssu генома L. infantum .
Экспрессия люциферазы светлячков также оценивалась в промастиготах L. infantum-Luc путем биолюминесцентной эмиссии (RLU) в считывателе микропланшетов, как описано в протоколах, раздел 2. Даже после нескольких проходов в культуре и у мышей BALB/c в течение 5 дней он сохранял уровень биолюминесценции; 569,3 ± 19,5 для дикого типа и 59361,9 ± 2673,3 (n = 2) для клонированного L. infantum-Luc (рис. 1B). Так, клон L. infantum-Luc, стабильно экспрессирующий люциферазу светлячков, был использован для заражения хомяков внутридесневыми или внутрибрюшинными путями.
Внутривенное введение инокулята в десневую вену
Чтобы ввести лейшманию в кровоток хомяков, следует позаботиться о том, чтобы свести к минимуму перфорацию вен, кровотечение и утечку инокулята. Таким образом, нижняя губа должна быть осторожно оттянута вниз, чтобы обнажить десневую вену (Рисунок 2A); и необходимо использовать иглу меньшего калибра 30 G, чтобы избежать чрезмерной перфорации вены. Игла должна быть расположена лицевой стороной вверх, чтобы вставить ее в вену под правильным углом (Рисунок 2B). Действительно, чтобы убедиться, что игла была введена в сосуд - нижнечелюстную лабиальную вену, поршень шприца необходимо потянуть вниз до тех пор, пока кровь не будет аспирирована в ствол иглы (Рисунок 2C). Перед удалением иглы необходимо слегка надавить ватным тампоном, чтобы стимулировать гемостаз (Рисунок 2D).
Продольная оценка с помощью биолюминесцентной визуализации
Хомяки, инфицированные внутрибрюшинно (IP) или внутридесневым (IG) L. infantum-Luc, наблюдались до 50-го dpi и оценивались с помощью биолюминесцентной визуализации до 22 dpi (рис. 3). Изображения были получены через 2 ч после внутрибрюшинной инфекции с 108 паразитами в брюшной полости; Изображения были получены в течение 30 с или 1 мин экспозиционного биннинга. У животных, инфицированных амастиготом, сигнал биолюминесценции был в >65 раза интенсивнее в брюшной полости (4,6 × 105 ± 3,7 × 105), чем у инфицированных промастиготом (6,8 × 103 ± 3,8 × 103) (табл. 1), что свидетельствует о том, что дифференцированные in vitro амастиготы обладают большей биолюминесцентностью, чем метациклические промастиготы в стационарной фазе и очищаются в подушке Фиколла.
Через сутки после заражения (1 dpi) получены биолюминесцентные изображения в течение 3 мин экспозиции (рис. 3). Наблюдалось снижение сигнала биолюминесценции в области живота на 45% у хомяков, инфицированных промастиготом, и на 70% у инфицированных амастиготом (рис. 3), что свидетельствует о том, что амастиготы деградировали в большей степени, чем метациклические промастиготы (табл. 1 и рис. 4). Через неделю после заражения (8 dpi) у животных, инфицированных промастиготом, поддерживался сигнал биолюминесценции (3,3 × 103 ± 5 × 103). Тем не менее, излучение биолюминесценции у инфицированных амастиготом хомяков снизилось на 95%, с 1,3 × 105± 1,1 × 105до 6,7 × 103± 7,5 × 103 (табл. 1) и достигло того же уровня у хомяков, инфицированных промастиготом. Через три недели после заражения (22 dpi) был получен сигнал биолюминесценции в течение 5 минут экспозиции и большого биннинга (рис. 3); сигнал был значительно ниже для животных, инфицированных промастиготами и амастиготами (табл. 1 и рис. 4).
Другая группа хомяков была инфицирована через индесневой путь амастиготами и промастиготами L. infantum-Luc (10,8); биолюминесцентное излучение наблюдалось в верхнечелюстной области (рис. 3). Наблюдение началось через 1 день после заражения, и хомяки, инфицированные амастиготом, демонстрировали больше сигнала биолюминесценции и излучения (7,3 × 103 ± 4,1 × 103), чем хомяки, инфицированные промастиготом (1 × 103 ± 5,7 × 102). Через неделю после заражения (8 dpi) наблюдалось снижение сигнала биолюминесценции на 36% у животных, инфицированных промастиготом, и на 90% у хомяков, инфицированных амастиготом; Яркость варьировалась от 7,3 × 103 ± 4,1 × 103 до 7,8 × 102 ± 5,6 × 102 (Таблица 1). Через три недели после заражения (22 dpi) также был получен сигнал биолюминесценции в течение 5 минут экспозиции и биндинга (рис. 3). Сигнал биолюминесценции был сходным и низким у животных, инфицированных промастиготом и амастиготом (табл. 1 и рис. 4) в голове животных, инфицированных десной, и не наблюдалось рассеивания инфекции в абдоминальную область по сигналу биолюминесценции.
Оценка инфекции в тканях и органах методом ПЦР
Мы выполнили обычную ПЦР для исследования инфекции в определенных органах, таких как печень, селезенка и лимфатические узлы, которые могут быть ниже предела обнаружения при визуализации in vivo . Целевой участок кДНК был более специфичен для амплификации ДНК L. infantum в инфицированных тканях и органах, а ПЦР для фермента GAPDH от хомяка представляла собой контроль целостности ДНК и реакцию ПЦР. В анализе учитывались только те образцы, которые были амплифицированы для GAPDH . Так, с помощью ПЦР у двух из трех хомяков, инфицированных через внутрибрюшинный путь аксеническими амастиготами, проявилась инфекция в тканях и органах; животное два (А2) в селезенке и животное три (А3) в печени, при давлении 50 точек на дюйм (рисунок 5А). Один хомяк был инфицирован внутрибрюшинно аксеническими промастиготами; у третьего животного (A3) (рис. 5B) наблюдалась амплификация в лимфатическом узле. Хомяки, инокулированные внутридесневыми промастиготами или аксеническими амастиготами при давлении 50 dpi, не могли демонстрировать четкую амплификацию — только полосу в печени животного (A1), инфицированного промастиготами (рис. 5C). Примечательно, что в течение 8 месяцев мы содержали трех животных, у которых инокулюм, введенный внутридесневым путем с амастиготами, незначительно подтекал во время инъекции. У двух из трех животных была обнаружена явная инфекция в печени, у одного и двух животных (рисунок 5D).
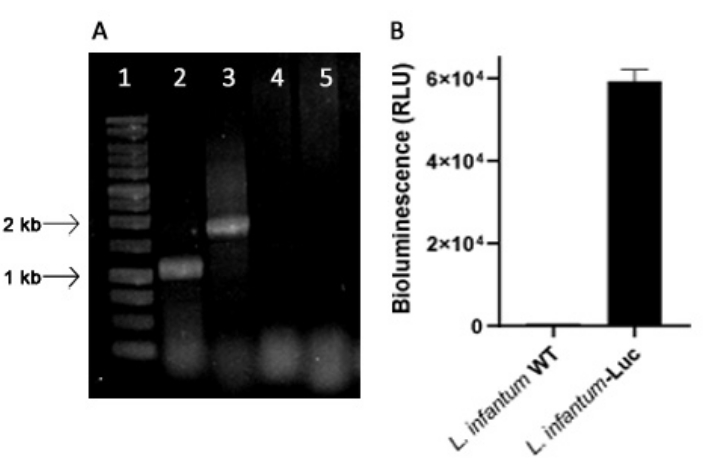
Рисунок 1: Оценка клона Leishmania infantum-Luc методом ПЦР и биолюминесцентной эмиссии. (A) Электрофорез в агарозном геле продуктов ПЦР для оценки интеграции плазмид в геном: дорожка 1 - 1 kb лестница ДНК; ПЦР геномной ДНК L. infantum-Luc, дорожка 2 - 5'ssu - utr1 (1,1 kb) и дорожка 3-hyg- 3'ssu (1,8 kb); ПЦР геномной ДНК L. infantum-wt, дорожки 4 и 5. (B) Биолюминесцентная эмиссия (RLU) промастигот клона L. infantum-Luc (10,6) в считывателе микропланшетов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Внутривенная инъекция Leishmania infantum-Luc в десневую вену. (A) Хомяка поместили в спинное пролежни, а нижнюю губу оттянули вниз. (B) Более тонкая игла (8 x 0,30 мм), соединенная со шприцем объемом 1 мл, располагалась ниже нижних резцов вдоль средней линии между парой зубов под углом 25º и вводилась на 2-4 мм в вену нижней челюсти. (C) Инокуляция 50 мкл (108) амастигот или промастигот в PBS. (D) Гемостаз с помощью ватного тампона и легкого давления на место инокуляции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
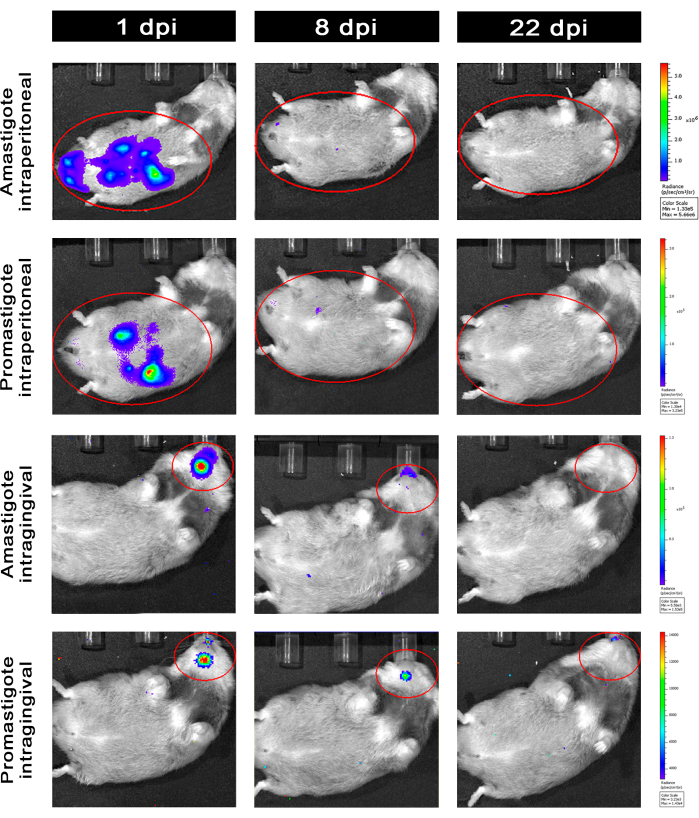
Рисунок 3: Последующее наблюдение с помощью биолюминесцентной визуализации in vivo . Репрезентативные изображения одного животного в группе: Инфицировано через внутрибрюшинное (верхние панели) или внутридесневое (нижние панели), с амастиготами или промастиготами L. infantum-Luc с разрешением 1, 8 и 22 dpi. Красный ROI представляет зондируемые области на брюшной полости и голове для внутрибрюшинной или внутридесневой инфекции соответственно. Данные показывают, что при 1 dpi у всех животных проявлялся сигнал биолюминесценции в брюшной полости или нижней челюсти. Сигнал падал после 8 точек на дюйм и был почти необнаруживаем ни в одной группе при 22 точках на дюйм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
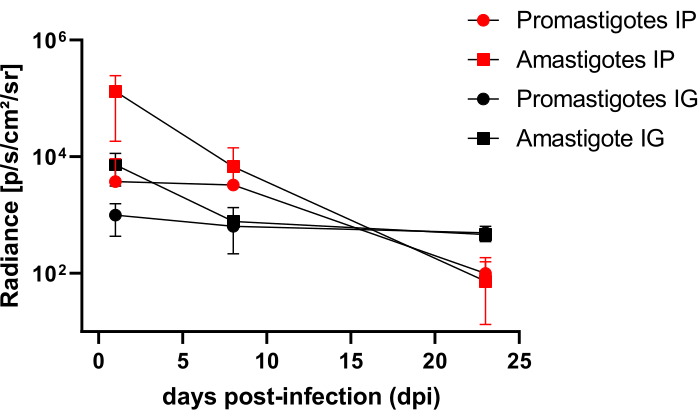
Рисунок 4: Сравнительный анализ излучения по биолюминесцентным изображениям. Количественная оценка излучения фотонов.sec-1.cm-2.sr-1 проводилась в брюшной полости или голове хомяков с помощью ручных инструментов измерения ROI. Средний фоновый ROI был вычтен из ROI измерений, чтобы удалить любой ложный сигнал. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
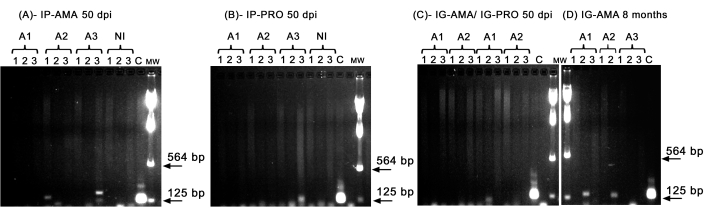
Рисунок 5: ПЦР-амплификация кДНК. (A) IP-AMA, хомяки, инфицированные через внутрибрюшинный путь амастиготом, 50 dpi (n = 3); (B) IP-PRO, инфицированный через внутрибрюшинный путь промастиготом, 50 dpi (n = 3); (C) IG-AMA, инфицированный внутридесневым путем с помощью амастигота (n = 2), IG-PRO, инфицированный через внутридесневой путь с помощью промастиготы (n = 2); (D) IG-AMA, инфицированный через интрагингивальный путь амастиготом, через 8 месяцев после инфицирования (n = 3). NI, неинфицированные хомяки в качестве отрицательного контроля (n = 2); С-геномная ДНК L. infantum-Luc, положительный контроль ПЦР. Ткани и органы: 1- селезенка, 2- печень, 3- лимфатические узлы. MW- маркер молекулярной массы, стрелками обозначены нижние полосы молекулярной массы. А1 - животное один, А2 - животное два, А3 - животное три. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Разрешение на дюйм | Amastigotes IP | Promastigotes IP | Амастиготес IG | Промастиготы IG | ||||||||
| Значить | СД | N | Значить | СД | N | Значить | СД | N | Значить | СД | N | |
| 0 | 4,6 х 105 | 3,7 х 105 | 3 | 6,8 х 103 | 3,8 х 103 | 3 | - | - | - | - | - | - |
| 1 | 1,3 х 105 | 1,1 х 105 | 3 | 3,8 х 103 | 5,5 х 103 | 3 | 7,3 х 103 | 4,1 х 103 | 2 | 1,0 х 103 | 5,7 х 102 | 2 |
| 8 | 6,7 х 103 | 7,5 х 103 | 3 | 3,3 х 103 | 5,0 х 103 | 3 | 7,8 х 102 | 5,6 х 102 | 2 | 6,4 х 102 | 8,2 х 101 | 2 |
| 22 | 7,3 х 101 | 8,5 х 101 | 3 | 9,9 х 101 | 8,6 х 101 | 3 | 4,6 х 102 | 7,5 х 101 | 2 | 5,0 х 102 | 1,5 х 102 | 2 |
Таблица 1: Исходные данные сравнительного анализа излучения биолюминесцентных изображений. Количественная оценка яркости средних фотонов.сек-1.см-2.ср-1 по группам и маршрутам. Сокращения: dpi = дни после заражения; SD = стандартное отклонение; N = размер выборки.
Обсуждение
Забор крови или внутривенное введение веществ хомякам необходимо для проведения различных научных исследований. Было разработано несколько методов для доступа к различным путям сбора или инокуляции, непосредственно связанным с целями исследования19. Из-за анатомии хомяка – короткого хвоста и конечностей – внутрисердечный путь обычно выбирают для внутривенного введения лейшмании. В зависимости от используемого штамма, внутрисердечный путь оказался предпочтительным в качестве референсного штамма L. infantum MHOM/BR/1974/PP75, заражение которого происходит в долгосрочной перспективе, 6-9 месяцев5. Однако именно инокулюм может привести к кровотечению и смерти животного. Таким образом, мы стандартизировали альтернативный путь внутривенной инокуляции инфекции в десневое сплетение, нижнечелюстную лабиальную вену, который причиняет меньший вред животному. Животные были инфицированы генетически модифицированным референсным штаммом L. infantum MHOM/BR/1974/PP75, который стабильно экспрессировал люциферазу светлячков даже после нескольких пассажей в культуре и на мышах (рис. 1), как и для других видов Leishmania , трансфицированных той же интегративной плазмидой20.
Нижнечелюстная лабиальная вена или десневая вена является лучшим путем для забора крови, а также для многократного забора крови10,11. Тем не менее, это первая демонстрация того, что десневая вена является возможным местом для внутривенного инфицирования Leishmania у хомяков. В отличие от забора крови, в котором обычно используется игла высокого калибра 26 G для предотвращения гемолиза крови10, эта игла не подходила для инокуляции Leishmania из-за перфорации вены, кровотечения и утечки инокулюма. При инфекции лейшмании через верхнечелюстную нижнечелюстную вену необходимо было использовать иглу 30G меньшего калибра. Еще одним аспектом, который отличает пункцию вены от инфекции через десневую вену, является скорость введения, составляющая примерно 1 мкл/с; и следить за тем, чтобы она вводилась в сосуд – нижнечелюстную лабиальную вену, а не застревала в слизистой, подкожной или внутрикожной. Из-за низкого кровообращения в десневом сплетении, 50 μл высокоплотного инокулята аксенических амастиготов или промастигот L. infantum-Luc, 2 x 109 паразитов/мл, должны были быть введены медленно (~ 1 мин), и иглу необходимо было удалить, удерживая тампон прижатым в течение 1 мин, чтобы инокулят мог дисперсировать в кровотоке (Рисунок 2).
Для лонгитюдной оценки инфекции хомяков инфицировали внутрибрюшинно (IP) или через внутридесневой (IG) путь L. infantum-Luc и наблюдали за ними в течение 50 dpi с помощью системы биолюминесцентной визуализации до эвтаназии. Учитывая, что референтный штамм PP75 может быть менее вирулентным сам по себе, а сверхэкспрессия люциферазы также может влиять на эффективность инфекции и поддерживать инфекцию в долгосрочной перспективе, для инфекции использовали высокий инокулят из 108паразитов. После инокуляции десны амастигот и промастигот L. infantum-Luc и оценки с помощью системы биолюминесцентной визуализации, биолюминесценция была ограничена верхнечелюстной областью хомяков через 24 ч после заражения. Действительно, у хомяков, инфицированных внутрибрюшинно амастиготами и промастиготами L. infantum-Luc, наблюдалась биолюминесценция, рассеянная по всему брюшной полости (рис. 3, 1 dpi). Непрерывное снижение биолюминесцентной эмиссии в течение всего времени, с первого дня инфекции до8-го дня и до 22-го dpi у хомяков, инфицированных L. infantum-Luc, не зависело от пути инокуляции (табл. 1 и рис. 4).
Однако, когда нагрузка паразитов в тканях животных низкая, она может быть ниже предела обнаружения биолюминесцентной визуализации, но может быть обнаружена и количественно определена с помощью ПЦР или количественной ПЦР. Как уже сообщалось, инфекция, вызванная штаммом PP75, действительно ниже, чем у других штаммов5, и лишь у нескольких развились клинические признаки заболевания из-за генетической изменчивости животных. В этом исследовании, несмотря на небольшое количество животных и низкую вирулентность этого штамма, аксенические амастиготы продемонстрировали преимущество при 50 dpi, демонстрируя лучшую инфекцию, чем промастиготы, что было продемонстрировано методом ПЦР (рис. 5). Через восемь месяцев после заражения амастиготами через десну паразиты могли быть обнаружены с помощью ПЦР в печени (рис. 5), и они также демонстрировали умеренную пилоэрекцию, сжатость орбиты и изогнутую осанку.
Аксенические амастиготы могут быть лучшим выбором для инфекции и последующего наблюдения, чем промастиготы21 , и имеют преимущество в том, что их легко производить в больших масштабах. Инокуляция десны является возможным и лучшим путем для внутривенного введения соединений и для инфицирования Leishmania и других патогенов, без повреждения или отека в месте нанесения в нижней челюсти или для здоровья животного.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/Decit-MS/CNPq/SES оказали финансовую поддержку этому исследованию. Спасибо Моник Рибейро де Лима за советы о путях вакцинации. Этот проект был разработан в соответствии с Соглашением осотрудничестве No 258/2017 между FIOCRUZ и Федеральным университетом Рио-де-Жанейро - UFRJ. Команда искренне благодарна видеопродюсерам Рикардо Баптисте Шмидту и Генилтону Жозе Виейре из Центра популяризации науки (МОК) за их неоценимую поддержку и помощь в съемках протоколов и проведении интервью.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Ссылки
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены