Method Article
In vivo (İn canlı) Leishmania infantum ile Enfekte Hamsterlerin Luciferaz İfade Eden Aksenik Amastigotların Dişeti Aşılaması ile Görüntülenmesi
Bu Makalede
Özet
Burada, L. infantum-Luc ile intraperitoneal (IP) veya intragingival (IG) enfekte olmuş altın hamsterlerin biyolüminesan görüntüleme ve PCR ile boylamsal bir değerlendirmesini sunuyoruz. Hamsterlar enfeksiyondan 1 gün sonra (1 dpi), enfeksiyondan 1 hafta sonra (8 dpi) ve enfeksiyondan 3 hafta sonra (22 dpi) değerlendirildi ve 50. dpi ve enfeksiyondan 8 ay sonra ötenazi yapıldı.
Özet
Amerikan tegumentary leishmaniasis (ATL) ve visceral leishmaniasis (VL) Dünya Sağlık Örgütü tarafından ihmal edilmiş olarak kabul edilmektedir. VL tedavi edilmezse öldürücü olabilir; Tedavide kullanılan ilaçlar toksiktir ve direnç durumları vardır. Klinik öncesi testler, hayvan modeline, kullanılan suşa ve aşılama yoluna bağlı olarak tedavi için yeni ilaçların keşfedilmesinde bir darboğaz oluşturabilir. Altın hamster, insan hastalığında gözlenen klinik ve immünopatolojik süreçlerin çoğunu sergileyen Viannia ve Leishmania alt cinslerine karşı yüksek duyarlılığı ile öne çıkar.
Kısa bir kuyruğu ve uzuvları olan hamster anatomisi ile, intrakardiyak yol genellikle Leishmania'nın intravenöz enjeksiyonu için seçimdir. Bununla birlikte, kanamaya ve sonunda hayvan ölümüne yol açabilen bir aşıdır. Bu nedenle, minimal invaziv olan, kolay venöz erişime izin veren ve hayvanda az sayıda lokal ve sistemik yaralanmaya neden olan gingival ven enfeksiyonu için alternatif bir intravenöz aşılama yolunu standardize ettik. Bu nedenle, lusiferaz (Luc) eksprese eden Leishmania Infantum ile intraperitoneal (İP) veya intragingival (IG) yolla enfekte olan hamsterlar, biyolüminesans görüntüleme sistemi ile 22 gün ve PCR ile enfeksiyondan 50 gün ve 8 ay sonra takip edildi.
L. infantum-Luc'un hem aksenik amastigotlarının hem de promastigotlarının dişeti inokülasyonundan sonra, dişeti pleksus çevresindeki dokularda enfeksiyonun bir göstergesi olan enjeksiyon bölgesinde biyolüminesans en az 2 hafta kısıtlandı. L. infantum-Luc ile intraperitoneal olarak enfekte olan hamsterlar, beklendiği gibi karın boyunca dağılmış biyolüminesans gösterdi. Bununla birlikte, biyolüminesans görüntüleme sistemi ile enfeksiyon 50. dpi'ye kadar azaldı ve sadece PCR ile tespit edilebildi. Aksenik amastigotlar, PCR ile değerlendirildiği gibi promastigotlardan daha iyi enfeksiyon gösterdi. Nitekim, enfeksiyondan 8 ay sonra, intravenöz yolla aksenik amastigotlarla aşılanan hayvanların karaciğerinde PCR ile parazitler tespit edilmiştir, bu da L. infantum MHOM/BR/1974/PP75'in referans suşunun bir özelliği olabilir, enfeksiyonu yavaş ilerleyen ve düşük parazit yükü gösteren, biyolüminesan görüntüleme çözünürlüğünün altında. Bu nedenle, aksenik amastigotlar enfeksiyon ve takip için promastigotlara göre daha iyi bir seçim olabilir ve dişeti inokülu, Leishmania ve diğer patojenlerin intravenöz enjeksiyonu için uygun bir yoldur.
Giriş
Leishmaniasis, dört merkezi eko-epidemiyolojik bölgedeki birçok ülkede endemik olan 20'den fazla Leishmania türünün neden olduğu ihmal edilmiş ve yeniden ortaya çıkan hastalıklar olarak kabul edilir: Latin Amerika, Kuzey ve Doğu Afrika ve Batı ve Güneydoğu Asya1. Tedavi edilmezse öldürücü olan tegumentary (TL) ve visseral leishmaniasis (VL) olarak gruplandırılabilirler. Brezilya'da VL'nin etiyolojik ajanı Leishmania infantum'dur ve tedavi beş değerlikli antimonyaller veya Amfoterisin B kullanılarak gerçekleştirilir. Bu ilaçlar intravenöz olarak uygulanır, yüksek toksisiteye sahiptir, advers reaksiyonlar gösterir ve direnç vakaları vardır2.
Bu nedenle, yeni kemoterapi arayışına yatırım yapmak gerekir. Klinik öncesi testler, aslında, hayvan modeline, kullanılan suşa, aşılama yoluna ve diğer lojistik, teknik ve operasyonel faktörlere bağlı olarak VL tedavisi için yeni ilaçların keşfinde bir darboğazdır. Altın hamster, Viannia ve Leishmania alt cinslerinin türlerine karşı yüksek duyarlılığı ile öne çıkar ve Leishmania braziliensis 3,4 ile yapılan önceki çalışmalarda gözlemlendiği gibi insan hastalığında gözlenen klinik ve immünopatolojik süreçlerin çoğunu gösterir. L. infantum ile enfekte olan hamster ayrıca insanlarda ve köpeklerde5 VL'nin karakteristik immünopatolojik süreçlerinin çoğunu geliştirir, örneğin anemi, lökopeni, trombositopeni ve hepatosplenomegali. Ek olarak, altın hamster soylu bir hayvandır ve insanlarda görüldüğü gibi klinik belirtilerin heterojenliğini yeniden üreterek tek tip bir yanıt göstermez3.
Enfeksiyon sonucu için göz önünde bulundurulması gereken bir diğer husus L. infantum suşu ve aşılama yoludur. L. infantum'un çeşitli suşları genetik arka plan ve tedaviye duyarlılık açısından farklılık gösterir 2,6,7. Bazı suşlar, promastigot enfeksiyonundan8 sonra karaciğer ve dalakta düşük parazit yüküne sahiptir ve aksenik amastigotlar, çok fazla araştırılmamış enfeksiyonu iyileştirmek için bir alternatif olabilir. Gerçekten de, intravenöz yol enfeksiyonu kolaylaştırır ve klinik belirtileri olan hayvanların sıklığını arttırır; Ancak intraperitoneal aşılama en çok kullanılanıdır. İntrakardiyak yol, L. infantum 5,8,9 ile intravenöz enfeksiyon için seçimdir. Bununla birlikte, hamsterlarda intragingival inokülasyon, enfeksiyon bölgesi olarak tanımlanmayan, intravenöz enjeksiyon için alternatif bir yoldur. Bildirilmesine rağmen, gingival venipunktur minimal invazivdir, kolay venöz erişim sağlar ve az sayıda lokal ve sistemik yaralanmaya neden olur10. Dişeti damarı ponksiyonu, hayvan sağlığını korurken sonuçların kalitesini ve uygulanabilirliğini en üst düzeye çıkarmak için önerilerle en çok uyumludur11.
Geleneksel yöntemler kullanılarak VL için bileşiklerin klinik öncesi değerlendirmesi, histopatolojik analiz ve dokulardaki parazit yükünün değerlendirilmesi için ötenazi yapılması gereken daha fazla hayvan gerektirir. Buna karşılık, biyolüminesan görüntüleme sistemi klinik öncesi çalışmaları hızlandırabilir ve hayvan sayısını azaltabilir. Enfekte dokulardaki biyolüminesan bölgeler, aynı hayvanda birkaç hafta boyunca gerçek zamanlı olarak takip edilebilir. Bu önemli teknolojik aracın standardizasyonu üzerine yapılan çeşitli çalışmalar, Trypanosoma cruzi, Leishmania spp. ve Toxoplasma gondii 12,13,14,15 ile enfekte olmuş farelerle yapılan çalışmalarda uygulamasını göstermiştir. Bununla birlikte, dokudaki parazit yüküne bağlı olarak, biyolüminesans, etkilenen organların kantitatif PCR ile değerlendirilmesini gerektiren in vivo görüntüleme sistemi tarafından eksik tespit edilebilir. Bu nedenle, biyolüminesan görüntüleme sistemi ve PCR ile takip için altın hamsterlerin dişeti damarında lusiferaz eksprese eden L. infantum'un intravenöz enjeksiyonuna dayalı bir metodoloji geliştirmeyi öneriyoruz.
Protokol
Hamsterleri içeren protokoller, Instituto Oswaldo Cruz/IOC Hayvan Araştırmalarında Etik Komitesi'nin yönergelerini takip etti (onay: CEUA/IOC L-015/2022).
1. Ateşböceği lusiferaz geninin Leishmania ekspresyon plazmidine klonlanması
- Plazmid pLEXSY-hyg2'yi BglII (10 U/μL) ve NotI (10 U/μL) endonükleaz ile sindirin. Önce BglII ile sindirin: 50μL plazmit (9 μg DNA), 30 μL kısıtlama enzimi tamponu, 3 μL sığır serum albümini (BSA), 3 μL BglII ve 300 μL'lik bir nihai hacme nükleaz içermeyen su ekleyin. 37 °C'de 3 saat inkübe edin.
- TOPOII vektör16'da klonlanan Kozak dizisi (Kozak-LUC) ile ateşböceği lusiferaz açık okuma çerçevesini serbest bırakmak için TOPOII/LUC plazmidini BamHI (10 U/μL) ve NotI ile sindirin. Önce BamHI ile sindirin: 100μL plazmidi (8.5 μg DNA) 30 μL kısıtlama enzimi tamponu ile karıştırın; 3 μL BSA, 3 μL BamHI ve 300 μL nihai hacme kadar nükleaz içermeyen su. 37 °C'de 3 saat inkübe edin.
- Her bir plazmidi bir silika zarı üzerinde temizleyin ve DNA'yı 100 μL'lik bir son hacim için 50 μL su ile iki kez elüte edin.
- Daha önce doğrusallaştırılmış pLEXSY-hyg2 ve TOPOII/LUC plazmitlerini NotI ile çift sindirin. Silika membrandan ayrıştırılan 100μL DNA'yı 15 μL tampon D'ye, 2 μL NotI'ye ve nükleaz içermeyen suyu 150 μL nihai hacme kadar karıştırın. 37 °C'de 1 saat inkübe edin.
- Jel, çift sindirilmiş vektörü (pLEXSY-hyg2) ve ek parçayı, Kozak-LUC'u, Tris-asetat EDTA (TAE) tamponu ile elektroforezden sonra %1'lik bir agaroz jelden saflaştırın. Bir neşter ile ~ 8 kb ve 1.6 kb bantlarını kesin. Dilimleri tartın, 1 hacim jele üç hacim tampon ekleyin, jeli çözmek için 50 ° C'de inkübe edin, silika zarına aktarın ve DNA'yı 20 μL su ile iki kez yıkayın ve elüte edin, son hacim 40 μL'dir.
- Çift sindirilmiş vektörü (pLEXSY-hyg2) ve kesici uç, Kozak-LUC'u T4 ligaz ile bağlayın: her ikisi de 55 ng/μL'de, 1:5 molar oranda 2 μL vektör ve kesici ucu karıştırın; 5 μL ligasyon tamponu ekleyin; 1 μL T4 DNA ligaz (1U/ mL), son hacim 10 μL. Gece boyunca 16 °C'de inkübe edin.
- 10 μL ligasyon reaksiyonuna 40 μL nükleaz içermeyen su ekleyin ve DNA'yı 10 hacim bütanol ile çökeltin. Bir mikrosantrifüjde 10 dakika boyunca en yüksek hızda santrifüjleyin, peleti %70 etanol ile yıkayın, 10 dakika boyunca en yüksek hızda santrifüjleyin, peletin tezgahta kurumasını bekleyin ve 4 μL su ekleyin.
- Ligasyon reaksiyonunun 4 μL'sini elektroyetkin bakteriler, JM109 (40 μL) ile karıştırın, karışımı bir küvete (d = 0.2 cm) aktarın ve buz üzerinde tutun. 2.500 V, 200 Ω, 25 μF'de elektrostatik yapın, küveti buza koyun ve 1 mL LB ortamı ekleyin. Karışımı hemen 15 mL'lik bir konik tüpe aktarın ve 37 °C'de 60 dakika ve 100 rpm inkübe edin.
- Karışımı iki LB agar / ampisilin (100 μg / mL) plaka üzerine yerleştirin: biri 200 μL ve diğeri tüm elektropore bakteri ile. Dönüştürülmüş bakterileri 10 dakika boyunca 2.000 × g'da santrifüjleyerek hacmi konsantre edin, peleti 100 μL'de yeniden süspanse edin ve tüm hacmi/peleti plakalayın. Plakaları 30 ° C'de 24-30 saat inkübe edin ve klonların büyümesini bekleyin.
- Klonları bir kürdan ile seçin ve 5 mL LB / ampisilin (100 μg / mL) ortamı içeren 50 mL konik tüplere aktarın. Miniprep kültürlerinin büyümesine izin vermek için 30 °C ve 100 rpm'de 20-24 saat inkübe edin.
- Plazmidi mini hazırlık kiti ile saflaştırın ve DNA'yı 30 μL su ile elüte edin. BamHI ile sindirilerek pLESXY-LUC-hyg2 yapısını içeren ekran klonları.
- Miniprep'ten 10 μL DNA'yı karıştırın; 2 μL restriksiyon enzimi tamponu; 0,2 μL BSA: 1 μL BamHI ve 20 μL nihai hacme kadar nükleaz içermeyen su. % 1 agaroz jel elektroforezinde beklenen pozitif klon parçalarını 37 ° C'de 1 saat inkübe edin: 3.450 ve 6.290 baz çifti.
- pLESXY-LUC-hyg2 yapısını daha büyük ölçekte saflaştırmak için bir maxiprep kültürü hazırlayın. Bir Erlenmeyer (1 L), ampisilin ile desteklenmiş 250 mL LB ortamı ve 1 mL miniprep transfekte edilmiş JM109 ekleyin ve 30 ° C ve 200 rpm'de 18-20 saat inkübe edin.
2. Lusiferaz eksprese eden Leishmania infantum üretimi ve seçimi
- Leishmania entegrasyon kasetini serbest bırakmak için, pLESXY-LUC-hyg2 plazmidini SwaI ile tamamlanana kadar kısıtlayın. 100 μL nihai hacme 40 μL plazmit (50 μg), 10 μL hızlı sindirim tamponu, 4 μL SwaI ve nükleaz içermeyen su ekleyin. Gece boyunca 30 °C'de inkübe edin.
- Etanol ile çökeltin, bir kez% 70 etanol ile yıkayın, 50 μL su ile tekrar süspanse edin ve buz üzerinde tutun.
- Schneider'in ortamındaki üstel büyüme fazında 10 dakika boyunca 1.000 × g'da santrifüj Leishmania MHOM / BR / 1974 / PP75 promastigotları. Peletleri beyin ve kalp infüzyonu (BHI) ortamıyla yıkayın ve 1,000 × g'da 10 dakika santrifüjleyin. Peletleri BHI'da 108 promastigot / mL'ye yeniden süspanse edin.
- L. infantum promastigotları (500 μL) pLESXY-LUC-hyg2 entegrasyon kaseti (50 μg) ile elektroporasyon küvetinde (d = 0.4 cm) buz üzerinde karıştırın. 1.500 V/25 mikro F ve 10 s aralıklarla iki darbeli elektropozit. Nabızdan sonra 10 dakika buz üzerinde tutun.
- Kesilen promastigotları, 26 ° C'de% 20 FCS ile desteklenmiş Schneider ortamı ile bir şişeye aktarın. 24 saat sonra, higromisin önce 50 μg / mL ekleyin, daha sonra 48 saat sonra 100 μg / mL'ye ve 1 hafta sonra 150 μg / mL'ye yükseltin.
- Schneider'in% 20 FCS ve 150 μg / mL higromisin ile desteklenmiş 96 oyuklu bir plakada seyreltmeyi sınırlayarak L. infantum-Luc'un transfekte edilmiş promastigotlarını klonlayın. Klon büyümesi için 26 °C'de inkübe edin.
- Mikroplaka okuyucuda biyolüminesan emisyon-bağıl lüminesans birimi (RLU) ile genetik olarak homojen ve oldukça etkileyici L. infantum-Luc'u seçmek için ekran klonları.
- Kısaca, 106 promastigotu beyaz 96 oyuklu bir plakada 100 μL substrat D-lusiferin (300 μg / mL) ile 25 mM HEPES pH 7.8, 15 mM MgCl2, 4 mM EGTA, 1 mM DTT, 1 μg/mL BSA, 2.5 mM ATP, %0.1 Triton X-100 ve 300 μM Koenzim A'dan oluşan tamponda karıştırın, hemen mikroplaka okuyucuda değerlendirilir.
3. 18S rRNA (ssu) ribozomal lokusuna genomik entegrasyonu değerlendirmek için PCR
- Lusiferaz ve vahşi tip eksprese eden promastigotlardan genomik DNA'yı saflaştırın (10,8). Promastigotları 15 mL konik tüplerde 10 dakika boyunca 1.000 × g'da santrifüjleyin, pelete fosfat tamponlu salin (PBS) ekleyin, bir Neubauer odası ile sayın ve 10 dakika boyunca 1.000 × g'da santrifüjleyin. Peleti lizis tamponu ile yeniden süspanse edin: 100 mM NaCl, 10 mM Tris, 25 mM EDTA, %0.5 SDS ve 0.1 mg/mL proteinaz K, 108/mL yoğunluğa kadar. Gece boyunca 56 °C'de inkübe edin.
- Bir hacim Fenol/Kloroform/İzoamil Alkol, 25:24:1 (h/v) ve bir hacim kloroform ile iki döngü DNA temizliği gerçekleştirin. Her ekstraksiyon döngüsü arasında, sulu fazı yeni tüplere aktarın ve 10 dakika boyunca 2.000 × g'da santrifüjleyin.
- DNA'yı iki hacim etanol ile çökeltin ve 5.000 × g, 10 dakika, 4 ° C'de santrifüjleyin. 1 mL %70 etanol ekleyin, bir mikrotüpe aktarın ve 15.000 × g'da 5 dakika santrifüjleyin.
- % 70 etanol ile ikinci bir yıkama yapın. Santrifüjlemeden sonra, süpernatanı atın ve peleti tezgahta kurutun.
- Genomik DNA'yı 50-100 μL ultra saf su ile 65 ° C'de 30 dakika boyunca yeniden hidratlayın, DNA'yı ölçün ve -20 ° C'de saklayın.
- Aşağıdaki PCR reaksiyonunu ayarlayarak pLEXSY kasetinin Leishmania genomuna entegrasyonunu değerlendirmek için tanısal PCR gerçekleştirin: 10 μL PCR Tamponu, 0.2 mM dNTP, 1 U DNA polimeraz, 1 μg genomik DNA, her primerden 0.5 μM ve 50 μL nihai hacme kadar nükleaz içermeyen su.
- pLEXSY vektöründe ve Leishmania genomunda hibritleşen primerleri seçin: (1) aprt ters primer A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', utr1 (aprt) bölgesinde hibritleşir; ve (2) Leishmania kromozomal 18SrRNA (ssu) lokusunda ssu ileri astar F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3'.
- Aşağıdaki amplifikasyon protokolünü kullanın: 2 dakika boyunca 94 ° C'de bir denatürasyon döngüsü; 30 döngü amplifikasyon, 94 °C'de 30 sn, 60 °C'de 30 sn, 72 °C'de 1 dakika; 72 °C'de 10 dakikalık son uzatma. PCR ürününün beklenen boyutu 1,1 Kb'dir.
- İkinci bir primer seti kullanın: (1) hyg ileri astar A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3 ve (2) pLEXSY vektörünün direnç marköründe ve Leishmania genomunun 18SrRNA (ssu) lokusunda hibritleşen ssu ters astar F3002 5'-CTGCAGGTTCACCTACCTAC-3'. 60 °C yerine 53 °C'lik tavlama sıcaklığı dışında, adım 3.6.2'de açıklanan aynı PCR protokolünü kullanın. Beklenen ürün 1.8 kb (hyg - 3'ssu).
- L. infantum genomunun ribozomal 18S rRNA lokusuna entegrasyon olup olmadığını kontrol etmek için PCR ürünlerini %1 agaroz jel elektroforezi ile analiz edin.
4. L. infantum- Luc metasiklik promastigot ve aksenik amastigot farklılaşması
- BHI ortamında, 25 mg / L hemin ve% 20 fetal buzağı serumu (FCS) ile desteklenmiş, yapısal olarak Luciferaz eksprese eden L. infantum-LucMHOM / BR / 1974 / PP75'i yetiştirin.
NOT: Higromisin, stabil transfektanların ortamından çekildi. - L. infantum-Luc'un metasiklik promastigotlarını elde etmek için, 75 cm'lik2 şişelerde 106 / mL promastigotları tohumlayın, 26 °C'de% 20 FCS ile desteklenmiş 20 mL BHI ortamı ekleyin ve 4 gün boyunca yatay pozisyonda tutun veya durağan büyüme fazına kadar hafif eğimli. Art arda 6-8 gün sonra, şişe artmış metasiklik promastigotlar içerir; Promastigotları 1.000 × g'da 4 ° C'de10 dakika santrifüjleyin.
- Promastigot peletini 20 mL DMEM düşük glikoz ile tekrar süspanse edin, Neubauer odasını kullanarak sayın ve 4 ° C'de10 dakika boyunca 1.000 × g'da santrifüjleyin.
- Peletlere 3-5 × 107 promastigot/mL yoğunlukta DMEM düşük glikoz ekleyin. 5 mL promastigotları DMEM, 2: 1 (h / v) ile seyreltilmiş 10 mL Ficoll yastığına dökün. Eğimi 100 × g'da 15 dakika boyunca 4 °C'de, fren kapalıyken ve yavaş hızlanırken santrifüjleyin.
- Arayüzde, Ficoll yastığının üstünde metasiklik promastigotları toplayın, Neubauer odasını kullanarak sayın ve 1,000 × g'da 4 °C'de 10 dakika santrifüjleyin. Artık Ficoll'u çıkarmak için peleti PBS ile yıkayın, Neubauer haznesini kullanarak sayın ve 1,000 ° C'de 10 dakika boyunca 4 ×g'da santrifüjleyin.
- Peleti PBS'de 2 × 109 / mL'ye yeniden süspanse edin. Aşılamadan önce promastigotları buz üzerinde tutun.
- Farklı promastigotlar L. infantum-Luc aksenik amastigotlara in vitro, aksenik olarak yetiştirilen amastigot (MAA) için modifiye edilmiş ortamda17.
- Early tuzları ve glutamin,% 0.5 tripto-kazein, 3 mM L-sistein, 15 mM D-glikoz, 4 mM NaHCO3, 0.33 mM Na2HPO4, 25 mM HEPES ile 9.55 g / L orta 199 ekleyerek MAA'yı hazırlayın ve 6.5'lik bir nihai pH'a kadar ve% 20 fetal buzağı serumu (FCS) ile takviye edin.
- Orta şişelerde (75cm2) 9 mL orta MAA ve 1 mL promastigot ile durağan büyüme fazında (7. gün), 2-3 × 107 promastigot/mL ile kültürlere başlayın. Amastigat farklılaşmasına izin vermek için 32 ° C'de 24-48 saat inkübe edin.
- Aksenik olarak yetiştirilen amastigotları, 2-3 × 107 / mL'lik bir yoğunluğa ulaşana kadar haftada iki ila üç pasaj tutun.
- Hamster enfeksiyonu için aksenik amastigot kültürünü artırın. % 20 FCS ile desteklenmiş 20 mL MAA ortamında yüksek yoğunluklu amastigot (5 × 106 / mL) içeren 150cm 2 şişe hazırlayın.
- 24 saat sonra, 1.000 × g'da 4 °C'de 10 dakika santrifüjleyin, aynı hacimde PBS ile yıkayın, Neubauer odasını kullanarak sayın ve 1.000 × g'da 4 °C'de 10 dakika santrifüjleyin. 50 μL'de 108 amastigot aşısını hazırlamak için PBS ekleyin.
5. Hayvanlar
- Erkek altın hamsterleri 4-6 haftalıkken temin edin ve 2 hafta karantinada tutun. L. infantum MHOM/BR/1974/PP75 ile enfekte olduklarında 6-8 haftalık olduklarından ve 80-100 g ağırlığında olduklarından emin olun.
NOT: Bu protokol hem erkek hem de dişi hamsterlar için geçerlidir. Bununla birlikte, o sırada mevcut olmaları nedeniyle, bu çalışmada sadece erkek hamsterlar kullanılmıştır. - Hamsterleri dört gruba ayırın: grup 1, intraperitoneal olarak amastigot ile enfekte olmuş (n = 3); promastigotlarla intraperitoneal olarak enfekte olan grup 2 (n = 3); dişeti toplardamarında amastigot ile enfekte olan grup 3 (n = 2); dişeti damarında promastigot ile enfekte olan grup 4 (n = 2); Grup 5, kontrol olarak enfekte olmamış hamsterlar (n = 2).
- Hayvanları, kontrollü bir havalandırma sistemi (10-15 hava değişimi/saat), 12 saat aydınlık/karanlık döngüsü, 21 ± 2 oC ve %40-60 nem ile donatılmış havalandırmalı raflarda tutun. Kağıt, saman, hidrofobik pamuk, karton rulolar, otoklavlanmış su ve gıda ad libitum gibi çevresel zenginleştirme sağlayın.
6. İntraperitoneal yolla enfeksiyon
- Hamsteri kafesin ızgarası üzerinde fiziksel olarak tutun, başparmağınızı ve işaret parmağınızı cımbız olarak kullanarak, başın yanındaki cildi başın yanındaki yanlardan sıkıştırmak için ve diğer parmaklar cildi sırttan çekerek mümkün olduğunca fazla cilt elde etmeye çalışın.
- Karın sağ alt kadranındaki aşılama bölgesini uyluğun arka kasları ile hizalayın.
- Hayvan vücudu 45º eğik, baş karından daha aşağıda ve iğne 15° ila 20° arasında olacak şekilde aşılayın.
- 1 mL şırıngaya bağlı 13 x 0.45 mm'lik bir iğne ile PBS'de 50 μL (108) aksenik amastigotları veya promastigotları aşılayın. Eğimin 0,5 cm ötesine yerleştirin. İğneyi karın içine soktuktan sonra, damar içine sokulmadığını doğrulamak için pistonu çekin ve sıvıyı dikkatlice enjekte edin.
7. Dişeti inokülasyonu ile intravenöz enfeksiyon
- Bölüm 6'yı takip ederek hamsterı dizginleyin. 13 x 0.45 mm'lik bir iğneye bağlı 3 mL'lik bir şırıngada intraperitoneal olarak 200 mg / kg% 10 ketamin hidroklorür ve% 2 ksilazin hidroklorür, 1.3 mL nihai hacim karışımı.
- Hayvanın uyuşturulduğundan emin olmak için yastığın interdigital tabanını sıkıştırarak pençeyi sıkıştırın.
- Anestezi uygulanmış hamsterı iki elinizle sırtüstü pozisyonda tutun ve diş etini ve diş eti damarını ortaya çıkarmak için alt dudağı başparmaklarınızla hafifçe aşağı çekin
- Alt kesici dişlerin altına, orta çizgi boyunca 25º'lik bir açıyla 1 mL'lik bir şırıngaya bağlı daha ince bir iğne (8 x 0,30 mm) yerleştirin ve mandibular labial vene 2-4 mm yerleştirin.
- İnokulumun intravenöz olduğunu ve iğnenin mandibular labial ven içine yerleştirildiğini doğrulamak için, iğnenin namlusuna (sarı kısım) kadar kanı aspire edin.
- 50 μL (10,8) amastigot veya promastigot aşısını, aşının ve kanın damardan dış ortama sızmasını önlemek ve kan dolaşımında dağılmasına izin vermek için tüm hacim aşılanana kadar 1 dakika boyunca PBS'ye yavaş ve dikkatli bir şekilde enjekte edin.
- İğneyi çıkarmadan önce pamuklu çubukla hafif baskı uygulayın. Aynı zamanda, kanamayı ve aşı kaybını önlemek için 1 dakika boyunca hafif basınç uygulayarak, bölgedeki hemostazı teşvik etmek için pamuklu çubuğu tutarak iğneyi damardan çıkarın
8. Kardiyak ponksiyon ekskanguiasyonu ile ötenazi
- Hayvanı, bölüm 7'de anlatıldığı gibi anestezi yapması için kısıtlayın. 5 mL'lik bir şırıngaya bağlı 20 x 0,55 mm'lik bir iğne ile, 45º'lik bir açıyla yerleştirilmiş ve ksifoid kıkırdağın hemen altında hafifçe sola eğimli olarak kardiyak ponksiyon yapın.
- 1 mL kan çekin. Terminal kan alımından sonra, şırıngayı çıkarın, ancak iğneyi kalpte tutun.
- Hayvan zaten nefes alıyorsa ve bir kalp atışı gösteriyorsa, 5 mL'lik bir şırınga ile tiyopental sodyum% 5 (200 mg / kg) uygulayın ve zaten kalpte bulunan 20 x 0.55 mm'lik iğneye bağlayın.
- 5 dakika sonra bir stetoskop ile herhangi bir solunum hareketi ve kalp atışı olup olmadığını doğrulayın.
9. Organ ve dokulardan DNA ekstraksiyonu
- Ötenaziden sonra dalak, mezenterik lenf bezleri ve karaciğer parçalarını toplayın.
- Dokuları kuru buz üzerinde dondurarak, çözdürerek ve iki neşter bıçağıyla keserek kesin. 17.5 μL proteinaz K (20 mg / mL) ile 600 μL lizis tamponunda 20 mg kıyma dokusunu sindirin ve gece boyunca 55 ° C'de inkübe edin.
- 15.000 × g'da 4 dakika boyunca santrifüj edin ve parçalanmamış doku parçalarını çıkarın.
- 200 μL protein çökeltme çözeltisi ekleyin, 20 saniye kuvvetlice karıştırın, buz üzerinde 5 dakika inkübe edin ve 15.000 × g'da 4 dakika santrifüjleyin.
- Süpernatanı başka bir tüpe aktarın, 600 μL izopropanol ekleyin ve DNA çökelene kadar hafifçe karıştırın. DNA'yı 15.000 × g'da 2 dakika santrifüjleyin ve peleti 30 dakika boyunca eğimli çalkalayıcı ve santrifüjde %70 etanol ile yıkayın.
- Etanolü atın ve peleti oda sıcaklığında kurutun. DNA'yı 50-200 μL ultra saf su ile 65 ° C'de 30 dakika boyunca yeniden hidratlayın, DNA'yı 0.1 μg / mL'ye seyreltin ve seyreltin ve -20 ° C'de saklayın.
10. Doku ve organlardaki enfeksiyonun PCR ile değerlendirilmesi
- Konvansiyonel PCR ile doku ve organların genomik DNA'sındaki parazit yükünü değerlendirin: 2.5 μL PCR Tamponu, 1.5 mMMgS04, 0,2 mM dNTP, 1 U DNA polimeraz, 300 ng genomik DNA, her primerden 0.2 μM ve 25 μL'lik bir nihai hacme kadar nükleaz içermeyen su.
- L. infantum kDNA18 protokolünü kullanarak çoğaltın: 94 ° C'de 2 dakika boyunca bir denatürasyon döngüsü; 39 amplifikasyon döngüsü, 94 °C'de 30 sn, 60 °C'de 15 sn, 72 °C'de 30 sn, 72 °C'de 5 dakikalık son uzatma. PCR ürününün beklenen boyutu 145 bp'dir. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- PCR3'ün endojen kontrolü olan hamster GAPDH'yi güçlendirin: 94 °C'de 2 dakika boyunca bir denatürasyon döngüsü, 39 döngü amplifikasyon, 94 °C'de 30 s, 58 °C'de 15 s, 72 °C'de 30 s, 72 °C'de 5 dakikalık son uzatma. (1) Fw GAPDH hamster 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH hamster 5'- TTCACCTGTTCCACAGCCTTG -3'.
- PCR ürünlerini %1 agaroz jel elektroforezi ile analiz edin.
11. İn vivo biyolüminesans görüntüleme ile hamster takibi
- Işık geçirmez bir odaya monte edilmiş soğutulmuş bir şarj bağlantılı kameradan (CCD) oluşan biyolüminesans in vivo görüntüleme sisteminde tüm hayvanın biyolüminesans emisyonu ile enfeksiyonun zaman içindeki ilerlemesini değerlendirin. Burun konisi ile görüntü alımı sırasında hayvanı uyuşturulmuş halde tutun.
- Biyolüminesans alımından önce ve anesteziyi indüklemeden 5 dakika önce, D-lusiferini (150 mg / kg) bölüm 6'yı takip ederek hamsterlara intraperitoneal olarak enjekte edin. PBS'de 15 mg / mL D-lusiferin potasyum tuzu stok çözeltisi hazırlayın, filtreyle sterilize edin ve -80 ° C'desaklayın.
- Hayvanlara D-lusiferin enjekte ettikten beş dakika sonra, oksijen açısından zengin bir indüksiyon odasında% 2 izofluran ile anestezi yapın. 5 dakika daha sonra, CCD kamerayı kullanarak biyolüminesans görüntüleri yakalayın. Enfeksiyondan 2 saat ve 24 saat sonra, enfeksiyondan 8 ve 22 gün sonra (dpi) ventral pozisyonda hamsterlerin görüntülerini elde edin.
NOT: İzofloran-oksijen verme cihazı ile görüntüleme işlemi sırasında anesteziyi koruyun. - Biyolüminesans emisyon seviyesine bağlı olarak, aşağıdaki parametreleri kullanın: 30 s ile 5 dakika arasında değişen maruz kalma süresi, Gruplama orta veya büyük, f/stop 1 ve görüş alanı D (12, 5 cm).
12. L. infantum-Luc ile enfekte olmuş hayvanlarda biyolüminesans miktar tayini
- Hayvanın ilgi alanlarını (ROI), boyutunu ve baş ve vücudundaki alanı belirlemek için manuel ölçüm aracını kullanın. Seçilen ROI'de CCD kamera tarafından elde edilen biyolüminesansı ölçün.
- Arka plan sinyalini ortalama arka plan yatırım getirisi ile ölçün ve manuel yatırım getirisinden elde edilen biyolüminesan emisyondan çıkarın.
- Biyolüminesans emisyonunu, zaman ve alana göre normalleştirilmiş bir birim olan parlaklık olarak ifade edin: photons.sec-1.cm-2.sr-1
Sonuçlar
L. infantum'da lusiferazın kararlı ifadesi
Genetik olarak modifiye edilmiş L. infantum, transkripsiyonu RNA polimeraz I tarafından yönlendirilen 18S rRNA (ssu) ribozomal lokusunda Leishmania genomuna entegre olan pLEXSY hattının plazmidi kullanılarak üretildi. Böylece, L. infantum-Luc klonları, Leishmania genomundaki plazmit entegrasyonu ve in vitro biyolüminesans emisyonu ile kararlı ekspresyon açısından değerlendirildi. Arka planın >120 kat üzerinde biyolüminesans gösteren yüksek eksprese edici klon, PCR ile genomik entegrasyonun değerlendirilmesi için seçildi. L. infantum-Luc klonunun promastigotlarının genomundaki plazmit entegrasyonunu ve biyolüminesans emisyonunu (RLU) değerlendirmek için PCR ürünlerinin agaroz jel elektroforezi için Şekil 1'e bakınız. Her PCR'den beklenen büyüklükte fragmanlar elde edildi; yaklaşık 1,1 kb'lik (5'ssu - utr1) bir ürün ve 1.8 kb'lik (hyg-3'ssu) bir başka ürün, L. infantum-Luc genomundan amplifiye edildi (Şekil 1A), plazmit kasetinin ve lusiferaz geninin L. infantum genomunun ssu lokusundaki entegrasyonunu doğruladı.
Ateşböceği lusiferaz ekspresyonu, protokoller, bölüm 2'de açıklandığı gibi, mikroplaka okuyucusunda biyolüminesans emisyonu (RLU) ile L. infantum-Luc'un promastigotlarında da değerlendirildi. Kültürde ve BALB / c farelerinde 5 gün boyunca birkaç geçişten sonra bile, biyolüminesans seviyesini korudu; Yabani tip arka plan için 569.3 ± 19.5 ve klonlanmış L. infantum-Luc için 59361.9 ± 2673.3 (n = 2) (Şekil 1B). Bu nedenle, ateşböceği lusiferazı stabil bir şekilde eksprese eden L. infantum-Luc klonu, hamsterleri intragingival veya intraperitoneal yollarla enfekte etmek için kullanıldı.
Dişeti toplardamarında intravenöz inokülum
Leishmania'yı hamsterların kan dolaşımına aşılamak için, damar delinmesini, kanamayı ve aşının sızmasını en aza indirmek için özen gösterilmelidir. Bu nedenle, dişeti damarını ortaya çıkarmak için alt dudağın nazikçe aşağı çekilmesi gerekir (Şekil 2A); ve damarın aşırı delinmesini önlemek için daha küçük bir ölçü 30 G iğne kullanılmalıdır. Damara uygun bir açıyla sokmak için iğnenin çerçeve yukarı bakacak şekilde konumlandırılması gerekir (Şekil 2B). Gerçekten de, iğnenin damara-mandibular labial ven'e enjekte edildiğinden emin olmak için, şırınga pistonu, iğne namlusuna kan aspire edilene kadar aşağı çekilmelidir (Şekil 2C). İğne çıkarılmadan önce, hemostazı teşvik etmek için pamuklu çubukla hafif basınç uygulanmalıdır (Şekil 2D).
Biyolüminesans görüntüleme ile boylamsal değerlendirme
L. infantum-Luc ile intraperitoneal (İP) veya intragingival (IG) yolla enfekte olan hamsterlar 50. dpi'ye kadar takip edildi ve 22 dpi'ye kadar biyolüminesans görüntüleme ile değerlendirildi (Şekil 3). Görüntüler, periton boşluğunda 108 parazit ile intraperitoneal enfeksiyondan 2 saat sonra elde edildi; Görüntüler 30 sn veya 1 dakikalık pozlama gruplama ortamı için elde edildi. Biyolüminesans sinyali, amastigot ile enfekte olmuş hayvanlarda (4.6 ×10 5 ± 3.7 × 105) karın bölgesinde promastigot enfekte olanlara göre (6.8 × 103 ± 3.8 × 103) >65 kat daha yoğundu) (Tablo 1), bu da in vitro olarak farklılaşan amastigotların, durağan fazda metasiklik promastigotlardan daha fazla biyolüminesan olduğunu ve Ficoll yastığında saflaştırıldığını göstermektedir.
Enfeksiyondan bir gün sonra (1 dpi), 3 dakikalık sergi için biyolüminesans görüntüleri elde edildi (Şekil 3). Promastigot ile enfekte olmuş hamsterlerde abdominal bölgedeki biyolüminesans sinyalinde %45'lik bir azalma ve amastigot ile enfekte olanlarda %70'lik bir azalma olmuştur (Şekil 3), bu da amastigotların metasiklik promastigotlardan daha fazla bozulduğunu göstermektedir (Tablo 1 ve Şekil 4). Enfeksiyondan bir hafta sonra (8 dpi), promastigot ile enfekte hayvanlar biyolüminesans sinyalini sürdürdü (3.3 × 103 ± 5 × 103). Bununla birlikte, amastigot ile enfekte olmuş hamsterlerde biyolüminesans emisyonu% 95 düşerek 1.3'×ten 105 '± 1.1'× 105'ten 6.7'× 103 ± 7.5 × 103'e düştü (Tablo 1) ve promastigot ile enfekte olmuş hamsterlerin aynı seviyesine ulaştı. Enfeksiyondan üç hafta sonra (22 dpi), 5 dakikalık pozlama ve büyük gruplama için bir biyolüminesans sinyali elde edildi (Şekil 3); promastigotlar ve amastigot ile enfekte olmuş hayvanlar için sinyal çok daha düşüktü (Tablo 1 ve Şekil 4).
Başka bir hamster grubu, L. infantum-Luc'un amastigotları ve promastigotları ile intragingival yolla enfekte olmuştur (10,8); maksiller bölgede biyolüminesans emisyonu gözlendi (Şekil 3). Takip enfeksiyondan 1 gün sonra başladı ve amastigot ile enfekte olmuş hamsterler, promastigot ile enfekte olanlardan (1 × 103 ± 5.7 × 102) daha fazla biyolüminesans sinyali ve parlaklık (7.3 × 103 ± 4.1 × 103) gösterdi. Enfeksiyondan bir hafta sonra (8 dpi), promastigot ile enfekte hayvanlarda biyolüminesans sinyalinde% 36 ve amastigot ile enfekte hamsterlerde% 90'lık bir düşüş gözlenmiştir; parlaklık 7.3 × 103 ± 4.1 × 103 ile 7.8 × 102 ± 5.6 × 102 arasında değişmiştir (Tablo 1). Enfeksiyondan üç hafta sonra (22 dpi), 5 dakikalık pozlama ve büyük gruplama için bir biyolüminesans sinyali de elde edildi (Şekil 3). Promastigot ve amastigot ile enfekte olmuş hayvanlarda dişeti ile enfekte olmuş hayvanların kafasında biyolüminesans sinyali benzer ve düşüktü (Tablo 1 ve Şekil 4) ve biyolüminesans sinyali ile enfeksiyonun abdominal bölgeye dağıldığı gözlenmedi.
Doku ve organlardaki enfeksiyonun PCR ile değerlendirilmesi
Karaciğer, dalak ve lenf nodları gibi in vivo görüntülemenin tespit sınırının altında olabilecek belirli organlardaki enfeksiyonu araştırmak için konvansiyonel PCR gerçekleştirdik. kDNA'nın hedef bölgesi, enfekte doku ve organlarda L. infantum DNA amplifikasyonu için daha spesifikti ve hamsterdan alınan GAPDH enzimi için PCR, DNA bütünlüğünün ve PCR reaksiyonunun bir kontrolüydü. Analizde sadece GAPDH için amplifiye edilen numuneler dikkate alınmıştır. Böylece, PCR ile, aksenik amastigotlarla intraperitoneal yolla enfekte olan üç hamsterdan ikisi doku ve organlarda enfeksiyon gösterdi; dalakta ikinci hayvan (A2) ve karaciğerde üçüncü hayvan (A3), 50 dpi'de (Şekil 5A). Bir hamster intraperitoneal olarak aksenik promastigotlarla enfekte edildi; üçüncü hayvan (A3) (Şekil 5B) lenf nodunda amplifikasyon gösterdi. İntragingival olarak 50 dpi'de promastigotlar veya aksenik amastigotlarla aşılanan hamsterlar, promastigotlarla enfekte olmuş bir hayvanın (A1) karaciğerinde sadece bir bant olan net bir amplifikasyon gösteremedi (Şekil 5C). Özellikle, 8 ay boyunca bakımı yapılan ve intragingival yolla amastigotlarla verilen aşıları enjeksiyon sırasında hafifçe sızan üç hayvanımız vardı. Üç hayvandan ikisi, birinci ve ikinci hayvanlarda karaciğerde belirgin bir enfeksiyon gösterdi (Şekil 5D).
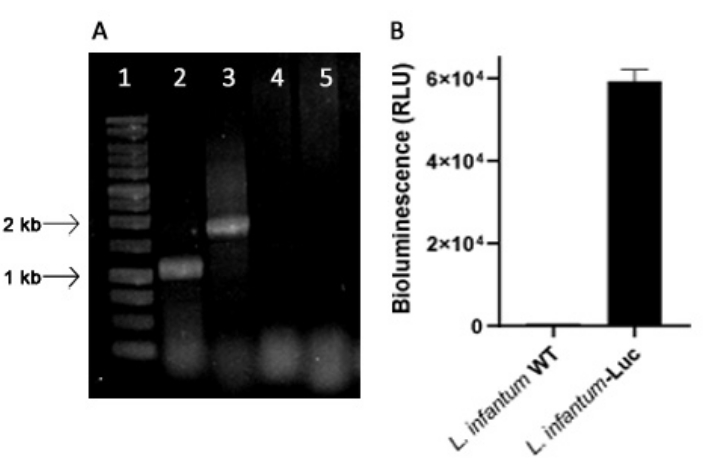
Şekil 1: Leishmania infantum-Luc klonunun PCR ve biyolüminesans emisyonu ile değerlendirilmesi. (A) Genomdaki plazmit entegrasyonunu değerlendirmek için PCR ürünlerinin agaroz jel elektroforezi: şerit 1 - 1 kb DNA merdiveni; L. infantum-Luc genomik DNA'sının PCR'si, şerit 2 - 5'ssu - utr1 (1.1 kb) ve şerit 3- hyg-3'ssu (1.8 kb); L. infantum-wt genomik DNA'nın PCR'si, şerit 4 ve 5. (B) Mikroplaka okuyucuda L. infantum-Luc klonunun (10,6) promastigotlarının biyolüminesans emisyonu (RLU). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Leishmania infantum-Luc'un dişeti venine intravenöz enjeksiyonu. (A) Hamster dorsal dekübite yerleştirildi ve alt dudak aşağı çekildi. (B) 1 mL'lik bir şırıngaya bağlı daha ince bir iğne (8 x 0.30 mm), 25º'lik bir açıyla diş çifti arasındaki orta çizgi boyunca alt kesici dişlerin altına yerleştirildi ve mandibularis labialis venine 2-4 mm yerleştirildi. (C) PBS'de 50 μL (10,8) amastigot veya promastigot aşısı. (D) Pamuklu çubuk kullanarak ve aşılama bölgesine hafif basınç uygulayarak hemostaz yapın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
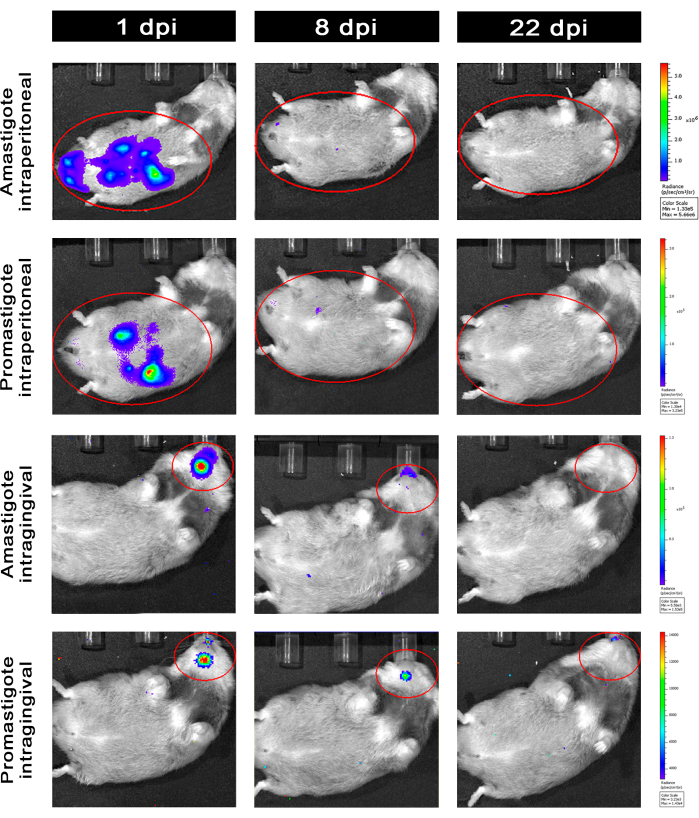
Şekil 3: İn vivo biyolüminesans görüntüleme ile takip. Grup başına bir hayvanın temsili görüntüleri: 1, 8 ve 22 dpi için L. infantum-Luc'un amastigotları veya promastigotları ile intraperitoneal (üst paneller) veya intragingival (alt paneller) yoluyla enfekte. Kırmızı ROI, intraperitoneal veya intragingival enfeksiyon için sırasıyla karın ve kafada problanan bölgeleri temsil eder. Veriler, 1 dpi'de tüm hayvanların karın veya mandibulada biyolüminesans sinyali gösterdiğini göstermektedir. Sinyal 8 dpi'den sonra düşüyordu ve 22 dpi'de herhangi bir grupta neredeyse algılanamıyordu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
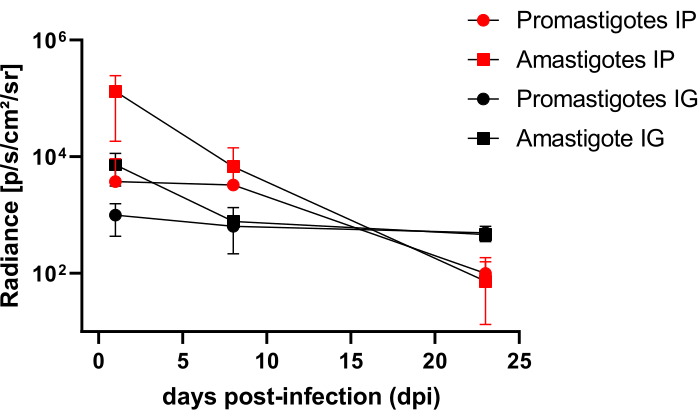
Şekil 4: Biyolüminesans görüntülerinden elde edilen parlaklığın karşılaştırmalı analizi. Parlaklık ölçümü photons.sec-1.cm-2.sr-1, manuel ROI ölçüm araçları ile hamsterların karnında veya başında gerçekleştirildi. Ortalama arka plan yatırım getirisi, herhangi bir sahte sinyali ortadan kaldırmak için ölçüm yatırım getirisinden çıkarıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
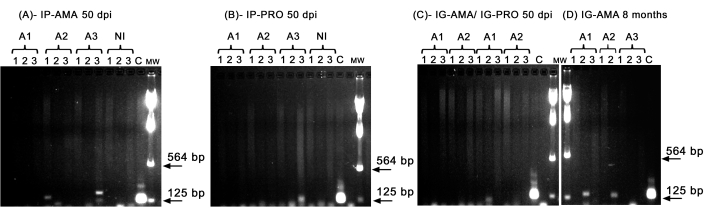
Şekil 5: kDNA'nın PCR amplifikasyonu. (A) IP-AMA, amastigot ile intraperitoneal yolla enfekte olmuş hamsterler, 50 dpi (n = 3); (B) Promastigotlarla intraperitoneal yolla enfekte IP-PRO, 50 dpi (n = 3); (C) AMASTİGOT ile intragingival yolla enfekte olan IG-AMA (n = 2), promastigot ile intragingival yolla enfekte olan IG-PRO (n = 2); (D) IG-AMA, enfeksiyondan 8 ay sonra amastigot ile intragingival yolla enfekte (n = 3). NI, negatif kontrol olarak enfekte olmamış hamsterlar (n = 2); C- L. infantum-Luc'un genomik DNA'sı, PCR'nin pozitif kontrolü. Dokular ve organlar: 1- dalak, 2- karaciğer, 3- lenf düğümleri. MW- moleküler ağırlık işaretçisi, oklar daha düşük moleküler ağırlık bantlarını gösterir. A1- birinci hayvan, A2- ikinci hayvan ve A3- üçüncü hayvan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| dpi | Amastigotes IP | Promastigotlar IP | Amastigotlar IG | Promastigotlar IG | ||||||||
| Demek | SD | N | Demek | SD | N | Demek | SD | N | Demek | SD | N | |
| 0 | 4,6 × 105 | 3,7 × 105 | 3 | 6,8 × 103 | 3,8 × 103 | 3 | - | - | - | - | - | - |
| 1 | 1,3 × 105 | 1,1 × 105 | 3 | 3,8 × 103 | 5,5 × 103 | 3 | 7,3 × 103 | 4,1 × 103 | 2 | 1,0 x 103 | 5,7 × 102 | 2 |
| 8 | 6,7 × 103 | 7,5 × 103 | 3 | 3,3 x 103 | 5,0 × 103 | 3 | 7,8 × 102 | 5,6 × 102 | 2 | 6,4 × 102 | 8,2 × 101 | 2 |
| 22 | 7,3 × 101 | 8,5 x 101 | 3 | 9,9 x 101 | 8,6 × 101 | 3 | 4,6 × 102 | 7,5 x 101 | 2 | 5,0 × 102 | 1,5 x 102 | 2 |
Tablo 1: Biyolüminesans görüntülerinin karşılaştırmalı parlaklık analizinden elde edilen ham veriler. Parlaklık nicelemesi ortalama fotons.sec-1.cm-2.sr-1 grup ve rotaya göre. Kısaltmalar: dpi = enfeksiyondan sonraki gün sayısı; SD = standart sapma; N = örneklem büyüklüğü.
Tartışmalar
Hamsterlara kan alınması veya intravenöz madde enjeksiyonu, çeşitli bilimsel çalışmalar için gereklidir. Araştırma hedefleri ile doğrudan ilişkili farklı toplama veya aşılama yollarına erişmek için çeşitli yöntemler geliştirilmiştir19. Hamster anatomisi nedeniyle - kısa bir kuyruk ve uzuvlar - intrakardiyak yol genellikle Leishmania'nın intravenöz enjeksiyonu için seçimdir. Kullanılan suşa bağlı olarak, intrakardiyak yol, enfeksiyonu uzun vadede, 6-9 ay boyunca ortaya çıkan referans suşu L. infantum MHOM / BR / 1974 / PP75 olarak avantajlı olduğunu kanıtladı5. Bununla birlikte, kanamaya ve hayvanın ölümüne yol açabilecek bir aşıdır. Bu nedenle, dişeti pleksusunda, mandibular labial vende enfeksiyon için hayvana daha az zarar veren alternatif bir intravenöz aşılama yolunu standardize ettik. Hayvanlar, aynı bütünleştirici plazmid 20 tarafından transfekte edilen diğer Leishmania türleri için ilişkili olarak, kültür ve farelerde birkaç geçişten sonra bile ateşböceği lusiferazı stabil bir şekilde ifade eden genetik olarak değiştirilmiş referans suşu L. infantum MHOM/BR/1974/PP75 ile enfekte edildi.
Mandibularis labialis veni veya gingival ven, kan örneklemesi için ve çoklu kan alımı için daha iyi bir yoldur10,11. Bununla birlikte, bu, dişeti damarının hamsterlarda Leishmania tarafından intravenöz enfeksiyon için uygun bir bölge olduğunun ilk göstergesidir. Kan hemolizini10 önlemek için genellikle yüksek ölçülü 26 G'lik bir iğne kullanan kan örneklemesinin aksine, bu iğne ölçer damar delinmesi, kanama ve aşının sızması nedeniyle Leishmania aşılaması için uygun değildi. Maksiller mandibularis veni yoluyla Leishmania enfeksiyonu için daha küçük bir 30G iğne gerekliydi. Damar ponksiyonunu dişeti damarı yoluyla enfeksiyona ayıran bir diğer husus, yaklaşık 1 μL/s'lik uygulama hızıdır; ve damar - mandibular labial ven içine enjekte edildiğinden ve mukoza, deri altı veya intradermal içinde yerleşmediğinden emin olmak için. Gingival pleksusun düşük kan döngüsü nedeniyle, 50 μL'lik yüksek yoğunluklu aksenik amastigot veya L. infantum-Luc promastigot aşısı, 2 x 109 parazit/mL, yavaşça inoküle edilmeli (~ 1 dakika) ve aşının kan dolaşımında dağılmasını sağlamak için sürüntü 1 dakika basılı tutularak iğne çıkarılmalıdır (Şekil 2).
Enfeksiyonun boylamsal değerlendirilmesi için hamsterlar intraperitoneal (İP) veya intragingival (IG) yolla L. infantum-Luc ile enfekte edildi ve ötenaziye kadar biyolüminesans görüntüleme sistemi tarafından 50 dpi takip edildi. Referans suş PP75'in kendi başına daha az öldürücü olabileceği ve lusiferazın süper ekspresyonunun da enfeksiyon etkinliğini etkileyebileceği ve enfeksiyonu uzun süre koruyabileceği göz önüne alındığında, enfeksiyon için 108 parazitten oluşan yüksek bir aşı kullanıldı. L. infantum-Luc'un hem amastigotlarının hem de promastigotlarının dişeti inokülasyonundan ve biyolüminesans görüntüleme sistemi ile değerlendirilmesinden sonra, biyolüminesans enfeksiyondan 24 saat sonra hamsterlerin maksiller bölgesi ile sınırlandırıldı. Gerçekten de, L. infantum-Luc'un amastigotları ve promastigotları ile intraperitoneal olarak enfekte olan hamsterlar, karın boyunca dağılmış biyolüminesans göstermiştir (Şekil 3, 1 dpi). L. infantum-Luc ile enfekte olmuş hamsterlerde enfeksiyonun ilk gününden 8. güne ve 22. dpi'ye kadar geçen süre boyunca biyolüminesan emisyondaki sürekli azalma, aşılama yolundan bağımsızdı (Tablo 1 ve Şekil 4).
Bununla birlikte, hayvan dokularındaki parazit yükü düşük olduğunda, biyolüminesans görüntüleme sisteminin tespit sınırının altında olabilir, ancak PCR veya qPCR ile tespit edilebilir ve ölçülebilir. Daha önce bildirildiği gibi, PP75 suşunun neden olduğu enfeksiyon gerçekten de diğer suşlarınkinden5 daha düşüktür ve hayvanların genetik değişkenliğine bağlı olarak hastalığın sadece birkaç klinik belirtisi gelişmiştir. Bu çalışmada, az sayıda hayvana ve bu suşun düşük virülansına rağmen, aksenik amastigotlar, PCR ile gösterildiği gibi, promastigotlardan daha iyi enfeksiyon gösteren 50 dpi'de bir avantaj göstermiştir (Şekil 5). Dişeti yolu ile amastigotlar ile enfeksiyondan sekiz ay sonra, karaciğerde PCR ile parazitler tespit edilebildi (Şekil 5) ve ayrıca orta derecede piloereksiyon, orbital sıkılık ve kemerli postür gösterdiler.
Aksenik amastigotlar, enfeksiyon ve takip için promastigotlardan21 daha iyi bir seçim olabilir ve büyük ölçekte üretilmesi kolay olma avantajına sahiptir. Dişeti inokülü, bileşiklerin intravenöz inokülasyonu ve Leishmania ve diğer patojenlerin enfeksiyonu için, mandibuladaki uygulama bölgesinde veya hayvan sağlığına zarar vermeden veya şişmeden uygulanabilir ve daha iyi bir yoldur.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/ Decit-MS/CNPq/SES bu araştırma için finansal destek sağlamıştır. Aşılama yolları hakkındaki tavsiyesi için Monique Ribeiro de Lima'ya teşekkürler. Bu proje, FIOCRUZ ve Universidade Federal do Rio de Janeiro-UFRJarasındaki 258 /2017 sayılı İşbirliği Anlaşması kapsamında geliştirilmiştir. Ekip, Bilim Popülerleştirme Merkezi'nden (IOC) video yapımcıları Ricardo Baptista Schmidt ve Genilton José Vieira'ya, protokollerin filme alınması ve röportajların yürütülmesindeki paha biçilmez destekleri ve yardımları için içtenlikle minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Referanslar
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır