Method Article
ב Vivo הדמיה של אוגרים נגועים בלישמניה אינפנטום על ידי חיסון חניכיים של אמסטיגוטים אקסניים המבטאים לוציפראז
In This Article
Summary
כאן אנו מציגים הערכה אורכית של אוגרים זהובים הנגועים תוך צפקית (IP) או דרך תוך חניכיים (IG) עם L. infantum-Luc על ידי הדמיה ביולוגית ועל ידי PCR. אוגרים הוערכו יום אחד לאחר ההדבקה (1 dpi), שבוע לאחר ההדבקה (8 dpi) ו-3 שבועות לאחר ההדבקה (22 dpi) והורדמו ב-50dpi ו-8 חודשים לאחר ההדבקה.
Abstract
לישמניאזיס טגומנטרי אמריקאי (ATL) ולישמניאזיס קרביים (VL) נחשבים מוזנחים על ידי ארגון הבריאות העולמי. VL יכול להיות קטלני אם לא מטפלים בו; התרופות המשמשות בטיפול רעילות, ויש מקרים של עמידות. בדיקות פרה-קליניות יכולות להוות צוואר בקבוק בגילוי תרופות חדשות לטיפול, בהתאם למודל החי, הזן בו נעשה שימוש ומסלול החיסון. האוגר הזהוב בולט ברגישותו הגבוהה לתת-הסוגים Viannia ו-Leishmania , ומציג רבים מהתהליכים הקליניים והאימונופתולוגיים שנצפו במחלות אנושיות.
על ידי אנטומיה של אוגר, שיש לה זנב וגפיים קצרים, המסלול התוך-לבבי הוא בדרך כלל הבחירה להזרקה תוך ורידית של לישמניה. עם זאת, זהו חיסון שעלול להוביל לדימום ובסופו של דבר למוות של בעלי חיים. לפיכך, תיקננו מסלול חיסון תוך-ורידי חלופי לזיהום בווריד החניכיים, שהוא זעיר פולשני, מאפשר גישה נוחה לוורידים וגורם למעט פגיעות מקומיות ומערכתיות לבעל החיים. לכן, אוגרים שנדבקו במסלול התוך-צפקי (IP) או תוך-חניכיים (IG) עם לישמניה אינפנטום המבטא לוציפראז (Luc) היו במעקב במשך 22 יום על ידי מערכת ההדמיה הביולוגית ו-50 יום ו-8 חודשים לאחר ההדבקה על ידי PCR.
לאחר חיסון חניכיים הן של אמסטיגוטים אקסניים והן של פרומסטיגוטים של L. infantum-Luc, ביולומינסנציה הוגבלה למשך שבועיים לפחות במקום ההזרקה, המהווה אינדיקטור לזיהום ברקמות סביב מקלעת החניכיים. אוגרים שנדבקו תוך צפקית ב-L. infantum-Luc הראו ביולומינסנציה מפוזרת בכל הבטן, כצפוי. עם זאת, על ידי מערכת ההדמיה הביו-לומינסנציה הזיהום ירד עד ה-50 dpi וניתן היה לזהות אותו רק על ידי PCR. אמסטיגוטים אקסניים הראו זיהום טוב יותר מאשר פרומסטיגוטים, כפי שהוערך על ידי PCR. ואכן, 8 חודשים לאחר ההדבקה, טפילים זוהו על ידי PCR בכבד של בעלי חיים שחוסנו באמסטיגוטים אקסניים בדרך התוך-ורידית, מה שיכול להיות מאפיין של זן הייחוס של L. infantum MHOM/BR/1974/PP75, שהזיהום שלו מתקדם לאט ומציג עומס טפילים נמוך, מתחת לרזולוציית ההדמיה הביולוגית. לפיכך, אמסטיגוטים אקסניים יכולים להיות בחירה טובה יותר לזיהום ומעקב מאשר פרומסטיגוטים, וחיסון החניכיים הוא דרך אפשרית להזרקה תוך ורידית של לישמניה, ופתוגנים אחרים.
Introduction
הלישמניאזיס נחשבת למחלות מוזנחות ומתעוררות מחדש הנגרמות על ידי יותר מ-20 מינים של לישמניה, אנדמיות במספר מדינות בארבעת האזורים האקולוגיים-אפידמיולוגיים המרכזיים: אמריקה הלטינית, צפון ומזרח אפריקה ומערב ודרום מזרח אסיה1. ניתן לקבץ אותם כטגומנטרי (TL) ולישמניאזיס קרביים (VL), שהיא קטלנית אם לא מטפלים בה. הגורם האטיולוגי של VL בברזיל הוא Leishmania infantum, והטיפול מתבצע באמצעות אנטימוניאלים מחומשים או Amphotericin B. תרופות אלו ניתנות דרך הווריד, בעלות רעילות גבוהה, מציגות תגובות שליליות וישנם מקרים של עמידות2.
לפיכך, יש צורך להשקיע בחיפוש אחר כימותרפיה חדשה. ניסויים פרה-קליניים מהווים, למעשה, צוואר בקבוק בגילוי תרופות חדשות לטיפול ב-VL, בהתאם למודל החי, הזן בו נעשה שימוש, מסלול החיסון וגורמים לוגיסטיים, טכניים ותפעוליים אחרים. האוגר הזהוב בולט ברגישותו הגבוהה למינים של תת-הסוגים Viannia ו-Leishmania, ומציג רבים מהתהליכים הקליניים והאימונופתולוגיים שנצפו במחלה האנושית כפי שנצפו במחקרים קודמים עם Leishmania braziliensis 3,4. האוגר הנגוע ב-L. infantum מפתח גם את רוב התהליכים האימונופתולוגיים האופייניים ל-VL בבני אדם וכלבים5, כגון אנמיה, לויקופניה, טרומבוציטופניה והפטוספלנומגליה. בנוסף, האוגר הזהוב הוא בעל חיים שנולד ואינו מראה תגובה אחידה, מה שמשחזר את ההטרוגניות של הביטויים הקליניים כפי שניתן לראות בבני אדם3.
היבט נוסף שיש לקחת בחשבון עבור תוצאת ההדבקה הוא זן L. infantum ודרך החיסון. מספר זנים של L. infantum נבדלים זה מזה ברקע הגנטי וברגישות לטיפול 2,6,7. לחלק מהזנים יש עומס טפילי נמוך בכבד ובטחול לאחר זיהום פרומסטיגוטים8, ואמסטיגוטים אקסניים יכולים להוות אלטרנטיבה לשיפור הזיהום שאינו נחקר הרבה. ואכן, הנתיב התוך-ורידי מעדיף זיהום ומגביר את תדירות בעלי החיים עם סימנים קליניים; אבל חיסון תוך-צפקי הוא הנפוץ ביותר. המסלול התוך-לבבי הוא הבחירה לזיהום תוך ורידי עם L. infantum 5,8,9. עם זאת, באוגרים, חיסון תוך חניכיים הוא דרך חלופית להזרקה תוך ורידית, שאינה מתוארת כאתר לזיהום. למרות הדיווח, ניקור ורידים חניכיים הוא זעיר פולשני, מאפשר גישה קלה לוורידים וגורם למעט פציעות מקומיות ומערכתיות10. ניקוב וריד החניכיים מסכים ביותר עם ההמלצות למקסם את האיכות והישימות של התוצאות תוך שמירה על רווחת בעלי החיים11.
הערכה פרה-קלינית של תרכובות ל-VL בשיטות מסורתיות דורשת יותר בעלי חיים, אותם יש להמית לצורך ניתוח היסטופתולוגי והערכת עומס הטפילים ברקמות. לעומת זאת, מערכת ההדמיה הביולוגית יכולה להאיץ מחקרים פרה-קליניים ולהפחית את מספר בעלי החיים. ניתן לעקוב אחר האתרים הביולוגיים ברקמות הנגועות בזמן אמת באותה חיה במשך מספר שבועות. מספר מחקרים על הסטנדרטיזציה של כלי טכנולוגי חיוני זה הראו את יישומו במחקרים עם עכברים שנדבקו ב-Trypanosoma cruzi, Leishmania spp. ו-Toxoplasma gondii 12,13,14,15. עם זאת, בהתאם לעומס הטפיל ברקמה, ניתן לזהות ביולומינסנציה על ידי מערכת ההדמיה in vivo, הדורשת הערכה על ידי PCR כמותי של האיברים הפגועים. לכן, אנו מציעים לפתח מתודולוגיה המבוססת על הזרקה תוך ורידית של L. infantum המבטא לוציפראז בווריד החניכיים של אוגרים זהובים למעקב על ידי מערכת ההדמיה הביולוגית וה-PCR.
Protocol
הפרוטוקולים הנוגעים לאוגרים פעלו בהתאם להנחיות של ועדת האתיקה במחקר בבעלי חיים של מכון אוסוולדו קרוז/IOC (אישור: CEUA/IOC L-015/2022).
1. שיבוט של גן לוציפראז גחלילית לפלסמיד ביטוי הלישמניה
- עכל את הפלסמיד pLEXSY-hyg2 עם אנדונוקלאז BglII (10 U/μL) ו-NotI (10 U/μL). עכל תחילה עם BglII: הוסף 50μL של פלסמיד (9 מיקרוגרם של DNA), 30 מיקרוליטר של מאגר אנזים הגבלה, 3 מיקרוליטר של אלבומין בסרום בקר (BSA), 3 מיקרוליטר של BglII ומים נטולי נוקלאז לנפח סופי של 300 מיקרוליטר. יש לדגור למשך 3 שעות בטמפרטורה של 37 מעלות צלזיוס.
- עכל את הפלסמיד TOPOII/LUC עם BamHI (10 U/μL) ו-NotI כדי לשחרר את מסגרת הקריאה הפתוחה של לוציפראז הגחלילית עם רצף Kozak (Kozak-LUC), משובט בווקטור TOPOII16. לעכל תחילה עם BamHI: מערבבים 100 מיקרוליטר פלסמיד (8.5 מיקרוגרם DNA) עם 30 מיקרוליטר של מאגר אנזימי הגבלה; 3 מיקרוליטר BSA, 3 מיקרוליטר BamHI ומים נטולי נוקלאז לנפח סופי של 300 מיקרוליטר. יש לדגור למשך 3 שעות בטמפרטורה של 37 מעלות צלזיוס.
- נקה כל פלסמיד על קרום סיליקה והוציא את ה-DNA פעמיים עם 50 מיקרוליטר מים לנפח סופי של 100 מיקרוליטר.
- עכל כפול את הפלסמידים pLEXSY-hyg2 ו-TOPOII/LUC שעברו בעבר ליניאריים עם NotI. מערבבים 100 מיקרוליטר מה-DNA שנפלט מקרום הסיליקה ל-15 מיקרוליטר של מאגר D, 2 מיקרוליטר של NotI ומים נטולי נוקלאז לנפח סופי של 150 מיקרוליטר. יש לדגור למשך שעה בטמפרטורה של 37 מעלות צלזיוס.
- ג'ל מטהר את הווקטור המעוכל הכפול (pLEXSY-hyg2) ואת התוספת, Kozak-LUC, מג'ל אגרוז 1% לאחר אלקטרופורזה עם מאגר Tris-acetate EDTA (TAE). הסר את הרצועות של ~8 kb ו-1.6kb בעזרת אזמל. שוקלים את הפרוסות, מוסיפים שלושה נפחים של חיץ לנפח אחד של ג'ל, דוגרים ב-50 מעלות צלזיוס כדי להמיס את הג'ל, מעבירים לקרום הסיליקה, ושוטפים ומסירים את ה-DNA פעמיים עם 20 מיקרוליטר מים, בנפח סופי של 40 מיקרוליטר.
- קשרו את הווקטור הכפול (pLEXSY-hyg2) ואת התוספת, Kozak-LUC, עם ה-T4 ligase: ערבבו 2 מיקרוליטר של וקטור והכניסו, שניהם ב-55 ננוגרם/מיקרוליטר, יחס מולארי של 1:5; הוסף 5 מיקרוליטר של מאגר קשירה; 1 מיקרוליטר של T4 DNA ליגאז (1U / מ"ל), נפח סופי של 10 מיקרוליטר. יש לדגור למשך הלילה בטמפרטורה של 16 מעלות צלזיוס.
- הוסף 40 מיקרוליטר של מים נטולי נוקלאז ל-10 מיקרוליטר של תגובת קשירה וזרז את ה-DNA עם 10 נפחים של בוטנול. צנטריפוגה במהירות מרבית למשך 10 דקות במיקרוצנטריפוגה, שוטפים את הגלולה עם 70% אתנול, צנטריפוגה במהירות מרבית למשך 10 דקות, נותנים לגלולה להתייבש על הספסל ומוסיפים 4 מיקרוליטר מים.
- מערבבים 4 מיקרוליטר של תגובת הקשירה עם חיידקים מוכשרים חשמלית, JM109 (40 מיקרוליטר), מעבירים את התערובת לקובטה (d = 0.2 ס"מ), ושומרים אותה על קרח. אלקטרופוראט ב -2,500 וולט, 200 Ω, 25 μF, הכניס את הקובט לקרח והוסף 1 מ"ל של מדיום LB. מעבירים מיד את התערובת לצינור חרוטי של 15 מ"ל ומדגרים בחום של 37 מעלות צלזיוס למשך 60 דקות ו-100 סל"ד.
- צלחת את התערובת על שתי צלחות אגר/אמפיצילין (100 מיקרוגרם/מ"ל): אחת עם 200 מיקרוליטר ואחרת עם כל החיידקים האלקטרופורטיים. רכז את הנפח על ידי צנטריפוגה של חיידקים שעברו טרנספורמציה ב-2,000 × גרם למשך 10 דקות, השהה מחדש את הגלולה ב-100 מיקרוליטר וצלחת את כל הנפח/גלולה. דגרו על הצלחות למשך 24-30 שעות בטמפרטורה של 30 מעלות צלזיוס והמתינו לשיבוטים שיגדלו.
- בחר שיבוטים בעזרת קיסם והעביר לצינורות חרוטיים של 50 מ"ל המכילים 5 מ"ל של מדיום LB/אמפיצילין (100 מיקרוגרם/מ"ל). דגירה למשך 20-24 שעות בטמפרטורה של 30 מעלות צלזיוס ו-100 סל"ד כדי לאפשר לתרביות מיני-הכנה לצמוח.
- טהר את הפלסמיד בעזרת ערכת המיני-הכנה והוציא את ה- DNA עם 30 מיקרוליטר מים. שיבוטי מסך המכילים את המבנה pLESXY-LUC-hyg2 על ידי עיכול עם BamHI.
- מערבבים 10 מיקרוליטר DNA ממיני-פרפ; 2 מיקרוליטר של מאגר אנזים הגבלה; 0.2 מיקרוליטר BSA: 1 מיקרוליטר BamHI ומים נטולי נוקלאז עד 20 מיקרוליטר נפח סופי. דגירה למשך שעה אחת ב-37 מעלות צלזיוס צפויים שברים של שיבוטים חיוביים באלקטרופורזה של ג'ל אגרוז 1%: 3,450 ו-6,290 זוגות בסיסים.
- הכן תרבית maxiprep כדי לטהר את המבנה pLESXY-LUC-hyg2 בקנה מידה גדול יותר. הוסף ארלנמאייר (1 ליטר), 250 מ"ל של מדיום LB בתוספת אמפיצילין, ו-1 מ"ל של ה-miniprep שהועבר JM109 ודגירה למשך 18-20 שעות ב-30 מעלות צלזיוס ו-200 סל"ד.
2. ייצור ובחירה של Leishmania infantum המבטא לוציפראז
- כדי לשחרר את קלטת האינטגרציה של Leishmania , הגבלה מעכלת את הפלסמיד pLESXY-LUC-hyg2 עד להשלמה עם SwaI. הוסף 40 מיקרוליטר פלסמיד (50 מיקרוגרם), 10 מיקרוליטר של מאגר עיכול מהיר, 4 מיקרוליטר SwaI ומים נטולי נוקלאז לנפח הסופי של 100 מיקרוליטר. יש לדגור למשך הלילה בטמפרטורה של 30 מעלות צלזיוס.
- משקעים באתנול, שוטפים פעם אחת עם 70% אתנול, משהים מחדש עם 50 מיקרוליטר מים ושומרים על קרח.
- צנטריפוגה לישמניה, MHOM/BR/1974/PP75, פרומסטיגוטים במשקל של 1,000 × גרם למשך 10 דקות בשלב הגידול האקספוננציאלי במדיום שניידר. שטפו את הגלולה עם מדיום עירוי מוח ולב (BHI), וצנטריפוגה בחום של 1,000 × גרם למשך 10 דקות. השעו מחדש את הגלולה ל-108 פרומסטיגוטים/מ"ל ב-BHI.
- מערבבים את L . infantum promastigotes (500 מיקרוליטר) עם קלטת אינטגרציה pLESXY-LUC-hyg2 (50 מיקרוגרם) בקובטה האלקטרופורציה (d = 0.4 ס"מ), על קרח. אלקטרופוראט עם שני פולסים של 1,500 וולט/25 מיקרו F ומרווחים של 10 שניות. לאחר הדופק, שמור על קרח למשך 10 דקות.
- העבירו את הפרומסטיגוטים שעברו טרנספטציה לבקבוק עם המדיום של שניידר בתוספת 20% FCS ב-26 מעלות צלזיוס. לאחר 24 שעות, הוסף תחילה 50 מיקרוגרם/מ"ל, ואז הגדל ל-100 מיקרוגרם/מ"ל לאחר 48 שעות, ו-150 מיקרוגרם/מ"ל לאחר שבוע אחד.
- שיבוט העביר פרומסטיגוטים של L. infantum-Luc על ידי הגבלת דילול בצלחת של 96 בארות עם שניידר בתוספת 20% FCS ו-150 מיקרוגרם/מ"ל היגרומיצין. דגירה בטמפרטורה של 26 מעלות צלזיוס לגידול שיבוטים.
- שיבוטי מסך לבחירת L. infantum-Luc הומוגני גנטית ואקספרסיבי מאוד על ידי יחידת זוהר יחסית לפליטה ביולוגית (RLU), בקורא המיקרו-פלטות.
- בקצרה, מערבבים 106 פרומסטיגוטים בצלחת לבנה של 96 בארות עם 100 מיקרוליטר של מצע D-luciferin (300 מיקרוגרם/מ"ל) במאגר המורכב מ-25 מ"מ HEPES pH 7.8, 15 מ"מ MgCl2, 4 מ"מ EGTA, 1 מ"מ DTT, 1 מיקרוגרם/מ"ל BSA, 2.5 מ"מ ATP, 0.1% טריטון X-100 ו-300 מיקרומטר קו-אנזים A, המוערכים מיד בקורא המיקרו-פלטות.
3. PCR להערכת אינטגרציה גנומית בלוקוס הריבוזומלי 18S rRNA (ssu)
- טיהור DNA גנומי מפרובסטיגוטים המבטאים לוציפראז וסוג פרא (10,8). פרומסטיגוטות צנטריפוגות ב-1,000 × גרם למשך 10 דקות בצינורות חרוטיים של 15 מ"ל, מוסיפים לגלולה מי מלח עם חוצץ פוספט (PBS), סופרים עם תא נויבאואר וצנטריפוגה ב-1,000 ×גרם למשך 10 דקות. השעו מחדש את הגלולה עם מאגר ליזה: 100 מ"מ NaCl, 10 מ"מ טריס, 25 מ"מ EDTA, 0.5% SDS ו-0.1 מ"ג/מ"ל פרוטאינאז K לצפיפות של 108/מ"ל. יש לדגור למשך הלילה בטמפרטורה של 56 מעלות צלזיוס.
- בצע שני מחזורים של ניקוי DNA עם נפח אחד של אלכוהול פנול/כלורופורם/איזואמיל, 25:24:1 (v/v), ועם נפח אחד של כלורופורם. בין כל מחזור מיצוי, העבירו את השלב המימי לצינורות וצנטריפוגה חדשים ב-2,000 × גרם למשך 10 דקות.
- זרז את ה- DNA בשני נפחים של אתנול וצנטריפוגה ב -5,000 × גרם, 10 דקות, 4 מעלות צלזיוס. מוסיפים 1 מ"ל של 70% אתנול, מעבירים למיקרו-צינור וצנטריפוגה ב-15,000 × גרם למשך 5 דקות.
- בצע שטיפה שנייה עם 70% אתנול. לאחר הצנטריפוגה, השליכו את הסופרנטנט וייבשו את הכדור על הספסל.
- הרטיבו מחדש את ה-DNA הגנומי עם 50-100 מיקרוליטר של מים טהורים במיוחד באמבט מים בטמפרטורה של 65 מעלות צלזיוס למשך 30 דקות, כמתו את ה-DNA ואחסנו ב-20 מעלות צלזיוס.
- בצע PCR אבחנתי כדי להעריך את האינטגרציה של קלטת pLEXSY בגנום הלישמניה על ידי הגדרת תגובת ה-PCR הבאה: 10 מיקרוליטר של מאגר PCR, 0.2 מ"מ dNTP, 1 U של DNA פולימראז, 1 מיקרוגרם של DNA גנומי, 0.5 מיקרומטר מכל פריימר, ומים נטולי נוקלאז לנפח סופי של 50 מיקרוליטר.
- בחר פריימרים שמתכלאים בווקטור pLEXSY ובגנום הלישמניה: (1) פריימר הפוך aprt A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', הכלאה באזור utr1 (aprt); ו-(2) פריימר קדימה ssu F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3', בלוקוס כרומוזומלי 18SrRNA (ssu) של לישמניה.
- השתמש בפרוטוקול ההגברה הבא: מחזור אחד של דנטורציה ב-94 מעלות צלזיוס למשך 2 דקות; 30 מחזורי הגברה, 30 שניות ב-94 מעלות צלזיוס, 30 שניות ב-60 מעלות צלזיוס, דקה אחת ב-72 מעלות צלזיוס; הארכה סופית של 10 דקות ב-72 מעלות צלזיוס. הגודל הצפוי של מוצר ה-PCR הוא 1.1 Kb.
- השתמש בקבוצה שנייה של פריימרים: (1) פריימר hyg קדימה A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3, ו-(2) פריימר ההפוך ssu F3002 5'-CTGCAGGTTCACCACCAGCTAC-3', אשר מתכלאים בסמן ההתנגדות של וקטור pLEXSY ולוקוס 18SrRNA (ssu) של גנום הלישמניה . השתמש באותו פרוטוקול PCR המתואר בשלב 3.6.2 למעט טמפרטורת החישול של 53 מעלות צלזיוס, במקום 60 מעלות צלזיוס. המוצר הצפוי הוא 1.8 קילו-בייט (hyg - 3'ssu).
- נתח את תוצרי ה-PCR על ידי אלקטרופורזה של ג'ל אגרוז 1% כדי לבדוק אם הייתה אינטגרציה בלוקוס הריבוזומלי 18S rRNA של הגנום של L. infantum .
4. L. infantum- פרומסטיגוטה מטאציקלית של לוק ודיפרנציאציה של אמסטיגוטה אקסנית
- לטפח L. infantum-LucMHOM/BR/1974/PP75, המבטא באופן מכונן לוציפראז, במדיום BHI, בתוספת 25 מ"ג/ליטר המין ו-20% סרום עגל עוברי (FCS).
הערה: היגרומיצין הוצא מהמדיום של טרנספקטנטים יציבים. - כדי להשיג פרומסטיגוטים מטאציקליים של L. infantum-Luc, זרע 10 פרומסטיגוטים6/מ"לבצלוחיות בגודל 75 ס"מ, הוסף 20 מ"ל של מדיום BHI בתוספת 20% FCS ב-26 מעלותצלזיוס ושמור במצב אופקי למשך 4 ימים או נוטה מעט עד לשלב הגידול הנייח. לאחר 6-8 ימים רצופים, הבקבוק מכיל פרומסטיגוטים מטציקליים מוגברים; צנטריפוגה את הפרומסטיגוטים ב -1,000 × גרם למשך 10 דקות ב -4 מעלות צלזיוס.
- השעו מחדש את גלולת הפרומסטיגוטים עם 20 מ"ל של גלוקוז נמוך DMEM, ספרו באמצעות תא נויבאואר וצנטריפוגה ב-1,000 × גרם למשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס.
- הוסף גלוקוז נמוך DMEM לגלולה בצפיפות 3-5 × 107 פרומסטיגוטים/מ"ל. יוצקים 5 מ"ל פרומסטיגוטים על כרית Ficoll של 10 מ"ל, מדוללת ב-DMEM, 2:1 (v/v). צנטריפוגה את השיפוע ב-100 × גרם למשך 15 דקות ב-4 מעלות צלזיוס, כשהבלם כבוי ותאוצה איטית.
- אסוף פרומסטיגוטים מטציקליים בממשק, בחלק העליון של כרית Ficoll, ספר באמצעות תא Neubauer, וצנטריפוגה ב-1,000 × גרם למשך 10 דקות ב-4 מעלותצלזיוס×.
- השעו מחדש את הגלולה ב-PBS ל-2 ×-109/מ"ל. שמור פרומסטיגוטים על קרח לפני החיסון.
- פרומסטיגוטים שונים של L. infantum-Luc לאמסטיגוטים אקסניים במבחנה, במדיום מותאם לאמסטיגוט שגדל באופן אקסני (MAA)17.
- הכן MAA על ידי הוספת 9.55 גרם/ליטר של בינוני 199 עם מלחי ארלי וגלוטמין, 0.5% טריפטו-קזאין, 3 מ"מ L-ציסטאין, 15 מ"מ D-גלוקוז, 4 מ"מ NaHCO3, 0.33 מ"מ Na2HPO4, 25 מ"מ HEPES ל-pH סופי של 6.5, ותוספת של 20% סרום עגל עוברי (FCS).
- התחל תרביות בצלוחיות בינוניות (75 ס"מ2) עם 9 מ"ל של MAA בינוני ו-1 מ"ל של פרומסטיגוטים בשלב הגדילה הנייח(היום השביעי), 2-3 × 107 פרומסטיגוטים / מ"ל. דגירה למשך 24-48 שעות בטמפרטורה של 32 מעלות צלזיוס כדי לאפשר בידול אמסטיגוטה.
- שמור על אמסטיגוטים שגדלו באופן אקסני בשניים עד שלושה מעברים בשבוע עד שהם מגיעים לצפיפות של 2-3 × 107 למ"ל.
- הרחב את תרבית האמסטיגוטים האקסניים לזיהום אוגרים. הכינו150 ס"מ 2 צלוחיות בצפיפות גבוהה של אמסטיגוטים (5 × 106 / מ"ל) ב -20 מ"ל של מדיום MAA בתוספת 20% FCS.
- לאחר 24 שעות, צנטריפוגה ב-1,000 × גרם למשך 10 דקות ב-4 מעלותצלזיוס, שטפו באותו נפח של PBS, ספרו באמצעות תא נויבאואר, וצנטריפוגה ב-1,000 × גרם למשך 10 דקות ב-4 מעלותצלזיוס.
5. בעלי חיים
- רכשו אוגרים זהובים זכרים בגיל 4-6 שבועות והחזיקו אותם בהסגר למשך שבועיים. ודא שהם בני 6-8 שבועות ומשקלם 80-100 גרם כאשר הם נגועים ב-L. infantum MHOM/BR/1974/PP75.
הערה: פרוטוקול זה חל על אוגרים זכרים ונקבות כאחד. עם זאת, בשל זמינותם באותה תקופה, רק אוגרים זכרים שימשו במחקר זה. - חלקו את האוגרים לארבע קבוצות: קבוצה 1, נגועה תוך צפקית באמסטיגוטה (n = 3); קבוצה 2, נגועה תוך צפקית עם פרומסטיגוטים (n = 3); קבוצה 3, נגועה בווריד החניכיים באמסטיגוט (n = 2); קבוצה 4, נגועה בווריד החניכיים עם פרומסטיגוטה (n = 2); קבוצה 5, אוגרים לא נגועים כביקורת (n = 2).
- שמור את בעלי החיים במתלים מאווררים, מצוידים במערכת אוורור מבוקרת (10-15 החלפות אוויר לשעה), מחזור אור/חושך של 12 שעות, בטמפרטורה של 21 ± 2 מעלות צלזיוסו-40-60% לחות. לספק העשרה סביבתית, כגון נייר, חציר, כותנה הידרופובית, גלילי קרטון, מים חיטוי ומזון אד ליביטום.
6. זיהום דרך המסלול התוך-צפקי
- רסנו פיזית את האוגר על רשת הכלוב, השתמשו באגודל ובאצבע המורה כפינצטה כדי לצבוט את העור בגב מהצדדים ליד הראש, והאצבעות האחרות מושכות את העור לאורך הגב, בניסיון להשיג כמה שיותר עור.
- יישר את אתר החיסון ברבע הימני התחתון של הבטן עם השרירים האחוריים של הירך.
- יש לחסן כאשר גוף החיה מוטה ב-45 מעלות, הראש נמוך מהבטן, והמחט ממוקמת ב-15 מעלות עד 20 מעלות.
- חיסון אמסטיגוטים אקסניים או פרומסטיגוטים, 50 מיקרוליטר (108) ב-PBS, עם מחט בגודל 13 x 0.45 מ"מ המחוברת למזרק של 1 מ"ל. הכנס 0.5 ס"מ מעבר לשיפוע. לאחר החדרת המחט לבטן, משוך את הבוכנה כדי לוודא שהיא לא הוחדרה לווריד, והזריק את הנוזל בזהירות.
7. זיהום תוך ורידי על ידי חיסון חניכיים
- רסנו את האוגר על ידי ביצוע סעיף 6. יש לתת תוך צפקית תערובת של 200 מ"ג/ק"ג של 10% קטמין הידרוכלוריד ו-10 מ"ג/ק"ג של 2% קסילזין הידרוכלוריד, נפח סופי של 1.3 מ"ל, במזרק של 3 מ"ל יחד עם מחט בגודל 13 x 0.45 מ"מ.
- צבט את הכפה על ידי הידוק הבסיס הבין-דיגיטלי של הכרית כדי להבטיח שהחיה מורדמת.
- רסנו את האוגר המורדם במצב שכיבה בשתי הידיים ומשכו בעדינות את השפה התחתונה עם האגודלים כדי לחשוף את החניכיים ואת וריד החניכיים
- מקם מחט דקה יותר (8 x 0.30 מ"מ) המחוברת למזרק של 1 מ"ל מתחת לחותכות התחתונות לאורך הקו האמצעי בין זוג השיניים בזווית של 25 מעלות, והכנס 2-4 מ"מ לווריד השפתיים של הלסת התחתונה.
- כדי לוודא שהחיסון היה תוך ורידי וכי המחט הוחדרה לווריד השפתיים של הלסת התחתונה, יש לשאוב דם עד לקנה המחט (החלק הצהוב).
- הזרקו לאט ובזהירות את החיסון של 50 מיקרוליטר (108) אמסטיגוטים או פרומסטיגוטים ב-PBS במשך דקה אחת עד שכל הנפח חוסן כדי למנוע דליפת החיסון והדם מהווריד לסביבה החיצונית ולאפשר פיזור בזרם הדם.
- לפני הסרת המחט, הפעל לחץ קל בעזרת צמר גפן. במקביל, הסר את המחט מהכלי על ידי שמירה על צמר גפן כדי לקדם המוסטזיס במקום, הפעלת לחץ קל למשך דקה אחת כדי למנוע דימום ואובדן החיסון
8. המתת חסד על ידי ניקוב לב
- לרסן את בעל החיים להרדים, כמתואר בסעיף 7. בצע ניקור לב עם מחט בגודל 20X0.55 מ"מ המחוברת למזרק של 5 מ"ל, מוחדרת בזווית של 45 מעלות ונוטה מעט שמאלה, ממש מתחת לסחוס ה-xiphoid.
- משוך 1 מ"ל דם. לאחר איסוף הדם הסופי, הסר את המזרק אך שמור על המחט בלב.
- אם בעל החיים כבר נושם ומראה דופק, יש לתת נתרן תיופנטל 5% (200 מ"ג/ק"ג) עם מזרק של 5 מ"ל ולחבר אותו למחט 20X0.55 מ"מ שכבר נמצאת בלב.
- לאחר 5 דקות, עם סטטוסקופ, בדוק אם יש תנועות נשימה ופעימות לב.
9. מיצוי DNA מאיברים ורקמות
- לאחר המתת חסד, אוספים את הטחול, בלוטות הלימפה המזנטריות ושברי הכבד.
- חותכים את הרקמות על ידי הקפאה על קרח יבש, הפשרה וחיתוך עם שני להבי אזמל. לעכל 20 מ"ג רקמות טחונות ב-600 מיקרוליטר של מאגר ליזה עם 17.5 מיקרוליטר של פרוטאינאז K (20 מ"ג/מ"ל) ולדגור ב-55 מעלות צלזיוס למשך הלילה.
- צנטריפוגה בעוצמה של 15,000 × גרם למשך 4 דקות להסרת שברי רקמות שאינן עוברות ליזה.
- מוסיפים 200 מיקרוליטר תמיסת משקעים חלבון, מערבבים במרץ במשך 20 שניות, מדגרים למשך 5 דקות על קרח וצנטריפוגה בחום של 15,000 × גרם למשך 4 דקות.
- מעבירים את הסופרנטנט לצינור אחר, מוסיפים 600 מיקרוליטר איזופרופנול ומערבבים בעדינות עד למשקעי DNA. צנטריפוגה את ה-DNA ב-15,000 × גרם למשך 2 דקות, ושטוף את הגלולה עם 70% אתנול למשך 30 דקות בשייקר הטיה וצנטריפוגה.
- השליכו את האתנול וייבשו את הגלולה בטמפרטורת החדר. הרטיבו מחדש את ה-DNA עם 50-200 מיקרוליטר של מים טהורים במיוחד ב-65 מעלות צלזיוס למשך 30 דקות, כמתו ודללו את ה-DNA ל-0.1 מיקרוגרם/מ"ל ואחסנו ב-20 מעלות צלזיוס.
10. הערכת זיהום ברקמות ואיברים על ידי PCR
- העריכו את עומס הטפילים ב-DNA הגנומי של רקמות ואיברים על ידי PCR קונבנציונלי: 2.5 מיקרוליטר של מאגר PCR, 1.5 מ"מ MgSO4, 0,2 מ"מ dNTP, 1 U של DNA פולימראז, 300 ננוגרם של DNA גנומי, 0.2 מיקרומטר מכל פריימר, ומים נטולי נוקלאז לנפח סופי של 25 מיקרוליטר.
- הגברה באמצעות הפרוטוקול של L. infantum kDNA18: מחזור אחד של דנטורציה ב-94 מעלות צלזיוס למשך 2 דקות; 39 מחזורי הגברה, 30 שניות ב-94 מעלות צלזיוס, 15 שניות ב-60 מעלות צלזיוס, 30 שניות ב-72 מעלות צלזיוס, הארכה סופית של 5 דקות ב-72 מעלות צלזיוס. הגודל הצפוי של תוצר ה-PCR הוא 145 bp. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- הגביר את האוגר GAPDH, הבקרה האנדוגנית של PCR3: מחזור אחד של דנטורציה ב-94 מעלות צלזיוס למשך 2 דקות, 39 מחזורי הגברה, 30 שניות ב-94 מעלות צלזיוס, 15 שניות ב-58 מעלות צלזיוס, 30 שניות ב-72 מעלות צלזיוס, הארכה סופית של 5 דקות ב-72 מעלות צלזיוס. (2) אוגר Rv GAPDH 5'- TTCACCTGTTCCACAGCCTTG -3'.
- נתח את מוצרי ה-PCR על ידי אלקטרופורזה של ג'ל אגרוז 1%.
11. מעקב אחר אוגרים על ידי הדמיית ביולומינסנציה in vivo
- העריכו את התקדמות הזיהום לאורך זמן על ידי פליטת הביו-לומינסנציה של החיה כולה במערכת ההדמיה הביו-לומינסנציה in vivo , המורכבת ממצלמה מקוררת (CCD) המותקנת על תא אטום לאור. שמור על בעל החיים מרדים במהלך רכישת התמונה עם משלוח חרוט אף.
- לפני רכישת ביולומינסנציה ו-5 דקות לפני השראת הרדמה, יש להזריק D-לוציפרין (150 מ"ג/ק"ג) תוך צפקי לאוגרים על ידי ביצוע סעיף 6. הכינו תמיסת מלאי מלח אשלגן D-luciferin של 15 מ"ג/מ"ל ב-PBS, עקרו מסננים ואחסנו בטמפרטורה של -80 מעלות צלזיוס.
- חמש דקות לאחר הזרקת D-לוציפרין לבעלי החיים, הרדימו אותם עם איזופלורן 2% בתא אינדוקציה עשיר בחמצן. לאחר 5 דקות נוספות, צלם תמונות ביולומינסנציה באמצעות מצלמת CCD. קבל תמונות של אוגרים במצב גחון 2 שעות ו-24 שעות לאחר ההדבקה, 8 ו-22 ימים לאחר ההדבקה (dpi).
הערה: שמור על הרדמה במהלך תהליך ההדמיה עם מכשיר אספקת האיזופלואורן-חמצן. - בהתבסס על רמת פליטת הביו-לומינסנציה, השתמש בפרמטרים הבאים: זמן חשיפה, נע בין 30 שניות ל-5 דקות, Binning בינוני או גדול, f/stop 1 ושדה ראייה D (12, 5 ס"מ).
12. כימות ביולומינסנציה בבעלי חיים הנגועים ב-L. infantum-Luc
- השתמש בכלי המדידה הידני כדי לזהות את אזורי העניין (ROI), הגודל והשטח בראש ובגוף של החיה. כמת ביולומינסנציה שנרכשה על ידי מצלמת CCD בהחזר ה-ROI שנבחר.
- מדוד את אות הרקע עם החזר ה-ROI הממוצע של הרקע והפחית מפליטת האור הביולוגי המתקבלת מה-ROI הידני.
- בטא את פליטת הביו-לומינסנציה בזוהר, יחידה מנורמלת לפי זמן ואזור: photons.sec-1.cm-2.sr-1
תוצאות
ביטוי יציב של לוציפראז ב-L. infantum
L. infantum מהונדס גנטית הופק באמצעות הפלסמיד של קו pLEXSY, המשתלב בגנום של לישמניה בלוקוס הריבוזומלי 18S rRNA (ssu), שהשעתוק שלו מונע על ידי RNA פולימראז I. לפיכך, שיבוטים של L. infantum-Luc הוערכו לאינטגרציה של פלסמיד בגנום של לישמניה, ולביטוי יציב על ידי פליטת ביולומינסנציה במבחנה. השיבוט בעל הביטוי הגבוה המציג ביולומינסנציה >פי 120 מעל הרקע נבחר להערכת אינטגרציה גנומית על ידי PCR. ראה איור 1 לאלקטרופורזה של ג'ל אגרוז של מוצרי PCR כדי להעריך את שילוב הפלסמיד בגנום ופליטת ביולומינסנציה (RLU) של פרומסטיגוטים של שיבוט L. infantum-Luc. שברים בגודל הצפוי התקבלו מכל PCR; תוצר אחד של כ-1,1 קילו-בייט (5'SSU - UTR1), ואחר של 1.8 קילו-בייט (Hyg-3'ssu) הוגברו מהגנום של L. infantum-Luc (איור 1A), מה שאישר את האינטגרציה של קלטת הפלסמיד וגן הלוציפראז בלוקוס ה-ssu של הגנום של L. infantum.
ביטוי לוציפראז הגחלילית הוערך גם בפרומסטיגוטים של L. infantum-Luc על ידי פליטת ביולומינסנציה (RLU) בקורא המיקרו-לוחות, כמתואר בפרוטוקולים, סעיף 2. גם לאחר מספר מעברים בתרבית ובעכברי BALB/c במשך 5 ימים, הוא שמר על רמת הביו-לומינסנציה; 569.3 ± 19.5 עבור הרקע של טיפוס הבר, ו-59361.9 ± 2673.3 (n = 2) עבור L. infantum-Luc משובט (איור 1B). לפיכך, שיבוט L. infantum-Luc המבטא ביציבות לוציפראז גחלילית, שימש להדבקת אוגרים בדרכים תוך-חניכיים או תוך-צפקיות.
חיסון תוך ורידי בווריד החניכיים
כדי לחסן את הלישמניה לזרם הדם של אוגרים, יש להקפיד למזער את ניקוב הוורידים, דימום ודליפה של החיסון. לכן, השפה התחתונה צריכה להיות מושכת בעדינות כלפי מטה כדי לחשוף את וריד החניכיים (איור 2A); ויש להשתמש במחט קטנה יותר של 30 גרם כדי למנוע ניקוב יתר של הווריד. יש למקם את המחט כשהמסגרת פונה כלפי מעלה כדי להיכנס לווריד בזווית נכונה (איור 2B). ואכן, כדי להבטיח שהמחט הוזרקה לתוך כלי הדם - וריד השפתיים המנדיבולרי, יש למשוך את בוכנת המזרק כלפי מטה עד לשאיבה של דם לתוך קנה המחט (איור 2C). לפני הסרת המחט צריך להפעיל לחץ קל עם צמר גפן כדי לקדם המוסטזיס (איור 2D).
הערכה אורכית על ידי הדמיה ביולומינסנציה
אוגרים שנדבקו תוך צפקית (IP) או דרך תוך-חניכיים (IG) עם L. infantum-Luc היו במעקב עדה-50 dpi והוערכו על ידי הדמיית ביולומינסנציה עד 22 dpi (איור 3). התמונות נרכשו שעתיים לאחר זיהום תוך-צפקי עם10-8 טפילים בחלל הצפק; התמונות נרכשו למשך 30 שניות או דקה אחת של מדיום Binning לתערוכה. אות הביו-לומינסנציה היה חזק פי >65 בבטן בבעלי חיים נגועים באמסטיגוט (4.6 × 105 ± 3.7 × 105) מאשר אלה הנגועים בפרומסטיגוט (6.8 × 103 ± 3.8 × 103) (טבלה 1), מה שמדגים כי אמסטיגוטים המובחנים במבחנה הם יותר ביו-לומינסצנטיים מאשר הפרומסטיגוטים המטאציקליים בשלב הנייח ומטוהרים בכרית פיקול.
יום אחד לאחר ההדבקה (1 dpi), תמונות ביולומינסנציה נרכשו במשך 3 דקות של חשיפה (איור 3). הייתה ירידה של 45% באות הביו-לומינסנציה באזור הבטן אצל אוגרים נגועים בפרומסטיגוט ו-70% דעיכה אצל אוגרים נגועים באמסטיגוט (איור 3), מה שמצביע על כך שאמסטיגוטים התפרקו במידה רבה יותר מאשר פרומסטיגוטים מטציקליים (טבלה 1 ואיור 4). שבוע לאחר ההדבקה (8 dpi), בעלי חיים נגועים בפרומסטיגוטה שמרו על אות הביולומינסנציה (3.3 × 103 ± 5 × 103). עם זאת, פליטת הביו-לומינסנציה באוגרים נגועים באמסטיגוטה ירדה ב-95%, מ-1.3 × 105 ±-1.1 ×-105 ל-6.7 × 103 ± 7.5 × 103 (טבלה 1) והגיעה לאותה רמה של אוגרים נגועים בפרומסטיגוטה. שלושה שבועות לאחר ההדבקה (22 dpi), נרכש אות ביולומינסנציה למשך 5 דקות של חשיפה ושילוב גדול (איור 3); האות היה נמוך בהרבה עבור פרומסטיגוטים ובעלי חיים נגועים באמסטיגוטים (טבלה 1 ואיור 4).
קבוצה נוספת של אוגרים נדבקה דרך הנתיב החניכיים באמסטיגוטים ופרומסטיגוטים של L. infantum-Luc (10,8); פליטת ביולומינסנציה נצפתה באזור הלסת העליונה (איור 3). המעקב החל יום אחד לאחר ההדבקה, ואוגרים נגועים באמסטיגוטה הראו יותר אות וזוהר ביולומינסנציה (7.3 × 103 ± 4.1 × 103) מאשר אוגרים נגועים בפרומסטיגוט (1 ×10 3 ± 5.7 × 102). שבוע לאחר ההדבקה (8 dpi), נצפתה ירידה של 36% באות הביולומינסנציה בבעלי חיים נגועים בפרומסטיגוטים ו-90% באוגרים הנגועים באמסטיגוטה; הקרינה נעה בין 7.3 × 103 ± 4.1 × 103 עד 7.8 × 102 ± 5.6 × 102 (טבלה 1). שלושה שבועות לאחר ההדבקה (22 dpi), נרכש גם אות ביולומינסנציה למשך 5 דקות של חשיפה ושילוב גדול (איור 3). אות הביו-לומינסנציה היה דומה ונמוך עבור בעלי חיים נגועים בפרומסטיגוט ואמסטיגוט (טבלה 1 ואיור 4) בראשם של בעלי חיים שנדבקו בחניכיים, ולא נצפה פיזור של הזיהום לאזור הבטן על ידי אות ביולומינסנציה.
הערכת זיהום ברקמות ואיברים על ידי PCR
ביצענו PCR קונבנציונלי כדי לחקור זיהום באיברים ספציפיים, כגון כבד, טחול ובלוטות לימפה, שיכול להיות מתחת לגבול הזיהוי של הדמיה in vivo . אזור המטרה של kDNA היה ספציפי יותר להגברת ה-DNA של L. infantum ברקמות ובאיברים נגועים, וה-PCR עבור האנזים GAPDH מהאוגר היה בקרה על שלמות ה-DNA ותגובת ה-PCR. רק הדגימות שהוגברו עבור GAPDH נלקחו בחשבון בניתוח. לפיכך, על ידי PCR, שניים מתוך שלושה אוגרים שנדבקו דרך המסלול התוך-צפקי באמסטיגוטים אקסניים הראו זיהום ברקמות ובאיברים; חיה שתיים (A2) בטחול וחיה שלוש (A3) בכבד, ב-50 dpi (איור 5A). אוגר אחד נדבק תוך צפקית בפרומסטיגוטים אקסניים; חיה 3 (A3) (איור 5B) הראתה הגברה בבלוטת הלימפה. אוגרים שחוסנו תוך חניכיים עם פרומסטיגוטים או אמסטיגוטים אקסניים ב-50 dpi לא יכלו להציג הגברה ברורה - רק רצועה בכבד של בעל חיים אחד (A1) נגוע בפרומסטיגוטים (איור 5C). יש לציין שהיו לנו שלושה בעלי חיים שהוחזקו במשך 8 חודשים שהחיסון שלהם הועבר בדרך החניכיים עם אמסטיגוטים דלף מעט במהלך ההזרקה. שתיים מתוך שלוש חיות הראו זיהום ברור בכבד, חיות אחת ושתיים (איור 5D).
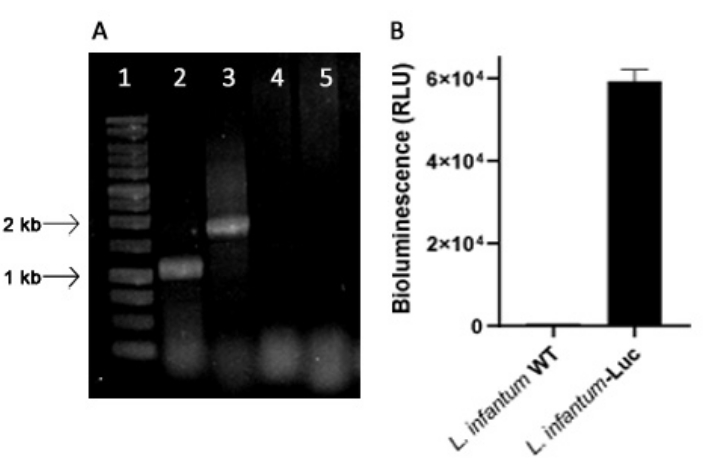
איור 1: הערכת שיבוט Leishmania infantum-Luc על ידי PCR ופליטת ביולומינסנציה. (A) אלקטרופורזה של ג'ל אגרוז של מוצרי PCR להערכת שילוב פלסמיד בגנום: נתיב 1 - 1 kb סולם DNA; PCR של ה-DNA הגנומי של L. infantum-Luc, נתיב 2 - 5'ssu - utr1 (1.1 kb) ונתיב 3- hyg- 3'ssu (1.8 kb); PCR של ה- DNA הגנומי של L. infantum-wt, נתיבים 4 ו -5. (B) פליטת ביולומינסנציה (RLU) של פרומסטיגוטים של שיבוט L. infantum-Luc (10,6) בקורא המיקרו-לוחות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הזרקה תוך-ורידית של Leishmania infantum-Luc לתוך וריד החניכיים. (A) האוגר הונח בדקוביטוס הגבי, והשפה התחתונה נמשכה כלפי מטה. (B) מחט דקה יותר (8 x 0.30 מ"מ) המחוברת למזרק של 1 מ"ל הוצבה מתחת לחותכות התחתונות לאורך הקו האמצעי בין זוג השיניים בזווית של 25 מעלות והוחדרה 2-4 מ"מ לתוך וריד הלסת התחתונה. (C) חיסון של 50 מיקרוליטר (108) של אמסטיגוטים או פרומסטיגוטים ב-PBS. (D) המוסטזיס באמצעות צמר גפן והפעלת לחץ קל על מקום החיסון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
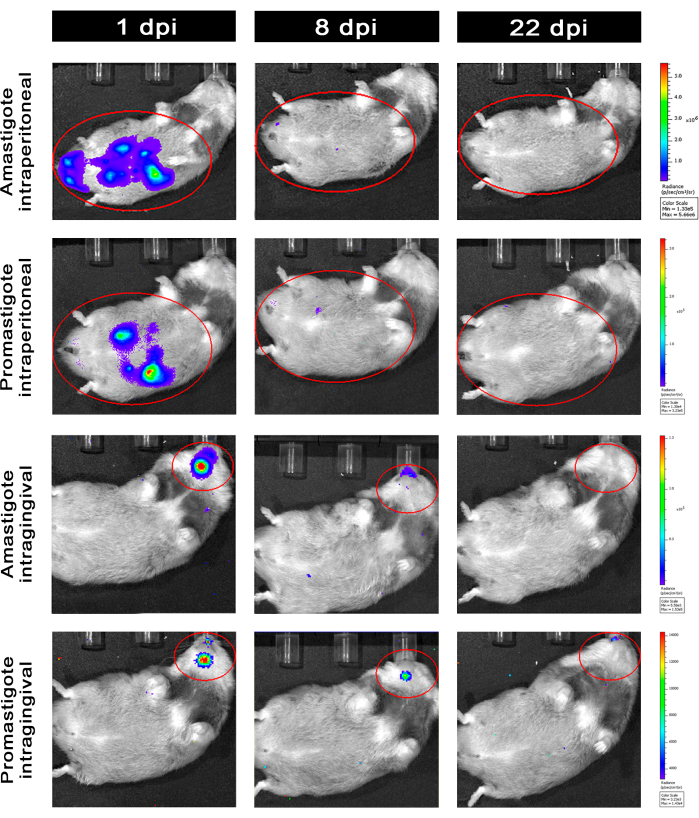
איור 3: מעקב על ידי הדמיית ביולומינסנציה in vivo . תמונות מייצגות של בעל חיים אחד לכל קבוצה: נגוע באמצעות תוך-צפקי (פאנלים עליונים) או תוך-חניכיים (פאנלים תחתונים), עם אמסטיגוטים או פרומסטיגוטים של L. infantum-Luc, עבור 1, 8 ו-22 dpi. ROI אדום המייצג את האזורים שנבדקו בבטן ובראש, לזיהום תוך-צפקי או תוך-חניכי, בהתאמה. הנתונים מראים כי ב-1 dpi, כל בעלי החיים הראו אות ביולומינסנציה בבטן או בלסת התחתונה. האות ירד לאחר 8 dpi וכמעט ולא ניתן היה להבחין בו באף קבוצה ב-22 dpi. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
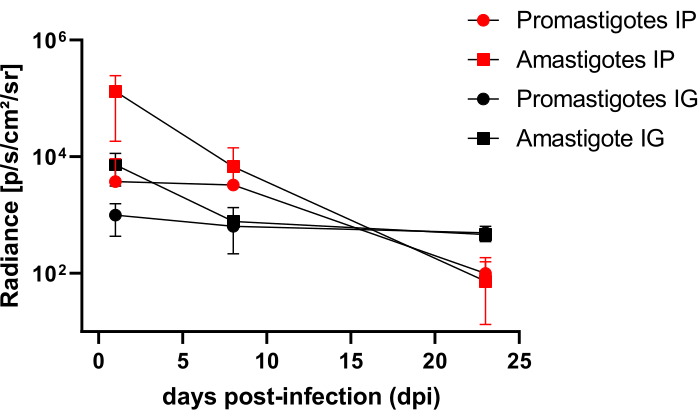
איור 4: ניתוח השוואתי של זוהר מתמונות ביולומינסנציה. פוטוני כימות קרינה בוצעו בבטן או בראש של אוגרים באמצעות כלי מדידת החזר ROI ידניים. החזר ה-ROI הממוצע ברקע הופחת מהחזר ה-ROI של המדידה כדי להסיר כל אות מזויף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
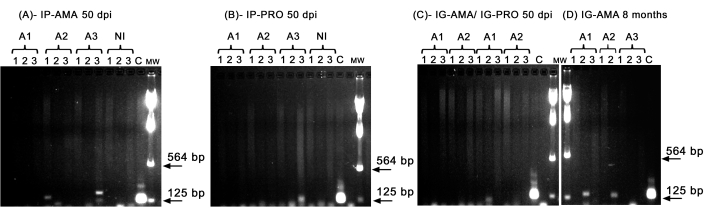
איור 5: הגברת PCR של kDNA. (A) IP-AMA, אוגרים נגועים בנתיב תוך-צפקי עם אמסטיגוט, 50 dpi (n = 3); (B) IP-PRO, נגוע בנתיב תוך-צפקי עם פרומסטיגוטים, 50 dpi (n = 3); (C) IG-AMA, נגוע במסלול תוך-חניכיים עם אמסטיגוט (n = 2), IG-PRO, נגוע בנתיב תוך חניכיים עם פרומסטיגוט (n = 2); (D) IG-AMA, נגוע בנתיב תוך-חניכיים עם אמסטיגוטה, 8 חודשים לאחר ההדבקה (n = 3). NI, אוגרים לא נגועים כביקורת שלילית (n = 2); C- DNA גנומי של L. infantum-Luc, בקרה חיובית של PCR. רקמות ואיברים: 1- טחול, 2- כבד, 3- בלוטות לימפה. MW- סמן משקל מולקולרי, החצים מציינים את רצועות המשקל המולקולרי הנמוכות יותר. A1- חיה אחת, A2- חיה שתיים, ו-A3- חיה שלוש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| DPI | כתובת IP של אמסטיגוטס | פרומסטיגוטס IP | Amastigotes IG | Promastigotes IG | ||||||||
| התכוון | ס"ד | N | התכוון | ס"ד | N | התכוון | ס"ד | N | התכוון | ס"ד | N | |
| 0 | 4.6 על 105 | 3.7 על 105 | 3 | 6.8 על 103 | 3.8 על 103 | 3 | - | - | - | - | - | - |
| 1 | 1.3 על 105 | 1.1 על 105 | 3 | 3.8 על 103 | 5.5 על 103 | 3 | 7.3 על 103 | 4.1 על 103 | 2 | 1.0 על 103 | 5.7 על 102 | 2 |
| 8 | 6.7 על 103 | 7.5 על 103 | 3 | 3.3 על 103 | 5.0 על 103 | 3 | 7.8 על 102 | 5.6 על 102 | 2 | 6.4 על 102 | 8.2 על 101 | 2 |
| 22 | 7.3 על 101 | 8.5 על 101 | 3 | 9.9 על 101 | 8.6 על 101 | 3 | 4.6 על 102 | 7.5 על 101 | 2 | 5.0 על 102 | 1.5 על 102 | 2 |
טבלה 1: נתונים גולמיים מניתוח זוהר השוואתי של תמונות ביולומינסנציה. ממוצע כימות קרינה פוטונים.sec-1.cm-2.sr-1 לפי קבוצה ומסלול. קיצורים: dpi = ימים לאחר ההדבקה; SD = סטיית תקן; N = גודל מדגם.
Discussion
איסוף דם או הזרקה תוך ורידית של חומרים לאוגרים נחוצים למחקרים מדעיים שונים. פותחו מספר שיטות לגישה למסלולי איסוף או חיסון שונים הקשורים ישירות למטרות המחקר19. בשל האנטומיה של האוגר - זנב וגפיים קצרים - המסלול התוך-לבבי הוא בדרך כלל הבחירה להזרקה תוך ורידית של לישמניה. בהתאם לזן בו נעשה שימוש, המסלול התוך-לבבי הוכיח את עצמו כיתרון כזן הייחוס L. infantum MHOM/BR/1974/PP75, שהזיהום שלו מתרחש לטווח ארוך, 6-9 חודשים5. עם זאת, זהו חיסון שעלול להוביל לדימום ולמות החיה. לפיכך, תיקננו מסלול חיסון תוך-ורידי חלופי לזיהום במקלעת החניכיים, וריד השפתיים של הלסת התחתונה, הגורם פחות נזק לבעל החיים. החיות נדבקו בזן הייחוס המהונדס גנטית L. infantum MHOM/BR/1974/PP75, שביטא ביציבות את לוציפראז הגחלילית גם לאחר מספר מעברים בתרבית ובעכברים (איור 1), כפי שקשור למיני לישמנייה אחרים שהועברו על ידי אותו פלסמיד אינטגרטיבי20.
הווריד הלסת התחתונה או וריד החניכיים הוא דרך טובה יותר לדגימת דם, ולאיסוף דם מרובה10,11. עם זאת, זוהי ההוכחה הראשונה לכך שווריד החניכיים הוא אתר אפשרי לזיהום תוך ורידי על ידי לישמניה. בניגוד לדגימת דם המשתמשת בדרך כלל במחט 26 גרם גבוהה כדי למנוע המוליזה בדם10, מד מחט זה לא התאים לחיסון לישמניה, עקב ניקוב ורידים, דימום ודליפה של החיסון. עבור זיהום לישמניה, דרך וריד הלסת התחתונה, מחט 30G קטנה יותר הייתה חיונית. היבט נוסף המבדיל בין ניקוב הווריד לזיהום באמצעות וריד חניכיים הוא קצב המתן של כ-1 מיקרוליטר לשנייה; וכדי להבטיח שהוא מוזרק לתוך הכלי - וריד השפתיים של הלסת התחתונה, והוא לא נתקע ברירית, תת עורית או תוך-עורית. בשל תחלופת הדם הנמוכה של מקלעת החניכיים, היה צורך לחסן לאט את ה-50 מיקרוליטר של חיסון בצפיפות גבוהה של אמסטיגוטים אקסניים או פרומסטיגוטים של L. infantum-Luc, 2 x 109 טפילים/מ"ל, באיטיות (~ 1 דקה), ויש להסיר את המחט על ידי לחיצה על המקלון למשך דקה אחת כדי לאפשר את פיזור החיסון בזרם הדם (איור 2).
לצורך הערכה אורכית של זיהום, אוגרים נדבקו תוך צפקית (IP) או דרך המסלול התוך-חניכיים (IG) עם L. infantum-Luc והיו במעקב של 50 dpi על ידי מערכת ההדמיה הביו-לומינסנציה עד להמתת חסד. בהתחשב בכך שזן הייחוס PP75 יכול להיות פחות אלים כשלעצמו וכי ביטוי העל של לוציפראז יכול גם להשפיע על יעילות הזיהום ולשמור על הזיהום לטווח הארוך, נעשה שימוש בחיסון גבוה של10-8 טפילים לזיהום. לאחר חיסון חניכיים של אמסטיגוטים ופרומסטיגוטים של L. infantum-Luc והערכה על ידי מערכת ההדמיה הביו-לומינסנציה, הביו-לומינסנציה הוגבלה לאזור הלסת העליונה של אוגרים 24 שעות לאחר ההדבקה. ואכן, אוגרים שנדבקו תוך צפקית באמסטיגוטים ופרומסטיגוטים של L. infantum-Luc הראו ביולומינסנציה מפוזרת בכל הבטן (איור 3, 1 dpi). הירידה המתמשכת בפליטת האור הביולוגי לאורך הזמן, מהיום הראשון להדבקהדרך היום השמיני ועד ל-22dpi באוגרים שנדבקו ב-L. infantum-Luc, הייתה בלתי תלויה במסלול החיסון (טבלה 1 ואיור 4).
עם זאת, כאשר עומס הטפילים ברקמות בעלי החיים נמוך, הוא יכול להיות מתחת לגבול הזיהוי של מערכת ההדמיה הביו-לומינסנציונית אך ניתן לזהות ולכמת אותו על ידי PCR או qPCR. כפי שכבר דווח, ההדבקה הנגרמת על ידי זן PP75 אכן נמוכה מזו של זנים אחרים5, ורק מעטים פיתחו סימנים קליניים של המחלה בשל השונות הגנטית של בעלי החיים. במחקר זה, למרות המספר הקטן של בעלי החיים והאלימות הנמוכה של זן זה, האמסטיגוטים האקסניים הראו יתרון ב-50 dpi, והראו זיהום טוב יותר מאשר פרומסטיגוטים, כפי שהודגם על ידי PCR (איור 5). שמונה חודשים לאחר ההדבקה באמסטיגוטים דרך נתיב החניכיים, ניתן היה לזהות טפילים על ידי PCR בכבד (איור 5) והם גם הפגינו פילוזקציה מתונה, הידוק אורביטלי ויציבה מקושתת.
אמסטיגוטים אקסניים יכולים להיות בחירה טובה יותר לזיהום ומעקב מאשר פרומסטיגוטים21 ויש להם את היתרון בכך שהם קלים לייצור בקנה מידה גדול. חיסון החניכיים אפשרי ומהווה מסלול טוב יותר לחיסון תוך ורידי של תרכובות ולהדבקה בלישמניה ופתוגנים אחרים, ללא נזק או נפיחות במקום היישום בלסת התחתונה או לבריאות בעל החיים.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/Decit-MS/CNPq/SES סיפקה תמיכה כספית למחקר זה. תודה למוניק ריביירו דה לימה על עצותיה לגבי דרכי החיסון. פרויקט זה פותח במסגרת הסכם שיתוף הפעולהמס' 258/2017 בין FIOCRUZ, לבין האוניברסיטה הפדרלית של ריו דה ז'ניירו- UFRJ. הצוות אסיר תודה למפיקי הווידיאו ריקרדו בפטיסטה שמידט וג'נילטון חוסה ויירה מהמרכז לפופולריזציה של המדע (IOC) על תמיכתם ועזרתם שלא יסולא בפז בצילום הפרוטוקולים ובביצוע הראיונות.
Materials
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
References
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved