Method Article
In vivo Imagem de hamsters infectados por Leishmania infantum por inoculação gengival de amastigotas axênicas expressando luciferase
Neste Artigo
Resumo
Aqui apresentamos uma avaliação longitudinal de hamsters dourados infectados intraperitonealmente (IP) ou via intragengival (IG) com L. infantum-Luc por imagem bioluminescente e por PCR. Os hamsters foram avaliados 1 dia após a infecção (1 dpi), 1 semana após a infecção (8 dpi) e 3 semanas após a infecção (22 dpi) e eutanasiados aos 50dpi e 8 meses após a infecção.
Resumo
A leishmaniose tegumentar americana (LTA) e a leishmaniose visceral (LV) são consideradas negligenciadas pela Organização Mundial da Saúde. A LV pode ser letal se não for tratada; Os medicamentos utilizados no tratamento são tóxicos e há casos de resistência. Os testes pré-clínicos podem representar um gargalo na descoberta de novos medicamentos para tratamento, dependendo do modelo animal, da cepa utilizada e da via de inóculo. O hamster dourado destaca-se por sua alta suscetibilidade aos subgêneros Viannia e Leishmania , exibindo muitos dos processos clínicos e imunopatológicos observados na doença humana.
Pela anatomia do hamster, que tem cauda e membros curtos, a via intracardíaca costuma ser a escolha para injeção intravenosa de Leishmania. No entanto, é um inóculo que pode levar ao sangramento e, eventualmente, à morte do animal. Assim, padronizamos uma via alternativa de inoculação intravenosa para infecção na veia gengival, que é minimamente invasiva, permite fácil acesso venoso e causa poucas lesões locais e sistêmicas ao animal. Portanto, hamsters infectados pela via intraperitoneal (IP) ou intragengival (IG) com Leishmania Infantum expressando luciferase (Luc) foram acompanhados por 22 dias pelo sistema de imagem de bioluminescência e 50 dias e 8 meses pós-infecção por PCR.
Após a inoculação gengival de ambas as amastigotas axênicas e promastigotas de L. infantum-Luc, a bioluminescência foi restrita por pelo menos 2 semanas no local da injeção, o que é um indicador de infecção nos tecidos ao redor do plexo gengival. Hamsters infectados intraperitonealmente com L. infantum-Luc apresentaram bioluminescência dispersa por todo o abdômen, como esperado. No entanto, pelo sistema de imagem de bioluminescência, a infecção diminuiu até o 50º dpi e só foi detectável por PCR. As amastigotas axênicas apresentaram melhor infecção do que as promastigotas, avaliadas por PCR. De fato, 8 meses após a infecção, os parasitas foram detectados por PCR no fígado de animais inoculados com amastigotas axênicas por via intravenosa, o que pode ser uma característica da cepa de referência de L. infantum MHOM/BR/1974/PP75, cuja infecção progride lentamente e apresenta baixa carga parasitária, abaixo da resolução da imagem bioluminescente. Assim, as amastigotas axênicas podem ser uma escolha melhor para infecção e acompanhamento do que as promastigotas, e o inóculo gengival é uma via viável para injeção intravenosa de Leishmania e outros patógenos.
Introdução
As leishmanioses são consideradas doenças negligenciadas e reemergentes causadas por mais de 20 espécies de Leishmania, endêmicas em vários países das quatro regiões ecoepidemiológicas centrais: América Latina, Norte e Leste da África e Oeste e Sudeste Asiático1. Elas podem ser agrupadas como leishmaniose tegumentar (LT) e visceral (LV), que é letal se não for tratada. O agente etiológico da LV no Brasil é a Leishmania infantum, e o tratamento é realizado com antimoniais pentavalentes ou Anfotericina B. Esses medicamentos são administrados por via intravenosa, têm alta toxicidade, apresentam reações adversas e há casos de resistência2.
Assim, é necessário investir na busca por novos quimioterápicos. Os testes pré-clínicos são, de fato, um gargalo na descoberta de novos fármacos para o tratamento da LV, dependendo do modelo animal, da cepa utilizada, da via de inóculo e de outros fatores logísticos, técnicos e operacionais. O hamster-dourado destaca-se por sua alta suscetibilidade a espécies dos subgêneros Viannia e Leishmania, exibindo muitos dos processos clínicos e imunopatológicos observados na doença humana, como observado em estudos anteriores com Leishmania braziliensis 3,4. O hamster infectado com L. infantum também desenvolve a maioria dos processos imunopatológicos característicos da LV em humanos e cães5, como anemia, leucopenia, trombocitopenia e hepatoesplenomegalia. Além disso, o hamster dourado é um animal não consanguíneo e não apresenta resposta uniforme, reproduzindo a heterogeneidade das manifestações clínicas observadas em humanos3.
Outro aspecto a considerar para o resultado da infecção é a cepa de L. infantum e a via de inoculação. Várias cepas de L. infantum diferem em antecedentes genéticos e suscetibilidade ao tratamento 2,6,7. Algumas cepas apresentam baixa carga parasitária no fígado e baço após infecção por promastigotas8, e as amastigotas axênicas podem ser uma alternativa para melhorar a infecção que não é muito explorada. De fato, a via intravenosa favorece a infecção e aumenta a frequência de animais com sinais clínicos; mas a inoculação intraperitoneal é a mais utilizada. A via intracardíaca é a escolha para infecção intravenosa por L. infantum 5,8,9. No entanto, em hamsters, a inoculação intragengival é uma via alternativa para injeção intravenosa, não descrita como local de infecção. Apesar de relatada, a punção venosa gengival é minimamente invasiva, permite fácil acesso venoso e causa poucas lesões locais e sistêmicas10. A punção da veia gengival é a que mais concorda com as recomendações para maximizar a qualidade e aplicabilidade dos resultados, preservando o bem-estar do animal11.
A avaliação pré-clínica de compostos para LV utilizando métodos tradicionais requer mais animais, que devem ser eutanasiados para análise histopatológica e avaliação da carga parasitária nos tecidos. Em contraste, o sistema de imagem bioluminescente pode acelerar os estudos pré-clínicos e reduzir o número de animais. Os locais bioluminescentes nos tecidos infectados podem ser acompanhados em tempo real no mesmo animal por várias semanas. Vários estudos sobre a padronização dessa ferramenta tecnológica crucial têm mostrado sua aplicação em estudos com camundongos infectados por Trypanosoma cruzi, Leishmania spp. e Toxoplasma gondii 12,13,14,15. No entanto, dependendo da carga parasitária no tecido, a bioluminescência pode ser subdetectada pelo sistema de imagem in vivo, o que requer avaliação por PCR quantitativo dos órgãos afetados. Portanto, propomos desenvolver uma metodologia baseada na injeção intravenosa de L. infantum expressando luciferase na veia gengival de hamsters dourados para acompanhamento pelo sistema de imagem bioluminescente e PCR.
Protocolo
Os protocolos envolvendo hamsters seguiram as diretrizes do Comitê de Ética em Pesquisa Animal do Instituto Oswaldo Cruz/COI (aprovação: CEUA/COI L-015/2022).
1. Clonagem do gene da luciferase Firefly no plasmídeo de expressão de Leishmania
- Digerir o plasmídeo pLEXSY-hyg2 com endonuclease BglII (10 U/μL) e NotI (10 U/μL). Digerir primeiro com BglII: adicionar 50 μL de plasmídeo (9 μg de ADN), 30 μL de tampão enzimático de restrição, 3 μL de albumina de soro bovino (BSA), 3 μL de BglII e água livre de nuclease a um volume final de 300 μL. Incubar durante 3 h a 37 °C.
- Digerir o plasmídeo TOPOII/LUC com BamHI (10 U/μL) e NotI para libertar o quadro de leitura aberto de luciferase de vaga-lume com a sequência de Kozak (Kozak-LUC), clonada no vetor TOPOII16. Digerir primeiro com BamHI: misturar 100 μL de plasmídeo (8,5 μg de ADN) com 30 μL de tampão enzimático de restrição; 3 μL de BSA, 3 μL de BamHI e água livre de nuclease até 300 μL de volume final. Incubar durante 3 h a 37 °C.
- Limpar cada plasmídeo numa membrana de sílica e eluir o ADN duas vezes com 50 μL de água para um volume final de 100 μL.
- Digerir duas vezes os plasmídeos pLEXSY-hyg2 e TOPOII/LUC previamente linearizados com NotI. Misture 100 μL do DNA eluído da membrana de sílica a 15 μL de tampão D, 2 μL de NotI e água livre de nuclease a 150 μL de volume final. Incubar durante 1 h a 37 °C.
- O gel purifica o vetor de digestão dupla (pLEXSY-hyg2) e a inserção, Kozak-LUC, de um gel de agarose a 1% após eletroforese com tampão de tris-acetato EDTA (TAE). Extirpar as bandas de ~ 8 kb e 1,6 kb com um bisturi. Pesar as fatias, adicionar três volumes de tampão a 1 volume de gel, incubar a 50 °C para dissolver o gel, transferir para a membrana de sílica e lavar e eluir o ADN duas vezes com 20 μl de água, com um volume final de 40 μl.
- Ligue o vetor de dupla digestão (pLEXSY-hyg2) e o inserto, Kozak-LUC, com a ligase T4: misture 2 μL de vetor e inserto, ambos a 55 ng/μL, razão molar de 1:5; adicionar 5 μL de tampão de ligação; 1 μL de DNA ligase T4 (1U/mL), volume final de 10 μL. Incubar durante a noite a 16 °C.
- Adicione 40 μL de água livre de nuclease aos 10 μL de reação de ligação e precipite o DNA com 10 volumes de butanol. Centrifugue em velocidade máxima por 10 min em uma microcentrífuga, lave o pellet com etanol a 70%, centrifugue em velocidade máxima por 10 min, deixe o pellet secar na bancada e adicione 4 μL de água.
- Misturar 4 μL da reação de ligação com bactérias eletrocompetentes, JM109 (40 μL), transferir a mistura para uma cubeta (d = 0,2 cm) e mantê-la no gelo. Eletroporar a 2.500 V, 200 Ω, 25 μF, colocar a cubeta no gelo e adicionar 1 mL de meio LB. Transferir imediatamente a mistura para um tubo cónico de 15 ml e incubar a 37 °C durante 60 min e 100 rpm.
- Coloque a mistura em duas placas de ágar LB / ampicilina (100 μg / mL): uma com 200 μL e outra com toda a bactéria eletroporada. Concentre o volume centrifugando bactérias transformadas a 2.000 × g por 10 min, ressuspenda o pellet em 100 μL e coloque todo o volume/pellet. Incubar as placas durante 24-30 h a 30 °C e esperar que os clones cresçam.
- Selecione os clones com um palito e transfira para tubos cônicos de 50 mL contendo 5 mL de meio LB / ampicilina (100 μg / mL). Incubar durante 20-24 h a 30 °C e 100 rpm para permitir o crescimento das culturas de minipreparação.
- Purifique o plasmídeo com o kit miniprep e elua o DNA com 30 μL de água. Clones de tela contendo a construção pLESXY-LUC-hyg2 por digestão com BamHI.
- Misture 10 μL de DNA de miniprep; 2 μL de tampão enzimático de restrição; 0,2 μL de BSA: 1 μL de BamHI e água livre de nuclease até 20 μL de volume final. Incubar por 1 h a 37 °C - fragmentos esperados de clones positivos em eletroforese em gel de agarose a 1%: 3.450 e 6.290 pares de bases.
- Prepare uma cultura maxiprep para purificar a construção pLESXY-LUC-hyg2 em uma escala maior. Adicione um Erlenmeyer (1 L), 250 mL de meio LB suplementado com ampicilina e 1 mL do miniprep transfectado JM109 e incube por 18-20 h a 30 ° C e 200 rpm.
2. Produção e seleção de Leishmania infantum expressando luciferase
- Para liberar o de integração de Leishmania , digerir o plasmídeo de restrição pLESXY-LUC-hyg2 até completar com SwaI. Adicione 40 μL de plasmídeo (50 μg), 10 μL de tampão de digestão rápida, 4 μL de SwaI e água livre de nuclease ao volume final de 100 μL. Incubar durante a noite a 30 °C.
- Precipitar com etanol, lavar uma vez com etanol a 70%, ressuspender com 50 μL de água e manter no gelo.
- Centrífuga Leishmania MHOM/BR/1974/PP75 promastigotas a 1.000 × g por 10 min na fase de crescimento exponencial em meio de Schneider. Lave o pellet com meio de infusão cerebral e cardíaca (BHI) e centrifugue a 1.000 × g por 10 min. Ressuspenda o pellet a 108 promastigotas/mL em BHI.
- Misturar os promastigotas de L. infantum (500 μL) com de integração pLESXY-LUC-hyg2 (50 μg) na cubeta de eletroporação (d = 0,4 cm), em gelo. Eletroporado com dois pulsos de 1.500 V/25 micro F e intervalos de 10 s. Após o pulso, mantenha no gelo por 10 min.
- Transferir as promastigotas transfectadas para um balão com meio de Schneider suplementado com 20% de FCS a 26 °C. Após 24 h, adicione higromicina primeiro 50 μg / mL, depois aumente para 100 μg / mL após 48 h e 150 μg / mL após 1 semana.
- Clone de promastigotas transfectados de L. infantum-Luc limitando a diluição em uma placa de 96 poços com Schneider suplementada com 20% de FCS e 150 μg/mL de higromicina. Incubar a 26 °C para o crescimento do clone.
- Triagem de clones para seleção de L. infantum-Luc geneticamente homogênea e altamente expressiva por unidade de luminescência relativa à emissão bioluminescente (RLU), no leitor de microplacas.
- Resumidamente, misturar 106 promastigotas em uma placa branca de 96 poços com os 100 μL de substrato D-luciferina (300 μg/mL) em tampão composto por 25 mM HEPES pH 7,8, 15 mM MgCl2, 4 mM EGTA, 1 mM DTT, 1 μg/mL BSA, 2,5 mM ATP, 0,1% Triton X-100 e 300 μM Coenzima A, imediatamente avaliados no leitor de microplacas.
3. PCR para avaliar a integração genômica no locus ribossômico 18S rRNA (ssu)
- Purificar o DNA genômico de promastigotas que expressam luciferase e tipo selvagem (10,8). Centrifugue promastigotas a 1.000 × g por 10 min em tubos cônicos de 15 mL, adicione solução salina tamponada com fosfato (PBS) ao pellet, conte com uma câmara de Neubauer e centrifugue a 1.000 ×g por 10 min. Ressuspenda o pellet com tampão de lise: 100 mM de NaCl, 10 mM de Tris, 25 mM de EDTA, 0,5% de SDS e 0,1 mg/mL de proteinase K até a densidade de 108/mL. Incubar durante a noite a 56 °C.
- Realize dois ciclos de limpeza do DNA com um volume de fenol/clorofórmio/álcool isoamílico, 25:24:1 (v/v) e com um volume de clorofórmio. Entre cada ciclo de extração, transferir a fase aquosa para novos tubos e centrifugar a 2.000 × g durante 10 min.
- Precipitar o ADN com dois volumes de etanol e centrifugar a 5.000 × g, 10 min, 4 °C. Adicione 1 mL de etanol a 70%, transfira para um microtubo e centrifugue a 15.000 × g por 5 min.
- Faça uma segunda lavagem com etanol a 70%. Após centrifugação, rejeitar o sobrenadante e secar o pellet no banco.
- Reidrate o DNA genômico com 50-100 μL de água ultrapura em banho-maria a 65 ° C por 30 min, quantifique o DNA e armazene a -20 ° C.
- Realize PCR diagnóstico para avaliar a integração do pLEXSY no genoma de Leishmania , configurando a seguinte reação de PCR: 10 μL de tampão PCR, 0,2 mM dNTP, 1 U de DNA polimerase, 1 μg de DNA genômico, 0,5 μM de cada primer e água livre de nuclease até 50 μL de volume final.
- Selecione primers que hibridizam no vetor pLEXSY e no genoma de Leishmania: (1) aprt reverse primer A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', hibridizar na região utr1 (aprt); e (2) ssu forward primer F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3', no locus cromossômico 18SrRNA (ssu) de Leishmania.
- Use o seguinte protocolo de amplificação: Um ciclo de desnaturação a 94 °C por 2 min; 30 ciclos de amplificação, 30 s a 94 °C, 30 s a 60 °C, 1 min a 72 °C; extensão final de 10 min a 72 °C. O tamanho esperado do produto de PCR é de 1,1 Kb.
- Use um segundo conjunto de primers: (1) primer hyg forward A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3 e (2) o primer reverso ssu F3002 5'-CTGCAGGTTCACCTACAGCTAC-3', que hibridizam no marcador de resistência do vetor pLEXSY e no locus 18SrRNA (ssu) do genoma de Leishmania . Utilizar o mesmo protocolo de PCR descrito no passo 3.6.2, excepto para a temperatura de recozimento de 53 °C, em vez de 60 °C. O produto esperado é de 1,8 kb (hyg - 3'ssu).
- Analise os produtos de PCR por eletroforese em gel de agarose a 1% para verificar se houve integração no locus ribossômico 18S rRNA do genoma de L. infantum .
4. L. infantum- Luc metacíclico promastigota e diferenciação axênica amastigota
- Cultivar L. infantum-LucMHOM/BR/1974/PP75, expressando constitutivamente Luciferase, em meio BHI, suplementado com 25 mg/L de hemina e 20% de soro fetal de bezerro (FCS).
NOTA: A higromicina foi retirada do meio de transfectantes estáveis. - Para a obtenção de promastigotas metacíclicos de L. infantum-Luc, semear 10 promastigotas6/mL em frascos de 75 cm2 , adicionar 20 mL de meio BHI suplementado com 20% de FCS a 26 oC e manter na posição horizontal por 4 dias ou ligeiramente inclinado até a fase estacionária de crescimento. Após 6-8 dias consecutivos, o frasco contém promastigotas metacíclicos aumentados; centrifugue as promastigotas a 1.000 × g por 10 min a 4 oC.
- Ressuspenda o pellet de promastigotas com 20 mL de DMEM com baixa glicose, conte usando a câmara de Neubauer e centrifugue a 1.000 × g por 10 min a 4 oC.
- Adicione DMEM com glicose baixa ao pellet com densidade de 3-5 × 107 promastigotas / mL. Despeje 5 mL de promastigotas em uma almofada Ficoll de 10 mL, diluída em DMEM, 2:1 (v/v). Centrifugar o gradiente a 100 × g durante 15 min a 4 °C, com o travão desligado e a aceleração lenta.
- Colete promastigotas metacíclicos na interface, na parte superior da almofada Ficoll, conte usando a câmara de Neubauer e centrifugue a 1.000 × g por 10 min a 4 oC. Lave o pellet com PBS para remover qualquer Ficoll residual, conte usando a câmara de Neubauer e centrifugue a 1.000 × g por 10 min a 4 oC.
- Suspenda novamente o pellet em PBS a 2 × 109 / mL. Mantenha as promastigotas no gelo antes da inoculação.
- Diferenciar promastigotas de L. infantum-Luc para amastigotas axênicas in vitro, em meio modificado para amastigotas cultivadas axenicamente (MAA)17.
- Prepare o MAA adicionando 9,55 g/L de meio 199 com sais de Early e glutamina, 0,5% de tripto-caseína, 3 mM de L-cisteína, 15 mM de D-glicose, 4 mM de NaHCO3, 0,33 mM de Na2HPO4, 25 mM de HEPES a um pH final de 6,5 e suplemente com 20% de soro fetal de bezerro (FCS).
- Iniciar culturas em frascos médios (75cm2) com 9 mL de MAA médio e 1 mL de promastigotas na fase estacionária de crescimento (7º dia), 2-3 × 107 promastigotas/mL. Incubar por 24-48 h a 32 °C para permitir a diferenciação amastigota.
- Mantenha as amastigotas cultivadas axenicamente por duas a três passagens por semana até que atinjam uma densidade de 2-3 × 107 / mL.
- Aumente a escala da cultura de amastigotas axênicas para infecção por hamster. Preparar frascos de 150 cm2 com alta densidade de amastigotas (5 × 106/mL) em 20 mL de meio MAA suplementado com 20% de FCS.
- Após 24 h, centrifugue a 1.000 × g por 10 min a 4 oC, lave com o mesmo volume de PBS, conte usando a câmara de Neubauer e centrifugue a 1.000 × g por 10 min a 4 oC. Adicione PBS para preparar o inóculo de 108 amastigotas em 50 μL.
5. Animais
- Adquira hamsters dourados machos com a idade de 4 a 6 semanas e mantenha-os em quarentena por 2 semanas. Certifique-se de que eles tenham de 6 a 8 semanas de idade e pesem 80-100 g quando estiverem infectados com L. infantum MHOM/BR/1974/PP75.
NOTA: Este protocolo se aplica a hamsters machos e fêmeas. No entanto, devido à sua disponibilidade na época, apenas hamsters machos foram utilizados neste estudo. - Divida os hamsters em quatro grupos: grupo 1, infectado intraperitonealmente com amastigota (n = 3); grupo 2, infectado intraperitonealmente com promastigotas (n = 3); grupo 3, infectado na veia gengival com amastigota (n = 2); grupo 4, infectado na veia gengival com promastigota (n = 2); grupo 5, hamsters não infectados como controle (n = 2).
- Manter os animais em prateleiras ventiladas, equipadas com sistema de ventilação controlada (10-15 trocas de ar/h), ciclo claro/escuro de 12 h, a 21 ± 2 oC e 40-60% de umidade. Fornecer enriquecimento ambiental, como papel, feno, algodão hidrofóbico, rolos de papelão, água autoclavada e alimentos ad libitum.
6. Infecção por via intraperitoneal
- Contenha fisicamente o hamster na grade da gaiola, usando o polegar e o indicador como pinças para beliscar a pele nas costas pelos lados perto da cabeça, e os outros dedos puxam a pele ao longo das costas, tentando obter o máximo de pele possível.
- Alinhe o local do inóculo no quadrante inferior direito abdominal com os músculos posteriores da coxa.
- Inocular com o corpo do animal inclinado a 45º, a cabeça mais baixa que o abdômen e a agulha posicionada a 15° a 20°.
- Inocular amastigotas ou promastigotas axênicas, 50 μL (108) em PBS, com uma agulha de 13 x 0,45 mm acoplada a uma seringa de 1 mL. Insira 0,5 cm além do chanfro. Depois de inserir a agulha no abdômen, puxe o êmbolo para confirmar que ela não foi inserida na veia e injete o líquido com cuidado.
7. Infecção intravenosa por inoculação gengival
- Contenha o hamster seguindo a seção 6. Administrar por via intraperitoneal uma mistura de 200 mg/kg de cloridrato de cetamina a 10% e 10 mg/kg de cloridrato de xilazina a 2%, volume final de 1,3 mL, em seringa de 3 mL acoplada a uma agulha de 13 x 0,45 mm.
- Aperte a pata prendendo a base interdigital da almofada para garantir que o animal esteja anestesiado.
- Contenha o hamster anestesiado em decúbito dorsal com as duas mãos e puxe suavemente o lábio inferior para baixo com os polegares para expor a gengiva e a veia gengival
- Posicione uma agulha mais fina (8 x 0,30 mm) acoplada a uma seringa de 1 mL abaixo dos incisivos inferiores ao longo da linha média entre o par de dentes em um ângulo de 25º e insira 2-4 mm na veia labial inferior.
- Para confirmar que o inóculo era intravenoso e que a agulha foi inserida na veia labial inferior, aspirar sangue até o cano da agulha (parte amarela).
- Injete lenta e cuidadosamente o inóculo de 50 μL (108) amastigotas ou promastigotas em PBS durante 1 min até que todo o volume tenha sido inoculado para evitar o vazamento do inóculo e sangue da veia para o ambiente externo e permitir a dispersão na corrente sanguínea.
- Antes da remoção da agulha, aplique uma leve pressão com um cotonete. Simultaneamente, retire a agulha do vaso mantendo o cotonete para promover hemostasia no local, aplicando leve pressão por 1 min para evitar sangramento e perda do inóculo
8. Eutanásia por exsanguinação por punção cardíaca
- Contenha o animal para anestesiar, conforme descrito na seção 7. Realizar punção cardíaca com agulha de 20 x 0,55 mm acoplada a seringa de 5 mL, inserida em ângulo de 45º e levemente inclinada para a esquerda, logo abaixo da cartilagem xifóide.
- Retire 1 mL de sangue. Após a coleta de sangue terminal, remova a seringa, mas mantenha a agulha no coração.
- Se o animal já estiver respirando e apresentar batimentos cardíacos, administre tiopental sódico a 5% (200 mg/kg) com uma seringa de 5 mL e acople-o à agulha de 20 x 0,55 mm que já está no coração.
- Após 5 min, com um estetoscópio, verifique se há movimentos respiratórios e batimentos cardíacos.
9. Extração de DNA de órgãos e tecidos
- Após a eutanásia, colete o baço, os gânglios linfáticos mesentéricos e fragmentos do fígado.
- Corte os tecidos congelando em gelo seco, descongelando e cortando com duas lâminas de bisturi. Digerir 20 mg de tecidos picados em 600 μL de tampão de lise com 17,5 μL de proteinase K (20 mg/ml) e incubar a 55 °C durante a noite.
- Centrifugue a 15.000 × g por 4 min para remover fragmentos de tecidos que não são lisados.
- Adicione 200 μL de solução de precipitação de proteínas, misture vigorosamente por 20 s, incube por 5 min em gelo e centrifugue a 15.000 × g por 4 min.
- Transfira o sobrenadante para outro tubo, adicione 600 μL de isopropanol e misture suavemente até a precipitação do DNA. Centrifugue o DNA a 15.000 × g por 2 min e lave o pellet com etanol a 70% por 30 min em um agitador de inclinação e centrífuga.
- Descarte o etanol e seque o pellet em temperatura ambiente. Reidrate o DNA com 50-200 μL de água ultrapura a 65 ° C por 30 min, quantifique e dilua o DNA a 0,1 μg / mL e armazene a -20 ° C.
10. Avaliação da infecção em tecidos e órgãos por PCR
- Avaliar a carga parasitária no DNA genômico de tecidos e órgãos por PCR convencional: 2,5 μL de tampão de PCR, 1,5 mM de MgSO4, 0,2 mM dNTP, 1 U de DNA polimerase, 300 ng de DNA genômico, 0,2 μM de cada primer e água livre de nuclease até um volume final de 25 μL.
- Amplificar usando o protocolo de L. infantum kDNA18: Um ciclo de desnaturação a 94 °C por 2 min; 39 ciclos de amplificação, 30 s a 94 °C, 15 s a 60 °C, 30 s a 72 °C, extensão final de 5 min a 72 °C. O tamanho esperado do produto de PCR é de 145 pb. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Amplificar hamster GAPDH, o controle endógeno da PCR3: Um ciclo de desnaturação a 94 °C por 2 min, 39 ciclos de amplificação, 30 s a 94 °C, 15 s a 58 °C, 30 s a 72 °C, extensão final de 5 min a 72 °C. (1) Fw GAPDH hamster 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH hamster 5'- TTCACCTGTTCCACAGCCTTG -3'.
- Analise os produtos de PCR por eletroforese em gel de agarose a 1%.
11. Acompanhamento de hamsters por imagens de bioluminescência in vivo
- Avaliar a progressão da infecção ao longo do tempo pela emissão de bioluminescência de todo o animal no sistema de imagem de bioluminescência in vivo , que consiste em uma câmera acoplada à carga resfriada (CCD) montada em uma câmara à prova de luz. Mantenha o animal anestesiado durante a aquisição da imagem com uma entrega de cone nasal.
- Antes da aquisição da bioluminescência e 5 minutos antes da indução da anestesia, injete D-luciferina (150 mg / kg) por via intraperitoneal em hamsters seguindo a seção 6. Prepare uma solução de estoque de sal de potássio de D-luciferina a 15 mg / mL em PBS, esterilize por filtro e armazene a -80 oC.
- Cinco minutos após a injeção de D-luciferina nos animais, anestesiar-lhes com isoflurano a 2% em uma câmara de indução rica em oxigênio. Após mais 5 minutos, capture imagens de bioluminescência usando a câmera CCD. Obter imagens de hamsters em posição ventral 2 h e 24 h após a infecção, 8 e 22 dias após a infecção (dpi).
NOTA: Mantenha a anestesia durante o processo de imagem com o dispositivo de fornecimento de isofluorano-oxigênio. - Com base no nível de emissão de bioluminescência, use os seguintes parâmetros: tempo de exposição, variando de 30 s a 5 min, Binning médio ou grande, f/stop 1 e campo de visão D (12,5 cm).
12. Quantificação da bioluminescência em animais infectados com L. infantum-Luc
- Use a ferramenta de medição manual para identificar as regiões de interesse (ROI), tamanho e área na cabeça e no corpo do animal. Quantifique a bioluminescência adquirida pela câmera CCD no ROI selecionado.
- Meça o sinal de fundo com o ROI médio de fundo e subtraia da emissão bioluminescente obtida do ROI manual.
- Expresse a emissão de bioluminescência em radiância, uma unidade normalizada pelo tempo e área: photons.sec-1.cm-2.sr-1
Resultados
Expressão estável de luciferase em L. infantum
L . infantum geneticamente modificado foi produzido utilizando o plasmídeo da linhagem pLEXSY, que se integra ao genoma de Leishmania no locus ribossômico 18S rRNA (ssu), cuja transcrição é conduzida pela RNA polimerase I. Assim, clones de L. infantum-Luc foram avaliados quanto à integração de plasmídeos no genoma de Leishmania, e quanto à expressão estável por emissão de bioluminescência in vitro. O clone altamente expressivo exibindo bioluminescência >120 vezes acima do fundo foi escolhido para avaliação da integração genômica por PCR. Veja a Figura 1 para eletroforese em gel de agarose de produtos de PCR para avaliar a integração do plasmídeo no genoma e a emissão de bioluminescência (RLU) de promastigotas do clone de L. infantum-Luc. Fragmentos do tamanho esperado foram obtidos de cada PCR; Um produto de aproximadamente 1,1 kB (5'ssu - UTR1) e outro de 1,8 kb (Hyg-3'ssu) foram amplificados a partir do genoma de L. infantum-Luc (Figura 1A), confirmando a integração do plasmidial e do gene da luciferase no locus ssu do genoma de L. infantum .
A expressão de luciferase de vaga-lume também foi avaliada em promastigotas de L. infantum-Luc por emissão de bioluminescência (RLU) no leitor de microplacas, conforme descrito nos protocolos, seção 2. Mesmo após várias passagens em cultura e em camundongos BALB/c por 5 dias, manteve o nível de bioluminescência; 569,3 ± 19,5 para o tipo selvagem e 59361,9 ± 2673,3 (n = 2) para L. infantum-Luc clonado (Figura 1B). Assim, o clone de L. infantum-Luc expressando de forma estável a luciferase do vaga-lume, foi usado para infectar hamsters por via intragengival ou intraperitoneal.
Inóculo intravenoso na veia gengival
Para inocular a Leishmania na corrente sanguínea de hamsters, deve-se tomar cuidado para minimizar a perfuração da veia, sangramento e vazamento do inóculo. Assim, o lábio inferior deve ser puxado suavemente para baixo para expor a veia gengival (Figura 2A); e uma agulha de calibre menor de 30 G deve ser usada para evitar perfuração excessiva da veia. A agulha deve ser posicionada com a moldura voltada para cima para ser inserida na veia em um ângulo adequado (Figura 2B). De fato, para garantir que a agulha foi injetada no vaso - a veia labial mandibular, o êmbolo da seringa deve ser puxado para baixo até que o sangue seja aspirado para o corpo da agulha (Figura 2C). Antes da remoção da agulha, uma leve pressão deve ser aplicada com um cotonete para promover a hemostasia (Figura 2D).
Avaliação longitudinal por imagem de bioluminescência
Hamsters infectados intraperitonealmente (IP) ou via intragengival (IG) com L. infantum-Luc foram acompanhados até o50º dpi e avaliados por imagem de bioluminescência até 22 dpi (Figura 3). As imagens foram adquiridas 2 h após a infecção intraperitoneal com 108 parasitas na cavidade peritoneal; As imagens foram adquiridas por 30 s ou 1 min de meio de exposição binning. O sinal de bioluminescência foi >65 vezes mais intenso no abdome nos animais infectados por amastigotas (4,6 × 105 ± 3,7 × 105) do que nos infectados por promastigotas (6,8 × 103 ± 3,8 × 103) (Tabela 1), o que demonstra que as amastigotas diferenciadas in vitro são mais bioluminescentes do que as promastigotas metacíclicas na fase estacionária e purificadas no coxim de Ficoll.
Um dia após a infecção (1 dpi), as imagens de bioluminescência foram adquiridas por 3 min de exposição (Figura 3). Houve uma diminuição de 45% no sinal de bioluminescência na região abdominal em hamsters infectados por promastigotas e 70% de decaimento em hamsters infectados por amastigotas (Figura 3), o que sugere que as amastigotas se degradaram em maior extensão do que as promastigotas metacíclicas (Tabela 1 e Figura 4). Uma semana após a infecção (8 dpi), os animais infectados com promastigotas mantiveram o sinal de bioluminescência (3,3 × 103 ± 5 × 103). No entanto, a emissão de bioluminescência em hamsters infectados com amastigotas caiu 95%, de 1,3 × 105 ± 1,1 × 105 para 6,7 × 103 ± 7,5 × 103 (Tabela 1) e atingiu o mesmo nível de hamsters infectados com promastigotas. Três semanas após a infecção (22 dpi), um sinal de bioluminescência foi adquirido por 5 min de exposição e binning large (Figura 3); o sinal foi muito menor para os animais infectados por promastigotas e amastigotas (Tabela 1 e Figura 4).
Outro grupo de hamsters foi infectado por via intragengival com amastigotas e promastigotas de L. infantum-Luc (10,8); a emissão de bioluminescência foi observada na região maxilar (Figura 3). O acompanhamento começou 1 dia após a infecção, e os hamsters infectados com amastigotas exibiram mais sinal de bioluminescência e radiância (7,3 × 103 ± 4,1 × 103) do que os infectados com promastigotas (1 × 103 ± 5,7 × 102). Uma semana após a infecção (8 dpi), foi observada uma queda de 36% no sinal de bioluminescência nos animais infectados com promastigotas e de 90% nos hamsters infectados com amastigotas; a radiância variou de 7,3 × 103 ± 4,1 × 103 a 7,8 × 102 ± 5,6 × 102 (Tabela 1). Três semanas após a infecção (22 dpi), um sinal de bioluminescência também foi adquirido por 5 min de exposição e binning large (Figura 3). O sinal de bioluminescência foi semelhante e baixo para os animais infectados com promastigotas e amastigotas (Tabela 1 e Figura 4) na cabeça dos animais infectados na gengiva e não foi observada dispersão da infecção para a região abdominal pelo sinal de bioluminescência.
Avaliação da infecção em tecidos e órgãos por PCR
Realizamos PCR convencional para investigar infecção em órgãos específicos, como fígado, baço e linfonodos, que poderiam estar abaixo do limite de detecção da imagem in vivo . A região alvo do kDNA foi mais específica para a amplificação do DNA de L. infantum em tecidos e órgãos infectados, e a PCR para a enzima GAPDH do hamster foi um controle da integridade do DNA e da reação de PCR. Apenas as amostras que foram amplificadas para GAPDH foram consideradas na análise. Assim, por PCR, dois dos três hamsters infectados por via intraperitoneal com amastigotas axênicas apresentaram infecção em tecidos e órgãos; animal dois (A2) no baço e animal três (A3) no fígado, a 50 dpi (Figura 5A). Um hamster foi infectado intraperitonealmente com promastigotas axênicos; o animal três (A3) (Figura 5B) apresentou amplificação no linfonodo. Hamsters inoculados intragengivalmente com promastigotas ou amastigotas axênicas a 50 dpi não puderam apresentar uma amplificação clara - apenas uma faixa no fígado do animal um (A1) infectado com promastigotas (Figura 5C). Notavelmente, tivemos três animais mantidos por 8 meses cujo inóculo entregue pela via intragengival com amastigotas vazou levemente durante a injeção. Dois dos três animais apresentaram uma infecção clara no fígado, os animais um e dois (Figura 5D).
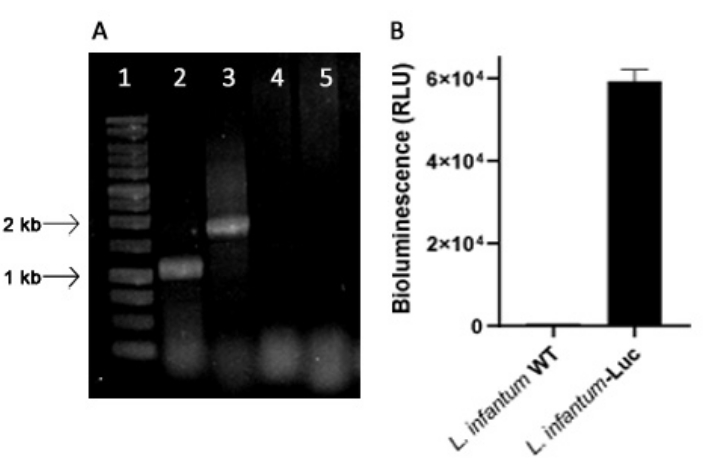
Figura 1: Avaliação do clone de Leishmania infantum-Luc por PCR e emissão de bioluminescência. (A) Eletroforese em gel de agarose de produtos de PCR para avaliar a integração do plasmídeo no genoma: pista 1 - 1 kb escada de DNA; PCR do DNA genômico de L. infantum-Luc, pista 2 - 5'ssu - utr1 (1,1 kb) e pista 3- hyg- 3'ssu (1,8 kb); PCR de DNA genômico de L. infantum-wt, pistas 4 e 5. (B) Emissão de bioluminescência (RLU) de promastigotas do clone de L. infantum-Luc (106) no leitor de microplacas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Injeção intravenosa de Leishmania infantum-Luc na veia gengival. (A) O hamster foi colocado em decúbito dorsal e o lábio inferior foi puxado para baixo. (B) Uma agulha mais fina (8 x 0,30 mm) acoplada a uma seringa de 1 mL foi posicionada abaixo dos incisivos inferiores ao longo da linha média entre o par de dentes em um ângulo de 25º e inserida 2-4 mm na veia labial inferior. (C) Inoculação de 50 μL (108) de amastigotas ou promastigotas em PBS. (D) Hemostasia usando um cotonete e aplicando uma leve pressão no local da inoculação. Clique aqui para ver uma versão maior desta figura.
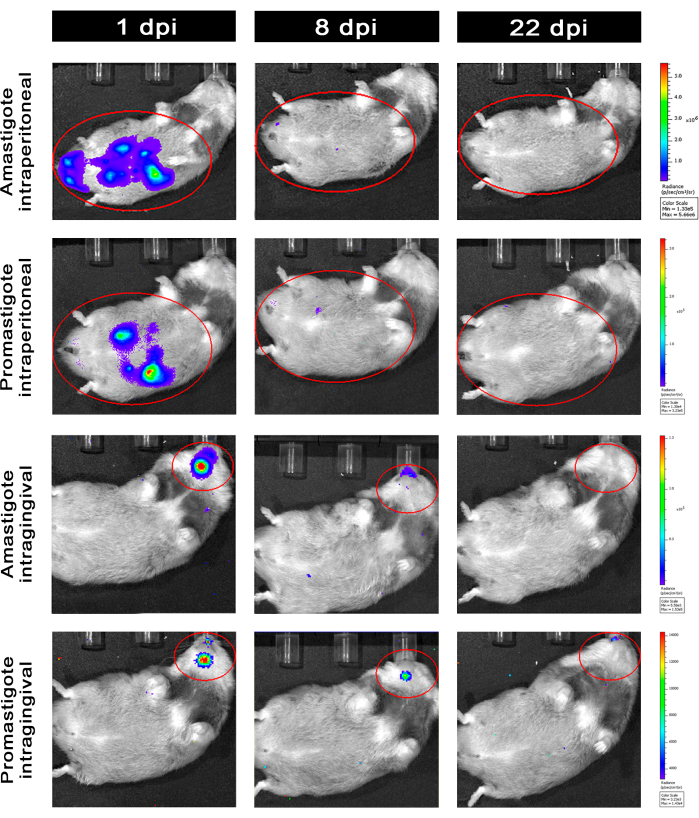
Figura 3: Acompanhamento por imagem de bioluminescência in vivo . Imagens representativas de um animal por grupo: Infectado via intraperitoneal (painéis superiores) ou intragengival (painéis inferiores), com amastigotas ou promastigotas de L. infantum-Luc, por 1, 8 e 22 dpi. ROI vermelho representando as regiões sondadas no abdômen e na cabeça, para infecção intraperitoneal ou intragengival, respectivamente. Os dados mostram que a 1 dpi, todos os animais apresentaram sinal de bioluminescência no abdômen ou mandíbula. O sinal estava caindo após 8 dpi e era quase indetectável em qualquer grupo a 22 dpi. Clique aqui para ver uma versão maior desta figura.
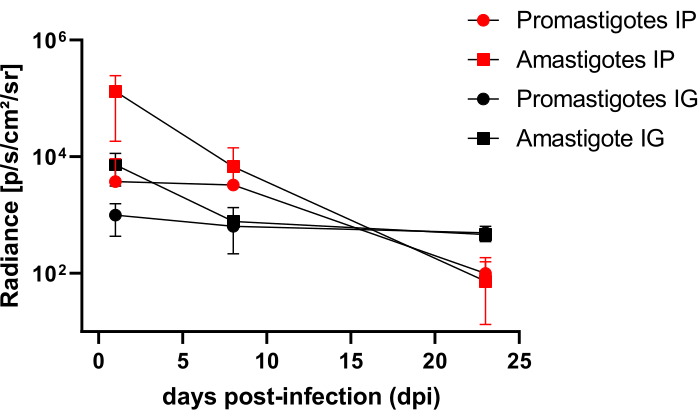
Figura 4: Análise comparativa da radiância das imagens de bioluminescência. A quantificação de radiância photons.sec-1.cm-2.sr-1 foi realizada no abdômen ou na cabeça de hamsters com ferramentas manuais de medição de ROI. O ROI médio de fundo foi subtraído do ROI de medição para remover qualquer sinal espúrio. Clique aqui para ver uma versão maior desta figura.
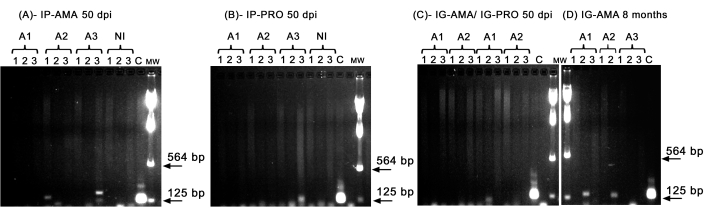
Figura 5: Amplificação de kDNA por PCR. (A) IP-AMA, hamsters infectados por via intraperitoneal com amastigota, 50 dpi (n = 3); (B) IP-PRO, infectado por via intraperitoneal com promastigotas, 50 dpi (n = 3); (C) IG-AMA, infectado por via intragengival com amastigota (n = 2), IG-PRO, infectado por via intragengival com promastigota (n = 2); (D) IG-AMA, infectado por via intragengival com amastigota, 8 meses após a infecção (n = 3). NI, hamsters não infectados como controle negativo (n = 2); C- DNA genômico de L. infantum-Luc, controle positivo de PCR. Tecidos e órgãos: 1- baço, 2- fígado, 3- gânglios linfáticos. MW- marcador de peso molecular, as setas indicam as bandas de peso molecular mais baixas. A1- animal um, A2- animal dois e A3- animal três. Clique aqui para ver uma versão maior desta figura.
| Dpi | Amastigotas IP | Promastigotas IP | Amastigotas IG | Promastigotas IG | ||||||||
| Significar | SD | N | Significar | SD | N | Significar | SD | N | Significar | SD | N | |
| 0 | 4,6 x 105 | 3,7 x 105 | 3 | 6,8 x 103 | 3,8 x 103 | 3 | - | - | - | - | - | - |
| 1 | 1,3 x 105 | 1,1 x 105 | 3 | 3,8 x 103 | 5,5 x 103 | 3 | 7,3 x 103 | 4.1 x 103 | 2 | 1.0 x 103 | 5,7 x 102 | 2 |
| 8 | 6,7 x 103 | 7,5 x 103 | 3 | 3,3 x 103 | 5.0 x 103 | 3 | 7,8 x 102 | 5,6 x 102 | 2 | 6,4 x 102 | 8,2 x 101 | 2 |
| 22 | 7,3 x 101 | 8,5 x 101 | 3 | 9,9 x 101 | 8,6 x 101 | 3 | 4.6 x 102 | 7,5 x 101 | 2 | 5,0 x 102 | 1,5 x 102 | 2 |
Tabela 1: Dados brutos da análise comparativa de radiância de imagens de bioluminescência. Quantificação de radiância média de fótons.seg-1.cm-2.sr-1 por grupo e rota. Abreviaturas: dpi = dias pós-infecção; DP = desvio padrão; N = tamanho da amostra.
Discussão
A coleta de sangue ou injeção intravenosa de substâncias em hamsters é necessária para vários estudos científicos. Vários métodos têm sido desenvolvidos para acessar diferentes rotas de coleta ou inoculação diretamente relacionadas aos objetivos da pesquisa19. Devido à anatomia do hamster - cauda e membros curtos - a via intracardíaca é geralmente a escolha para injeção intravenosa de Leishmania. Dependendo da cepa utilizada, a via intracardíaca mostrou-se vantajosa como cepa de referência L. infantum MHOM/BR/1974/PP75, cuja infecção ocorre a longo prazo, 6-9 meses5. No entanto, é um inóculo que pode levar ao sangramento e à morte do animal. Assim, padronizamos uma via alternativa de inoculação intravenosa para infecção no plexo gengival, veia labial inferior, que causa menos danos ao animal. Os animais foram infectados com a cepa de referência geneticamente modificada L. infantum MHOM/BR/1974/PP75, que expressou de forma estável a luciferase do vaga-lume mesmo após várias passagens em cultura e camundongos (Figura 1), como relacionado para outras espécies de Leishmania transfectadas pelo mesmo plasmídeo integrativo20.
A veia mandibular labial ou a veia gengival é a melhor via para coleta de sangue e coleta múltiplade sangue 10,11. No entanto, esta é a primeira demonstração de que a veia gengival é um local viável para infecção intravenosa por Leishmania em hamsters. Em contraste com a coleta de sangue que geralmente usa uma agulha de calibre alto 26 G para evitar hemólise sanguínea10, esse calibre de agulha não foi apropriado para inoculação de Leishmania, devido à perfuração da veia, sangramento e vazamento do inóculo. Para infecção por Leishmania através da veia maxilar mandibular, uma agulha 30G de calibre menor era essencial. Outro aspecto que diferencia a punção venosa da infecção via veia gengival é a taxa de administração, em torno de 1 μL/s; e para garantir que seja injetado no vaso - a veia labial mandibular, e não se aloje na mucosa, subcutânea ou intradérmica. Devido à baixa renovação sanguínea do plexo gengival, os 50 μL de um inóculo de alta densidade de amastigotas axênicos ou promastigotas de L. infantum-Luc, 2 x 109 parasitas/mL, tiveram que ser inoculados lentamente (~ 1 min), e a agulha deve ser removida mantendo o swab pressionado por 1 min para permitir a dispersão do inóculo na corrente sanguínea (Figura 2).
Para avaliação longitudinal da infecção, os hamsters foram infectados por via intraperitoneal (IP) ou por via intragengival (IG) com L. infantum-Luc e acompanhados por 50 dpi pelo sistema de imagem de bioluminescência até a eutanásia. Considerando que a cepa de referência PP75 poderia ser menos virulenta per se e que a superexpressão de luciferase também poderia impactar a eficácia da infecção e manter a infecção a longo prazo, um alto inóculo de 108 parasitas foi usado para infecção. Após a inoculação gengival de ambas as amastigotas e promastigotas de L. infantum-Luc e avaliação pelo sistema de imagem de bioluminescência, a bioluminescência foi restrita à região maxilar de hamsters 24 h após a infecção. De fato, hamsters infectados intraperitonealmente com amastigotas e promastigotas de L. infantum-Luc exibiram bioluminescência dispersa por todo o abdômen (Figura 3, 1 dpi). A diminuição contínua da emissão bioluminescente ao longo do tempo, desde o primeiro dia de infecção até o8º dia e até o22º dpi em hamsters infectados com L. infantum-Luc, foi independente da via de inoculação (Tabela 1 e Figura 4).
No entanto, quando a carga parasitária nos tecidos animais é baixa, ela pode estar abaixo do limite de detecção do sistema de imagem de bioluminescência, mas pode ser detectada e quantificada por PCR ou qPCR. Como já relatado, a infecção causada pela cepa PP75 é de fato menor do que a de outras cepas5, e apenas alguns desenvolveram sinais clínicos da doença devido à variabilidade genética dos animais. Neste estudo, apesar do pequeno número de animais e da baixa virulência dessa cepa, as amastigotas axênicas demonstraram vantagem a 50 dpi, apresentando melhor infecção do que as promastigotas, como demonstrado pela PCR (Figura 5). Oito meses após a infecção por amastigotas por via gengival, os parasitas puderam ser detectados por PCR no fígado (Figura 5) e também apresentaram piloereção moderada, aperto orbital e postura arqueada.
As amastigotas axênicas podem ser uma melhor escolha para infecção e acompanhamento do que as promastigotas21 e têm a vantagem de serem fáceis de produzir em larga escala. O inóculo gengival é viável e uma melhor via para inoculação intravenosa de compostos e para infecção de Leishmania e outros patógenos, sem danos ou inchaço no local de aplicação na mandíbula ou à saúde animal.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. O PPSUS/Decit-MS/CNPq/SES forneceu apoio financeiro para esta pesquisa. Obrigado a Monique Ribeiro de Lima por seus conselhos sobre as rotas de inoculação. Este projeto foi desenvolvido no âmbito doAcordo de Cooperação nº 258/2017 entre a FIOCRUZ e a Universidade Federal do Rio de Janeiro - UFRJ. A equipe agradece sinceramente aos produtores de vídeo Ricardo Baptista Schmidt e Genilton José Vieira, do Centro de Popularização da Ciência (IOC), pelo inestimável apoio e assistência na filmagem dos protocolos e na realização das entrevistas.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Referências
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados