A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير وتوصيف فيلم هيدروجيل قائم على الألجينات والصبار المحمل بحمض الفوسيديك
In This Article
Summary
تم تطوير تركيبة من فيلم هيدروجيل محمل بحمض الفوسيديك بنسب مختلفة من الصبار وتم وصفها في هذه الدراسة.
Abstract
تم تحضير فيلم هيدروجيل جديد محمل بحمض الفوسيديك عبر تقنية صب المذيبات باستخدام الألجينات والصبار. تم تحسين أغشية الهيدروجيل باستخدام نسب مختلفة من ألجينات الصوديوم والصبار والجلسرين. أظهرت الأفلام التي تحتوي على 10٪ من الجلسرين (وزن / وزن من الجينات) أفضل مظهر. أثر دمج الصبار على السماكة وسلوك التورم ونفاذية بخار الماء وملف إطلاق الدواء لأغشية الهيدروجيل. أدى ارتفاع محتوى الصبار إلى أغشية أكثر سمكا (تصل إلى نسبة معينة) ، وزيادة التورم ، وانخفاض نفاذية بخار الماء ، وإطلاق الدواء لفترة طويلة تصل إلى 93٪ على مدار 12 ساعة. أكد تحليل التحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FTIR) وجود مجموعات وظيفية رئيسية والتفاعل بين مكونات الهيدروجيل. تشير الدراسة إلى أن الجمع بين ألجينات الصوديوم والصبار والجلسرين يمكن أن يحسن الخصائص الميكانيكية وملامح إطلاق الأدوية لأغشية الهيدروجيل ، مما يجعلها خيارا واعدا لتعزيز توصيل الأدوية الموضعية وتطبيقات التئام الجروح.
Introduction
حمض الفوسيديك هو مضاد حيوي ستيرويدي قوي مشتق من فوسيديوم كوكسينيوم. يستخدم على نطاق واسع لعلاج التهابات الجلد بالمكورات العنقودية والقوباء. يتمتع هذا الدواء بفعالية عالية ، حتى ضد السلالات المقاومة للمضادات الحيوية ، وسمية منخفضة ، مما يجعله خيارا مناسبا لإدارة التهابات الجلد1. على عكس المضادات الحيوية الموضعية الأخرى ، يتغلغل حمض الفوسيديك بعمق في الجلد ، مما يعزز آثاره المضادة للميكروبات ، خاصة في المناطق التي يتلف فيها الحاجز الواقي للجلد. يسمح هيكلها بخصائص الذوبان متعددة الاستخدامات ، مما يتيح التوزيع الواسع النطاق في جميع أنحاء أنسجة الجسم ، والذي يتم تعزيزه بشكل أكبر في شكل مكل الصوديوم لتحسين قابلية الذوبان في الماء ومعدلاتالاختراق 2،3. يمكن إعطاء حمض الفوسيديك بطرق مختلفة ، بما في ذلك عن طريق الفم والوريد والموضعيا ، والتكيف مع احتياجات العلاج المختلفة وجعله خيارا مرنا لمختلف أنواع العدوى4.
ظهرت الهلاميات المائية ، بمحتواها المائي العالي وتوافقها الحيوي ، كناقلات مبتكرة للمضادات الحيوية في علاج الجروح ، مما يوفر الاحتفاظ بالرطوبة ، وإطلاق الأدوية الخاضع للرتحكم ، وتحسين نتائج المرضى. إنها مصنوعة من بوليمرات طبيعية أو اصطناعية مثل الجينات ، والتي تفضل لتوافقها الحيوي القوي ، والقدرة على تحمل التكاليف ، وخصائص الهلام التي تحاكي مصفوفات الأنسجة الطبيعية خارجالخلية 5. توفر الهلاميات المائية القائمة على الجينات ، على وجه الخصوص ، بيئة رطبة مواتية للتئام الجروح ، ولا تلتصق بالجرح ، وتسمح بإزالتها بسهولة ، مما يجعلها مثالية لتوصيل المواد النشطة بيولوجيا ودعم تجديد الأنسجة. يمثل تطوير الهلاميات المائية التي تغلف المضادات الحيوية تقدما كبيرا في العناية بالجروح ، مما يضمن توصيل الأدوية المستهدفة والآثار العلاجية المستمرة6،7.
يهدف الهيدروجيل المقترح المحمل بحمض الفوسيديك / الصبار إلى التغلب على تحديات ذوبان حمض الفوسيديك وتعزيز تغلغل الجلد. الصبار ، المعروف بخصائصه الصديقة للبشرة والمرطبة والمضادة للبكتيريا ، يعمل أيضا كمحسن للاختراق الكيميائي ، مما قد يحسن فعالية حمض الفوسيديك في علاج التهابات الجلد8،9. تستفيد هذه التركيبة المبتكرة من التأثيرات التآزرية للصبار وهيدروجيل الألجينات لخلق بيئة شفاء مواتية ، وتحسين توصيل الأدوية ، وتقديم حل واعد لتعزيز علاج التهابات الجلد ، والاستفادة القصوى من النشاط المضاد للميكروبات القوي لحمض الفوسيديك مع تحسين نتائج التوصيل والشفاء10.
Protocol
تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تحضير أفلام هيدروجيل حمض الفوسيديك
- تحضير محاليل ألجينات الصوديوم (2.0٪ وزن / حجم) والصبار (1.0٪ وزن / حجم) عن طريق إذابتها في الماء المقطر.
- أضف 200 مجم من حمض الفوسيديك إلى محلول ألجينات الصوديوم وحركه لمدة 1 ساعة.
- أضف الجلسرين إلى محلول الجينات بتركيزات 10٪ و 12٪ و 14٪ (وزن / وزن ، بناء على كتلة الألجينات).
- اجمع بين محاليل الجينات والصبار لتحقيق نسب الجينات / الصبار النهائية (v / v) 100: 0 و 90:10 و 80:20 و 75:25.
- صب 25 مل من كل خليط في أطباق بتري زجاجية (100 مم × 20 مم) واتركها لتجف في درجة حرارة الغرفة (25 درجة مئوية) والرطوبة الخاضعة للرقابة (50٪) لمدة يومين.
- اغمر الأغشية المجففة في محلول مائي من كلوريد الكالسيوم (CaCl2) (5.0٪ وزن / حجم) لمدة 5 دقائق للحصول على أغشية الهيدروجيل.
- اغسل الأغشية الناتجة بالماء المقطر وجففها في درجة حرارة الغرفة قبل الاستخدام.
2. تحديد سمك الفيلم
- استخدم ميكرومتر رقمي لقياس سمك الفيلم11.
- خذ القياسات في خمس نقاط مميزة عبر الفيلم.
- سجل القياسات التي تم الحصول عليها من كل نقطة.
- احسب متوسط سمك الفيلم بناء على القياسات التي تم إجراؤها.
3. تحديد مؤشر التورم
- قطع عينات الفيلم إلى مربعات 2 سم × 2 سم باستخدام سكين المختبر.
- قم بوزن كل عينة بدقة.
- انقع العينات في المخزن المؤقت PBS (درجة الحموضة 6.8) في درجة حرارة الغرفة لمدة 24 ساعة.
- امتصاص أي ماء زائد على سطح الفيلم باستخدام ورق الترشيح.
- قم بوزن العينات مرة أخرى.
- قم بوزن الأفلام على فترات زمنية مختلفة. احسب قدرة التورم باستخدام المعادلة التالية:
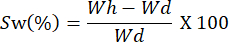
ملاحظة: يمثل Wh الوزن المائي للعينة ، ويتوافق Wd مع الوزن الجاف للعينة.
4. نفاذية بخار الماء أو اختبار الانسداد
- قم بتغطية فتحة دورق زجاجي يحتوي على 50 مل من الماء بورق ترشيح11.
- قم بتطبيق محلول تشكيل فيلم على إحدى الأوراق واسمح لها بتطوير فيلم.
- قم بتخزين الدورق في درجة حرارة الغرفة والرطوبة.
- قم بتقييم نفاذية الفيلم للماء بناء على انخفاض وزن الماء داخل الدرق.
- لتحديد تقييم نفاذية بخار الماء لفيلم الهيدروجيل المحضر ، استخدم الصيغة التالية:
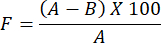
ملاحظة: يقيس عامل الانسداد ، F ، نفاذية الفيلم. يتم تحديده عن طريق حساب الفرق في وزن الماء بين دورق زجاجي مغطى بورق ترشيح بدون فيلم ودورق زجاجي مغطى بورق ترشيح مطلي بالفيلم. تشير قيمة عامل الانسداد الأصغر إلى نفاذية أكبر للفيلم.
5. التحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FTIR)
- ضع عينة الهيدروجيل على بلورة ATR لآلة التحليل الطيفي FTIR.
- اضبط نطاق الرقم الموجي على 4000-400 سم −1.
- اضبط معدل المسح الضوئي على 60 عملية مسح لكل عينة.
- اضبط الدقة على 4 سم −1.
- سجل خلفية هوائية قبل كل تشغيل عينة.
- قم بإجراء التحليل لكل عينة هيدروجيل على حدة.
- تحليل أطياف FTIR لكل عينة هيدروجيل لتأكيد المجموعات الوظيفية وفحص التفاعلات بين جميع المكونات12.
- كرر تحليل الصبار الخام وألجينات الصوديوم والجلسرين وحمض الفوسيديك بشكل منفصل.
6. كالوريمتر المسح التفاضلي (DSC)
- استخدم أداة تحليل حراري متاحة تجاريا للحصول على الملامح الحرارية.
- اصنع عينات القياس من قطع دائرية متعددة مقطوعة من فيلم البوليمر.
- تحقق من نطاق درجة الحرارة من 25-230 درجة مئوية.
- اضبط معدل التسخين / التبريد على 20 درجة مئوية / دقيقة.
- قم بإجراء معايرة درجة الحرارة والمحتوى الحراري باستخدام الإنديوم القياسي مع البرامج المتوافقة.
7. اختبار إطلاق المخدرات
- قم بإعداد محلول 50 مل PBS (الرقم الهيدروجيني = 7.4) كوسيط الذوبان.
- اغمر أغشية الهيدروجيل في PBS عند 37 درجة مئوية لمدة 24 ساعة مع التقليب بمعدل 50 دورة في الدقيقة.
- على فترات محددة مسبقا ، اجمع 2 مل من العينات.
- تمييع وتصفية العينات التي تم جمعها من خلال مرشح حقنة.
- قم بتجديد حجم مكافئ من PBS على الفور.
- تقييم تركيزات حمض الفوسيديك المنبعث باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية ، وقياس الامتصاص عند 285 نانومتر.
- قم بتقييم حركية إطلاق حمض الفوسيديك باستخدام نماذج الترتيب الصفري ، من الدرجة الأولى ، Higuchi ، و Korsmeyer-Peppas4.
النتائج
تحضير فيلم هيدروجيل الألجينات / الصبار
تم استخدام نسب مختلفة من ألجينات الصوديوم والصبار والجلسرين لتحضير تركيبة فيلم الهيدروجيل. تم إجراء التحضير والتقييم النهائي للتركيبات فقط باستخدام 10٪ من الجلسرين (وزن / وزن من الألجينات). يوضح الشك?...
Discussion
تم دمج حمض الفوسيديك في أغشية الهيدروجيل الجينات بنسب مختلفة من الصبار والجلسرين. لم يؤثر وجود الصبار على المظهر ، ولكن لوحظ انخفاض في اللزوجة في المحاليل التي تحتوي على الصبار أثناء التحضير. تشير نتائج اختبار السماكة إلى أن إدراج الصبار قد يكون له بع...
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل مشروع دعم الباحثين بجامعة الأميرة نورة بنت عبد الرحمن رقم (PNURSP2024R30) ، جامعة الأميرة نورة بنت عبد الرحمن ، الرياض ، المملكة العربية السعودية. تم تمويل هذا البحث من قبل مشروع دعم الباحثين رقم (RSPD2024R811) ، جامعة الملك سعود ، الرياض ، المملكة العربية السعودية.
Materials
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
References
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved