Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Développement et caractérisation d’un film hydrogel à base d’alginate et d’aloe vera chargé d’acide fusidique
Dans cet article
Résumé
Une formulation de film d’hydrogel chargé d’acide fusidique a été développée avec différents ratios d’Aloe vera et caractérisée dans cette étude.
Résumé
Un nouveau film d’hydrogel chargé d’acide fusidique a été préparé par la technique de coulée au solvant à l’aide d’alginate et d’aloe vera. Les films d’hydrogel ont été optimisés à l’aide de différents ratios d’alginate de sodium, d’aloe vera et de glycérine. Les films contenant 10 % de glycérine (p/p d’alginate) présentaient le meilleur aspect. L’incorporation d’Aloe vera a influencé l’épaisseur, le comportement de gonflement, la perméabilité à la vapeur d’eau et le profil de libération de médicament des films d’hydrogel. Une teneur plus élevée en aloe vera a entraîné des films plus épais (jusqu’à un certain rapport), une augmentation de l’enflure, une réduction de la perméabilité à la vapeur d’eau et une libération prolongée du médicament jusqu’à 93 % sur 12 heures. L’analyse par spectroscopie infrarouge à transformée de Fourier (FTIR) a confirmé la présence de groupes fonctionnels clés et l’interaction entre les composants de l’hydrogel. L’étude suggère que la combinaison d’alginate de sodium, d’aloe vera et de glycérine peut améliorer les propriétés mécaniques et les profils de libération de médicaments des films d’hydrogel, ce qui en fait une option prometteuse pour l’administration de médicaments topiques améliorés et les applications de cicatrisation des plaies.
Introduction
L’acide fusidique est un puissant antibiotique stéroïdien dérivé de Fusidium coccineum. Il est largement utilisé pour traiter les infections cutanées staphylococciques et l’impétigo. Ce médicament a une efficacité élevée, même contre les souches résistantes aux antibiotiques, et une faible toxicité, ce qui en fait une option appropriée pour gérer les infections cutanées1. Contrairement à d’autres antibiotiques topiques, l’acide fusidique pénètre profondément dans la peau, renforçant ses effets antimicrobiens, en particulier dans les zones où la barrière protectrice de la peau est endommagée. Sa structure permet des caractéristiques de solubilité polyvalentes, permettant une distribution généralisée dans tous les tissus corporels, qui est encore améliorée dans sa forme de fusidate de sodium pour une meilleure solubilité dans l’eau et des taux de pénétration 2,3. L’acide fusidique peut être administré de différentes manières, notamment par voie orale, intraveineuse et topique, s’adaptant ainsi aux différents besoins de traitement et ce qui en fait un choix flexible pour diverses infections4.
Les hydrogels, avec leur teneur élevée en eau et leur biocompatibilité, sont devenus des vecteurs innovants pour les antibiotiques dans le traitement des plaies, offrant une rétention d’humidité, une libération contrôlée des médicaments et de meilleurs résultats pour les patients. Ils sont fabriqués à partir de polymères naturels ou synthétiques comme l’alginate, qui est favorisé pour sa forte biocompatibilité, son prix abordable et ses propriétés de gélification qui imitent les matrices extracellulaires des tissus naturels5. Les hydrogels à base d’alginate, en particulier, offrent un environnement humide propice à la cicatrisation des plaies, n’adhèrent pas à la plaie et permettent un retrait facile, ce qui les rend idéaux pour délivrer des substances bioactives et favoriser la régénération des tissus. Le développement d’hydrogels encapsulant des antibiotiques représente une avancée significative dans le traitement des plaies, assurant une administration ciblée de médicaments et des effets thérapeutiques durables 6,7.
L’hydrogel d’alginate et d’aloe vera chargé en acide fusidique proposé vise à surmonter les problèmes de solubilité de l’acide fusidique et à améliorer sa pénétration cutanée. L’aloe vera, connu pour ses propriétés bénéfiques pour la peau, hydratantes et antibactériennes, sert également d’amplificateur de pénétration chimique, améliorant potentiellement l’efficacité de l’acide fusidique dans le traitement des infections cutanées 8,9. Cette formulation innovante exploite les effets synergiques de l’aloe vera et de l’hydrogel d’alginate pour créer un environnement propice à la guérison, optimiser l’administration des médicaments et offrir une solution prometteuse pour un traitement amélioré des infections cutanées, en tirant le meilleur parti de la puissante activité antimicrobienne de l’acide fusidique avec une administration améliorée et des résultats de guérison10.
Protocole
Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation des films d’hydrogel d’acide fusidique
- Préparez des solutions d’alginate de sodium (2,0 % p/v) et d’Aloe vera (1,0 % p/v) en les dissolvant dans de l’eau distillée.
- Ajouter 200 mg d’acide fusidique à la solution d’alginate de sodium et remuer pendant 1 h.
- Ajouter du glycérol à la solution d’alginate à des concentrations de 10 %, 12 % et 14 % (p/p, en fonction de la masse d’alginate).
- Combinez les solutions d’alginate et d’aloe vera pour obtenir des rapports finaux alginate/aloe vera (v/v) de 100:0, 90:10, 80:20 et 75:25.
- Verser 25 ml de chaque mélange dans des boîtes de Pétri en verre (100 mm x 20 mm) et laisser sécher à température ambiante (25 °C) et à humidité contrôlée (50 %) pendant 2 jours.
- Immerger les films séchés dans une solution aqueuse de chlorure de calcium (CaCl2) (5,0 % p/v) pendant 5 min pour obtenir les films d’hydrogel.
- Lavez les films obtenus avec de l’eau distillée et séchez-les à température ambiante avant utilisation.
2. Détermination de l’épaisseur du film
- Utilisez un micromètre numérique pour mesurer l’épaisseur du film11.
- Prenez des mesures à cinq points distincts du film.
- Enregistrez les mesures obtenues à partir de chaque point.
- Calculez l’épaisseur moyenne du film sur la base des mesures prises.
3. Détermination de l’indice de gonflement
- Coupez les échantillons de film en carrés de 2 cm x 2 cm à l’aide d’un couteau de laboratoire.
- Pesez chaque échantillon avec précision.
- Faire tremper les échantillons dans un tampon PBS (pH 6,8) à température ambiante pendant 24 h.
- Absorbez tout excès d’eau sur la surface du film à l’aide de papier filtre.
- Pesez à nouveau les échantillons.
- Pesez les films à différents intervalles de temps. Calculez la capacité de gonflement à l’aide de l’équation suivante :
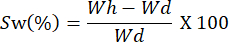
REMARQUE : Wh représente le poids hydraté de l’échantillon, et Wd correspond au poids sec de l’échantillon.
4. Test de perméabilité ou d’occlusion à la vapeur d’eau
- Couvrir l’ouverture d’un bécher en verre contenant 50 mL d’eau avec du papier filtre11.
- Appliquez une solution filmogèner sur l’un des papiers et laissez-le développer un film.
- Conservez le bécher à température et humidité ambiantes.
- Évaluez la perméabilité du film à l’eau en fonction de la diminution du poids de l’eau dans le bécher.
- Pour déterminer l’évaluation de la perméabilité à la vapeur d’eau du film d’hydrogel préparé, utilisez la formule suivante :
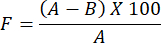
REMARQUE : Le facteur d’occlusivité, F, mesure la perméabilité d’un film. Il est déterminé en calculant la différence de poids de l’eau entre un bécher en verre recouvert de papier filtre sans film et un bécher en verre recouvert de papier filtre recouvert de film. Une valeur de facteur d’occlusivité plus faible indique une plus grande perméabilité du film.
5. Spectroscopie infrarouge à transformée de Fourier (FTIR)
- Placez l’échantillon d’hydrogel sur le cristal ATR de la machine de spectroscopie FTIR.
- Réglez la plage de numéros d’onde sur 4000-400 cm−1.
- Réglez la fréquence de balayage sur 60 balayages par échantillon.
- Réglez la résolution sur 4 cm−1.
- Enregistrez un bruit de fond avant chaque échantillon.
- Exécutez l’analyse de chaque échantillon d’hydrogel individuellement.
- Analyser les spectres FTIR de chaque échantillon d’hydrogel pour confirmer les groupes fonctionnels et examiner les interactions entre tous les composants12.
- Répétez l’analyse pour l’aloe vera brut, l’alginate de sodium, la glycérine et l’acide fusidique séparément.
6. Calorimétrie différentielle à balayage (DSC)
- Utiliser un instrument d’analyse thermique disponible dans le commerce pour acquérir des profils thermiques.
- Fabriquez les échantillons de mesure à partir de plusieurs pièces circulaires découpées dans le film polymère.
- Examinez la plage de température de 25 à 230 °C.
- Réglez la vitesse de chauffage/refroidissement à 20 °C/min.
- Effectuez l’étalonnage de la température et de l’enthalpie à l’aide d’indium standard avec un logiciel compatible.
7. Test de libération de drogue
- Préparez une solution de 50 mL de PBS (pH = 7,4) comme milieu de dissolution.
- Immerger les films d’hydrogel dans du PBS à 37 °C pendant 24 h en agitant à 50 tr/min.
- À des intervalles prédéterminés, prélever 2 mL des échantillons.
- Diluez et filtrez les échantillons collectés à l’aide d’un filtre à seringue.
- Réapprovisionnez rapidement un volume équivalent de PBS.
- Évaluer les concentrations d’acide fusidique libérées à l’aide d’un spectrophotomètre UV, en mesurant l’absorption à 285 nm.
- Évaluer la cinétique de libération de l’acide fusidique à l’aide des modèles d’ordre zéro, de premier ordre, de Higuchi et de Korsmeyer-Peppas4.
Résultats
Préparation du film hydrogel d’alginate/Aloe vera
Différents ratios d’alginate de sodium, d’aloe vera et de glycérine ont été utilisés pour préparer la formulation du film d’hydrogel. La préparation finale et l’évaluation des formulations ont été effectuées uniquement avec 10 % de glycérine (p/p d’alginate). La figure 1 montre le film d’hydrogel avec différents ratios d’Aloe vera . ...
Discussion
L’acide fusidique a été incorporé dans des films d’hydrogel d’alginate avec divers ratios d’aloe vera et de glycérine. La présence d’Aloe vera n’a pas affecté l’apparence, mais une diminution de la viscosité a été observée dans les solutions contenant de l’Aloe vera pendant la préparation. Les résultats des tests d’épaisseur suggèrent que l’inclusion d’Aloe vera peut avoir un certain impact sur l’épaisseur du film...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par le numéro de projet de soutien aux chercheurs de l’Université Princess Nourah bint Abdulrahman (PNURSP2024R30), Université Princess Nourah bint Abdulrahman, Riyad, Arabie saoudite. Cette recherche a été financée par le numéro de projet de soutien aux chercheurs (RSPD2024R811), Université du roi Saoud, Riyad, Arabie saoudite.
matériels
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
Références
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon