Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo y caracterización de una película de hidrogel a base de alginato-aloe vera cargada de ácido fusídico
En este artículo
Resumen
En este estudio se desarrolló una formulación de película de hidrogel cargada de ácido fusídico con diferentes proporciones de Aloe vera y se caracterizó en este estudio.
Resumen
Se preparó una nueva película de hidrogel cargada de ácido fusídico mediante la técnica de fundición con solvente utilizando alginato y Aloe vera. Las películas de hidrogel se optimizaron utilizando diferentes proporciones de alginato de sodio, aloe vera y glicerina. Las películas que contenían un 10% de glicerina (p/p de alginato) exhibieron la mejor apariencia. La incorporación de aloe vera influyó en el grosor, el comportamiento de hinchamiento, la permeabilidad al vapor de agua y el perfil de liberación de fármacos de las películas de hidrogel. Un mayor contenido de Aloe vera dio lugar a películas más gruesas (hasta una cierta proporción), un aumento de la hinchazón, una menor permeabilidad al vapor de agua y una liberación prolongada del fármaco de hasta el 93% durante 12 horas. El análisis de espectroscopia infrarroja por transformada de Fourier (FTIR) confirmó la presencia de grupos funcionales clave y la interacción entre los componentes del hidrogel. El estudio sugiere que la combinación de alginato de sodio, aloe vera y glicerina puede mejorar las propiedades mecánicas y los perfiles de liberación de fármacos de las películas de hidrogel, lo que las convierte en una opción prometedora para mejorar la administración tópica de fármacos y las aplicaciones de cicatrización de heridas.
Introducción
El ácido fusídico es un potente antibiótico esteroideo derivado del Fusidium coccineum. Es ampliamente utilizado para tratar infecciones cutáneas estafilocócicas e impétigo. Este fármaco tiene una alta eficacia, incluso contra cepas resistentes a los antibióticos, y una baja toxicidad, lo que lo convierte en una opción adecuada para el tratamiento de las infeccionescutáneas 1. A diferencia de otros antibióticos tópicos, el ácido fusídico penetra profundamente en la piel, mejorando sus efectos antimicrobianos, especialmente en áreas donde la barrera protectora de la piel está dañada. Su estructura permite características de solubilidad versátiles, lo que permite una amplia distribución en todos los tejidos corporales, que se mejora aún más en su forma de fusidato de sodio para una mejor solubilidad en agua y tasas de penetración 2,3. El ácido fusídico puede administrarse de varias maneras, incluyendo por vía oral, intravenosa y tópica, adaptándose a las diferentes necesidades de tratamiento y convirtiéndolo en una opción flexible para diversas infecciones4.
Los hidrogeles, con su alto contenido de agua y biocompatibilidad, se han convertido en portadores innovadores de antibióticos en el tratamiento de heridas, proporcionando retención de humedad, liberación controlada de fármacos y mejores resultados para los pacientes. Están hechos de polímeros naturales o sintéticos como el alginato, que se ve favorecido por su fuerte biocompatibilidad, asequibilidad y propiedades de gelificación que imitan las matrices extracelulares de los tejidos naturales5. Los hidrogeles a base de alginato, en particular, ofrecen un ambiente húmedo propicio para la cicatrización de heridas, no se adhieren a la herida y permiten una fácil eliminación, lo que los hace ideales para administrar sustancias bioactivas y apoyar la regeneración de tejidos. El desarrollo de hidrogeles que encapsulan antibióticos representa un avance significativo en el cuidado de heridas, asegurando la administración de fármacos dirigidos y efectos terapéuticos sostenidos 6,7.
El hidrogel de alginato / aloe vera cargado de ácido fusídico propuesto tiene como objetivo superar los desafíos de solubilidad del ácido fusídico y mejorar su penetración dérmica. El aloe vera, conocido por sus propiedades beneficiosas para la piel, hidratantes y antibacterianas, también sirve como potenciador de la penetración química, lo que podría mejorar la eficacia del ácido fusídico en el tratamiento de las infecciones de la piel 8,9. Esta innovadora formulación aprovecha los efectos sinérgicos del aloe vera y el hidrogel de alginato para crear un entorno de curación propicio, optimizar la administración de fármacos y ofrecer una solución prometedora para mejorar el tratamiento de las infecciones de la piel, aprovechando al máximo la potente actividad antimicrobiana del ácido fusídico con una mejor entrega y resultados de curación10.
Protocolo
Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Preparación de películas de hidrogel de ácido fusídico
- Prepare soluciones de alginato de sodio (2.0% p/v) y aloe vera (1.0% p/v) disolviéndolos en agua destilada.
- Añadir 200 mg de ácido fusídico a la solución de alginato sódico y agitar durante 1 h.
- Agregue glicerol a la solución de alginato a concentraciones de 10%, 12% y 14% (p/p, según la masa de alginato).
- Combine las soluciones de alginato y aloe vera para lograr proporciones finales de alginato/aloe vera (v/v) de 100:0, 90:10, 80:20 y 75:25.
- Eche 25 mL de cada mezcla en placas de Petri de vidrio (100 mm x 20 mm) y deje secar a temperatura ambiente (25 °C) y humedad controlada (50%) durante 2 días.
- Sumerja las películas secas en una solución acuosa de cloruro de calcio (CaCl2) (5,0% p/v) durante 5 min para obtener las películas de hidrogel.
- Lave las películas resultantes con agua destilada y séquelas a temperatura ambiente antes de usarlas.
2. Determinación del espesor de la película
- Utilice un micrómetro digital para medir el espesor de la película11.
- Tome medidas en cinco puntos distintos a lo largo de la película.
- Registre las mediciones obtenidas de cada punto.
- Calcule el espesor medio de la película en función de las medidas tomadas.
3. Determinación del índice de hinchazón
- Corte las muestras de película en cuadrados de 2 cm x 2 cm con un cuchillo de laboratorio.
- Pese cada muestra con precisión.
- Remojar las muestras en tampón PBS (pH 6,8) a temperatura ambiente durante 24 h.
- Absorjee el exceso de agua en la superficie de la película con papel de filtro.
- Vuelva a pesar las muestras.
- Pesa las películas en diferentes intervalos de tiempo. Calcule la capacidad de hinchamiento utilizando la siguiente ecuación:
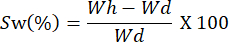
NOTA: Wh representa el peso hidratado de la muestra, y Wd corresponde al peso seco de la muestra.
4. Prueba de permeabilidad u oclusión al vapor de agua
- Cubra la abertura de un vaso de precipitados de vidrio que contenga 50 ml de agua con papel de filtro11.
- Aplique una solución formadora de película a uno de los papeles y permita que revele una película.
- Guarde el vaso de precipitados a temperatura ambiente y humedad.
- Evalúe la permeabilidad de la película al agua en función de la disminución del peso del agua dentro del vaso de precipitados.
- Para determinar la evaluación de la permeabilidad al vapor de agua para la película de hidrogel preparada, utilice la siguiente fórmula:
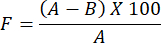
NOTA: El factor de oclusividad, F, mide la permeabilidad de una película. Se determina calculando la diferencia de peso del agua entre un vaso de vidrio cubierto con papel de filtro sin película y un vaso de vidrio cubierto con papel de filtro recubierto con la película. Un valor de factor de oclusividad más pequeño indica una mayor permeabilidad de la película.
5. Espectroscopia infrarroja por transformada de Fourier (FTIR)
- Coloque la muestra de hidrogel en el cristal ATR de la máquina de espectroscopia FTIR.
- Establezca el rango de número de onda en 4000-400 cm−1.
- Establezca la velocidad de escaneo en 60 escaneos por muestra.
- Establezca la resolución en 4 cm−1.
- Registre un fondo de aire antes de cada ejecución de muestra.
- Realice el análisis para cada muestra de hidrogel individualmente.
- Analice los espectros FTIR de cada muestra de hidrogel para confirmar los grupos funcionales y examinar las interacciones entre todos los componentes12.
- Repita el análisis para el aloe vera crudo, el alginato de sodio, la glicerina y el ácido fusídico por separado.
6. Calorimetría diferencial de barrido (DSC)
- Utilice un instrumento de análisis térmico disponible en el mercado para adquirir perfiles térmicos.
- Elabore las muestras de medición a partir de múltiples piezas circulares cortadas de la película de polímero.
- Investigue el rango de temperatura de 25 a 230 °C.
- Ajuste la velocidad de calentamiento/enfriamiento a 20 °C/min.
- Realice la calibración de la temperatura y la entalpía utilizando indio estándar con software compatible.
7. Prueba de liberación de drogas
- Prepare una solución de 50 mL de PBS (pH = 7,4) como medio de disolución.
- Sumerja las películas de hidrogel en PBS a 37 °C durante 24 h mientras agita a una velocidad de 50 rpm.
- A intervalos predeterminados, recoja 2 ml de las muestras.
- Diluir y filtrar las muestras recogidas a través de un filtro de jeringa.
- Reponga rápidamente un volumen equivalente de PBS.
- Evalúe las concentraciones de ácido fusídico liberadas utilizando un espectrofotómetro UV, midiendo la absorción a 285 nm.
- Evaluar la cinética de liberación de ácido fusídico utilizando modelos de orden cero, primer orden, Higuchi y Korsmeyer-Peppas4.
Resultados
Preparación de película de hidrogel de alginato/aloe vera
Se utilizaron diferentes proporciones de alginato de sodio, aloe vera y glicerina para preparar la formulación de la película de hidrogel. La preparación final y la evaluación de las formulaciones se llevaron a cabo únicamente con glicerina al 10% (p/p de alginato). En la figura 1 se muestra la película de hidrogel con diferentes proporciones de Aloe v...
Discusión
El ácido fusídico se incorporó en películas de hidrogel de alginato con varias proporciones de Aloe vera y glicerina. La presencia de Aloe vera no afectó la apariencia, pero se observó una disminución de la viscosidad en las soluciones que contenían Aloe vera durante la preparación. Los hallazgos de las pruebas de espesor sugieren que la inclusión de Aloe vera puede tener algún impacto en el espesor de la película hasta cierto punto, pero n...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por el Proyecto de Apoyo a los Investigadores de la Universidad Princesa Nourah bint Abdulrahman (PNURSP2024R30), Universidad Princesa Nourah bint Abdulrahman, Riad, Arabia Saudita. Esta investigación fue financiada por el Proyecto de Apoyo a Investigadores número (RSPD2024R811) de la Universidad Rey Saud, Riad, Arabia Saudita.
Materiales
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
Referencias
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados