È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sviluppo e caratterizzazione di film di idrogel a base di alginato-aloe vera caricato con acido fusidico
In questo articolo
Riepilogo
In questo studio è stata sviluppata una formulazione di film di idrogel caricato con acido fusidico con diversi rapporti di Aloe vera .
Abstract
Un nuovo film di idrogel caricato con acido fusidico è stato preparato mediante la tecnica di colata a solvente utilizzando alginato e aloe vera. I film di idrogel sono stati ottimizzati utilizzando diversi rapporti di alginato di sodio, aloe vera e glicerina. Le pellicole contenenti il 10% di glicerina (p/p di alginato) hanno mostrato l'aspetto migliore. L'incorporazione dell'Aloe vera ha influenzato lo spessore, il comportamento di gonfiore, la permeabilità al vapore acqueo e il profilo di rilascio del farmaco dei film di idrogel. Un contenuto più elevato di Aloe vera ha comportato film più spessi (fino a un certo rapporto), aumento del gonfiore, riduzione della permeabilità al vapore acqueo e un rilascio prolungato del farmaco fino al 93% nell'arco di 12 ore. L'analisi della spettroscopia infrarossa in trasformata di Fourier (FTIR) ha confermato la presenza di gruppi funzionali chiave e l'interazione tra i componenti dell'idrogel. Lo studio suggerisce che la combinazione di alginato di sodio, aloe vera e glicerina può migliorare le proprietà meccaniche e i profili di rilascio dei farmaci dei film di idrogel, rendendoli un'opzione promettente per una migliore somministrazione topica di farmaci e applicazioni di guarigione delle ferite.
Introduzione
L'acido fusidico è un potente antibiotico steroideo derivato dal Fusidium coccineum. È ampiamente usato per trattare le infezioni cutanee da stafilococco e l'impetigine. Questo farmaco ha un'elevata efficacia, anche contro ceppi resistenti agli antibiotici, e una bassa tossicità, il che lo rende un'opzione adatta per la gestione delle infezioni cutanee1. A differenza di altri antibiotici topici, l'acido fusidico penetra in profondità nella pelle, potenziando i suoi effetti antimicrobici, soprattutto nelle aree in cui la barriera protettiva della pelle è danneggiata. La sua struttura consente caratteristiche di solubilità versatili, consentendo un'ampia distribuzione in tutti i tessuti corporei, che è ulteriormente migliorata nella sua forma fusidato di sodio per una migliore solubilità in acqua e velocità di penetrazione 2,3. L'acido fusidico può essere somministrato in vari modi, tra cui per via orale, endovenosa e topica, adattandosi alle diverse esigenze di trattamento e rendendolo una scelta flessibile per varie infezioni4.
Gli idrogel, con il loro alto contenuto di acqua e biocompatibilità, sono emersi come vettori innovativi per gli antibiotici nel trattamento delle ferite, fornendo ritenzione di umidità, rilascio controllato di farmaci e migliori risultati per i pazienti. Sono realizzati con polimeri naturali o sintetici come l'alginato, che è favorito per la sua forte biocompatibilità, convenienza e proprietà di gelificazione che imitano le matrici extracellulari dei tessuti naturali5. Gli idrogel a base di alginato, in particolare, offrono un ambiente umido favorevole alla guarigione delle ferite, non aderiscono alla ferita e ne consentono una facile rimozione, rendendoli ideali per fornire sostanze bioattive e supportare la rigenerazione dei tessuti. Lo sviluppo di idrogel che incapsulano antibiotici rappresenta un progresso significativo nella cura delle ferite, garantendo una somministrazione mirata di farmaci ed effetti terapeutici sostenuti 6,7.
L'alginato/idrogel di aloe vera caricato con acido fusidico proposto mira a superare le sfide di solubilità dell'acido fusidico e a migliorarne la penetrazione dermica. L'aloe vera, nota per le sue proprietà dermocompatibili, idratanti e antibatteriche, funge anche da potenziatore della penetrazione chimica, migliorando potenzialmente l'efficacia dell'acido fusidico nel trattamento delle infezioni della pelle 8,9. Questa formulazione innovativa sfrutta gli effetti sinergici dell'aloe vera e dell'alginato idrogel per creare un ambiente di guarigione favorevole, ottimizzare la somministrazione dei farmaci e offrire una soluzione promettente per un trattamento avanzato delle infezioni della pelle, sfruttando al massimo la potente attività antimicrobica dell'acido fusidico con migliori risultati di somministrazione e guarigione10.
Protocollo
I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Preparazione di film di idrogel di acido fusidico
- Preparare soluzioni di alginato di sodio (2,0% p/v) e Aloe vera (1,0% p/v) sciogliendole in acqua distillata.
- Aggiungere 200 mg di acido fusidico alla soluzione di alginato di sodio e mescolare per 1 ora.
- Aggiungere glicerolo alla soluzione di alginato a concentrazioni del 10%, 12% e 14% (p/p, in base alla massa dell'alginato).
- Combina le soluzioni di alginato e aloe vera per ottenere rapporti finali alginato/aloe vera (v/v) di 100:0, 90:10, 80:20 e 75:25.
- Versare 25 mL di ogni miscela in piastre di Petri di vetro (100 mm x 20 mm) e lasciare asciugare a temperatura ambiente (25 °C) e umidità controllata (50%) per 2 giorni.
- Immergere i film essiccati in una soluzione acquosa di cloruro di calcio (CaCl2) (5,0% p/v) per 5 minuti per ottenere i film di idrogel.
- Lavare le pellicole risultanti con acqua distillata e asciugarle a temperatura ambiente prima dell'uso.
2. Determinazione dello spessore del film
- Utilizzare un micrometro digitale per misurare lo spessore del film11.
- Prendi le misure in cinque punti distinti del film.
- Registrare le misurazioni ottenute da ciascun punto.
- Calcola lo spessore medio del film in base alle misure effettuate.
3. Determinazione dell'indice di rigonfiamento
- Tagliare i campioni di pellicola in quadrati di 2 cm x 2 cm utilizzando un coltello da laboratorio.
- Pesa accuratamente ogni campione.
- Immergere i campioni in tampone PBS (pH 6,8) a temperatura ambiente per 24 ore.
- Assorbire l'acqua in eccesso sulla superficie del film utilizzando carta da filtro.
- Pesare nuovamente i campioni.
- Pesare le pellicole a intervalli di tempo diversi. Calcola la capacità di rigonfiamento utilizzando la seguente equazione:
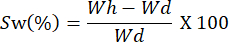
NOTA: Wh rappresenta il peso idrato del campione e Wd corrisponde al peso secco del campione.
4. Test di permeabilità al vapore acqueo o di occlusione
- Coprire l'apertura di un becher di vetro contenente 50 ml di acqua con carta da filtro11.
- Applicare una soluzione filmogena su una delle carte e lasciarla sviluppare una pellicola.
- Conservare il becher a temperatura e umidità ambiente.
- Valutare la permeabilità del film all'acqua in base alla diminuzione del peso dell'acqua all'interno del becher.
- Per determinare la valutazione della permeabilità al vapore acqueo per il film di idrogel preparato, utilizzare la seguente formula:
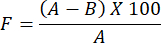
NOTA: Il fattore di occlusività, F, misura la permeabilità di un film. Viene determinato calcolando la differenza di peso dell'acqua tra un bicchiere di vetro ricoperto di carta da filtro senza pellicola e un bicchiere di vetro ricoperto di carta da filtro rivestita con la pellicola. Un valore del fattore di occlusività più piccolo indica una maggiore permeabilità del film.
5. Spettroscopia infrarossa a trasformata di Fourier (FTIR)
- Posizionare il campione di idrogel sul cristallo ATR della macchina per spettroscopia FTIR.
- Impostare l'intervallo del numero d'onda su 4000-400 cm−1.
- Impostare la velocità di scansione su 60 scansioni per campione.
- Impostare la risoluzione su 4 cm−1.
- Registra uno sfondo aereo prima di ogni campionamento.
- Eseguire l'analisi per ogni campione di idrogel individualmente.
- Analizzare gli spettri FTIR per ciascun campione di idrogel per confermare i gruppi funzionali ed esaminare le interazioni tra tutti i componenti12.
- Ripetere l'analisi separatamente per l'aloe vera grezza, l'alginato di sodio, la glicerina e l'acido fusidico.
6. Calorimetria differenziale a scansione (DSC)
- Utilizzare uno strumento di analisi termica disponibile in commercio per acquisire profili termici.
- Crea i campioni di misurazione da più pezzi circolari tagliati dal film polimerico.
- Esaminare l'intervallo di temperatura da 25 a 230 °C.
- Impostare la velocità di riscaldamento/raffreddamento a 20 °C/min.
- Eseguire la calibrazione della temperatura e dell'entalpia utilizzando indio standard con software compatibile.
7. Test di rilascio del farmaco
- Preparare una soluzione di 50 mL di PBS (pH = 7,4) come mezzo di dissoluzione.
- Immergere i film di idrogel in PBS a 37 °C per 24 ore mescolando a una velocità di 50 giri/min.
- A intervalli predeterminati, raccogliere 2 mL di campioni.
- Diluire e filtrare i campioni raccolti attraverso un filtro a siringa.
- Rifornire prontamente un volume equivalente di PBS.
- Valutare le concentrazioni di acido fusidico rilasciato utilizzando uno spettrofotometro UV, misurando l'assorbimento a 285 nm.
- Valutare la cinetica di rilascio dell'acido fusidico utilizzando i modelli di ordine zero, di primo ordine, di Higuchi e Korsmeyer-Peppas4.
Risultati
Preparazione del film di idrogel di alginato/aloe vera
Diversi rapporti di alginato di sodio, aloe vera e glicerina sono stati utilizzati per preparare la formulazione del film di idrogel. La preparazione finale e la valutazione delle formulazioni sono state effettuate solo con il 10% di glicerina (p/p di alginato). La Figura 1 mostra il film di idrogel con diversi rapporti di Aloe vera . Questa selezione è sta...
Discussione
L'acido fusidico è stato incorporato in film di alginato idrogel con vari rapporti di aloe vera e glicerina. La presenza di Aloe vera non ha influito sull'aspetto, ma durante la preparazione è stata osservata una diminuzione della viscosità nelle soluzioni contenenti Aloe vera . I risultati dei test di spessore suggeriscono che l'inclusione di Aloe vera può avere un certo impatto sullo spessore del film in una certa misura, ma non è considerata si...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato dai ricercatori dell'Università Princess Nourah bint Abdulrahman che sostengono il progetto numero (PNURSP2024R30), Princess Nourah bint Abdulrahman University, Riyadh, Arabia Saudita. Questa ricerca è stata finanziata dal Researchers Supporting Project number (RSPD2024R811), King Saud University, Riyadh, Arabia Saudita.
Materiali
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
Riferimenti
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon