Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разработка и определение характеристик гидрогелевой пленки на основе альгината и алоэ вера , обогащенной фузидиевой кислотой
В этой статье
Резюме
В данном исследовании была разработана формула гидрогелевой пленки, обогащенной фузидиевой кислотой, с различными соотношениями алоэ вера .
Аннотация
Новая гидрогелевая пленка с фузидиевой кислотой была получена методом литья растворителем с использованием альгината и алоэ вера. Гидрогелевые пленки были оптимизированы с использованием различных соотношений альгината натрия, алоэ вера и глицерина. Пленки, содержащие 10% глицерина (по мас.% альгината), показали наилучший внешний вид. Включение алоэ вера влияло на толщину, набухание, проницаемость водяного пара и профиль высвобождения лекарств из гидрогелевых пленок. Более высокое содержание алоэ вера приводило к более толстым пленкам (до определенного соотношения), увеличению набухания, снижению проницаемости водяного пара и более длительному высвобождению препарата до 93% в течение 12 часов. Анализ инфракрасной спектроскопии с преобразованием Фурье (ИК-Фурье) подтвердил наличие ключевых функциональных групп и взаимодействие между компонентами гидрогеля. Исследование предполагает, что комбинация альгината натрия, алоэ вера и глицерина может улучшить механические свойства и профили высвобождения лекарств гидрогелевых пленок, что делает их многообещающим вариантом для улучшенной местной доставки лекарств и заживления ран.
Введение
Фузидиевая кислота является мощным стероидным антибиотиком, полученным из Fusidium coccineum. Он широко используется для лечения стафилококковых инфекций кожи и импетиго. Этот препарат обладает высокой эффективностью, даже против устойчивых к антибиотикам штаммов, и низкой токсичностью, что делает его подходящим вариантом для лечения кожных инфекций1. В отличие от других антибиотиков местного применения, фузидиевая кислота глубоко проникает в кожу, усиливая ее антимикробное действие, особенно в зонах, где поврежден защитный барьер кожи. Его структура обеспечивает универсальные характеристики растворимости, что позволяет широко распространяться по тканям организма, что еще больше усиливается в форме фузидата натрия для лучшей растворимости в воде и скорости проникновения 2,3. Фузидиевая кислота может вводиться различными способами, в том числе перорально, внутривенно и местно, адаптируясь к различным потребностям лечения и делая ее гибким выбором для различных инфекций4.
Гидрогели, благодаря высокому содержанию воды и биосовместимости, стали инновационными носителями антибиотиков при лечении ран, обеспечивая удержание влаги, контролируемое высвобождение лекарств и улучшая результаты лечения пациентов. Они изготавливаются из натуральных или синтетических полимеров, таких как альгинат, который пользуется популярностью благодаря своей сильной биосовместимости, доступности и гелеобразующим свойствам, имитирующим естественные тканевые внеклеточные матрицы5. Гидрогели на основе альгината, в частности, обеспечивают влажную среду, способствующую заживлению раны, не прилипают к ране и легко удаляются, что делает их идеальными для доставки биологически активных веществ и поддержки регенерации тканей. Разработка гидрогелей, инкапсулирующих антибиотики, представляет собой значительный шаг вперед в лечении ран, обеспечивая адресную доставку лекарств и устойчивые терапевтические эффекты 6,7.
Предлагаемый гидрогель альгината / алоэ вера, обогащенный фузидиевой кислотой, направлен на преодоление проблем растворимости фузидиевой кислоты и улучшение ее проникновения в кожу. Алоэ вера, известное своими благоприятными для кожи, увлажняющими и антибактериальными свойствами, также служит усилителем проникновения химических веществ, потенциально повышая эффективность фузидиевой кислоты при лечении кожных инфекций 8,9. Эта инновационная формула использует синергетические эффекты алоэ вера и альгинатного гидрогеля для создания благоприятной лечебной среды, оптимизации доставки лекарств и предлагает многообещающее решение для расширенного лечения кожных инфекций, максимально используя мощную антимикробную активность фузидиевой кислоты с улучшенной доставкой и результатами заживления10.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Приготовление гидрогелевых пленок фузидиевой кислоты
- Приготовьте растворы альгината натрия (2,0% мас./об.) и алоэ вера (1,0% мас./об.), растворив их в дистиллированной воде.
- Добавьте 200 мг фузидиевой кислоты в раствор альгината натрия и перемешивайте в течение 1 ч.
- Добавьте глицерин в раствор альгината в концентрациях 10%, 12% и 14% (масса, в пересчете на массу альгината).
- Объедините растворы альгината и алоэ вера , чтобы получить итоговое соотношение альгината/алоэ вера (v/v) 100:0, 90:10, 80:20 и 75:25.
- Вылейте по 25 мл каждой смеси в стеклянные чашки Петри (100 мм x 20 мм) и оставьте сохнуть при комнатной температуре (25 °C) и контролируемой влажности (50%) на 2 дня.
- Погрузите высушенные пленки в водный раствор хлорида кальция (CaCl2) (5,0% по массе) на 5 минут для получения гидрогелевых пленок.
- Получившиеся пленки промойте дистиллированной водой и высушите при комнатной температуре перед использованием.
2. Определение толщины пленки
- С помощью цифрового микрометра измерьте толщину пленки11.
- Проведите измерения в пяти различных точках на пленке.
- Запишите измерения, полученные из каждой точки.
- Рассчитайте среднюю толщину пленки на основе проведенных измерений.
3. Определение индекса отечности
- Разрежьте образцы пленки на квадраты размером 2 см х 2 см с помощью лабораторного ножа.
- Тщательно взвесьте каждый образец.
- Замочите образцы в буфере PBS (pH 6,8) при комнатной температуре на 24 часа.
- Впитайте лишнюю воду с поверхности пленки с помощью фильтровальной бумаги.
- Еще раз взвесьте образцы.
- Взвешивайте пленки через разные временные интервалы. Рассчитайте способность к набуханию с помощью следующего уравнения:
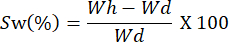
ПРИМЕЧАНИЕ: Wh представляет гидратированный вес образца, а Wd соответствует сухому весу образца.
4. Испытание на паропроницаемость или окклюзию
- Закройте отверстие стеклянного стакана, содержащего 50 мл воды, фильтровальной бумагой11.
- Нанесите пленкообразующий раствор на одну из бумаг и дайте ей проявить пленку.
- Храните стакан при комнатной температуре и влажности.
- Оцените проницаемость пленки для воды на основе уменьшения веса воды внутри стакана.
- Для определения оценки паропроницаемости водяного пара для приготовленной гидрогелевой пленки используют следующую формулу:
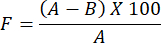
ПРИМЕЧАНИЕ: Коэффициент окклюзии, F, измеряет проницаемость пленки. Она определяется путем вычисления разницы в весе воды между стеклянным стаканом, покрытым фильтровальной бумагой без пленки, и стеклянным стаканом, покрытым фильтровальной бумагой, покрытым пленкой. Меньшее значение коэффициента окклюзионности указывает на большую проницаемость пленки.
5. Инфракрасная спектроскопия с преобразованием Фурье (FTIR)
- Поместите образец гидрогеля на кристалл НПВО аппарата ИК-Фурье-спектроскопии.
- Установите диапазон волновых чисел равным 4000-400 см−1.
- Установите частоту сканирования равной 60 сканированиям на образец.
- Установите разрешение на 4 см−1.
- Записывайте воздушный фон перед каждым прогоном образца.
- Проводите анализ для каждого образца гидрогеля по отдельности.
- Анализ ИК-Фурье спектров для каждого образца гидрогеля для подтверждения функциональных групп и изучения взаимодействий между всеми компонентами12.
- Повторите анализ на сырое алоэ вера, альгинат натрия, глицерин и фузидиевую кислоту отдельно.
6. Дифференциальная сканирующая калориметрия (ДСК)
- Используйте коммерчески доступный прибор для термического анализа для получения тепловых профилей.
- Изготовьте измерительные образцы из нескольких круглых частей, вырезанных из полимерной пленки.
- Исследуйте диапазон температур от 25 до 230 °C.
- Установите скорость нагрева/охлаждения на уровне 20 °C/мин.
- Выполните калибровку температуры и энтальпии с использованием стандартного индия с совместимым программным обеспечением.
7. Тест на высвобождение наркотика
- В качестве среды растворения приготовьте раствор 50 мл PBS (pH = 7,4).
- Погрузите гидрогелевые пленки в PBS при температуре 37 °C на 24 часа, помешивая со скоростью 50 об/мин.
- Через заданные промежутки времени соберите 2 мл образцов.
- Разведите и отфильтруйте собранные образцы через шприцевой фильтр.
- Оперативно пополняйте эквивалентный объем PBS.
- Оцените концентрации выделяемой фузидиевой кислоты с помощью УФ-спектрофотометра, измеряя поглощение при длине волны 285 нм.
- Оцените кинетику высвобождения фузидиевой кислоты с использованием моделей нулевого порядка, первого порядка, Хигучи и модели Корсмейера-Пеппаса4.
Результаты
Приготовление гидрогелевой пленки альгинат/Алоэ вера
Для приготовления рецептуры гидрогелевой пленки использовались различные соотношения альгината натрия, алоэ вера и глицерина. Окончательное приготовление и оценка составов проводились толь...
Обсуждение
Фузидиевая кислота была включена в альгинатные гидрогелевые пленки с различными соотношениями алоэ вера и глицерина. Присутствие Алоэ вера не влияло на внешний вид, но в растворах, содержащих Алоэ вера , во время приготовления наблюдалось снижение вязк...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Университетом принцессы Нуры бинт Абдулрахман Исследователи Проект поддержки проекта (PNURSP2024R30), Университет принцессы Нуры бинт Абдулрахман, Эр-Рияд, Саудовская Аравия. Это исследование было профинансировано Проектом поддержки исследователей No (RSPD2024R811), Университет короля Сауда, Эр-Рияд, Саудовская Аравия.
Материалы
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
Ссылки
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены