Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung und Charakterisierung von Fusidinsäure-beladenen Alginat-Aloe Vera-basierten Hydrogelfilmen
In diesem Artikel
Zusammenfassung
In dieser Studie wurde eine Formulierung aus Fusidinsäure-beladenem Hydrogelfilm mit unterschiedlichen Aloe Vera Verhältnissen entwickelt und charakterisiert.
Zusammenfassung
Ein neuer mit Fusidinsäure beladener Hydrogelfilm wurde im Lösemittelgießverfahren unter Verwendung von Alginat und Aloe Vera hergestellt. Die Hydrogelfilme wurden mit unterschiedlichen Verhältnissen von Natriumalginat, Aloe Vera und Glycerin optimiert. Die Folien mit 10 % Glycerin (w/w Alginat) zeigten das beste Aussehen. Die Einarbeitung von Aloe Vera beeinflusste die Dicke, das Quellverhalten, die Wasserdampfdurchlässigkeit und das Wirkstofffreisetzungsprofil der Hydrogelfilme. Ein höherer Aloe-Vera-Gehalt führte zu dickeren Filmen (bis zu einem bestimmten Verhältnis), erhöhter Quellung, verringerter Wasserdampfdurchlässigkeit und einer verlängerten Wirkstofffreisetzung von bis zu 93 % über 12 Stunden. Die Analyse der Fourier-Transformations-Infrarotspektroskopie (FTIR) bestätigte das Vorhandensein wichtiger funktioneller Gruppen und die Wechselwirkung zwischen den Hydrogelkomponenten. Die Studie legt nahe, dass die Kombination von Natriumalginat, Aloe Vera und Glycerin die mechanischen Eigenschaften und Wirkstofffreisetzungsprofile von Hydrogelfilmen verbessern kann, was sie zu einer vielversprechenden Option für eine verbesserte topische Wirkstoffabgabe und Wundheilungsanwendungen macht.
Einleitung
Fusidinsäure ist ein starkes steroidales Antibiotikum, das aus Fusidium coccineum gewonnen wird. Es wird häufig zur Behandlung von Staphylokokken-Hautinfektionen und Impetigo eingesetzt. Dieses Medikament hat eine hohe Wirksamkeit, auch gegen antibiotikaresistente Stämme, und eine geringe Toxizität, was es zu einer geeigneten Option für die Behandlung von Hautinfektionen macht1. Im Gegensatz zu anderen topischen Antibiotika dringt Fusidinsäure tief in die Haut ein und verstärkt ihre antimikrobielle Wirkung, insbesondere in Bereichen, in denen die Schutzbarriere der Haut geschädigt ist. Seine Struktur ermöglicht vielseitige Löslichkeitseigenschaften und ermöglicht eine weit verbreitete Verteilung im Körpergewebe, was in seiner Natriumfusidatform für eine bessere Wasserlöslichkeit und Penetrationsraten weiter verbessert wird 2,3. Fusidinsäure kann auf verschiedene Arten verabreicht werden, einschließlich oral, intravenös und topisch, was sich an unterschiedliche Behandlungsbedürfnisse anpasst und sie zu einer flexiblen Wahl für verschiedene Infektionen macht4.
Hydrogele haben sich mit ihrem hohen Wassergehalt und ihrer Biokompatibilität als innovative Träger für Antibiotika in der Wundbehandlung erwiesen, da sie eine Feuchtigkeitsspeicherung, eine kontrollierte Wirkstofffreisetzung und verbesserte Patientenergebnisse bieten. Sie werden aus natürlichen oder synthetischen Polymeren wie Alginat hergestellt, das aufgrund seiner starken Biokompatibilität, Erschwinglichkeit und Gelierungseigenschaften, die extrazelluläre Matrizen von natürlichem Gewebe nachahmen, bevorzugtwird 5. Insbesondere Hydrogele auf Alginatbasis bieten ein feuchtes Milieu, das die Wundheilung fördert, kleben nicht an der Wunde an und lassen sich leicht entfernen, was sie ideal für die Abgabe bioaktiver Substanzen und die Unterstützung der Geweberegeneration macht. Die Entwicklung von Hydrogelen, die Antibiotika verkapseln, stellt einen bedeutenden Fortschritt in der Wundversorgung dar und gewährleistet eine gezielte Wirkstoffabgabe und nachhaltige therapeutische Effekte 6,7.
Das vorgeschlagene mit Fusidinsäure beladene Alginat/Aloe Vera-Hydrogel zielt darauf ab, die Löslichkeitsprobleme von Fusidinsäure zu überwinden und ihre dermale Penetration zu verbessern. Aloe Vera, bekannt für ihre hautfreundlichen, feuchtigkeitsspendenden und antibakteriellen Eigenschaften, dient auch als chemischer Penetrationsverstärker, der möglicherweise die Wirksamkeit von Fusidinsäure bei der Behandlung von Hautinfektionen verbessert 8,9. Diese innovative Formulierung nutzt die synergistischen Effekte von Aloe Vera und Alginat-Hydrogel, um ein förderliches Heilungsmilieu zu schaffen, die Wirkstoffabgabe zu optimieren und eine vielversprechende Lösung für eine verbesserte Behandlung von Hautinfektionen zu bieten, indem sie die starke antimikrobielle Wirkung der Fusidinsäure optimal nutzt und die Abgabe und Heilung verbessert10.
Protokoll
Die Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Herstellung von Fusidinsäure-Hydrogelfilmen
- Bereiten Sie Lösungen von Natriumalginat (2,0 % w/v) und Aloe Vera (1,0 % w/v) vor, indem Sie sie in destilliertem Wasser auflösen.
- Geben Sie 200 mg Fusidinsäure in die Natriumalginatlösung und rühren Sie 1 h lang.
- Geben Sie Glycerin in Konzentrationen von 10 %, 12 % und 14 % (w/w, bezogen auf die Alginatmasse) zur Alginatlösung.
- Kombinieren Sie die Alginat- und Aloe Vera-Lösungen, um ein endgültiges Alginat/Aloe-Vera-Verhältnis (v/v) von 100:0, 90:10, 80:20 und 75:25 zu erreichen.
- 25 ml jeder Mischung in Petrischalen aus Glas (100 mm x 20 mm) gießen und 2 Tage lang bei Raumtemperatur (25 °C) und kontrollierter Luftfeuchtigkeit (50 %) trocknen lassen.
- Tauchen Sie die getrockneten Filme 5 Minuten lang in eine wässrige Lösung aus Calciumchlorid (CaCl2) (5,0 % w/v), um die Hydrogelfilme zu erhalten.
- Waschen Sie die entstandenen Filme mit destilliertem Wasser und trocknen Sie sie vor Gebrauch bei Raumtemperatur.
2. Bestimmung der Foliendicke
- Verwenden Sie ein digitales Mikrometer, um die Dicke der Foliezu messen 11.
- Nehmen Sie Messungen an fünf verschiedenen Punkten auf der Folie vor.
- Notieren Sie die Messungen, die Sie von jedem Punkt aus erhalten haben.
- Berechnen Sie die durchschnittliche Foliendicke basierend auf den durchgeführten Messungen.
3. Bestimmung des Quellindex
- Schneiden Sie die Filmproben mit einem Labormesser in 2 cm x 2 cm große Quadrate.
- Wiegen Sie jede Probe genau.
- Die Proben werden 24 Stunden lang in PBS-Puffer (pH 6,8) bei Raumtemperatur eingeweicht.
- Nehmen Sie überschüssiges Wasser auf der Folienoberfläche mit Filterpapier auf.
- Wiegen Sie die Proben erneut.
- Wiegen Sie die Filme in unterschiedlichen Zeitabständen. Berechnen Sie die Quellkapazität mit der folgenden Gleichung:
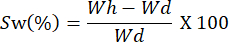
HINWEIS: Wh steht für das hydratisierte Gewicht der Probe und Wd entspricht dem Trockengewicht der Probe.
4. Prüfung der Wasserdampfdurchlässigkeit oder des Okklusionstests
- Die Öffnung eines Glasbechers mit 50 ml Wasser ist mit Filterpapierabzudecken 11.
- Tragen Sie eine Filmbildungslösung auf eines der Papiere auf und lassen Sie es einen Film bilden.
- Lagern Sie das Becherglas bei Raumtemperatur und Luftfeuchtigkeit.
- Beurteilen Sie die Wasserdurchlässigkeit der Folie anhand der Abnahme des Wassergewichts im Becherglas.
- Um die Bewertung der Wasserdampfdurchlässigkeit für den vorbereiteten Hydrogelfilm zu bestimmen, verwenden Sie die folgende Formel:
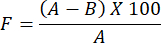
HINWEIS: Der Okklusivitätsfaktor F misst die Durchlässigkeit eines Films. Sie wird durch Berechnung der Differenz des Wassergewichts zwischen einem mit Filterpapier bedeckten Glasbecherglas ohne Folie und einem Glasbecherglas, das mit Filterpapier bedeckt ist, das mit der Folie beschichtet ist, bestimmt. Ein kleinerer Wert des Okklusivitätsfaktors weist auf eine höhere Durchlässigkeit des Films hin.
5. Fourier-Transformations-Infrarotspektroskopie (FTIR)
- Legen Sie die Hydrogelprobe auf den ATR-Kristall des FTIR-Spektroskopiegeräts.
- Stellen Sie den Wellenzahlbereich auf 4000-400 cm-1 ein.
- Stellen Sie die Scanrate auf 60 Scans pro Probe ein.
- Stellen Sie die Auflösung auf 4 cm-1 ein.
- Nehmen Sie vor jedem Probenlauf einen Lufthintergrund auf.
- Führen Sie die Analyse für jede Hydrogelprobe einzeln durch.
- Analysieren Sie die FTIR-Spektren für jede Hydrogelprobe, um funktionelle Gruppen zu bestätigen und Wechselwirkungen zwischen allen Komponentenzu untersuchen 12.
- Wiederholen Sie die Analyse für rohe Aloe Vera, Natriumalginat, Glycerin und Fusidinsäure separat.
6. Dynamische Differenzkalorimetrie (DSC)
- Verwenden Sie ein handelsübliches thermisches Analysegerät, um thermische Profile zu erfassen.
- Stellen Sie die Messproben aus mehreren kreisförmigen Stücken her, die aus der Polymerfolie geschnitten wurden.
- Untersuchen Sie den Temperaturbereich von 25-230 °C.
- Stellen Sie die Heiz-/Kühlrate auf 20 °C/min ein.
- Führen Sie die Temperatur- und Enthalpiekalibrierung mit Standard-Indium mit kompatibler Software durch.
7. Test auf Drogenfreisetzung
- Bereiten Sie eine Lösung von 50 mL PBS (pH = 7,4) als Auflösungsmedium vor.
- Tauchen Sie die Hydrogelfilme 24 Stunden lang bei 37 °C in PBS ein und rühren Sie dabei mit einer Geschwindigkeit von 50 U/min.
- Sammeln Sie in festgelegten Abständen 2 mL der Proben.
- Verdünnen und filtrieren Sie die gesammelten Proben durch einen Spritzenfilter.
- Füllen Sie umgehend ein entsprechendes Volumen an PBS auf.
- Beurteilen Sie die Konzentrationen der freigesetzten Fusidinsäure mit einem UV-Spektralphotometer und messen Sie die Absorption bei 285 nm.
- Bewerten Sie die Freisetzungskinetik von Fusidinsäure unter Verwendung von Modellen nullter Ordnung, erster Ordnung, Higuchi und Korsmeyer-Peppas4.
Ergebnisse
Herstellung eines Alginat/Aloe Vera Hydrogel-Films
Zur Herstellung der Formulierung des Hydrogelfilms wurden unterschiedliche Verhältnisse von Natriumalginat, Aloe Vera und Glycerin verwendet. Die abschließende Vorbereitung und Bewertung der Rezepturen erfolgte nur mit 10% Glycerin (w/w Alginat). Abbildung 1 zeigt den Hydrogelfilm mit unterschiedlichen Aloe Vera Anteilen. Diese Auswahl wurde getroffen, weil an...
Diskussion
Fusidinsäure wurde in Alginat-Hydrogel-Filme mit verschiedenen Verhältnissen von Aloe Vera und Glycerin eingearbeitet. Das Vorhandensein von Aloe Vera hatte keinen Einfluss auf das Aussehen, aber in den Lösungen, die Aloe Vera enthielten, wurde während der Zubereitung eine Abnahme der Viskosität beobachtet. Die Ergebnisse der Dickentests deuten darauf hin, dass die Aufnahme von Aloe Vera bis zu einem gewissen Grad einen gewissen Einfluss auf die S...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde unterstützt von der Princess Nourah bint Abdulrahman University Researchers Supporting Project Nummer (PNURSP2024R30), Princess Nourah bint Abdulrahman University, Riad, Saudi-Arabien. Diese Forschung wurde von der Researchers Supporting Project Nummer (RSPD2024R811) der King Saud University, Riad, Saudi-Arabien, finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
Referenzen
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105 (2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714 (2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620 (2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063 (2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977 (2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444 (2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187 (2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177 (2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474 (2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten