需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
夫西地酸负载海藻酸盐-芦荟 基水凝胶薄膜的开发和表征
摘要
开发了具有不同芦 荟 比例的夫西地酸负载水凝胶薄膜配方,并在本研究中进行了表征。
摘要
通过使用藻酸盐和芦荟的溶剂流延技术制备了一种新的载有夫西二酸的水凝胶薄膜。使用不同比例的海藻酸钠、芦荟和甘油优化水凝胶膜。含有 10% 甘油 (w/w 藻酸盐) 的薄膜表现出最佳外观。掺入芦荟会影响水凝胶膜的厚度、溶胀行为、水蒸气渗透性和药物释放曲线。较高的芦荟含量导致薄膜更厚(达到一定比例)、肿胀增加、水蒸气渗透性降低,并且在 12 小时内药物释放时间延长高达 93%。傅里叶变换红外光谱 (FTIR) 分析证实了关键官能团的存在以及水凝胶成分之间的相互作用。研究表明,海藻酸钠、芦荟和甘油的组合可以改善水凝胶膜的机械性能和药物释放曲线,使其成为增强局部药物输送和伤口愈合应用的有前途的选择。
引言
夫西地酸是一种有效的类固醇抗生素,来源于 Fusidium coccineum。它被广泛用于治疗葡萄球菌性皮肤感染和脓疱病。这种药物具有很高的疗效,即使对抗生素耐药菌株也是如此,而且毒性低,使其成为管理皮肤感染的合适选择1。与其他外用抗生素不同,夫西地酸可深入皮肤,增强其抗菌作用,尤其是在皮肤保护屏障受损的区域。其结构具有多种溶解特性,能够广泛分布于整个身体组织中,其梭状钠形式进一步增强,以获得更好的水溶性和渗透率 2,3。夫西地酸可以通过多种方式给药,包括口服、静脉注射和局部给药,以适应不同的治疗需求,使其成为各种感染的灵活选择4。
水凝胶具有高含水量和生物相容性,已成为伤口治疗中抗生素的创新载体,可提供保湿、控制药物释放并改善患者预后。它们由天然或合成聚合物(如藻酸盐)制成,海藻酸盐因其强大的生物相容性、经济性和模拟天然组织细胞外基质的凝胶特性而受到青睐5。特别是藻酸盐基水凝胶,提供有利于伤口愈合的潮湿环境,不会粘附在伤口上,并且易于去除,使其成为输送生物活性物质和支持组织再生的理想选择。封装抗生素的水凝胶的开发代表了伤口护理的重大进步,确保了靶向药物递送和持续的治疗效果 6,7。
拟议的含夫西地酸海藻酸盐/芦荟水凝胶旨在克服夫西地酸的溶解度挑战并增强其皮肤渗透性。芦荟以其亲肤、保湿和抗菌特性而闻名,也可用作化学渗透增强剂,有可能提高夫西地酸治疗皮肤感染的疗效 8,9。这种创新配方利用芦荟和藻酸盐水凝胶的协同作用,创造有利的愈合环境,优化药物输送,并为加强皮肤感染的治疗提供有前途的解决方案,充分利用夫西地酸的强大抗菌活性,改善输送和愈合结果10。
Access restricted. Please log in or start a trial to view this content.
研究方案
本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 夫西地酸水凝胶薄膜的制备
- 通过将海藻酸钠 (2.0% w/v) 和 芦荟 (1.0% w/v) 溶解在蒸馏水中来制备它们溶液。
- 向海藻酸钠溶液中加入 200 mg 夫西地酸并搅拌 1 小时。
- 将甘油以 10%、12% 和 14% 的浓度(w/w,基于藻酸盐质量)添加到藻酸盐溶液中。
- 将藻酸盐和 芦荟 溶液混合,最终藻酸盐/芦荟 比 (v/v) 为 100:0、90:10、80:20 和 75:25。
- 将 25 mL 每种混合物浇注到玻璃培养皿 (100 mm x 20 mm) 中,并在室温 (25 °C) 和控制湿度 (50%) 下干燥 2 天。
- 将干燥的薄膜浸入氯化钙 (CaCl2) 水溶液 (5.0% w/v) 中 5 分钟,以获得水凝胶薄膜。
- 用蒸馏水清洗所得薄膜,并在使用前在室温下干燥。
2. 确定薄膜厚度
- 使用数字千分尺测量薄膜的厚度11.
- 在胶片的 5 个不同点进行测量。
- 记录从每个点获得的测量值。
- 根据所进行的测量计算平均薄膜厚度。
3. 确定溶胀指数
- 使用实验室刀将胶片样品切成 2 cm x 2 cm 的正方形。
- 准确称量每个样品。
- 将样品在室温下浸泡在 PBS 缓冲液 (pH 6.8) 中 24 小时。
- 使用滤纸吸收薄膜表面多余的水分。
- 再次称量样品。
- 以不同的时间间隔称量薄膜。使用以下公式计算膨胀能力:
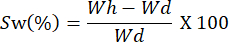
注: Wh 代表样品的水合重, Wd 对应于样品的干重。
4. 水蒸气渗透性或闭塞性测试
- 用滤纸11 盖住装有 50 mL 水的玻璃烧杯的开口。
- 将成膜溶液涂在其中一张纸上,并使其显影。
- 将烧杯存放在室温和湿度下。
- 根据烧杯内水重量的减少来评估薄膜对水的渗透性。
- 为了确定制备的水凝胶膜的水蒸气渗透性评估,请使用以下公式:
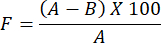
注意:遮蔽系数 F 测量薄膜的磁导率。它是通过计算覆盖有无薄膜滤纸的玻璃烧杯与覆盖有薄膜的滤纸的玻璃烧杯之间的水重量差来确定的。遮挡系数值越小,表示薄膜渗透性越大。
5. 傅里叶变换红外光谱 (FTIR)
- 将水凝胶样品放在 FTIR 光谱仪的 ATR 晶体上。
- 将波数范围设置为 4000-400 cm−1。
- 将扫描速率设置为每个样本 60 次扫描。
- 将分辨率设置为 4 cm−1。
- 在每次样品运行之前记录空气背景。
- 单独运行每个水凝胶样品的分析。
- 分析每个水凝胶样品的 FTIR 光谱,以确认官能团并检查所有组分之间的相互作用12。
- 分别对生 芦荟、海藻酸钠、甘油和夫西地酸重复分析。
6. 差示扫描量热法 (DSC)
- 使用市售的热分析仪获取热分布。
- 从聚合物膜上切下的多个圆形片制作测量样品。
- 研究 25-230 °C 的温度范围。
- 将加热/冷却速率设置为 20 °C/min。
- 使用标准铟和兼容软件进行温度和焓校准。
7. 药物释放试验
- 制备 50 mL PBS (pH = 7.4) 溶液作为溶出介质。
- 将水凝胶膜浸入 37 °C 的 PBS 中 24 小时,同时以 50 rpm 的速率搅拌。
- 在预定的时间间隔内,收集 2 mL 样品。
- 通过注射器过滤器稀释和过滤收集的样品。
- 立即补充等体积的 PBS。
- 使用紫外分光光度计评估释放的夫西地酸浓度,测量 285 nm 处的吸收。
- 使用零级、一级、Higuchi 和 Korsmeyer-Peppas 模型评估夫西地酸的释放动力学4.
Access restricted. Please log in or start a trial to view this content.
结果
海藻酸盐/芦荟 水凝胶膜的制备
采用不同比例的海藻酸钠、 芦荟和甘油制备水凝胶膜制剂。制剂的最终制备和评估仅使用 10% 甘油(海藻酸盐 w/w )进行。 图 1 显示了具有不同芦 荟 比例的水凝胶膜。之所以选择这种甘油,是因为其他甘油比例不能提供必要的粘合性和柔韧性,从而导致薄膜形成不正确。薄膜的强?...
Access restricted. Please log in or start a trial to view this content.
讨论
夫西地酸掺入具有不同比例的 芦荟 和甘油的藻酸盐水凝胶膜中。 芦荟 的存在不会影响外观,但在制备过程中观察到含有 芦荟 的溶液的粘度降低。厚度测试的结果表明,芦 荟 的加入可能在一定程度上对薄膜厚度产生一些影响,但并不被认为显着。一般来说,没有适合所有应用的单一理想厚度。然而,研究表明,薄膜的粘合和机械性能受厚度?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可披露的。
致谢
这项研究得到了沙特阿拉伯利雅得 Nourah bint Abdulrahman 公主大学研究人员支持项目编号 (PNURSP2024R30) 的支持。这项研究由沙特阿拉伯利雅得沙特国王大学的研究人员支持项目编号 (RSPD2024R811) 资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Aloe vera | Local supplier, Kuala Lumpur, Malaysia | It was raw aloe vera bark and prepared the materials in our lab | |
| Calcium Chloride | R&M Chemicals | ||
| Differential Scanning Calorimetry | Netzsch-Gruppe | DSC 300 Caliris | |
| FTIR spectroscopy | Perkin Elmer | 107914 | |
| Fusidic Acid | Sigma-Aldrich, St. Louis, MO, USA | PHR2810 | certified reference material, pharmaceutical secondary standard |
| Glycerin | Sigma-Aldrich, St. Louis, MO, USA | PHR1020 | United States Pharmacopeia (USP) Reference Standard |
| Micrometer Screw Gauge | Blomker Industries, Malaysia | ||
| NETZSCH proteus software | Netzsch-Gruppe | DSC 300 Caliris | |
| Phosphate Buffer Saline | Sigma-Aldrich, St. Louis, MO, USA | P4417 | Tablets |
| Sodium alginate | Sigma-Aldrich, St. Louis, MO, USA | W201502 | |
| thermal analysis instrument | NETZSCH | DSC Caliris | |
| UV-SPECTROPHOTOMETER / UV LINE-9400 | SECOMAM | / 8512047 |
参考文献
- Bandyopadhyay, D. Topical antibacterials in dermatology. Indian J Dermatol. 66 (2), 117-125 (2021).
- Williamson, D. A., Carter, G. P., Howden, B. P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin Microbiol Rev. 30, 827-860 (2017).
- Bonamonte, D., Belloni Fortina, A., Neri, L., Patrizi, A. Fusidic acid in skin infections and infected atopic eczema. G Ital Dermatol Venereol. 149 (4), 453-459 (2014).
- Curbete, M. M., Nunes, R. A. Critical review of the properties of fusidic acid and analytical methods for its determination. Crit Rev Anal Chem. 46 (4), 352-360 (2015).
- Zhao, C., Zhou, L., Chiao, M., Yang, W. Antibacterial hydrogel coating: Strategies in surface chemistry. Adv Colloid Interface. 285, 102280-102280 (2020).
- Ahmed, E. M. Hydrogel- Preparation, characterization, and applications: A review. J Adv Res. 6, 105-121 (2015).
- Stan, D., et al. Wound healing applications of creams and "smart" hydrogels. Exp Dermatol. 30 (9), 1218-1232 (2021).
- Cole, L., Heard, C. M. Skin permeation enhancement potential of Aloe vera and a proposed mechanism of action based upon size exclusion and pull effect. Int J Pharm. 333 (1-2), 10-16 (2007).
- Sharma, K., Mittal, A., Chauhan, N. Aloe vera as penetration enhancer. Int J Drug Dev Res. 7, 31-43 (2015).
- Parhi, R., Suresh, P., Mondal, S., Kumar, P. M. Novel penetration enhancers for skin applications: A Review. Curr Drug Deliv. 9 (2), 219-230 (2012).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Alginate/Aloe vera films reinforced with tragacanth gum. Food Chemistry: Mol Sci. 30 (4), 100105(2022).
- Gull, N., et al. In vitro study of chitosan-based multi-responsive hydrogels as drug release vehicles: a preclinical study. RSC Adv. 9 (53), 31078-31091 (2019).
- Ciarleglio, G., Cinti, F., Toto, E., Santonicola, M. G. Synthesis and characterization of alginate gel beads with embedded zeolite structures as carriers of hydrophobic curcumin. Gels. 9 (9), 714(2023).
- Dong, H., et al. Smart polycationic hydrogel dressing for dynamic wound healing. Small. 18 (25), 2201620(2022).
- Giz, A. S., et al. A detailed investigation of the effect of calcium cross-linking and glycerol plasticizing on the physical properties of alginate films. Int J Biol Macromol. 148, 49-55 (2020).
- Fadhilah, S., Aisyah, N., Mohd, N., Mat, K. A. Sodium alginate film: The effect of crosslinker on physical and mechanical properties. IOP Conf Ser Mater Sci. 509, 012063(2019).
- Kudłacik-Kramarczyk, S., et al. Investigations on the impact of the introduction of the Aloe vera into the hydrogel matrix on cytotoxic and hydrophilic properties of these systems considered as potential wound dressings. Mater Sci Eng C. 123, 111977(2021).
- Pereira, R., et al. Development of novel alginate based hydrogel films for wound healing applications. Int J Biol Macromol. 52, 221-230 (2013).
- Hadi, A., Nawab, A., Alam, F., Zehra, K. Physical, mechanical, optical, barrier, and antioxidant properties of sodium alginate-Aloe vera biocomposite film. J Food Process. 45 (5), e15444(2021).
- Yoshida, C. M., et al. Effect of chitosan and Aloe vera extract concentrations on the physicochemical properties of chitosan biofilms. Polymers. 13 (8), 1187(2021).
- Nuutila, K., Eriksson, E. Moist wound healing with commonly available dressings. Adv Wound Care. 10 (12), 685-698 (2021).
- Naeem, F., et al. pH-responsive cross-linked polymeric matrices based on natural polymers: effect of process variables on swelling characterization and drug delivery properties. BioImpacts: BI. 7 (3), 177(2017).
- Mahmood, A., et al. Aloe vera-based polymeric network: A promising approach for sustained drug delivery, development, characterization, and in vitro evaluation. Gels. 9 (6), 474(2023).
- Kamaraj, N., Rajaguru, P. Y., Issac, P., Sundaresan, S. Fabrication, characterization, in vitro drug release and glucose uptake activity of 14-deoxy, 11, 12-didehydroandrographolide loaded polycaprolactone nanoparticles. Asian J Pharm Sci. 11 (4), 353-362 (2017).
- Chalitangkoon, J., Wongkittisin, M., Monvisade, P. Silver loaded hydroxyethylacryl chitosan/sodium alginate hydrogel films for controlled drug release wound dressings. Int J Biol Macromol. 159, 194-203 (2020).
- Laracuente, M. L., Yu, M. H., McHugh, K. J. Zero-order drug delivery: State of the art and future prospects. J Control Release. 327, 834-856 (2020).
- Wang, Y., et al. A sustained zero-order release carrier for long-acting, peakless basal insulin therapy. J Mater Chem B. 8 (9), 1952-1959 (2020).
- Unagolla, J. M., Jayasuriya, A. C. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system. Eur J Pharm Sci. 114, 199-209 (2018).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。