A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصنيع وتوصيف رقع الإبر الدقيقة لتحميل وتسليم الإكسوسومات
In This Article
Summary
تمتلك Exosomes إمكانات سريرية كبيرة ، لكن تطبيقها العملي محدود بسبب سهولة إزالة الجسم الحي وضعف الاستقرار. تقدم الإبر الدقيقة حلا من خلال تمكين التسليم الموضعي عن طريق ثقب الحواجز الفسيولوجية والحفاظ على الحالة الجافة ، وبالتالي معالجة قيود إعطاء الإكسوسوم وتوسيع فائدتها السريرية.
Abstract
تمتلك الإكسوسومات ، باعتبارها "الجيل التالي" من العلاجات الحيوية الناشئة ونواقل توصيل الأدوية ، إمكانات هائلة في مجالات طبية حيوية متنوعة ، تتراوح من توصيل الأدوية والطب التجديدي إلى تشخيص الأمراض والعلاج المناعي للأورام. ومع ذلك ، فإن التخليص السريع عن طريق حقن البلعة التقليدية وضعف استقرار الإكسوسومات يحد من تطبيقها السريري. تعمل الإبر الدقيقة كحل يطيل وقت بقاء الإكسوسومات في موقع الإدارة ، وبالتالي الحفاظ على تركيز الدواء وتسهيل التأثيرات العلاجية المستدامة. بالإضافة إلى ذلك ، تمتلك الإبر الدقيقة أيضا القدرة على الحفاظ على استقرار المواد النشطة بيولوجيا. لذلك ، نقدم رقعة إبرة مجهرية لتحميل وتوصيل الإكسوسومات ونشارك الطرق ، بما في ذلك عزل الإكسوسومات ، وتصنيع ، وتوصيف بقع الإبر الدقيقة المحملة بالإكسوسوم. تم تصنيع رقع الإبرة الدقيقة باستخدام تريهالوز وحمض الهيالورونيك كمواد طرف والبولي فينيل بيروليدون كمادة داعمة من خلال طريقة صب من خطوتين. أظهرت الإبر الدقيقة قوة ميكانيكية قوية ، مع نصائح قادرة على تحمل 2 N. تم استخدام جلد الخنزير لمحاكاة جلد الإنسان ، وذابت أطراف الإبر الدقيقة تماما في غضون 60 ثانية بعد ثقب الجلد. أظهرت الإكسوسومات المنبعثة من الإبر الدقيقة مورفولوجيا وحجم الجسيمات وبروتينات العلامات والوظائف البيولوجية المماثلة لتلك الموجودة في الإكسوسومات الطازجة ، مما مكن الخلايا المتغصنة من امتصاص وتعزيز نضجها.
Introduction
تم اقتراح Exosomes ، وهي حويصلات صغيرة تطلقها الخلايا في المصفوفة خارج الخلية ، كعلاجات حيوية محتملة ونواقل توصيل الأدوية لعلاج العديد من الأمراض والسرطانات1. أثناء عملية التكوين الحيوي ، تغلف الإكسوسومات جزيئات نشطة بيولوجيا مختلفة من داخل الخلايا ، بما في ذلك البروتينات الوظيفية والأحماض النووية2. نتيجة لذلك ، عندما تمتصها الخلايا المتلقية أثناء عملية النقل ، فإن الإكسوسومات لديها القدرة على تعديل التعبير الجيني والوظائف الخلوية في الخلايا المستهدفة3. كنوع من رسول المعلومات الطبيعية ، تم الاستفادة الكاملة من exosomes في تجديد الأنسجة ، وتنظيم المناعة ، وكناقل توصيل4. من خلال التقنيات الهندسية ، يمكن إثراء روابط محددة على سطح exosomes ، مما يتيح تحريض أو تثبيط أحداث الإشارة في الخلايا المتلقية أو استهداف أنواع معينة من الخلايا5. يمكن أيضا تحميل عوامل العلاج الكيميائي في exosomes لعلاج السرطان6. علاوة على ذلك ، تتمتع الإكسوسومات بالقدرة على عبور الحاجز الدموي الدماغي لتوصيل البضائع العلاجية ، مما يجعلها واعدة للغاية لعلاج اضطرابات الدماغ7. بالمقارنة مع الجسيمات الشحمية ، تظهر الإكسوسومات امتصاصا خلويا محسنا وتوافقا حيويامحسنا 8. فهي قادرة على دخول الخلايا الأخرى بكفاءة مع إظهار تحمل أفضل وسمية أقل9. ومع ذلك ، فإن حقن البلعة التقليدية للإكسوسومات عرضة للعزل والتخليص السريع من الكبد والكلى والطحال في مجرى الدم10. علاوة على ذلك ، تتمتع الإكسوسومات باستقرار ضعيف في المختبر وتكون عرضة لظروف التخزين ، مما يحد من تطبيقاتها السريرية11.
الإبر الدقيقة ، وهي مجموعة من أطراف الإبر ذات الحجم المجهري ، لديها القدرة على اختراق الحواجز الفسيولوجية لتوصيل الأدوية الجزيئية الصغيرة12 ، والبروتينات13 ، والأحماض النووية14 ، والأدوية النانوية15. تم تصميم الإبر الدقيقة بدقة لاستهداف الآفات على سطح الجلد ، وتضمن أطرافها المشتتة توزيعا موحدا للأدوية في الموقع المستهدف ، وبالتالي تضخيم تأثيرها العلاجي16. يسهل التصميم والتركيب المادي للإبر الدقيقة التخزين الجاف للمواد النشطة بيولوجيا مثل البروتينات والأحماض النووية ، مما يعزز استقرارها17. طرق الحقن التقليدية لها مدة عمل قصيرة نسبيا ويمكن أن تسبب الألم ، مما يثير الخوف لدى المرضى18. يقلل طول الإبرة الدقيقة بحجم ميكرومتر من صدمة الأنسجة ويمنع تحفيز الأعصاب ، وبالتالي القضاء على الألم وتحسين امتثال المريض19. بالإضافة إلى ذلك ، تسمح الطبيعة سهلة الاستخدام للإبر الدقيقة للمرضى بإدارة العلاج ذاتيا دون الحاجة إلى موظفين متخصصين16. بالإضافة إلى الجلد ، يمكن أيضا استخدام الإبر الدقيقة في الأنسجة مثل العينين20 والغشاء المخاطي للفم21 والقلب22 والأوعية الدموية23. يوفر تطبيق الإبر الدقيقة للتوصيل السريري للإكسوسومات استراتيجية واعدة ومستقبلية.
ومن ثم ، فإننا نقدم رقعة إبرة مجهرية محملة بالإكسوسوم (exo@MN) ونكشف عن طريقة تصنيعها. تم تصنيع رقع الإبر الدقيقة باستخدام طريقة صب من خطوتين ، جنبا إلى جنب مع الطرد المركزي والتجفيف بالفراغ ، مما يعزز تجميع الإكسوسومات عند أطراف الإبرة الدقيقة ، وبالتالي تعزيز كفاءة التسليم. تم بناء كل من أطراف الإبرة والدعامة باستخدام مواد تظهر توافقا حيويا ممتازا وقابلية للذوبان في الماء. تم دمج تريهالوز وحمض الهيالورونيك (HA) كمواد طرف لتوفير الحماية للإكسوسومات ، وتم اختيار البولي فينيل بيروليدون (PVP) المذاب في الإيثانول المطلق كمادة دعم. تم تمييز مورفولوجيا رقعة الإبرة الدقيقة باستخدام المجهر المجهري والمجهر الإلكتروني الماسح (SEM). تم تقييم الاختبار الميكانيكي للإبرة الدقيقة باستخدام مقياس الشد لتأكيد قدرتها على اختراق الجلد ، وتم فحص معدل الإطلاق على جلد الخنزير ليكون 60 ثانية. علاوة على ذلك ، تم وصف مورفولوجيا وحجم ومحتوى البروتين لكل من الإكسوسومات الطازجة والإكسوسومات في exo@MN باستخدام المجهر الإلكتروني النافذ (TEM) ، وتحليل تتبع الجسيمات النانوية (NTA) ، والنشاف الغربي (WB). تم تحديد استيعاب الإكسوسومات بواسطة الخلايا المتغصنة (DCs) باستخدام مجهر المسح بالليزر متحد البؤر (CLSM) ، وتم تقييم نضج DCs من خلال قياس التدفق الخلوي. التوصيف المورفولوجي والوظائف البيولوجية لنوعي الإكسوسومات متسقة بشكل أساسي.
Protocol
لا تتطلب هذه الدراسة تصريحا أخلاقيا لأن جلد الخنزير المستخدم في التجارب الموصوفة في القسم 3 تم شراؤه كآذان خنازير صالحة للأكل من السوق ولم يتم الحصول عليه من التجارب.
1. عزل الإكسوسومات
- زراعة الخلايا
- زراعة خلايا سرطان المبيض الظهارية للفأر ID8 في وسط زراعة النسر المعدل (DMEM) من Dulbecco الذي يحتوي على 10٪ مصل بقري جنيني و 1٪ محلول بنسلين ستربتومايسين (100×) (انظر جدول المواد) في أطباق بتري بقطر 15 سم.
- احتضان خلايا ID8 في حاضنة CO2 (انظر جدول المواد) عند 37 درجة مئوية و 5٪ CO2 حتى تصل كثافة الخلية إلى 90٪.
- عزل الإكسوسومات
- قم بإزالة وسط الاستزراع من أطباق بتري واغسله مرتين باستخدام محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS). أضف 20 مل من DMEM بدون مصل بقري جنيني (انظر جدول المواد) ومحلول البنسلين والستربتومايسين (انظر جدول المواد). استمر في الحضانة عند 37 درجة مئوية و 5٪ CO2 لمدة 48 ساعة.
- جمع طاف ثقافة الخلية من 20 طبق بتري بقطر 15 سم. أجهزة الطرد المركزي عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية وجمع المادة الطافية لإزالة الخلايا الحرة.
- أجهزة الطرد المركزي عند 2000 × جم لمدة 10 دقائق 4 درجة مئوية ، وجمع المادة الطافية لإزالة الحطام الخلوي.
- قم بتوصيل نظام ترشيح الفراغ القابل للتصرف 0.22 ميكرومتر (انظر جدول المواد) بمضخة تفريغ المياه المتداولة (انظر جدول المواد). قم بإنشاء فراغ للسماح للطافي بالمرور عبر غشاء سلفون البولي إيثر 0.22 ميكرومتر والدخول إلى الغرفة السفلية لنظام الترشيح ، مما يؤدي إلى إزالة الحويصلات أو الشوائب التي يزيد حجمها عن 0.22 ميكرومتر من المادة الطافية بشكل فعال.
- لتوصيل مضخة التفريغ ، قم بتشغيل مفتاح المضخة ثم قم بتوصيله بمدخل الهواء لنظام ترشيح الفراغ. عند الإغلاق ، افصل الاتصال بالمضخة أولا ثم قم بإيقاف تشغيل مضخة التفريغ. يساعد هذا الإجراء على منع التدفق العكسي لمضخة التفريغ وتلوث سائل الاستزراع.
- أضف 15 مل من المادة الطافية إلى الأنبوب الداخلي لأنبوب الترشيح الفائق 100 كيلو دالتون (انظر جدول المواد). جهاز طرد مركزي عند 3500 × جم لمدة 10 دقائق عند 4 درجات مئوية ، وإزالة السائل من الأنبوب الخارجي.
ملاحظة: احتفظ بجزيئات أكبر من 100 كيلو دالتون على غشاء الأنبوب الداخلي ، بينما سيتم طرد البروتينات الأصغر من 100 كيلو دالتون إلى الأنبوب الخارجي مع المحلول. كانت الإكسوسومات أكبر من 100 كيلو دالتون وتم تجميعها على غشاء الأنبوب الداخلي. - كرر الخطوات المذكورة أعلاه حتى يصبح الحجم الكلي للسائل في حدود 5 مل. اجمع السائل من الأنبوب الداخلي وأضف 1 مل من DPBS. استخدم ماصة لتكرار ماصة في الأنبوب الداخلي ، مما يضمن إعادة تعليق الإكسوسومات المرفقة في DPBS ، ثم قم بجمعها.
- جهاز طرد مركزي عند 10000 × جم لمدة 60 دقيقة عند 4 درجات مئوية ، ونقل المادة الطافية إلى أنبوب طرد مركزي سريع المفاجئة سعة 6 مل (انظر جدول المواد). أغلق الأنبوب بمادة مانعة للتسرب الحراري.
- جهاز طرد مركزي عند 100000 × جم لمدة 2 ساعة و 4 درجات مئوية باستخدام جهاز طرد مركزي فائق (انظر جدول المواد). قم بقطع أنبوب الطرد المركزي السريع ، وإزالة المادة الطافية ، وإعادة تعليق الحبيبات في 100 ميكرولتر من DPBS. هذا هو الحل الخارجي.
ملاحظة: أثناء عملية تعليق الحبيبات ، من الضروري ماصة وتحريك جدار الأنبوب 200 مرة على الأقل باستخدام ماصة.
2. تلفيق exo@MN
- تحضير القالب الرئيسي
- قم ببناء نموذج إبرة مجهرية بمصفوفة 10 × 10 باستخدام برنامج CAD ، يتميز بأطراف مخروطية الشكل مع المعلمات التالية: ارتفاع 1200 ميكرومتر ، وقطر قاعدة 400 ميكرومتر ، وخطوة (المسافة بين الإبر الدقيقة المجاورة) 900 ميكرومتر.
- استخدم راتنج HTL كمادة واطبع القالب الرئيسي للإبرة الدقيقة باستخدام طابعة 3D (انظر جدول المواد).
- اغمر القالب الرئيسي في الإيثانول المطلق لمدة 1 ساعة لإزالة أي راتنج ملتصق بالسطح.
- فضح القالب للأشعة فوق البنفسجية لمدة 5 دقائق لعلاجه.
- اغمر القالب مرة أخرى في الإيثانول المطلق لمدة 1 ساعة ، متبوعا بتجفيفه عند 60 درجة مئوية في فرن تجفيف لمدة 1 ساعة. القالب الرئيسي جاهز.
- تحضير قالب الإنتاج
- امزج المكونات A و B من polydimethylsiloxane (PDMS ، انظر جدول المواد) بنسبة 10: 1. يقلب جيدا ويصب الخليط في قالب رئيسي.
- ضع قالب PDMS تحت ضغط 1 رطل لكل بوصة مربعة لمدة 15 دقيقة لإزالة فقاعات الهواء من خليط PDMS.
- قم بمعالجة قالب PDMS عند 60 درجة مئوية لمدة 2 ساعة ثم قم بإزالة القوالب للحصول على قالب إنتاج الإبرة الدقيقة.
- نظف قالب الإنتاج بماء فائق النقاء قبل الاستخدام.
- تحضير الحل
- حدد محتوى البروتين في محلول الإكسوسوم باستخدام مجموعة مقايسة BCA (انظر جدول المواد). أضف كمية مناسبة من DPBS لتحقيق تركيز 10 ميكروغرام / ميكرولتر لمحلول الإكسوسوم.
- تحضير محلول 200 ملغم / مل تريهالوز (انظر جدول المواد) باستخدام DPBS كمذيب. يقلب لمدة 20 دقيقة لضمان الذوبان الكامل.
- تحضير محلول من حمض الهيالورونيك 200 ملغ / مل (HA ، انظر جدول المواد) باستخدام DPBS كمذيب. يقلب طوال الليل لضمان الذوبان الكامل.
- تحضير محلول 150 ملغم / مل بولي فينيل بيروليدون (PVP ، انظر جدول المواد) باستخدام الإيثانول المطلق كمذيب. يقلب طوال الليل لضمان الذوبان الكامل.
- امزج محلول الإكسوسوم (10 ميكروغرام / ميكرولتر) ومحلول تريهالوز (200 مجم / مل) بنسبة حجم 1: 1. ثم أضف حجما مساويا من محلول حمض الهيالورونيك (200 مجم / مل). تخلط جيدا للحصول على حل طرف.
- تلفيق exo@MN
- قم بمعالجة سطح قالب PDMS باستخدام منظف البلازما (انظر جدول المواد) لمدة 30 ثانية بدرجة منخفضة لتعزيز قابليته للماء.
- أضف 40 ميكرولتر من محلول الطرف إلى قالب PDMS. جهاز طرد مركزي في درجة حرارة الغرفة (RT) و 3000 × جم لمدة 3 دقائق لضمان ملء السائل لطبقة إبرة القالب.
- إزالة السائل الزائد في القالب وجفف في RT في فرن تجفيف فراغ (انظر جدول المواد) لمدة 1 يوم.
- أضف 200 ميكرولتر من محلول PVP إلى قالب PDMS. جهاز طرد مركزي 3000 × جم لمدة 3 دقائق في RT لضمان أن السائل يملأ طبقة الدعم للقالب.
- تجفيف القالب في RT في فرن التجفيف لمدة 1 يوم ، ثم demold للحصول على التصحيح exo@MN.
ملاحظة: احتفظ برقعة exo@MN مخزنة في فرن تجفيف حتى تصبح جاهزة للاستخدام.
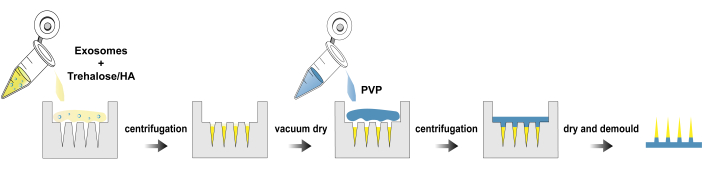
الشكل 1: عملية تصنيع بقع exo@MN. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. توصيف بقع exo@MN
- مراقبة التشكل
- الصق دعامة الرقعة على سطح مائل بزاوية 45 درجة وضعها تحت مجهر ستيريو (انظر جدول المواد).
- قم بتشغيل المنور والتقط مورفولوجيا التصحيح باستخدام هدف 4x.
- المجهر الإلكتروني الماسح (SEM)
- قم بتوصيل الرقعة بمرحلة العينة باستخدام مادة لاصقة موصلة وعالجها بطبقة دقيقة تلقائية (انظر جدول المواد) لمدة 30 ثانية.
- التقط صورا لرقعة exo@MN باستخدام SEM (انظر جدول المواد) بجهد متسارع يبلغ 1 كيلو فولت.
- الاختبارات الميكانيكية
- اقطع صفيفا 3 × 3 من الرقعة وضعه مع توجيه الأطراف لأعلى على المنصة الصلبة لمقياس الشد (انظر جدول المواد). اضبط ارتفاع المسبار لتقريبه من أطراف الإبرة دون لمسها.
- اضبط المعلمات على التوقف عندما يصل الضغط إلى 20 نيوتن تلقائيا. ضغط أطراف الإبرة عموديا بسرعة 0.5 مم / دقيقة وسجل ملف تعريف الحمل مقابل الإزاحة.
- انحلال
- شراء آذان الخنازير الطازجة من السوق وتقطيعها إلى قطع (5 سم × 5 سم × 0.3 سم). انشر جلد الخنزير على طاولة واستخدم الورق لتجفيف رطوبة السطح.
- قم بإعداد أربع بقع إبرة مجهرية جافة بحيث تكون أطراف الإبرة متجهة لأسفل على جلد الخنزير ، مع تباعد كل رقعة قليلا. باستخدام إصبعي الإبهام والسبابة ، اضغط عموديا لأسفل على كل رقعة إبرة دقيقة. قم بإزالة رقعة واحدة كل 15 ثانية.
- ضع الرقعة التي تمت إزالتها على الفور في فرن تجفيف وجففها لمدة 5 دقائق. اقطع عمودا من أطراف الإبرة الدقيقة ، وضعها أفقيا تحت المجهر (انظر جدول المواد) ، واستخدم عدسة موضوعية 4x لمراقبة انحلال الأطراف.
4. توصيف الإكسوسومات في رقعة exo@MN
ملاحظة: يتم إذابة أطراف exo@MN الإبرة الدقيقة في 100 ميكرولتر من محلول DPBS لإجراء التوصيف التالي على الإكسوسومات المفرزة.
- المجهر الإلكتروني النافذ (TEM)
- عالج الشبكة النحاسية (انظر جدول المواد) بمعالجة محبة للماء باستخدام منظف أيوني (انظر جدول المواد) لمدة 5 دقائق.
- قم بتوزيع 10 ميكرولتر من العينة على الجانب الكربوني للشبكة النحاسية. اتركه لمدة 1 دقيقة ، ثم قم بإزالة السائل عن طريق نشافه بورق الترشيح من الحواف.
- أضف 10 ميكرولتر من أسيتات اليورانيل 3٪ (انظر جدول المواد) إلى العينة. اتركه لمدة 10 ثوان ، ثم قم بإزالة السائل عن طريق النشاف بورق الترشيح من الحواف.
- أضف 10 ميكرولتر من 3٪ أسيتات اليورانيل إلى العينة. اتركه لمدة 1 دقيقة ، ثم قم بإزالة السائل عن طريق تنشيفه بورق الترشيح من الحواف وتجفيفه في الهواء عند RT.
- التقط صورا للإكسوسومات باستخدام TEM (انظر جدول المواد) بجهد متسارع يبلغ 80 كيلو فولت.
- تحليل تتبع الجسيمات النانوية (NTA)
- قم بتخفيف محلول الإكسوسوم باستخدام DPBS لتحقيق تركيز جسيم قدره 1 × 107 جسيمات / مل. احقن ببطء 1 مل من محلول الإكسوسوم في غرفة العينة في NTA باستخدام حقنة 1 مل (انظر جدول المواد).
- اضبط نوع إجراء التشغيل القياسي (SOP) للأداة على EV-488 للكشف عن توزيع حجم الإكسوسومات.
- النشاف الغربي (WB)
- تحضير محلول التحلل عن طريق خلط محلول تحلل مقايسة الترسيب المناعي الإشعاعي (RIPA): فلوريد فينيل ميثان سلفونيل (انظر جدول المواد) بنسبة 100: 1. تحلل الإكسوسومات على الجليد لمدة 20 دقيقة ، دوامة كل 10 دقائق.
- جهاز طرد مركزي المحلول عند 12000 × جم لمدة 10 دقائق عند 4 درجات مئوية. جمع طاف لقياس تركيز البروتين.
- أضف 5x SDS-PAGE تحميل المخزن المؤقت (انظر جدول المواد) إلى المادة الطافية بنسبة حجم 1: 4 واخلطها جيدا. يسخن على حرارة 100 درجة مئوية لمدة 10 دقائق لتشويه البروتينات.
- أضف 5 ميكرولتر من علامة البروتين الملطخة مسبقا 180 كيلو دالتون (انظر جدول المواد) و 10 ميكروغرام من العينة المشوهة إلى هلام مسبق الصب بنسبة 4٪ -20٪ (انظر جدول المواد). قم بتشغيل نظام الرحلان الكهربائي (انظر جدول المواد) عند 60 فولت لمدة 10 دقائق ثم عند 140 فولت لمدة 50 دقيقة.
- نقل البروتينات من الجل إلى غشاء PVDF (انظر جدول المواد) المنشط مسبقا مع الميثانول. قم بإجراء نظام الرحلان الكهربائي عند 290 مللي أمبير لمدة 90 دقيقة على الجليد.
- احتضان غشاء PVDF في محلول الحليب الخالي من الدسم 5 ٪ لمدة 1 ساعة. اغسل ثلاث مرات بمحلول ملحي مخزن مع توين (TBST ، انظر جدول المواد) لمدة 5 دقائق لكل منها.
- قطع النطاقات المستهدفة على أساس موقف البروتين. احتضان الأربطة بجسم مضاد CD63 مضاد للفأر وجسم مضاد Alix مضاد للفأر (انظر جدول المواد) مخفف إلى التركيز المناسب وفقا لتعليمات الشركة الصانعة ، واحتضان طوال الليل عند 4 درجات مئوية.
- اغسل الأربطة ثلاث مرات باستخدام TBST. احتضان مع IgG المضاد للأرانب المترافق HRP (انظر جدول المواد) في RT لمدة 1 ساعة. ثم اغسل ثلاث مرات باستخدام TBST مرة أخرى.
- قم بتطبيق كاشف اكتشاف ECL فائق (انظر جدول المواد) لتغطية سطح الأشرطة ، وقم على الفور بكشف الأربطة والتقاطها باستخدام جهاز تصوير هلام (انظر جدول المواد).
- الفحص المجهري بالليزر متحد البؤر (CLSM)
- قم بزراعة 5 × 105 DCs في طبق متحد البؤر باستخدام 2 مل من وسيط معهد روزويل بارك التذكاري 1640 (RPMI 1640) (انظر جدول المواد). أضف الإكسوسومات أو exo@MN ، واحتضن عند 37 درجة مئوية لمدة 24 ساعة.
- أضف قطرة من Hoechst 33342 إلى كل طبق متحد البؤر واحتضانها في الظلام على حرارة 37 درجة مئوية لمدة 20 دقيقة.
- قم بإجراء التصوير باستخدام CLSM (انظر جدول المواد) باستخدام عدسة موضوعية 60x. ضع قطرة من زيت الغمر (انظر جدول المواد) على العدسة وضع الطبق متحد البؤر على المسرح. اضبط محاور x / y / z لتحديد المستوى البؤري المناسب للخلايا.
- ابدأ التصوير باستخدام قنوات DAPI / TRITC / TD ، وحدد دقة 1024 بكسل ، واضبط الوضع السريع على 1/8 ثانية.
- قياس التدفق الخلوي
- قم بزراعة DCs في لوحة مكونة من 6 آبار ، كل بئر يحتوي على 5 × 105 خلايا و 2 مل من 1640 متوسط. أضف كميات متساوية من محلول DPBS ، exosomes ، microneedles بدون exosomes ، و exo@MN ، على التوالي ، واحتضان عند 37 درجة مئوية لمدة 24 ساعة.
- نقل الوسيط من كل بئر إلى أنابيب الطرد المركزي. أجهزة الطرد المركزي عند 300 × جم لمدة 3 دقائق عند 4 درجات مئوية ، وإزالة المادة الطافية.
- أضف 0.5 ميكرولتر من الجسم المضاد FITC-CD11c ، و 2.5 ميكرولتر من الجسم المضاد APC-CD80 ، و 0.5 ميكرولتر من الجسم المضاد I-A / I-E الأزرق المحيط الهادئ (انظر جدول المواد) إلى 100 ميكرولتر من محلول BSA بنسبة 5٪ (انظر جدول المواد). تخلط جيدا ، وإعادة تعليق الخلايا ، واحتضان على شاكر في الجليد وفي الظلام لمدة 20 دقيقة.
- أضف 1 مل من DPBS وأجهزة الطرد المركزي عند 300 × جم لمدة 3 دقائق عند 4 درجات مئوية ، ثم قم بإزالة المادة الطافية. كرر الغسيل مرتين لإزالة الأجسام المضادة غير المنضمة ، ثم تابع تحليل قنوات الفلورسنت المقابلة عبر قياس التدفق الخلوي (انظر جدول المواد).
- أولا ، في مخطط التشتت FSC-A / SSC-A ، بوابة مجموعة الخلايا الرئيسية ك P1. في مخطط التشتت SSC-A / SSC-H لمحتوى الخلية P1 ، قم ببوابة منطقة P2 مربعة على طول القطر لإزالة الخلايا المجمعة.
- قم بإجراء تحليل مضان على مجموعة خلايا P2 باستخدام قنوات FITC و APC و Pacific Blue. قم بتعيين حالة التوقف لجمع 10000 خلية في بوابة P2.
5. التحليل الإحصائي
- التعبير عن البيانات الكمية كوسيلة ± الانحرافات المعيارية (SD). تقييم الدلالة الإحصائية باستخدام تحليل t-test باستخدام تطبيق برنامج تحليل البيانات المناسب. ضع في اعتبارك قيم p أقل من 0.05 للإشارة إلى الدلالة الإحصائية. * ع < 0.05 ، ** ع < 0.01 ، ***ع < 0.001 ، **** ف < 0.0001.
النتائج
هنا ، نقدم بروتوكولا لعزل exosomes وتصنيع وتوصيف رقعة exo@MN. يوضح الشكل 1 المخطط الانسيابي للعملية لتصنيع رقعة exo@MN. تم خلط الإكسوسومات مع تريهالوز و HA ، ثم تمت إضافة الخليط إلى قالب الإبرة الدقيقة والطرد المركزي. سهلت هذه العملية تجميع الإكسوسومات عند أطراف الإبرة ، مما عزز الإطل...
Discussion
حاليا ، تشمل الطرق الرئيسية لعزل الإكسوسومات الطرد المركزي الفائق ، والطرد المركزي المتدرج الكثافة ، والترشيح الفائق ، وهطول الأمطار ، والخرز المغناطيسي المناعي ، وعلم الموائع الدقيقة24. نظرا لقدرة التحميل المحدودة للإبر الدقيقة الناتجة عن مساحة طرف الإبرة الصغيرة ، من الضر...
Disclosures
H. C. ، F.L.Q ، و S.J.M هم مخترعون في طلب براءة اختراع تم تقديمه بناء على البيانات الواردة في هذه المخطوطة. HC هو المؤسس العلمي لشركة Medcraft Biotech. شركه.
Acknowledgements
تقدر FQ الدعم المقدم من برنامج البحث والتطوير الرائد في تشجيانغ (2022C03031) ، والبرنامج الوطني للبحث والتطوير الرئيسي في الصين (2021YFA0910103) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (22274141 ، 22074080) ، ومؤسسة العلوم الطبيعية بمقاطعة شاندونغ (ZR2022ZD28) وبرنامج تايشان للباحثين في مقاطعة شاندونغ (tsqn201909106). ويقر صاحب البلاغ بالدعم المالي المقدم من المؤسسة الوطنية للعلوم الطبيعية في الصين (82202329). يقر المؤلفون باستخدام الأدوات في المرفق الأساسي للأجهزة المشتركة في معهد هانغتشو للطب (HIM) ، الأكاديمية الصينية للعلوم.
Materials
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
References
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved