Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изготовление и определение характеристик микроигольчатых пластырей для загрузки и доставки экзосом
В этой статье
Резюме
Экзосомы обладают значительным клиническим потенциалом, но их практическое применение ограничено из-за легкого клиренса in vivo и плохой стабильности. Микроиглы представляют собой решение, обеспечивающее локализованную доставку путем прокола физиологических барьеров и сохранения в сухом состоянии, тем самым устраняя ограничения введения экзосом и расширяя их клиническую полезность.
Аннотация
Экзосомы, как новые биотерапевтические средства «следующего поколения» и векторы доставки лекарств, обладают огромным потенциалом в различных областях биомедицины, начиная от доставки лекарств и регенеративной медицины и заканчивая диагностикой заболеваний и иммунотерапией опухолей. Однако быстрый клиренс при традиционной болюсной инъекции и плохая стабильность экзосом ограничивают их клиническое применение. Микроиглы служат раствором, который продлевает время пребывания экзосом в месте введения, тем самым поддерживая концентрацию препарата и способствуя длительному терапевтическому эффекту. Кроме того, микроиглы также обладают способностью поддерживать стабильность биоактивных веществ. Поэтому мы представляем пластырь с микроиглами для загрузки и доставки экзосом и делимся методами, включая выделение экзосом, изготовление и характеристику нагруженных экзосомами микроигольчатых пластырей. Пластыри с микроиглами были изготовлены с использованием трегалозы и гиалуроновой кислоты в качестве материалов наконечника и поливинилпирролидона в качестве основного материала с помощью двухэтапного метода литья. Микроиглы продемонстрировали высокую механическую прочность, а наконечники были способны выдержать 2 Н. Для имитации человеческой кожи использовалась свиная кожа, и кончики микроигл полностью расплавились в течение 60 с после прокола кожи. Экзосомы, высвобождаемые из микроигл, демонстрировали морфологию, размер частиц, маркерные белки и биологические функции, сопоставимые с таковыми у свежих экзосом, что позволяло дендритным клеткам поглощать и способствовать их созреванию.
Введение
Экзосомы, которые представляют собой небольшие везикулы, высвобождаемые клетками во внеклеточный матрикс, были предложены в качестве потенциальных биотерапевтических средств и векторов доставки лекарств для лечения ряда заболеваний и видоврака. В процессе биогенеза экзосомы инкапсулируют различные биологически активные молекулы из клеток, включая функциональные белки и нуклеиновыекислоты. В результате, поглощаемые клетками-реципиентами в процессе транспортировки, экзосомы обладают способностью модулировать экспрессию генов и клеточные функциив клетках-мишенях. В качестве своего рода естественного посланника информации экзосомы были в полной мере использованы в регенерации тканей, иммунной регуляции и вкачестве носителя доставки. С помощью инженерных методов специфические лиганды могут быть обогащены на поверхности экзосом, что позволяет индукционизировать или ингибировать сигнальные события в клетках-реципиентах или нацеливаться на определенные типы клеток. Химиотерапевтические агенты также могут быть загружены в экзосомы для лечения рака6. Кроме того, экзосомы обладают способностью пересекать гематоэнцефалический барьер для доставки терапевтического груза, что делает их весьма перспективными для лечения заболеваний головногомозга. По сравнению с липосомами, экзосомы демонстрируют повышенное поглощение клетками и улучшенную биосовместимость. Они способны эффективно проникать в другие клетки, демонстрируя при этом лучшую переносимость и меньшую токсичность9. Тем не менее, традиционная болюсная инъекция экзосом подвержена секвестрации и быстрому выведению печенью, почками и селезенкой вкровоток. Кроме того, экзосомы обладают плохой стабильностью in vitro и чувствительны к условиям хранения, которые ограничивают ихклиническое применение.
Микроиглы, представляющие собой массив наконечников игл микрометрического размера, обладают способностью проникать через физиологические барьеры для доставки низкомолекулярных лекарств12, белков13, нуклеиновых кислот14 и нанолекарств15. Микроиглы точно спроектированы для нацеливания на поражения на поверхности кожи, а их дисперсные кончики обеспечивают равномерное распределение лекарств в целевом участке, тем самым усиливая их терапевтическое воздействие16. Конструкция и состав материала микроигл облегчают сухое хранение биологически активных веществ, таких как белки и нуклеиновые кислоты, повышая их стабильность17. Традиционные инъекционные методы имеют относительно короткую продолжительность действия и могут вызывать боль, вызывая страх у пациентов18. Микрометровая длина микроиглы сводит к минимуму травмирование тканей и предотвращает стимуляцию нервов, тем самым устраняя боль и улучшая комплаентность пациента19. Кроме того, удобный в использовании характер микроигл позволяет пациентам самостоятельно проводить лечение без необходимости использования специализированного персонала16. Помимо кожи, микроиглы также могут быть использованы в таких тканях, как глаза20, слизистая оболочка полости рта21, сердце22 и кровеносные сосуды23. Применение микроигл для клинической доставки экзосом обеспечивает многообещающую и перспективную стратегию.
В связи с этим мы представляем пластырь с микроиглами (exo@MN), нагруженный экзосомами, и раскрываем метод его изготовления. Пластыри с микроиглами были изготовлены с использованием двухэтапного метода литья, наряду с центрифугированием и вакуумной сушкой, что способствует агрегации экзосом на кончиках микроигл, тем самым повышая эффективность доставки. Как кончики игл, так и подложка были изготовлены с использованием материалов, которые демонстрируют превосходную биосовместимость и растворимость в воде. Трегалоза и гиалуроновая кислота (ГК) были включены в качестве материалов наконечника для обеспечения защиты экзосом, а поливинилпирролидон (ПВП), растворенный в абсолютном этаноле, был выбран в качестве основного материала. Морфологию микроигольчатого пластыря охарактеризовали с помощью микроскопии и сканирующего электронного микроскопа (СЭМ). Механические испытания микроигл оценивались с помощью растяжителя, чтобы подтвердить их способность проникать в кожу, а скорость высвобождения из кожи свиньи была исследована как 60 с. Кроме того, морфология, размер и содержание белка как в свежих экзосомах, так и в экзосомах в exo@MN были охарактеризованы с помощью просвечивающего электронного микроскопа (TEM), анализа отслеживания наночастиц (NTA) и вестерн-блоттинга (WB). Интернализацию экзосом дендритными клетками (ДК) охарактеризовали с помощью конфокального лазерного сканирующего микроскопа (КЛСМ), а созревание ДК оценивали с помощью проточной цитометрии. Морфологическая характеристика и биологические функции двух типов экзосом в основном согласуются.
протокол
Данное исследование не требует этического разрешения, поскольку свиная кожа, использованная для экспериментов, описанных в разделе 3, была приобретена в качестве съедобных свиных ушей на рынке, а не получена от экспериментальных животных.
1. Выделение экзосом
- Культура клеток
- Культивировать эпителиальные клетки рака яичников мышей ID8 в культуральной среде Dulbecco Modified Eagle Medium (DMEM), содержащей 10% фетальной бычьей сыворотки и 1% раствор пенициллин-стрептомицина (100×) (см. Таблицу материалов) в чашках Петри диаметром 15 см.
- Инкубируйте клетки ID8 в инкубаторе сCO2 (см. Таблицу материалов) при 37 °C и 5% CO2 до тех пор, пока плотность клеток не достигнет 90%.
- Выделение экзосом
- Удалите питательную среду из чашек Петри и дважды промойте фосфатно-солевым буфером Дульбекко (DPBS). Добавьте 20 мл DMEM без фетальной бычьей сыворотки (см. Таблицу материалов) и раствор пенициллин-стрептомицина (см. Таблицу материалов). Продолжайте инкубацию при 37 °C и 5%CO2 в течение 48 часов.
- Соберите надосадочную жидкость клеточной культуры из 20 чашек Петри диаметром 15 см. Центрифугируйте при 300 x g в течение 10 мин при 4 °C и соберите надосадочную жидкость для удаления свободных клеток.
- Центрифугируйте при 2000 x g в течение 10 мин 4 °C и соберите надосадочную жидкость для удаления клеточного мусора.
- Подключите одноразовую систему вакуумной фильтрации 0,22 мкм (см. Таблицу материалов) к вакуумному насосу циркуляционной воды (см. Таблицу материалов). Создание вакуума, позволяющего надосадочной жидкости проходить через мембрану из полиэфирсульфонового слоя толщиной 0,22 мкм и попадать в нижнюю камеру системы фильтрации, эффективно удаляя из надосадочной жидкости везикулы или примеси размером более 0,22 мкм.
- Чтобы подключить вакуумный насос, включите переключатель насоса, а затем подключите его к воздухозаборнику системы вакуумной фильтрации. При закрытии сначала отсоедините соединение с насосом, а затем выключите вакуумный насос. Эта процедура помогает предотвратить обратный поток вакуумного насоса и загрязнение питательной жидкости.
- Добавьте 15 мл надосадочной жидкости во внутреннюю трубку ультрафильтрационной трубки с давлением 100 кДа (см. Таблицу материалов). Центрифугируйте при 3500 x g в течение 10 минут при 4 °C и удалите жидкость из внешней пробирки.
ПРИМЕЧАНИЕ: Удерживайте частицы с массой более 100 кДа на внутренней мембране трубки, в то время как белки с массой менее 100 кДа будут центрифугироваться во внешнюю пробирку вместе с раствором. Экзосомы имели размер более 100 кДа и агрегировались на мембране внутренней трубки. - Повторяйте вышеуказанные действия до тех пор, пока общий объем жидкости не окажется в пределах 5 мл. Соберите жидкость из внутренней трубки и добавьте 1 мл DPBS. С помощью пипетки многократно проводите пипетку во внутреннюю трубку, обеспечивая ресуспендирование прикрепленных экзосом в DPBS, а затем соберите их.
- Центрифугируйте при давлении 10000 x g в течение 60 мин при 4 °C и перенесите надосадочную жидкость в быстросъемную центрифужную пробирку объемом 6 мл (см. Таблицу материалов). Запечатайте трубку термосварщиком.
- Центрифугируйте при давлении 100 000 x g в течение 2 ч 4 °C с использованием ультрацентрифуги (см. Таблицу материалов). Разрежьте быстрозащелкивающуюся пробирку центрифуги, удалите надосадочную жидкость и снова суспендируйте гранулу в 100 μл DPBS. Это экзосомное решение.
ПРИМЕЧАНИЕ: В процессе повторного взвешивания гранулы необходимо пипетировать и перемешивать стенку трубки не менее 200 раз с помощью пипетки.
2. Изготовление exo@MN
- Подготовка мастер-формы
- Постройте модель микроигл с матрицей 10 x 10 с помощью программного обеспечения CAD, с наконечниками конической формы со следующими параметрами: высота 1200 мкм, диаметр основания 400 мкм и шаг (расстояние между соседними микроиглами) 900 мкм.
- Используйте смолу HTL в качестве материала и напечатайте мастер-форму микроиглы с помощью 3D-принтера (см. Таблицу материалов).
- Погрузите мастер-форму в абсолютный этанол на 1 час, чтобы удалить смолу, прилипшую к поверхности.
- Подвергните форму воздействию ультрафиолета на 5 минут, чтобы она затвердела.
- Еще раз погрузите форму в абсолютный этанол на 1 ч, после чего высушите при 60 °C в сушильном шкафу в течение 1 ч. Мастер-форма готова.
- Подготовка производственной формы
- Смешайте компоненты А и В полидиметилсилоксана (ПДМС, см. Таблицу материалов) в соотношении 10:1. Хорошо перемешайте и вылейте смесь в мастер-форму.
- Поместите форму PDMS под давление 1 фунт на квадратный дюйм на 15 минут, чтобы удалить пузырьки воздуха из смеси PDMS.
- Отверждите пресс-форму PDMS при 60 °C в течение 2 часов, а затем очистите до получения производственной формы микроиглы.
- Перед использованием очистите производственную форму сверхчистой водой.
- Приготовление раствора
- Количественно оцените содержание белка в растворе экзосомы с помощью набора для анализа BCA (см. Таблицу материалов). Добавьте соответствующее количество DPBS для достижения концентрации 10 мкг/мкл для раствора экзосомы.
- Приготовьте раствор трегалозы 200 мг/мл (см. Таблицу материалов) с использованием DPBS в качестве растворителя. Помешивайте в течение 20 минут, чтобы обеспечить полное растворение.
- Приготовьте раствор гиалуроновой кислоты (ГК) в концентрации 200 мг/мл (ГК, см. Таблицу материалов) с использованием DPBS в качестве растворителя. Перемешайте в течение ночи, чтобы обеспечить полное растворение.
- Приготовьте раствор поливинилпирролидона 150 мг/мл (ПВП, см. Таблицу материалов) с использованием абсолютного этанола в качестве растворителя. Перемешайте в течение ночи, чтобы обеспечить полное растворение.
- Смешайте раствор экзосомы (10 мкг/мкл) и раствор трегалозы (200 мг/мл) в соотношении 1:1 по объему. Затем добавьте равный объем раствора гиалуроновой кислоты (200 мг/мл). Тщательно перемешайте до получения кончика раствора.
- Изготовление exo@MN
- Обрабатывайте поверхность пресс-формы PDMS с помощью плазменного очистителя (см. Таблицу материалов) в течение 30 с при низком уклоне для повышения ее гидрофильности.
- Добавьте 40 μл раствора наконечника в форму PDMS. Центрифугируйте при комнатной температуре (RT) и 3000 x g в течение 3 минут, чтобы жидкость заполнила слой иглы формы.
- Удалите лишнюю жидкость из формы и высушите при температуре RT в вакуумной сушильной печи (см. Таблицу материалов) в течение 1 суток.
- Добавьте 200 μл раствора ПВП в форму PDMS. Центрифугируйте 3000 x g в течение 3 минут при RT, чтобы жидкость заполнила подкладочный слой формы.
- Высушите форму по RT в сушильном шкафу в течение 1 суток, затем демолд до получения exo@MN заплатки.
ПРИМЕЧАНИЕ: Храните пластырь exo@MN в сушильном шкафу до тех пор, пока он не будет готов к использованию.
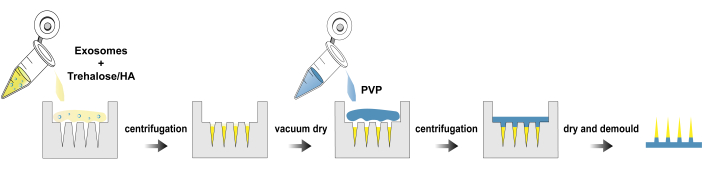
Рисунок 1: Процесс изготовления exo@MN патчей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Характеристика exo@MN патчей
- Наблюдение за морфологией
- Наклейте подложку пластыря на наклонную под углом 45° поверхность и поместите ее под стереомикроскоп (см. Таблицу материалов).
- Включите осветитель и зафиксируйте морфологию пятна с помощью объектива с 4-кратным увеличением.
- Сканирующая электронная микроскопия (СЭМ)
- Прикрепите пластырь к предметному столику с помощью проводящего клея и обработайте его автоматическим тонким покрытием (см. Таблицу материалов) в течение 30 секунд.
- Получение изображений exo@MN патча с помощью СЭМ (см. Таблицу материалов) с ускоряющим напряжением 1 кВ.
- Механические испытания
- Вырежьте из заплатки массив 3 х 3 и поместите его кончиками вверх на жесткую платформу измерителя натяжения (см. Таблицу материалов). Отрегулируйте высоту щупа так, чтобы он приблизился к кончикам игл, не касаясь их.
- Установите параметры на автоматическую остановку, когда давление достигнет 20 Н. Сожмите кончики игл вертикально со скоростью 0,5 мм/мин и запишите профиль зависимости нагрузки от смещения.
- Растворение
- Купите свежие свиные уши на рынке и нарежьте их на кусочки (5 см х 5 см х 0,3 см). Расстелите свиную шкуру на столе и с помощью бумаги высушите поверхностную влагу.
- Подготовьте четыре сухих пластыря с микроиглами кончиками игл вниз на коже свиньи, слегка раздвинув каждый пластырь. Большим и указательным пальцами вертикально надавите вниз на каждый пластырь с микроиглами. Снимайте по одному пластырю каждые 15 с.
- Немедленно поместите снятую заплатку в сушильную духовку и сушите в течение 5 минут. Отрежьте столбик наконечников микроигл, поместите их горизонтально под микроскоп (см. Таблицу материалов) и используйте объектив с 4-кратным увеличением, чтобы наблюдать за растворением наконечников.
4. Характеристика экзосом в exo@MN участке
ПРИМЕЧАНИЕ: Кончики микроигл exo@MN растворяют в 100 мкл раствора DPBS для выполнения следующей характеристики высвобождающихся экзосом.
- Просвечивающая электронная микроскопия (ПЭМ)
- Обработайте медную сетку (см. Таблицу материалов) гидрофильной обработкой с использованием ионного очистителя (см. Таблицу материалов) в течение 5 минут.
- Вынесите 10 мкл образца на углеродную сторону медной сетки. Дайте постоять 1 минуту, затем удалите жидкость, промокнув ее фильтровальной бумагой с краев.
- Добавьте в образец 10 мкл 3% уранилацетата (см. Таблицу материалов). Дайте постоять 10 с, затем удалите жидкость, промокнув фильтровальной бумагой с краев.
- Добавьте в образец 10 мкл 3% уранилацетата. Дайте постоять 1 минуту, затем удалите жидкость, промокнув ее фильтровальной бумагой с краев, и высушите на воздухе при RT.
- Получение изображений экзосом с помощью ПЭМ (см. таблицу материалов) с ускоряющим напряжением 80 кВ.
- Анализ отслеживания наночастиц (NTA)
- Разбавьте раствор экзосомы DPBS до достижения концентрации частиц 1 x 107 частиц/мл. Медленно введите 1 мл раствора экзосомы в камеру для образцов NTA с помощью шприца объемом 1 мл (см. Таблицу материалов).
- Установите тип стандартной операционной процедуры (СОП) прибора на EV-488, чтобы определить распределение экзосом по размерам.
- Вестерн-блоттинг (WB)
- Приготовьте буфер для лизиса, смешав буфер для лизиса методом радиоиммунопреципитации (RIPA): фенилметансульфонилфторид (см. Таблицу материалов) в соотношении 100:1. Лизируйте экзосомы на льду в течение 20 минут, совершая вихревые операции каждые 10 минут.
- Центрифугируйте раствор при 12 000 x g в течение 10 минут при 4 °C. Соберите надосадочную жидкость, чтобы измерить концентрацию белка.
- Добавьте 5x буфер загрузки SDS-PAGE (см. Таблицу материалов) к надосадочной жидкости в объемном соотношении 1 : 4 и хорошо перемешайте. Нагрейте до 100 °C в течение 10 минут, чтобы денатурировать белки.
- Добавьте 5 мкл предварительно окрашенного белкового маркера с массой 180 кДа (см. Таблицу материалов) и 10 г денатурированного образца в 4%-20% сборный гель (см. Таблицу материалов). Запустите систему электрофореза (см. Таблицу материалов) при напряжении 60 В в течение 10 минут, а затем при напряжении 140 В в течение 50 минут.
- Перенесите белки из геля на мембрану из ПВДФ (см. Таблицу материалов), предварительно активированную метанолом. Выполните систему электрофореза при давлении 290 мА в течение 90 мин на льду.
- Мембрану PVDF инкубировать в 5% растворе обезжиренного молока в течение 1 ч. Трижды промыть трис буферным солевым раствором с подростком (TBST, см. Таблицу материалов) в течение 5 минут каждый.
- Вырежьте целевые полосы в зависимости от положения белка. Инкубируйте полосы с антителом против мыши CD63 и антителом против мыши Alix (см. Таблицу материалов), разведенными до соответствующей концентрации в соответствии с инструкциями производителя, и инкубируйте в течение ночи при 4 °C.
- Промойте ленты три раза с TBST. Инкубировать с HRP-конъюгированным антикроличьим IgG (см. Таблицу материалов) при РТ в течение 1 ч. Затем снова трижды постирайте TBST.
- Нанесите реагент для обнаружения супер ECL (см. Таблицу материалов), чтобы покрыть поверхность полос, и немедленно экспонируйте и захватывайте полосы с помощью гелевого имиджера (см. Таблицу материалов).
- Конфокальная лазерная сканирующая микроскопия (CLSM)
- Обработайте 5 x 105 DC в конфокальной чашке, используя 2 мл среды Roswell Park Memorial Institute 1640 (RPMI 1640) (см. Таблицу материалов). Добавьте экзосомы или exo@MN и инкубируйте при 37 °C в течение 24 часов.
- Добавьте каплю Hoechst 33342 в каждую конфокальную чашку и выдерживайте в темноте при температуре 37 °C в течение 20 минут.
- Выполняйте визуализацию с помощью CLSM (см. Таблицу материалов) с использованием объектива с 60-кратным увеличением. Нанесите каплю иммерсионного масла (см. Таблицу материалов) на линзу и поставьте конфокальную тарелку на сцену. Отрегулируйте оси x/y/z, чтобы найти соответствующую фокальную плоскость ячеек.
- Запустите изображение с помощью каналов DAPI/TRITC/TD, выберите разрешение 1024 пикселя и установите быстрый режим на 1/8 с.
- Проточная цитометрия
- Культивируйте ДК в 6-луночном планшете, каждая лунка содержит 5 x 105 клеток и 2 мл среды 1640. Добавьте равные объемы раствора DPBS, экзосом, микроигл без экзосом и exo@MN соответственно и инкубируйте при 37 °C в течение 24 ч.
- Переложите среду из каждой лунки в центробежные трубки. Центрифугируйте при 300 x g в течение 3 минут при 4 °C и удалите надосадочную жидкость.
- Добавьте 0,5 мкл антитела FITC-CD11c, 2,5 мкл антитела APC-CD80 и 0,5 мкл антитела Pacific Blue I-A/I-E (см. Таблицу материалов) в 100 мкл 5% раствора БСА (см. Таблицу материалов). Хорошо перемешайте, ресуспензируйте ячейки и выдержите на шейкере во льду и в темноте в течение 20 минут.
- Добавьте 1 мл DPBS и центрифугируйте при 300 x g в течение 3 минут при 4 °C, затем удалите надосадочную жидкость. Повторите промывку дважды, чтобы удалить несвязанные антитела, а затем перейдите к анализу соответствующих флуоресцентных каналов с помощью проточной цитометрии (см. Таблицу материалов).
- Во-первых, на диаграмме рассеяния FSC-A/SSC-A зарегистрируйте основную популяцию клеток как P1. На диаграмме рассеяния SSC-A/SSC-H популяции клеток P1 затворите квадратную область P2 вдоль диагонали, чтобы удалить агрегированные ячейки.
- Выполнение флуоресцентного анализа популяции P2-клеток с использованием каналов FITC, APC и Pacific Blue. Установите условие стопа, чтобы собрать 10 000 ячеек в вентили P2.
5. Статистический анализ
- Выражайте количественные данные в виде средств ± стандартных отклонений (SD). Оценивайте статистическую значимость с помощью анализа t-критерия с помощью соответствующего программного обеспечения для анализа данных. Рассматривайте p-значения меньше 0,05 для указания статистической значимости. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
Результаты
Здесь мы представляем протокол выделения экзосом, изготовления и характеризации exo@MN патча. На рисунке 1 показана технологическая схема изготовления exo@MN патча. Экзосомы смешивали с трегалозой и ГК, а затем смесь добавляли в форму для микроигл и центрифугировали. Этот пр?...
Обсуждение
В настоящее время основными методами выделения экзосом являются ультрацентрифугирование, центрифугирование с градиентом плотности, ультрафильтрация, преципитация, иммуноаффинные магнитные шарики и микрофлюидика24. Из-за ограниченной нагрузочной способности микроигл, в...
Раскрытие информации
H.C., F.L.Q. и S.J.M являются изобретателями в патентной заявке, которая была подана на основе данных в этой рукописи. Х.К. является научным основателем компании Medcraft Biotech. Инк.
Благодарности
F.L.Q. благодарит за поддержку, оказанную Новаторской программой исследований и разработок провинции Чжэцзян (2022C03031), Национальной программой ключевых исследований и разработок Китая (2021YFA0910103), Национальным фондом естественных наук Китая (22274141, 22074080), Фондом естественных наук провинции Шаньдун (ZR2022ZD28) и Программой ученых Тайшань провинции Шаньдун (tsqn201909106). Х.К. выражает признательность за финансовую поддержку от Национального фонда естественных наук Китая (82202329). Авторы признают использование инструментов в Центре общего использования измерительных приборов в Институте медицины Ханчжоу (HIM) Китайской академии наук.
Материалы
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
Ссылки
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены