需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于加载和递送外泌体的微针贴片的制造和表征
摘要
外泌体具有显著的临床潜力, 但由于体内易 清除且稳定性差,其实际应用受到限制。微针提供了一种解决方案,通过刺穿生理屏障和干态保存来实现局部递送,从而解决了外泌体给药的局限性并扩大了其临床应用。
摘要
外泌体作为新兴的“下一代”生物治疗药物和药物递送载体,在从药物递送和再生医学到疾病诊断和肿瘤免疫治疗等多个生物医学领域具有巨大潜力。然而,传统推注的快速清除和外泌体的稳定性差限制了其临床应用。微针作为一种溶液,可延长外泌体在给药部位的停留时间,从而维持药物浓度并促进持续的治疗效果。此外,微针还具有维持生物活性物质稳定性的能力。因此,我们介绍了一种用于加载和递送外泌体的微针贴片,并分享了包括外泌体分离、制造和表征外泌体负载的微针贴片的方法。以海藻糖和透明质酸为尖端材料,聚乙烯吡咯烷酮为基材,通过两步铸造法制备微针贴片。微针表现出强大的机械强度,尖端能够承受 2 N。猪皮用于模拟人体皮肤,微针尖端在皮肤穿刺后 60 秒内完全熔化。从微针释放的外泌体表现出与新鲜外泌体相当的形态、粒径、标志蛋白和生物学功能,使树突状细胞能够摄取并促进其成熟。
引言
外泌体是细胞释放到细胞外基质中的小囊泡,已被提议作为治疗多种疾病和癌症的潜在生物治疗药物和药物递送载体1。在其生物发生过程中,外泌体封装了细胞内的各种生物活性分子,包括功能性蛋白和核酸2。因此,当外泌体在运输过程中被受体细胞吸收时,外泌体具有调节靶细胞中基因表达和细胞功能的能力3。作为一种天然信息信使,外泌体在组织再生、免疫调节和作为递送载体中得到了充分利用4。通过工程技术,可以在外泌体表面富集特异性配体,从而能够诱导或抑制受体细胞中的信号转导事件或靶向特定细胞类型5。化疗剂也可以加载到外泌体中用于癌症治疗6。此外,外泌体能够穿过血脑屏障进行治疗性货物递送,使其在治疗脑部疾病方面非常有前途7。与脂质体相比,外泌体表现出增强的细胞摄取和更好的生物相容性8。它们能够有效地进入其他细胞,同时表现出更好的耐受性和更低的毒性9。然而,传统的外泌体推注容易被血流中的肝脏、肾脏和脾脏隔离和快速清除10。此外,外泌体 在体外 稳定性差,易受储存条件的影响,这限制了它们的临床应用11。
微针是一系列微米大小的针尖,能够穿透生理屏障,以递送小分子药物12、蛋白质13、核酸14 和纳米药物15。微针经过精确设计,可针对皮肤表面的病变,其分散的尖端可确保药物在目标部位均匀分布,从而放大其治疗效果16。微针的设计和材料组成有助于蛋白质和核酸等生物活性物质的干储存,从而提高其稳定性17。传统的注射方法作用持续时间相对较短,会引起疼痛,使患者感到恐惧18。微米级的微针长度可最大限度地减少组织创伤并防止神经刺激,从而消除疼痛并提高患者的依从性19。此外,微针的用户友好性使患者无需专业人员即可自行进行治疗16。除了皮肤,微针还可用于眼睛20、口腔粘膜21、心脏22 和血管23 等组织。微针在外泌体临床递送中的应用提供了一种有前途且具有前瞻性的策略。
因此,我们介绍了一种加载外泌体的微针 (exo@MN) 贴片并公开了其制造方法。微针贴片采用两步铸造法制备,同时离心和真空干燥,促进外泌体在微针尖端聚集,从而提高递送效率。针尖和背衬均使用具有优异生物相容性和水溶性的材料制成。海藻糖和透明质酸 (HA) 作为尖端材料,为外泌体提供保护,选择溶解在无水乙醇中的聚乙烯吡咯烷酮 (PVP) 作为基材。使用显微镜和扫描电子显微镜 (SEM) 对微针贴片的形态进行了表征。使用拉伸仪评估微针的机械测试,以确认其穿透皮肤的能力,并在猪皮肤上的释放速率为 60 s。此外,使用透射电子显微镜 (TEM) 、纳米颗粒示踪分析 (NTA) 和蛋白质印迹 (WB) 对新鲜外泌体和exo@MN中外泌体的形态、大小和蛋白质含量进行了表征。使用共聚焦激光扫描显微镜 (CLSM) 表征树突状细胞 (DC) 对外泌体的内化,并通过流式细胞术评估 DC 的成熟。两种外泌体的形态学特征和生物学功能基本一致。
研究方案
这项研究不需要道德审查,因为用于第 3 节中描述的实验的猪皮是从市场上作为可食用的猪耳朵购买的,而不是来自实验动物。
1. 外泌体的分离
- 细胞培养
- 在直径为 15 cm 的培养皿中,在含有 10% 胎牛血清和 1% 青霉素 - 链霉素溶液 (100×) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 培养基中培养小鼠卵巢上皮癌细胞 ID8(参见 材料表)。
- 将 ID8 细胞在 CO2 培养箱(参见 材料表)中于 37 °C 和 5% CO2 孵育,直至细胞密度达到 90%。
- 外泌体的分离
- 从培养皿中取出培养基,并用 Dulbecco 磷酸盐缓冲盐水 (DPBS) 洗涤两次。加入 20 mL 不含胎牛血清的 DMEM(参见 材料表)和青霉素-链霉素溶液(参见 材料表)。在 37 °C 和 5% CO2 下继续孵育 48 小时。
- 从 20 个直径为 15 cm 的培养皿中收集细胞培养上清液。在 4 °C 下以 300 x g 离心 10 分钟,并收集上清液以去除游离细胞。
- 在 4°C 下以 2000 x g 离心 10 分钟,并收集上清液以去除细胞碎片。
- 将 0.22 μm 一次性真空过滤系统(参见 材料表)连接到循环水真空泵(参见 材料表)。产生真空,使上清液穿过 0.22 μm 聚醚砜膜并进入过滤系统的下腔室,从而有效地去除上清液中大于 0.22 μm 的囊泡或杂质。
- 要连接真空泵,请打开泵开关,然后将其连接到真空过滤系统的进气口。关闭时,先断开与泵的连接,然后关闭真空泵。此程序有助于防止真空泵回流和培养液污染。
- 将 15 mL 上清液添加到 100 kDa 超滤管的内管中(参见 材料表)。在 4 °C 下以 3500 x g 离心 10 分钟,然后从外管中取出液体。
注:将大于 100 kDa 的颗粒保留在内管膜上,而小于 100 kDa 的蛋白质将与溶液一起离心到外管中。外泌体大于 100 kDa,聚集在内管膜上。 - 重复上述步骤,直到液体的总体积在 5 mL 以内。从内管中收集液体并加入 1 mL DPBS。使用移液管在内管中反复移液,确保附着的外泌体重悬于 DPBS 中,然后收集它们。
- 在 4 °C 下以 10000 x g 离心 60 分钟,然后将上清液转移到 6 mL 快速吸附离心管中(参见 材料表)。用热封机密封管子。
- 使用超速离心机在 4°C 下以 100,000 x g 离心 2 小时(参见 材料表)。切开 quick-snap 离心管,去除上清液,然后将沉淀重悬于 100 μL DPBS 中。这是外泌体解决方案。
注意:在重悬沉淀的过程中,必须使用移液管移液管壁至少 200 次。
2. exo@MN的制造
- 母模的准备
- 使用 CAD 软件构建具有 10 x 10 阵列的微针模型,其锥形尖端具有以下参数:高度为 1200 μm,基部直径为 400 μm,间距(相邻微针之间的距离)为 900 μm。
- 使用 HTL 树脂作为材料,并使用 3D 打印机打印微针的母模(参见 材料表)。
- 将母模浸入无水乙醇中 1 小时,以去除粘附在表面的任何树脂。
- 将模具暴露在紫外线下 5 分钟以使其固化。
- 将模具再次浸入无水乙醇中 1 小时,然后在 60 °C 下在干燥箱中干燥 1 小时。母模已准备就绪。
- 生产模具的准备
- 以 10:1 的比例混合聚二甲基硅氧烷(PDMS,参见 材料表)的 A 和 B 组分。搅拌均匀,然后将混合物倒入母模中。
- 将 PDMS 模具置于 1 psi 的压力下 15 分钟,以去除 PDMS 混合物中的气泡。
- 将 PDMS 模具在 60 °C 下固化 2 h,然后脱模,得到微针的生产模具。
- 使用前用超纯水清洗生产模具。
- 溶液的制备
- 使用 BCA 测定试剂盒定量外泌体溶液的蛋白质含量(参见 材料表)。加入适量的 DPBS 以达到外泌体溶液的浓度为 10 μg/μL。
- 使用 DPBS 作为溶剂制备 200 mg/mL 海藻糖溶液(参见 材料表)。搅拌 20 分钟以确保完全溶解。
- 使用 DPBS 作为溶剂制备 200 mg/mL 透明质酸(HA,参见 材料表)的溶液。搅拌过夜以确保完全溶解。
- 使用无水乙醇作为溶剂,制备 150 mg/mL 聚乙烯吡咯烷酮(PVP,参见 材料表)的溶液。搅拌过夜以确保完全溶解。
- 将外泌体溶液 (10 μg/μL) 和海藻糖溶液 (200 mg/mL) 以 1:1 的体积比混合。然后,加入等体积的 HA 溶液 (200 mg/mL)。充分混合以获得吸头溶液。
- exo@MN的制造
- 使用等离子清洗剂(参见 材料表)以低等级加工 PDMS 模具的表面 30 秒,以增强其亲水性。
- 将 40 μL 吸头溶液添加到 PDMS 模具中。在室温 (RT) 和 3000 x g 下离心 3 分钟,以确保液体充满模具的针层。
- 去除模具中多余的液体,并在真空干燥箱中在 RT 下干燥 1 天(参见 材料表)。
- 向 PDMS 模具中加入 200 μL PVP 溶液。在 RT 下以 3000 x g 离心 3 分钟,以确保液体充满模具的背衬层。
- 将霉菌在干燥箱中室温干燥 1 天,然后脱模以获得exo@MN补丁。
注意:将 exo@MN 贴剂存放在烘箱中,直到准备好使用。
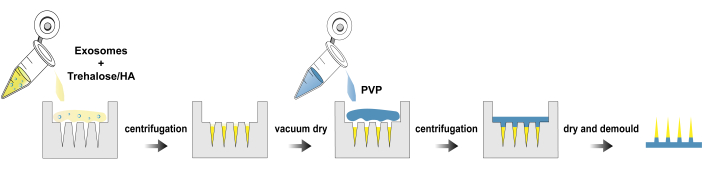
图 1:exo@MN 补丁的制造过程。请单击此处查看此图的较大版本。
3. exo@MN 补丁的表征
- 形态观察
- 将贴片的背衬粘贴到 45° 倾斜的表面上,并将其放置在立体显微镜下(参见 材料表)。
- 打开照明器并使用 4 倍物镜捕捉贴片的形态。
- 扫描电子显微镜 (SEM)
- 使用导电粘合剂将贴片贴在样品台上,并用自动精细涂布机(参见 材料表)处理 30 秒。
- 使用 SEM (参见 材料表) 以 1 kV 的加速电压捕获exo@MN片的图像。
- 机械测试
- 从贴片上切出一个 3 x 3 的阵列,并将其尖端朝上放置在拉伸计的刚性平台上(参见 材料表)。调整探头的高度,使其靠近针尖而不接触针尖。
- 将参数设置为在压力达到 20 N 时自动停止。以 0.5 mm/min 的速度垂直压缩针尖,并记录负载与位移曲线。
- 解散
- 从市面上购买新鲜的猪耳朵,切成小块(5 cm x 5 cm x 0.3 cm)。将猪皮铺在桌子上,用纸擦干表面水分。
- 准备四个干燥的微针贴片,针尖朝下贴在猪皮上,将每个贴片稍微分开。用拇指和食指垂直按下每个微针贴片。每 15 秒删除一个补丁。
- 立即将去除的贴片放入烘箱中干燥 5 分钟。切下一列微针尖端,将它们水平放置在显微镜下(参见 材料表),并使用 4 倍物镜观察尖端的溶解。
4. exo@MN 贴片中外泌体的表征
注:将 exo@MN 的微针尖端溶解在 100 μL DPBS 溶液中,以对释放的外泌体进行以下表征。
- 透射电子显微镜 (TEM)
- 使用离子清洁剂(参见材料表)对铜网(参见材料表)进行亲水处理 5 分钟。
- 将 10 μL 样品分配到铜网的碳侧。静置 1 分钟,然后用滤纸从边缘吸干液体,以去除液体。
- 向样品中加入 10 μL 3% 乙酸铀酰(参见 材料表)。静置 10 秒,然后用滤纸从边缘吸干以去除液体。
- 向样品中加入 10 μL 3% 乙酸铀酰。静置 1 分钟,然后用滤纸从边缘吸干液体,并在室温下风干,以去除液体。
- 使用 TEM(参见 材料表)以 80 kV 的加速电压捕获外泌体的图像。
- 纳米颗粒跟踪分析 (NTA)
- 用 DPBS 稀释外泌体溶液,使颗粒浓度达到 1 x 107 个颗粒/mL。使用 1 mL 注射器将 1 mL 外泌体溶液缓慢注入 NTA 的样品室(参见 材料表)。
- 将仪器的标准操作程序 (SOP) 类型设置为 EV-488 以检测外泌体的大小分布。
- 蛋白质印迹 (WB)
- 通过以 100:1 的比例混合放射免疫沉淀测定 (RIPA) 裂解缓冲液:苯基甲磺酰氟(参见 材料表)来制备裂解缓冲液。将外泌体在冰上裂解 20 分钟,每 10 分钟涡旋一次。
- 将溶液在 4 °C 下以 12,000 x g 离心 10 分钟。 收集上清液以测量蛋白质浓度。
- 将 5x SDS-PAGE 上样缓冲液(参见 材料表)以 1 : 4 的体积比例加入上清液中并充分混合。在 100 °C 下加热 10 分钟以使蛋白质变性。
- 将 5 μL 的 180 kDa 预染蛋白质标记物(参见 材料表)和 10 μg 变性样品添加到 4%-20% 的预制凝胶中(参见 材料表)。在 60 V 下运行电泳系统(参见 材料表)10 分钟,然后在 140 V 下运行 50 分钟。
- 将蛋白质从凝胶转移到用甲醇预活化的 PVDF 膜(参见 材料表)上。在冰上以 290 mA 进行电泳系统 90 分钟。
- 将 PVDF 膜在 5% 脱脂牛奶溶液中孵育 1 小时。用含吐温的 tris 缓冲盐水(TBST,参见 材料表)洗涤 3 次,每次 5 分钟。
- 根据蛋白质的位置切出目标条带。根据制造商的说明,将条带与稀释至适当浓度的抗小鼠CD63抗体和抗小鼠Alix抗体(参见 材料表)一起孵育,并在4°C下孵育过夜。
- 用 TBST 清洗带子 3 次。在 RT 下与 HRP 偶联的抗兔 IgG(参见 材料表)孵育 1 小时。然后,再次用 TBST 洗涤 3 次。
- 使用超级 ECL 检测试剂(参见 材料表)覆盖条带表面,并立即使用凝胶成像仪曝光和捕获条带(参见 材料表)。
- 共聚焦激光扫描显微镜 (CLSM)
- 使用 2 mL Roswell Park Memorial Institute 1640 (RPMI 1640) 培养基在共聚焦培养皿中培养 5 x 105 个 DC(参见 材料表)。加入外泌体或exo@MN,并在 37 °C 下孵育 24 小时。
- 向每个共聚焦皿中加入一滴Hoechst 33342,并在37°C的黑暗中孵育20分钟。
- 使用 60 倍物镜通过 CLSM(参见 材料表)进行成像。在镜头上滴一滴浸油(参见 材料表),然后将共聚焦皿放在载物台上。调整 x/y/z 轴以定位单元的适当焦平面。
- 使用 DAPI/TRITC/TD 通道启动成像,选择 1024 px 的分辨率,并将快速模式设置为 1/8 秒。
- 流式细胞术
- 在 6 孔板中培养 DC,每个孔包含 5 x 10个 5 个细胞和 2 mL 1640 培养基。分别加入等体积的 DPBS、外泌体、不含外泌体的微针和 exo@MN 溶液,并在 37 °C 下孵育 24 小时。
- 将培养基从每个孔转移到离心管中。在 4 °C 下以 300 x g 离心 3 分钟,然后去除上清液。
- 将 0.5 μL FITC-CD11c 抗体、2.5 μL APC-CD80 抗体和 0.5 μL Pacific Blue I-A/I-E 抗体(参见 材料表)添加到 100 μL 5% BSA 溶液中(参见 材料表)。充分混合,重悬细胞,并在摇床上在冰上和黑暗中孵育 20 分钟。
- 加入 1 mL DPBS 并在 4 °C 下以 300 x g 离心 3 分钟,然后去除上清液。重复洗涤两次以去除未结合的抗体,然后继续通过流式细胞术分析相应的荧光通道(参见 材料表)。
- 首先,在 FSC-A/SSC-A 散点图中,将主要细胞群设为 P1。在 P1 细胞群的 SSC-A/SSC-H 散点图中,沿对角线对方形 P2 区域进行门控以去除聚集的细胞。
- 使用 FITC、APC 和 Pacific Blue 通道对 P2 细胞群进行荧光分析。设置停止条件以在 P2 门中收集 10,000 个单元格。
5. 统计分析
- 将定量数据表示为标准差 (SD) ±平均值。使用适当的数据分析软件应用程序,通过 t 检验分析评估统计显著性。考虑小于 0.05 的 p 值以指示统计显著性。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。
结果
在这里,我们提出了一种用于分离外泌体、exo@MN 贴片的制造和表征的方案。 图 1 说明了制造exo@MN贴片的工艺流程图。将外泌体与海藻糖和 HA 混合,然后将混合物加入微针模具中并离心分离。这个过程促进了外泌体在针尖的聚集,促进了快速释放。干燥后,加入 PVP 溶液并离心以完全填充模具。完全干燥后,去除霉菌以获得exo@MN补丁。使用显微镜和 SEM 表征微针的形态,如图...
讨论
目前,分离外泌体的主要方法包括超速离心、密度梯度离心、超滤、沉淀、免疫亲和磁珠和微流控24。由于微针尖端空间小导致负载能力有限,因此需要增加外泌体的浓度以加载更多。因此,我们选择超滤浓缩细胞培养上清液,然后用超速离心分离外泌体。通过少量液体重悬来增加外泌体的浓度,以便微针可以加载数十至数百微克的外泌体。然而,这种方法导致分离的外泌体溶?...
披露声明
H. C.、F.L.Q 和 SJM 是根据本手稿中的数据提交的专利申请的发明人。H.C. 是 Medcraft Biotech 的科学创始人。公司。
致谢
F.L.Q. 感谢浙江省先锋研发计划(2022C03031)、国家重点研发计划(2021YFA0910103)、国家自然科学基金(22274141,22074080)、山东省自然科学基金(ZR2022ZD28)和山东省泰山学者计划(tsqn201909106)的支持。H.C. 感谢中国国家自然科学基金 (82202329) 的财政支持。作者承认了中国科学院杭州医学研究所 (HIM) 共享仪器核心设施的仪器使用情况。
材料
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
参考文献
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。