Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Eksozomların yüklenmesi ve teslimi için mikroiğne yamalarının üretimi ve karakterizasyonu
Bu Makalede
Özet
Eksozomlar önemli klinik potansiyele sahiptir, ancak kolay in vivo klerens ve zayıf stabilite nedeniyle pratik uygulamaları sınırlıdır. Mikroiğneler, fizyolojik engelleri delerek ve kuru halde koruma sağlayarak lokalize uygulamayı mümkün kılarak, böylece eksozom uygulamasının sınırlamalarını ele alarak ve klinik faydalarını genişleterek bir çözüm sunar.
Özet
Ortaya çıkan "yeni nesil" biyoterapötikler ve ilaç dağıtım vektörleri olarak eksozomlar, ilaç dağıtımı ve rejeneratif tıptan hastalık teşhisi ve tümör immünoterapisine kadar çeşitli biyomedikal alanlarda muazzam bir potansiyele sahiptir. Bununla birlikte, geleneksel bolus enjeksiyonu ile hızlı klerens ve eksozomların zayıf stabilitesi, klinik uygulamalarını kısıtlamaktadır. Mikroiğneler, eksozomların uygulama bölgesinde kalma süresini uzatan, böylece ilaç konsantrasyonunu koruyan ve sürekli terapötik etkileri kolaylaştıran bir çözelti görevi görür. Ek olarak, mikroiğneler ayrıca biyoaktif maddelerin stabilitesini koruma yeteneğine de sahiptir. Bu nedenle, eksozomların yüklenmesi ve iletilmesi için bir mikroiğne yaması sunuyoruz ve eksozomların izolasyonu, eksozom yüklü mikroiğne yamalarının üretimi ve karakterizasyonu dahil olmak üzere yöntemleri paylaşıyoruz. Mikroiğne yamaları, uç malzemeleri olarak trehaloz ve hyaluronik asit ve destek malzemesi olarak polivinilpirolidon kullanılarak iki aşamalı bir döküm yöntemi ile üretildi. Mikroiğneler, insan derisini simüle etmek için 2 N. Domuz derisine dayanabilen uçlarla sağlam mekanik mukavemet gösterdi ve mikroiğnelerin uçları cilt delinmesinden sonra 60 saniye içinde tamamen eridi. Mikroiğnelerden salınan eksozomlar, morfoloji, partikül boyutu, işaretleyici proteinler ve taze eksozomlarınkiyle karşılaştırılabilir biyolojik işlevler sergiledi, bu da dendritik hücrelerin alımını sağladı ve olgunlaşmalarını teşvik etti.
Giriş
Hücreler tarafından hücre dışı matrise salınan küçük veziküller olan eksozomlar, çeşitli hastalıkların ve kanserlerin tedavisi için potansiyel biyoterapötikler ve ilaç dağıtım vektörleri olarak önerilmiştir1. Biyogenez süreçleri sırasında eksozomlar, fonksiyonel proteinler ve nükleik asitler2 dahil olmak üzere hücrelerin içinden çeşitli biyolojik olarak aktif molekülleri kapsüller. Sonuç olarak, taşıma işlemi sırasında alıcı hücreler tarafından alındığında, eksozomlar hedef hücrelerde gen ekspresyonunu ve hücresel fonksiyonları modüle etme yeteneğine sahiptir3. Bir tür doğal bilgi habercisi olarak, eksozomlar doku yenilenmesinde, bağışıklık regülasyonunda ve bir dağıtım taşıyıcısı olarak tam olarak kullanılmıştır4. Mühendislik teknikleri sayesinde, eksozomların yüzeyinde spesifik ligandlar zenginleştirilebilir, bu da alıcı hücrelerde sinyal olaylarının indüksiyonunu veya inhibisyonunu mümkün kılarveya belirli hücre tiplerini hedefler5. Kemoterapötik ajanlar ayrıca kanser tedavisi için eksozomlara da yüklenebilir6. Ayrıca, eksozomlar, terapötik kargo teslimatı için kan-beyin bariyerini geçme yeteneğine sahiptir ve bu da onları beyin bozukluklarının tedavisi için oldukça umut verici hale getirir7. Lipozomlarla karşılaştırıldığında, eksozomlar gelişmiş hücresel alım ve gelişmiş biyouyumluluk sergiler8. Daha iyi tolerans ve daha düşük toksisite gösterirken diğer hücrelere verimli bir şekilde girebilirler9. Bununla birlikte, eksozomların geleneksel bolus enjeksiyonu, kan dolaşımındaki karaciğer, böbrekler ve dalak tarafından sekestrasyona ve hızlı temizlemeye eğilimlidir10. Ayrıca, eksozomlar in vitro olarak zayıf stabiliteye sahiptir ve klinik uygulamalarını kısıtlayan depolama koşullarına karşı hassastır11.
Bir dizi mikrometrik boyutlu iğne ucu olan mikroiğneler, küçük moleküllü ilaçların12, proteinlerin13, nükleik asitlerin14 ve nanoilaçların15 verilmesi için fizyolojik engellere nüfuz etme yeteneğine sahiptir. Mikroiğneler, cilt yüzeyindeki lezyonları hedeflemek için hassas bir şekilde tasarlanmıştır ve dağınık uçları, hedeflenen bölgede homojen ilaç dağılımı sağlar, böylece terapötik etkilerini artırır16. Mikroiğnelerin tasarımı ve malzeme bileşimi, proteinler ve nükleik asitler gibi biyoaktif maddelerin kuru depolanmasını kolaylaştırarak stabilitelerini arttırır17. Geleneksel enjeksiyon yöntemleri nispeten kısa bir etki süresine sahiptir ve ağrıya neden olarak hastalarda korkuya neden olabilir18. Mikrometre boyutundaki mikroiğne uzunluğu, doku travmasını en aza indirir ve sinir uyarımını önler, böylece ağrıyı ortadan kaldırır ve hasta uyumunu artırır19. Ek olarak, mikroiğnelerin kullanıcı dostu yapısı, hastaların uzman personele ihtiyaç duymadan tedaviyi kendi kendilerine uygulamalarına olanak tanır16. Mikroiğneler cildin yanı sıra gözler20, ağız mukozası21, kalp22 ve kan damarları23 gibi dokularda da kullanılabilir. Eksozomların klinik olarak verilmesi için mikroiğnelerin uygulanması umut verici ve ileriye dönük bir strateji sağlar.
Bu nedenle, eksozom yüklü bir mikroiğne (exo@MN) yaması tanıtıyoruz ve üretim yöntemini açıklıyoruz. Mikroiğne yamaları, mikroiğne uçlarında eksozomların toplanmasını teşvik eden ve böylece dağıtım verimliliğini artıran santrifüjleme ve vakumlu kurutma ile birlikte iki aşamalı bir döküm yöntemi kullanılarak üretildi. Hem iğne uçları hem de destek, mükemmel biyouyumluluk ve suda çözünürlük sergileyen malzemeler kullanılarak yapılmıştır. Eksozomlar için koruma sağlamak için trehaloz ve hyaluronik asit (HA) uç materyaller olarak dahil edildi ve destek materyali olarak mutlak etanol içinde çözünen polivinilpirolidon (PVP) seçildi. Mikroiğne yamasının morfolojisi, mikroskopi ve taramalı elektron mikroskobu (SEM) kullanılarak karakterize edildi. Mikroiğnenin mekanik testi, cilde nüfuz etme yeteneklerini doğrulamak için bir gerilme ölçer kullanılarak değerlendirildi ve domuz derisi üzerindeki salım hızının 60 s olduğu araştırıldı. Ayrıca, exo@MN'daki hem taze eksozomların hem de eksozomların morfolojisi, boyutu ve protein içeriği, transmisyon elektron mikroskobu (TEM), nanopartikül izleme analizi (NTA) ve western blotting (WB) kullanılarak karakterize edildi. Eksozomların dendritik hücreler (DC'ler) tarafından içselleştirilmesi, konfokal lazer tarama mikroskobu (CLSM) kullanılarak karakterize edildi ve DC'lerin olgunlaşması akış sitometrisi ile değerlendirildi. İki tür eksozomun morfolojik karakterizasyonu ve biyolojik işlevleri esasen tutarlıdır.
Protokol
Bölüm 3'te açıklanan deneyler için kullanılan domuz derisi, deney hayvanlarından elde edilmediği için piyasadan yenilebilir domuz kulakları olarak satın alındığından, bu çalışma etik izin gerektirmez.
1. Eksozomların izolasyonu
- Hücre kültürü
- %10 fetal sığır serumu ve %1 penisilin-streptomisin solüsyonu (100×) içeren Dulbecco'nun Modifiye Eagle Medium (DMEM) kültür ortamında fare yumurtalık epitel kanseri hücreleri ID8'i yetiştirin (bkz. Malzeme Tablosu) 15 cm çapında Petri kaplarında.
- ID8 hücrelerini bir CO2 inkübatöründe ( Malzeme Tablosuna bakınız) 37 ° C'de ve% 5 CO2'de hücre yoğunluğu %90'a ulaşana kadar inkübe edin.
- Eksozomların izolasyonu
- Kültür ortamını Petri kaplarından çıkarın ve Dulbecco'nun fosfat tamponlu salini (DPBS) ile iki kez yıkayın. Fetal sığır serumu ( Materyal Tablosuna bakınız) ve penisilin-streptomisin çözeltisi ( Materyal Tablosuna bakınız) olmadan 20 mL DMEM ekleyin. İnkübasyona 37 °C ve %5 CO2'de 48 saat devam edin.
- Hücre kültürü süpernatantını 15 cm çapında 20 Petri kabından toplayın. 4 ° C'de 10 dakika boyunca 300 x g'da santrifüjleyin ve serbest hücreleri çıkarmak için süpernatanı toplayın.
- 10 dakika 4 °C boyunca 2000 x g'da santrifüjleyin ve hücresel kalıntıları gidermek için süpernatanı toplayın.
- 0.22 μm tek kullanımlık vakum filtreleme sistemini (Malzeme Tablosuna bakın) sirkülasyonlu su vakum pompasına bağlayın (Malzeme Tablosuna bakın). Süpernatantın 0.22 μm polieter sülfon membranından geçmesine ve filtrasyon sisteminin alt odasına girmesine izin vermek için bir vakum oluşturun, süpernatanttan 0.22 μm'den daha büyük vezikülleri veya safsızlıkları etkili bir şekilde giderin.
- Vakum pompasını bağlamak için pompa anahtarını açın ve ardından vakum filtreleme sisteminin hava girişine bağlayın. Kapatırken, önce pompa ile olan bağlantıyı kesin ve ardından vakum pompasını kapatın. Bu prosedür, vakum pompasının geri akışını ve kültür sıvısının kirlenmesini önlemeye yardımcı olur.
- 100 kDa'lık ultrafiltrasyon tüpünün iç borusuna 15 mL süpernatan ekleyin ( Malzeme Tablosuna bakınız). 3500 ° C'de 10 dakika boyunca 4 x g'da santrifüjleyin ve sıvıyı dış tüpten çıkarın.
NOT: 100 kDa'dan küçük proteinler çözelti ile birlikte dış tüpe santrifüjlenirken, iç tüp zarında 100 kDa'dan büyük partikülleri tutun. Eksozomlar 100 kDa'dan daha büyüktü ve iç tüp zarı üzerinde toplandı. - Sıvının toplam hacmi 5 mL içinde olana kadar yukarıdaki adımları tekrarlayın. Sıvıyı iç tüpten toplayın ve 1 mL DPBS ekleyin. İç tüpe tekrar tekrar pipetlemek için bir pipet kullanın, DPBS'de bağlı eksozomların yeniden süspansiyonunu sağlayın ve ardından bunları toplayın.
- 4 ° C'de 60 dakika boyunca 10000 x g'da santrifüjleyin ve süpernatanı 6 mL'lik hızlı yapışan bir santrifüj tüpüne aktarın (Malzeme Tablosuna bakınız). Tüpü bir ısı mühürleyici ile kapatın.
- Bir ultrasantrifüj kullanarak 2 saat 4 ° C'de 100.000 x g'da santrifüjleyin (bkz. Hızlı çıtçıtlı santrifüj tüpünü kesin, süpernatanı çıkarın ve peleti 100 μL DPBS'de yeniden süspanse edin. Bu eksozom çözeltisidir.
NOT: Peletin yeniden süspanse edilmesi işlemi sırasında, tüp duvarını bir pipet kullanarak en az 200 kez pipetlemek ve çalkalamak gerekir.
2. exo@MN imalatı
- Ana kalıbın hazırlanması
- CAD yazılımını kullanarak 10 x 10 dizili, aşağıdaki parametrelere sahip konik şekilli uçlara sahip bir mikro iğne modeli oluşturun: 1200 μm yükseklik, 400 μm taban çapı ve 900 μm'lik bir aralık (bitişik mikro iğneler arasındaki mesafe).
- Malzeme olarak HTL reçinesini kullanın ve bir 3D yazıcı kullanarak mikroiğnenin ana kalıbını yazdırın (Malzeme Tablosuna bakınız).
- Yüzeye yapışan reçineyi çıkarmak için ana kalıbı 1 saat boyunca mutlak etanole batırın.
- Kürlenmesi için kalıbı 5 dakika ultraviyole ışığa maruz bırakın.
- Kalıbı bir kez daha 1 saat mutlak etanole batırın, ardından 60 °C'de 1 saat kurutma fırınında kurutun. Ana kalıp hazır.
- Üretim kalıbının hazırlanması
- Polidimetilsiloksanın A ve B bileşenlerini (PDMS, Malzeme Tablosuna bakınız) 10:1 oranında karıştırın. İyice karıştırın ve karışımı bir ana kalıba dökün.
- PDMS karışımından hava kabarcıklarını çıkarmak için PDMS kalıbını 15 dakika boyunca 1 psi basınç altına yerleştirin.
- PDMS kalıbını 60 °C'de 2 saat sertleştirin ve ardından mikroiğnenin üretim kalıbını elde etmek için kalıptan çıkarın.
- Kullanmadan önce üretim kalıbını ultra saf su ile temizleyin.
- Çözeltinin hazırlanması
- Bir BCA test kiti kullanarak eksozom çözeltisinin protein içeriğini ölçün (bkz . Malzeme Tablosu). Eksozom çözeltisi için 10 μg/μL'lik bir konsantrasyon elde etmek için uygun miktarda DPBS ekleyin.
- Çözücü olarak DPBS kullanarak 200 mg / mL trehalozlu bir çözelti hazırlayın ( Malzeme Tablosuna bakınız). Tam çözünmeyi sağlamak için 20 dakika karıştırın.
- Çözücü olarak DPBS kullanarak 200 mg / mL hyaluronik asit (HA, Malzeme Tablosuna bakınız) çözeltisi hazırlayın. Tam çözünmeyi sağlamak için gece boyunca karıştırın.
- Çözücü olarak mutlak etanol kullanarak 150 mg / mL polivinilpirolidon (PVP, Malzeme Tablosuna bakınız) çözeltisi hazırlayın. Tam çözünmeyi sağlamak için gece boyunca karıştırın.
- Eksozom çözeltisini (10 μg / μL) ve trehaloz çözeltisini (200 mg / mL) 1: 1 hacim oranında karıştırın. Ardından, eşit miktarda HA çözeltisi (200 mg / mL) ekleyin. Uç çözeltisini elde etmek için iyice karıştırın.
- exo@MN imalatı
- PDMS kalıbının yüzeyini, hidrofilikliğini arttırmak için bir plazma temizleyici (Malzeme Tablosuna bakınız) kullanarak 30 saniye boyunca düşük bir kalitede işleyin.
- PDMS kalıbına 40 μL uç çözeltisi ekleyin. Sıvının kalıbın iğne tabakasını doldurduğundan emin olmak için oda sıcaklığında (RT) ve 3000 x g'da 3 dakika santrifüjleyin.
- Kalıptaki fazla sıvıyı çıkarın ve RT'de vakumlu kurutma fırınında ( Malzeme Tablosuna bakınız) 1 gün kurutun.
- PDMS kalıbına 200 μL PVP çözeltisi ekleyin. Sıvının kalıbın destek tabakasını doldurduğundan emin olmak için RT'de 3 dakika boyunca 3000 x g santrifüjleyin.
- Kalıbı RT'de 1 gün boyunca bir kurutma fırınında kurutun, ardından exo@MN yamayı elde etmek için kalıptan çıkarın.
NOT: exo@MN yamasını kullanıma hazır olana kadar kurutma fırınında saklayın.
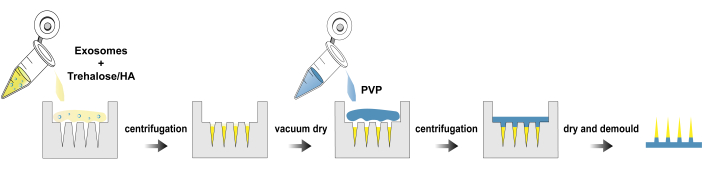
Şekil 1: exo@MN yamalarının üretim süreci. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. exo@MN yamalarının karakterizasyonu
- Morfolojinin gözlemlenmesi
- Yamanın arkasını 45° eğimli bir yüzeye yapıştırın ve stereo mikroskop altına yerleştirin (bkz. Malzeme Tablosu).
- Aydınlatıcıyı açın ve 4x objektif kullanarak yamanın morfolojisini yakalayın.
- Taramalı elektron mikroskobu (SEM)
- Yamayı iletken yapıştırıcı kullanarak numune aşamasına yapıştırın ve 30 saniye boyunca otomatik ince kaplayıcı ( Malzeme Tablosuna bakın) ile işlemden geçirin.
- 1 kV'luk bir hızlanma gerilimi ile SEM ( Malzeme Tablosuna bakın) kullanarak exo@MN yamanın görüntülerini yakalayın.
- Mekanik test
- Yamadan 3 x 3'lük bir dizi kesin ve uçları yukarı bakacak şekilde bir çekme ölçerin rijit platformuna yerleştirin (bkz. Malzeme Tablosu). Probun yüksekliğini, iğne uçlarına dokunmadan yaklaştırmak için ayarlayın.
- Parametreleri, basınç otomatik olarak 20 N'ye ulaştığında duracak şekilde ayarlayın. İğne uçlarını 0,5 mm/dak hızında dikey olarak sıkıştırın ve yüke karşı yer değiştirme profilini kaydedin.
- Dağılma
- Piyasadan taze domuz kulakları satın alın ve parçalara ayırın (5 cm x 5 cm x 0,3 cm). Domuz derisini bir masanın üzerine yayın ve yüzey nemini kurutmak için kağıt kullanın.
- İğne uçları domuz derisine bakacak şekilde dört kuru mikro iğne yaması hazırlayın ve her bir yamayı hafifçe aralıklı hale getirin. Başparmak ve işaret parmaklarını kullanarak, her bir mikroiğne yamasına dikey olarak bastırın. Her 15 saniyede bir yama çıkarın.
- Çıkarılan yamayı hemen bir kurutma fırınına koyun ve 5 dakika kurutun. Mikroiğne uçlarından oluşan bir sütunu kesin, bunları bir mikroskop altında yatay olarak yerleştirin ( Malzeme Tablosuna bakın) ve uçların çözünmesini gözlemlemek için 4x objektif lens kullanın.
4. exo@MN yamadaki eksozomların karakterizasyonu
NOT: exo@MN'nin mikroiğne uçları, salınan eksozomlar üzerinde aşağıdaki karakterizasyonu gerçekleştirmek için 100 μL DPBS çözeltisi içinde çözülür.
- Transmisyon elektron mikroskobu (TEM)
- Bakır ağa (Malzeme Tablosuna bakınız) 5 dakika boyunca bir iyon temizleyici (Malzeme Tablosuna bakınız) kullanarak hidrofilik bir işlemle muamele edin.
- Numunenin 10 μL'sini bakır ağın karbon tarafına dağıtın. 1 dakika bekletin, ardından sıvıyı kenarlarından filtre kağıdı ile kurulayarak çıkarın.
- Numuneye 10 μL %3 uranil asetat ( Malzeme Tablosuna bakınız) ekleyin. 10 saniye bekletin, ardından sıvıyı kenarlarından filtre kağıdı ile kurulayarak çıkarın.
- Numuneye 10 μL %3 uranil asetat ekleyin. 1 dakika bekletin, ardından sıvıyı kenarlarından filtre kağıdı ile kurutarak çıkarın ve RT'de havayla kurutun.
- 80 kV'luk bir hızlanma gerilimi ile TEM ( Malzeme Tablosuna bakınız) kullanarak eksozomların görüntülerini yakalayın.
- Nanopartikül izleme analizi (NTA)
- 1 x 107 partikül / mL'lik bir partikül konsantrasyonu elde etmek için eksozom çözeltisini DPBS ile seyreltin. 1 mL şırınga kullanarak NTA'nın numune odasına 1 mL eksozom solüsyonunu yavaşça enjekte edin (bkz. Malzeme Tablosu).
- Eksozomların boyut dağılımını tespit etmek için cihazın standart çalıştırma prosedürü (SOP) tipini EV-488 olarak ayarlayın.
- Batı lekeleme (WB)
- Radyoimmünopresipitasyon tahlili (RIPA) lizis tamponu: fenilmetansülfonil florür (Malzeme Tablosuna bakınız) 100:1 oranında karıştırarak lizis tamponunu hazırlayın. Eksozomları 20 dakika boyunca buz üzerinde parçalayın, her 10 dakikada bir girdap yapın.
- Çözeltiyi 12.000 x g'da 4 ° C'de 10 dakika santrifüjleyin. Protein konsantrasyonunu ölçmek için süpernatanı toplayın.
- Süpernajanta 1: 4 hacim oranında 5x SDS-PAGE yükleme tamponu ( Malzeme Tablosuna bakınız) ekleyin ve iyice karıştırın. Proteinleri denatüre etmek için 100 °C'de 10 dakika ısıtın.
- %4-20'lik bir prekast jele 5 μL 180 μL önceden boyanmış protein markörü (Malzeme Tablosuna bakınız) ve 10 μg denatüre numune ekleyin (bkz. Malzeme Tablosu). Elektroforez sistemini ( Malzeme Tablosuna bakınız) 60 V'ta 10 dakika ve ardından 140 V'ta 50 dakika çalıştırın.
- Proteinleri jelden metanol ile önceden aktive edilmiş bir PVDF membranına ( Malzeme Tablosuna bakınız) aktarın. Elektroforez sistemini buz üzerinde 90 dakika boyunca 290 mA'da gerçekleştirin.
- PVDF membranını %5 yağsız süt çözeltisinde 1 saat inkübe edin. Her biri 5 dakika boyunca ara (TBST, Malzeme Tablosuna bakınız) tris tamponlu tuzlu su ile üç kez yıkayın.
- Proteinin konumuna göre hedef bantları kesin. Bantları, üreticinin talimatlarına göre uygun konsantrasyona seyreltilmiş anti-fare CD63 antikoru ve anti-fare Alix antikoru ( Malzeme Tablosuna bakınız) ile inkübe edin ve gece boyunca 4 °C'de inkübe edin.
- Bantları TBST ile üç kez yıkayın. HRP ile konjuge anti-tavşan IgG (Malzeme Tablosuna bakınız) ile RT'de 1 saat inkübe edin. Daha sonra tekrar TBST ile üç kez yıkayın.
- Bantların yüzeyini kaplamak için bir süper ECL algılama reaktifi uygulayın ( Malzeme Tablosuna bakın) ve bir jel görüntüleyici kullanarak bantları hemen açığa çıkarın ve yakalayın (Malzeme Tablosuna bakın).
- Konfokal lazer tarama mikroskobu (CLSM)
- 2 mL Roswell Park Memorial Institute 1640 (RPMI 1640) ortamı kullanarak konfokal bir tabakta 5 x10 5 DC yetiştirin (Malzeme Tablosuna bakınız). Eksozom veya exo@MN ekleyin ve 37 °C'de 24 saat inkübe edin.
- Her bir konfokal kaba bir damla Hoechst 33342 ekleyin ve karanlıkta 37 ° C'de 20 dakika inkübe edin.
- 60x objektif lens kullanarak bir CLSM ( Malzeme Tablosuna bakın) ile görüntüleme gerçekleştirin. Lensin üzerine bir damla daldırma yağı uygulayın ( Malzeme Tablosuna bakın) ve konfokal çanağı sahneye yerleştirin. Hücrelerin uygun odak düzlemini bulmak için x/y/z eksenlerini ayarlayın.
- DAPI/TRITC/TD kanallarıyla görüntülemeyi başlatın, 1024 piksellik bir çözünürlük seçin ve hızlı modu 1/8 s'ye ayarlayın.
- Akış sitometrisi
- DC'leri, her biri 5 x 105 hücre ve 2 mL 1640 ortam içeren 6 oyuklu bir plakada yetiştirin. Sırasıyla eşit hacimlerde DPBS, eksozomlar, eksozomsuz mikroiğneler ve exo@MN çözeltisi ekleyin ve 37 ° C'de 24 saat inkübe edin.
- Ortamı her kuyudan santrifüj tüplere aktarın. 300 ° C'de 3 dakika boyunca 4 x g'da santrifüjleyin ve süpernatanı çıkarın.
- 100 μL %5 BSA çözeltisine 0.5 μL FITC-CD11c antikoru, 2.5 μL APC-CD80 antikoru ve 0.5 μL Pasifik Mavisi I-A/I-E antikoru (Malzeme Tablosuna bakınız) ekleyin (Malzeme Tablosuna bakınız). İyice karıştırın, hücreleri yeniden süspanse edin ve buzda ve karanlıkta 20 dakika boyunca bir çalkalayıcı üzerinde inkübe edin.
- 1 mL DPBS ekleyin ve 300 °C'de 3 dakika boyunca 4 x g'da santrifüjleyin, ardından süpernatanı çıkarın. Bağlanmamış antikorları çıkarmak için yıkamayı iki kez tekrarlayın ve ardından akış sitometrisi yoluyla karşılık gelen floresan kanallarını analiz etmeye devam edin (bkz. Malzeme Tablosu).
- İlk olarak, FSC-A/SSC-A saçılma grafiğinde, ana hücre popülasyonunu P1 olarak geçitleyin. P1 hücre popülasyonunun SSC-A/SSC-H dağılım grafiğinde, toplanmış hücreleri çıkarmak için köşegen boyunca kare bir P2 bölgesi geçirin.
- FITC, APC ve Pacific Blue kanallarını kullanarak P2 hücre popülasyonu üzerinde floresan analizi yapın. P2 kapısında 10.000 hücre toplamak için durdurma koşulunu ayarlayın.
5. İstatistiksel analiz
- Nicel verileri standart sapmalar (SD) ± ortalamalar olarak ifade edin. Uygun bir veri analizi yazılımı uygulaması kullanarak t-testi analizini kullanarak istatistiksel anlamlılığı değerlendirin. İstatistiksel anlamlılığı belirtmek için 0,05'ten küçük p değerlerini göz önünde bulundurun. *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001.
Sonuçlar
Burada, eksozomların izolasyonu, exo@MN yamanın üretimi ve karakterizasyonu için bir protokol sunuyoruz. Şekil 1 , exo@MN yamanın üretimi için süreç akış şemasını göstermektedir. Eksozomlar trehaloz ve HA ile karıştırıldı ve karışım daha sonra mikroiğne kalıbına eklendi ve santrifüjlendi. Bu işlem, eksozomların iğne uçlarında toplanmasını kolaylaştırarak hızlı salınımı teşvik etti. Kuruduktan sonra, PVP çözeltisi ilave edildi ve kalıbı tamamen d...
Tartışmalar
Şu anda, eksozomları izole etmek için ana yöntemler arasında ultrasantrifüjleme, yoğunluk gradyanlı santrifüjleme, ultrafiltrasyon, çökeltme, immünoaffinite manyetik boncuklar ve mikroakışkanlar24 bulunmaktadır. Küçük iğne ucu boşluklarının neden olduğu mikro iğnelerin sınırlı yükleme kapasitesi nedeniyle, daha fazla yükleme yapmak için eksozom konsantrasyonunu artırmak gerekir. Bu nedenle, hücre kültürü süpernatantını konsantre etmek için ultrafiltrasyonu se...
Açıklamalar
H. C., F.L.Q ve S.J.M, bu el yazmasındaki verilere dayanarak yapılan bir patent başvurusunun mucitleridir. HC, Medcraft Biotech'in bilimsel kurucusudur. Inc.
Teşekkürler
FLQ, Zhejiang Öncü Ar-Ge Programı (2022C03031), Çin Ulusal Anahtar Araştırma ve Geliştirme Programı (2021YFA0910103), Çin Ulusal Doğa Bilimleri Vakfı (22274141, 22074080), Shandong Eyaleti Doğa Bilimleri Vakfı (ZR2022ZD28) ve Shandong Eyaleti Taishan Burs Programı (tsqn201909106) tarafından desteklenen desteği takdir etmektedir. HC, Çin Ulusal Doğa Bilimleri Vakfı'nın (82202329) mali desteğini kabul eder. Yazarlar, Çin Bilimler Akademisi, Hangzhou Tıp Enstitüsü'ndeki (HIM) Paylaşılan Enstrümantasyon Çekirdek Tesisinde cihazların kullanımını kabul etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
Referanslar
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır