Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fabrication et caractérisation de patchs de micro-aiguilles pour le chargement et l’administration d’exosomes
Dans cet article
Résumé
Les exosomes possèdent un potentiel clinique important, mais leur application pratique est limitée en raison de la facilité d’élimination in vivo et de la faible stabilité. Les micro-aiguilles présentent une solution en permettant une administration localisée en perforant les barrières physiologiques et la conservation à l’état sec, remédiant ainsi aux limites de l’administration d’exosomes et élargissant leur utilité clinique.
Résumé
Les exosomes, en tant que biothérapies émergentes de « nouvelle génération » et vecteurs d’administration de médicaments, recèlent un immense potentiel dans divers domaines biomédicaux, allant de l’administration de médicaments et de la médecine régénérative au diagnostic des maladies et à l’immunothérapie tumorale. Cependant, la clairance rapide par injection traditionnelle en bolus et la faible stabilité des exosomes limitent leur application clinique. Les micro-aiguilles servent de solution qui prolonge le temps de séjour des exosomes sur le site d’administration, maintenant ainsi la concentration du médicament et facilitant les effets thérapeutiques durables. De plus, les micro-aiguilles possèdent également la capacité de maintenir la stabilité des substances bioactives. Par conséquent, nous introduisons un patch de micro-aiguilles pour le chargement et l’administration d’exosomes et partageons les méthodes, y compris l’isolement des exosomes, la fabrication et la caractérisation des patchs de micro-aiguilles chargés d’exosomes. Les patchs à micro-aiguilles ont été fabriqués en utilisant du tréhalose et de l’acide hyaluronique comme matériaux de pointe et de la polyvinylpyrrolidone comme matériau de support par une méthode de moulage en deux étapes. Les micro-aiguilles ont démontré une résistance mécanique robuste, avec des pointes capables de résister à 2 N. La peau de porc a été utilisée pour simuler la peau humaine, et les pointes des micro-aiguilles ont complètement fondu dans les 60 secondes suivant la perforation de la peau. Les exosomes libérés par les micro-aiguilles présentaient une morphologie, une taille de particules, des protéines marqueurs et des fonctions biologiques comparables à celles des exosomes frais, permettant l’absorption des cellules dendritiques et favorisant leur maturation.
Introduction
Les exosomes, qui sont de petites vésicules libérées par les cellules dans la matrice extracellulaire, ont été proposés comme biothérapies potentielles et vecteurs d’administration de médicaments pour le traitement de plusieurs maladies et cancers1. Au cours de leur processus de biogenèse, les exosomes encapsulent diverses molécules biologiquement actives à l’intérieur des cellules, y compris des protéines fonctionnelles et des acides nucléiques2. Par conséquent, lorsqu’ils sont absorbés par les cellules réceptrices pendant le processus de transport, les exosomes ont la capacité de moduler l’expression des gènes et les fonctions cellulaires dans les cellules cibles3. En tant que sorte de messager d’information naturel, les exosomes ont été pleinement exploités dans la régénération des tissus, la régulation immunitaire et en tant que vecteur de livraison4. Grâce à des techniques d’ingénierie, des ligands spécifiques peuvent être enrichis à la surface des exosomes, ce qui permet d’induction ou d’inhibition d’événements de signalisation dans les cellules réceptrices ou de cibler des types cellulaires spécifiques5. Les agents chimiothérapeutiques peuvent également être chargés dans les exosomes pour le traitement du cancer6. De plus, les exosomes ont la capacité de traverser la barrière hémato-encéphalique pour l’administration de cargaisons thérapeutiques, ce qui les rend très prometteurs pour le traitement des troubles cérébraux7. Par rapport aux liposomes, les exosomes présentent une absorption cellulaire accrue et une biocompatibilité améliorée8. Ils sont capables de pénétrer efficacement dans d’autres cellules tout en faisant preuve d’une meilleure tolérance et d’une toxicité plus faible9. Cependant, l’injection traditionnelle d’exosomes en bolus est sujette à la séquestration et à l’élimination rapide par le foie, les reins et la rate dans la circulation sanguine10. De plus, les exosomes ont une faible stabilité in vitro et sont sensibles aux conditions de stockage, ce qui limite leurs applications cliniques11.
Les micro-aiguilles, un ensemble de pointes d’aiguilles de taille micrométrique, ont la capacité de pénétrer les barrières physiologiques pour l’administration de petites molécules de médicaments12, de protéines13, d’acides nucléiques14 et de nanomédicaments15. Les micro-aiguilles sont conçues avec précision pour cibler les lésions à la surface de la peau, et leurs pointes dispersées assurent une distribution uniforme du médicament sur le site ciblé, amplifiant ainsi leur impact thérapeutique16. La conception et la composition des matériaux des micro-aiguilles facilitent le stockage à sec de substances bioactives telles que les protéines et les acides nucléiques, améliorant ainsi leur stabilité17. Les méthodes d’injection traditionnelles ont une durée d’action relativement courte et peuvent provoquer des douleurs, induisant la peur chez les patients18. La longueur de la micro-aiguille, de taille micrométrique, minimise les traumatismes tissulaires et empêche la stimulation nerveuse, éliminant ainsi la douleur et améliorant l’observance du patient19. De plus, la nature conviviale des micro-aiguilles permet aux patients de s’auto-administrer le traitement sans avoir besoin de personnel spécialisé16. En plus de la peau, les micro-aiguilles peuvent également être utilisées dans des tissus tels que les yeux20, la muqueuse buccale21, le cœur22 et les vaisseaux sanguins23. L’application de micro-aiguilles pour l’administration clinique d’exosomes fournit une stratégie prometteuse et prospective.
Par conséquent, nous introduisons un patch de micro-aiguille (exo@MN) chargé d’exosomes et divulguons sa méthode de fabrication. Les patchs à micro-aiguilles ont été fabriqués à l’aide d’une méthode de coulée en deux étapes, ainsi que d’une centrifugation et d’un séchage sous vide, ce qui favorise l’agrégation des exosomes à l’extrémité des micro-aiguilles, améliorant ainsi l’efficacité de l’administration. Les pointes des aiguilles et le support ont été fabriqués à l’aide de matériaux qui présentent une excellente biocompatibilité et une excellente solubilité dans l’eau. Le tréhalose et l’acide hyaluronique (HA) ont été incorporés comme matériaux de pointe pour protéger les exosomes, et la polyvinylpyrrolidone (PVP) dissoute dans de l’éthanol absolu a été choisie comme matériau de support. La morphologie du patch de micro-aiguilles a été caractérisée à l’aide de la microscopie et du microscope électronique à balayage (MEB). Les essais mécaniques des micro-aiguilles ont été évalués à l’aide d’un tensimètre pour confirmer leur capacité à pénétrer la peau, et le taux de libération sur la peau de porc a été évalué à 60 s. De plus, la morphologie, la taille et la teneur en protéines des exosomes frais et des exosomes en exo@MN ont été caractérisées à l’aide d’un microscope électronique à transmission (MET), d’une analyse de suivi des nanoparticules (NTA) et d’un western blot (WB). L’internalisation des exosomes par les cellules dendritiques (DC) a été caractérisée à l’aide d’un microscope confocal à balayage laser (CLSM), et la maturation des DC a été évaluée par cytométrie en flux. La caractérisation morphologique et les fonctions biologiques des deux types d’exosomes sont essentiellement cohérentes.
Protocole
Cette étude n’a pas besoin d’une autorisation éthique, car la peau de porc utilisée pour les expériences décrites à la section 3 a été achetée sur le marché sous forme d’oreilles de porc comestibles et ne provient pas d’animaux de laboratoire.
1. Isolement des exosomes
- Culture cellulaire
- Cultivez des cellules cancéreuses épithéliales de l’ovaire ID8 de souris dans un milieu de culture DMEM (Modified Eagle Medium) de souris contenant 10 % de sérum fœtal bovin et une solution de pénicilline-streptomycine à 1 % (100×) (voir le tableau des matériaux) dans des boîtes de Pétri d’un diamètre de 15 cm.
- Incuber des cellules ID8 dans un incubateur de CO2 (voir Tableau des matériaux) à 37 °C et 5 % de CO2 jusqu’à ce que la densité cellulaire atteigne 90 %.
- Isolement des exosomes
- Retirez le milieu de culture des boîtes de Pétri et lavez-le deux fois avec la solution saline tamponnée au phosphate (DPBS) de Dulbecco. Ajouter 20 mL de DMEM sans sérum fœtal bovin (voir le tableau des matières) et une solution de pénicilline-streptomycine (voir le tableau des matériaux). Poursuivre l’incubation à 37 °C et 5% de CO2 pendant 48 h.
- Prélever le surnageant de culture cellulaire dans 20 boîtes de Pétri de 15 cm de diamètre. Centrifuger à 300 x g pendant 10 min à 4 °C et recueillir le surnageant pour éliminer les cellules libres.
- Centrifuger à 2000 x g pendant 10 min 4 °C, et recueillir le surnageant pour éliminer les débris cellulaires.
- Connectez le système de filtration sous vide jetable de 0,22 μm (voir tableau des matériaux) à la pompe à vide d’eau de circulation (voir tableau des matériaux). Créez un vide pour permettre au surnageant de passer à travers la membrane de polyéther sulfone de 0,22 μm et d’entrer dans la chambre inférieure du système de filtration, éliminant ainsi efficacement les vésicules ou les impuretés de plus de 0,22 μm du surnageant.
- Pour connecter la pompe à vide, allumez l’interrupteur de la pompe, puis connectez-la à l’entrée d’air du système de filtration sous vide. Lors de la fermeture, débranchez d’abord la connexion avec la pompe, puis éteignez la pompe à vide. Cette procédure permet d’éviter le reflux de la pompe à vide et la contamination du liquide de culture.
- Ajouter 15 mL de surnageant dans le tube intérieur du tube d’ultrafiltration de 100 kDa (voir le tableau des matériaux). Centrifuger à 3500 x g pendant 10 min à 4 °C et retirer le liquide du tube extérieur.
REMARQUE : Retenir les particules de plus de 100 kDa sur la membrane du tube intérieur, tandis que les protéines de moins de 100 kDa seront centrifugées dans le tube extérieur avec la solution. Les exosomes étaient supérieurs à 100 kDa et étaient agrégés sur la membrane du tube interne. - Répétez les étapes ci-dessus jusqu’à ce que le volume total du liquide soit inférieur à 5 ml. Recueillir le liquide de la chambre à air et ajouter 1 mL de DPBS. À l’aide d’une pipette, pipeter à plusieurs reprises dans le tube intérieur, en veillant à la remise en suspension des exosomes attachés dans le DPBS, puis collectez-les.
- Centrifuger à 10000 x g pendant 60 min à 4 °C et transférer le surnageant dans un tube à centrifuger à enclenchement rapide de 6 mL (voir le tableau des matériaux). Scellez le tube avec une thermosoudeuse.
- Centrifugeuse à 100 000 x g pendant 2 h 4 °C à l’aide d’une ultracentrifugeuse (voir tableau des matériaux). Ouvrez le tube de centrifugation à enclenchement rapide, retirez le surnageant et remettez la pastille en suspension dans 100 μL de DPBS. C’est la solution de l’exosome.
REMARQUE : Pendant le processus de remise en suspension de la pastille, il est nécessaire de pipeter et d’agiter la paroi du tube au moins 200 fois à l’aide d’une pipette.
2. Fabrication de exo@MN
- Préparation du moule maître
- Construisez un modèle de micro-aiguille avec un réseau de 10 x 10 à l’aide d’un logiciel de CAO, avec des pointes de forme conique avec les paramètres suivants : une hauteur de 1200 μm, un diamètre de base de 400 μm et un pas (distance entre les micro-aiguilles adjacentes) de 900 μm.
- Utilisez de la résine HTL comme matériau et imprimez le moule maître de la micro-aiguille à l’aide d’une imprimante 3D (voir tableau des matériaux).
- Plongez le moule maître dans de l’éthanol absolu pendant 1 h pour enlever toute résine adhérant à la surface.
- Exposez le moule à la lumière ultraviolette pendant 5 minutes pour le durcir.
- Plongez à nouveau le moule dans de l’éthanol absolu pendant 1 h, puis séchez-le à 60 °C dans une étuve de séchage pendant 1 h. Le moule maître est prêt.
- Préparation du moule de production
- Mélangez les composants A et B du polydiméthylsiloxane (PDMS, voir le tableau des matériaux) dans un rapport de 10:1. Mélangez bien et versez le mélange dans un moule maître.
- Placez le moule PDMS sous une pression de 1 psi pendant 15 min pour éliminer les bulles d’air du mélange PDMS.
- Durcir le moule PDMS à 60 °C pendant 2 h puis démouler pour obtenir le moule de production de la micro-aiguille.
- Nettoyez le moule de production avec de l’eau ultra-pure avant utilisation.
- Préparation de la solution
- Quantifiez la teneur en protéines de la solution d’exosomes à l’aide d’un kit de dosage BCA (voir la table des matériaux). Ajouter une quantité appropriée de DPBS pour obtenir une concentration de 10 μg/μL pour la solution d’exosomes.
- Préparez une solution de tréhalose à 200 mg/mL (voir le tableau des matériaux) en utilisant le DPBS comme solvant. Remuer pendant 20 minutes pour assurer une dissolution complète.
- Préparez une solution de 200 mg/mL d’acide hyaluronique (HA, voir tableau des matériaux) en utilisant le DPBS comme solvant. Remuer toute la nuit pour assurer une dissolution complète.
- Préparez une solution de 150 mg/mL de polyvinylpyrrolidone (PVP, voir le tableau des matières) en utilisant de l’éthanol absolu comme solvant. Remuer toute la nuit pour assurer une dissolution complète.
- Mélanger la solution d’exosome (10 μg/μL) et la solution de tréhalose (200 mg/mL) dans un rapport de volume de 1:1. Ajouter ensuite un volume égal de solution d’AH (200 mg/mL). Mélangez soigneusement pour obtenir la solution de pointe.
- Fabrication de exo@MN
- Traitez la surface du moule PDMS à l’aide d’un nettoyeur plasma (voir le tableau des matériaux) pendant 30 s à faible intensité pour améliorer son hydrophilie.
- Ajouter 40 μL de la solution de pointe dans le moule PDMS. Centrifuger à température ambiante (RT) et 3000 x g pendant 3 min pour s’assurer que le liquide remplit la couche d’aiguille du moule.
- Retirer l’excès de liquide dans le moule et sécher à RT dans une étuve de séchage sous vide (voir tableau des matériaux) pendant 1 jour.
- Ajouter 200 μL de solution PVP dans le moule PDMS. Centrifuger 3000 x g pendant 3 min à RT pour s’assurer que le liquide remplit la couche de support du moule.
- Sécher le moule à RT dans une étuve de séchage pendant 1 jour, puis démouler pour obtenir le patch exo@MN.
REMARQUE : Conservez le patch exo@MN dans un four de séchage jusqu’à ce qu’il soit prêt à l’emploi.
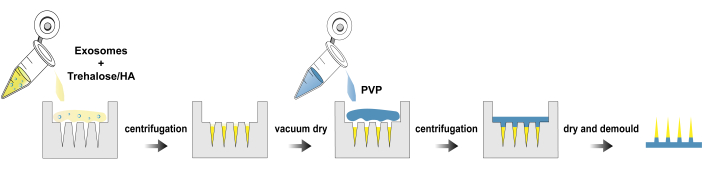
Figure 1 : Processus de fabrication de exo@MN patchs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Caractérisation des patchs exo@MN
- Observation de la morphologie
- Collez le support du patch sur une surface inclinée à 45° et placez-le sous un microscope stéréoscopique (voir Tableau des matériaux).
- Allumez l’illuminateur et capturez la morphologie du patch à l’aide d’un objectif 4x.
- Microscopie électronique à balayage (MEB)
- Fixez le patch à la platine de l’échantillon à l’aide d’un adhésif conducteur et traitez-le avec un enduiseur automatique fin (voir le tableau des matériaux) pendant 30 s.
- Capturez des images du patch exo@MN à l’aide du MEB (voir Tableau des matériaux) avec une tension d’accélération de 1 kV.
- Essais mécaniques
- Découpez un réseau de 3 x 3 dans le patch et placez-le avec les pointes vers le haut sur la plate-forme rigide d’un tensimètre (voir le tableau des matériaux). Ajustez la hauteur de la sonde pour la rapprocher des pointes des aiguilles sans les toucher.
- Réglez les paramètres pour qu’ils s’arrêtent automatiquement lorsque la pression atteint 20 N. Comprimez les pointes des aiguilles verticalement à une vitesse de 0,5 mm/min et enregistrez le profil de charge en fonction du déplacement.
- Dissolution
- Achetez des oreilles de porc fraîches au marché et coupez-les en morceaux (5 cm x 5 cm x 0,3 cm). Étalez la peau de porc sur une table et utilisez du papier pour sécher l’humidité de surface.
- Préparez quatre patchs secs à micro-aiguilles avec les pointes des aiguilles vers le bas sur la peau du porc, en espaçant légèrement chaque patch. À l’aide du pouce et de l’index, appuyez verticalement sur chaque patch de micro-aiguille. Retirez un timbre toutes les 15 s.
- Placez immédiatement le patch retiré dans une étuve de séchage et séchez-le pendant 5 min. Coupez une colonne de pointes de micro-aiguilles, placez-les horizontalement sous un microscope (voir le tableau des matériaux) et utilisez une lentille d’objectif 4x pour observer la dissolution des pointes.
4. Caractérisation des exosomes dans exo@MN patch
REMARQUE : Les pointes des micro-aiguilles de exo@MN sont dissoutes dans 100 μL de solution de DPBS pour effectuer la caractérisation suivante sur les exosomes libérés.
- Microscopie électronique à transmission (MET)
- Traitez le treillis de cuivre (voir Tableau des matériaux) avec un traitement hydrophile à l’aide d’un nettoyant ionique (voir Tableau des matériaux) pendant 5 min.
- Versez 10 μL de l’échantillon sur le côté carbone du treillis de cuivre. Laissez reposer pendant 1 min, puis retirez le liquide en l’épongeant avec du papier filtre sur les bords.
- Ajouter 10 μL d’acétate d’uranyle à 3 % (voir le tableau des matériaux) à l’échantillon. Laissez reposer pendant 10 s, puis retirez le liquide en épongeant avec du papier filtre sur les bords.
- Ajouter 10 μL d’acétate d’uranyle à 3 % à l’échantillon. Laissez reposer pendant 1 min, puis retirez le liquide en l’épongeant avec du papier filtre sur les bords et en le faisant sécher à l’air libre à RT.
- Capturer des images des exosomes à l’aide de la MET (voir Tableau des matériaux) avec une tension d’accélération de 80 kV.
- Analyse de suivi des nanoparticules (NTA)
- Diluer la solution d’exosomes avec du DPBS pour obtenir une concentration de particules de 1 x 107 particules/mL. Injecter lentement 1 mL de la solution d’exosome dans la chambre d’échantillonnage du NTA à l’aide d’une seringue de 1 mL (voir le Tableau des matières).
- Réglez le type de procédure d’utilisation standard (SOP) de l’instrument sur EV-488 pour détecter la distribution granulométrique des exosomes.
- Western blot (WB)
- Préparez le tampon de lyse en mélangeant le tampon de lyse du test de radio-immunoprécipitation (RIPA) : fluorure de phénylméthanesulfonyle (voir le tableau des matériaux) dans un rapport de 100:1. Lyser les exosomes sur la glace pendant 20 min, en tourbillonnant toutes les 10 min.
- Centrifuger la solution à 12 000 x g pendant 10 min à 4 °C. Prélever le surnageant pour mesurer la concentration en protéines.
- Ajoutez 5 tampons de chargement SDS-PAGE (voir tableau des matériaux) au surnageant dans un rapport de volume de 1 : 4 et mélangez bien. Chauffer à 100 °C pendant 10 min pour dénaturer les protéines.
- Ajouter 5 μL d’un marqueur protéique pré-coloré de 180 kDa (voir le tableau des matériaux) et 10 μg d’échantillon dénaturé à un gel préfabriqué à 4 % à 20 % (voir le tableau des matériaux). Faites fonctionner le système d’électrophorèse (voir tableau des matériaux) à 60 V pendant 10 min, puis à 140 V pendant 50 min.
- Transférez les protéines du gel vers une membrane PVDF (voir Tableau des matériaux) pré-activée avec du méthanol. Effectuer le système d’électrophorèse à 290 mA pendant 90 min sur glace.
- Incuber la membrane PVDF dans une solution de lait écrémé à 5 % pendant 1 h. Laver trois fois avec une solution saline tamponnée avec tween (TBST, voir tableau des matériaux) pendant 5 min chacune.
- Découpez les bandes cibles en fonction de la position de la protéine. Incuber les bandes avec l’anticorps anti-souris CD63 et l’anticorps anti-souris Alix (voir le tableau des matériaux) dilués à la concentration appropriée selon les instructions du fabricant, et incuber toute la nuit à 4 °C.
- Lavez les bandes trois fois avec du TBST. Incuber avec des IgG anti-lapin conjuguées à la HRP (voir tableau des matériaux) à RT pendant 1 h. Ensuite, lavez à nouveau trois fois avec du TBST.
- Appliquez un réactif de détection super ECL (voir Tableau des matériaux) pour couvrir la surface des bandes, et exposez et capturez immédiatement les bandes à l’aide d’un imageur sur gel (voir Table des matériaux).
- Microscopie confocale à balayage laser (CLSM)
- Cultivez 5 x 105 DC dans une boîte confocale en utilisant 2 ml de milieu Roswell Park Memorial Institute 1640 (RPMI 1640) (voir la table des matériaux). Ajouter des exosomes ou du exo@MN et incuber à 37 °C pendant 24 h.
- Ajouter une goutte de Hoechst 33342 dans chaque plat confocal et incuber dans l’obscurité à 37 °C pendant 20 min.
- Effectuez l’imagerie avec un CLSM (voir Tableau des matériaux) à l’aide d’un objectif 60x. Appliquez une goutte d’huile d’immersion (voir tableau des matériaux) sur l’objectif et placez la parabole confocale sur la platine. Ajustez les axes x/y/z pour localiser le plan focal approprié des cellules.
- Lancez l’imagerie avec les canaux DAPI/TRITC/TD, sélectionnez une résolution de 1024 px et réglez le mode rapide sur 1/8 s.
- Cytométrie en flux
- Cultivez les DC dans une plaque à 6 puits, chaque puits contenant 5 x 105 cellules et 2 mL de milieu 1640. Ajouter des volumes égaux de solution de DPBS, d’exosomes, de micro-aiguilles sans exosomes et de exo@MN, respectivement, et incuber à 37 °C pendant 24 h.
- Transférez le fluide de chaque puits dans des tubes centrifuges. Centrifuger à 300 x g pendant 3 min à 4 °C et retirer le surnageant.
- Ajouter 0,5 μL d’anticorps FITC-CD11c, 2,5 μL d’anticorps APC-CD80 et 0,5 μL d’anticorps Pacific Blue I-A/I-E (voir le tableau des matières) à 100 μL de solution de BSA à 5 % (voir le tableau des matériaux). Mélangez bien, remettez les cellules en suspension et incubez sur un shaker dans de la glace et à l’obscurité pendant 20 min.
- Ajouter 1 mL de DPBS et centrifuger à 300 x g pendant 3 min à 4 °C, puis retirer le surnageant. Répétez le lavage deux fois pour éliminer les anticorps non liés, puis procédez à l’analyse des canaux fluorescents correspondants par cytométrie en flux (voir le tableau des matériaux).
- Tout d’abord, dans le diagramme de dispersion FSC-A/SSC-A, la population cellulaire principale est P1. Dans le nuage de points SSC-A/SSC-H de la population de cellules P1, tracez une barrière d’une région P2 carrée le long de la diagonale pour supprimer les cellules agrégées.
- Effectuez une analyse de fluorescence sur la population de cellules P2 à l’aide des canaux FITC, APC et Pacific Blue. Définissez la condition d’arrêt pour collecter 10 000 cellules dans la porte P2.
5. Analyse statistique
- Exprimer les données quantitatives en moyens ±écarts-types (ET). Évaluez la signification statistique à l’aide de l’analyse du test t à l’aide d’un logiciel d’analyse de données approprié. Considérez des valeurs p inférieures à 0,05 pour indiquer la signification statistique. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
Résultats
Ici, nous présentons un protocole pour l’isolement des exosomes, la fabrication et la caractérisation de exo@MN patch. La figure 1 illustre l’organigramme du processus de fabrication de exo@MN patch. Les exosomes ont été mélangés avec du tréhalose et de l’HA, puis le mélange a été ajouté au moule à micro-aiguilles et centrifugé. Ce processus a facilité l’agrégation des exosomes à l’extrémité des aiguilles, favorisant une libération rapide. Après séchage, une so...
Discussion
Actuellement, les principales méthodes d’isolement des exosomes comprennent l’ultracentrifugation, la centrifugation à gradient de densité, l’ultrafiltration, la précipitation, les billes magnétiques d’immunoaffinité et la microfluidique24. En raison de la capacité de charge limitée des micro-aiguilles causée par leur petit espace de pointe d’aiguille, il est nécessaire d’augmenter la concentration d’exosomes pour charger davantage. Par conséquent, nous avons choisi l’ul...
Déclarations de divulgation
H. C., F.L.Q et S.J.M sont les inventeurs d’une demande de brevet qui a été déposée sur la base des données de ce manuscrit. H.C. est le fondateur scientifique de Medcraft Biotech. Inc.
Remerciements
F.L.Q. apprécie le soutien du Programme de R&D pionnier du Zhejiang (2022C03031), du Programme national de recherche et développement clés de la Chine (2021YFA0910103), de la Fondation nationale des sciences naturelles de Chine (22274141, 22074080), de la Fondation des sciences naturelles de la province du Shandong (ZR2022ZD28) et du Taishan Scholar Program de la province du Shandong (tsqn201909106). H.C. tient à souligner le soutien financier de la Fondation nationale des sciences naturelles de Chine (82202329). Les auteurs reconnaissent l’utilisation d’instruments à la plateforme d’instrumentation partagée de l’Institut de médecine de Hangzhou (HIM) de l’Académie chinoise des sciences.
matériels
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
Références
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon