Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Charakterisierung von Mikronadelpflastern für das Laden und Verabreichen von Exosomen
In diesem Artikel
Zusammenfassung
Exosomen besitzen ein erhebliches klinisches Potenzial, aber ihre praktische Anwendung ist aufgrund der einfachen In-vivo-Clearance und der schlechten Stabilität begrenzt. Mikronadeln stellen eine Lösung dar, indem sie eine lokalisierte Verabreichung ermöglichen, indem sie physiologische Barrieren durchstechen und den Trockenzustand konservieren, wodurch die Einschränkungen der Exosomenverabreichung behoben und ihr klinischer Nutzen erweitert wird.
Zusammenfassung
Exosomen bergen als aufstrebende Biotherapeutika der "nächsten Generation" und Drug-Delivery-Vektoren ein immenses Potenzial in verschiedenen biomedizinischen Bereichen, die von der Wirkstoffverabreichung und regenerativen Medizin bis hin zur Krankheitsdiagnose und Tumorimmuntherapie reichen. Die schnelle Clearance durch traditionelle Bolusinjektion und die schlechte Stabilität der Exosomen schränken jedoch deren klinische Anwendung ein. Mikronadeln dienen als Lösung, die die Verweilzeit von Exosomen an der Verabreichungsstelle verlängert, wodurch die Wirkstoffkonzentration aufrechterhalten und nachhaltige therapeutische Effekte ermöglicht werden. Darüber hinaus besitzen Mikronadeln auch die Fähigkeit, die Stabilität bioaktiver Substanzen zu erhalten. Aus diesem Grund stellen wir ein Mikronadelpflaster zum Laden und Verabreichen von Exosomen vor und teilen die Methoden, einschließlich der Isolierung von Exosomen, der Herstellung und Charakterisierung von mit Exosomen beladenen Mikronadelpflastern. Die Mikronadelpflaster wurden unter Verwendung von Trehalose und Hyaluronsäure als Spitzenmaterialien und Polyvinylpyrrolidon als Trägermaterial in einem zweistufigen Gießverfahren hergestellt. Die Mikronadeln zeigten eine robuste mechanische Festigkeit, wobei die Spitzen 2 N standhalten konnten. Schweinehaut wurde verwendet, um die menschliche Haut zu simulieren, und die Spitzen der Mikronadeln schmolzen innerhalb von 60 s nach der Hautpunktion vollständig zusammen. Die von den Mikronadeln freigesetzten Exosomen wiesen eine Morphologie, Partikelgröße, Markerproteine und biologische Funktionen auf, die mit denen frischer Exosomen vergleichbar waren, was die Aufnahme dendritischer Zellen ermöglichte und ihre Reifung förderte.
Einleitung
Exosomen, bei denen es sich um kleine Vesikel handelt, die von Zellen in die extrazelluläre Matrix freigesetzt werden, wurden als potenzielle Biotherapeutika und Vektoren für die Verabreichung von Medikamenten für die Behandlung verschiedener Krankheiten und Krebsarten vorgeschlagen1. Während ihres Biogeneseprozesses kapseln Exosomen verschiedene biologisch aktive Moleküle aus dem Zellinneren ein, darunter funktionelle Proteine und Nukleinsäuren2. Infolgedessen haben Exosomen, wenn sie während des Transportprozesses von Empfängerzellen aufgenommen werden, die Fähigkeit, die Genexpression und die zellulären Funktionen in den Zielzellen zu modulieren3. Als eine Art natürlicher Informationsbote wurden Exosomen bei der Geweberegeneration, der Immunregulation und als Träger voll ausgeschöpft4. Durch technische Techniken können spezifische Liganden auf der Oberfläche von Exosomen angereichert werden, was die Induktion oder Hemmung von Signalereignissen in Empfängerzellen ermöglicht oder auf bestimmte Zelltypen abzielt5. Chemotherapeutika können auch zur Krebsbehandlung in Exosomen geladen werden6. Darüber hinaus haben Exosomen die Fähigkeit, die Blut-Hirn-Schranke für die therapeutische Frachtabgabe zu überwinden, was sie für die Behandlung von Hirnerkrankungen sehr vielversprechend macht7. Im Vergleich zu Liposomen weisen Exosomen eine erhöhte zelluläre Aufnahme und eine verbesserte Biokompatibilitätauf 8. Sie sind in der Lage, effizient in andere Zellen einzudringen und gleichzeitig eine bessere Toleranz und geringere Toxizität zu zeigen9. Die traditionelle Bolusinjektion von Exosomen ist jedoch anfällig für eine Sequestrierung und eine schnelle Beseitigung durch Leber, Nieren und Milz im Blutkreislauf10. Darüber hinaus haben Exosomen eine schlechte Stabilität in vitro und sind anfällig für Lagerbedingungen, die ihre klinische Anwendung einschränken11.
Mikronadeln, ein Array von mikrometrischen Nadelspitzen, haben die Fähigkeit, physiologische Barrieren für die Verabreichung von niedermolekularen Arzneimitteln12, Proteinen13, Nukleinsäuren14 und Nanoarzneimitteln15 zu durchdringen. Mikronadeln sind so konstruiert, dass sie auf Läsionen auf der Hautoberfläche abzielen, und ihre dispergierten Spitzen sorgen für eine gleichmäßige Wirkstoffverteilung an der Zielstelle, wodurch ihre therapeutische Wirkung verstärktwird 16. Das Design und die Materialzusammensetzung von Mikronadeln erleichtern die trockene Lagerung von bioaktiven Substanzen wie Proteinen und Nukleinsäuren und erhöhen so deren Stabilität17. Herkömmliche Injektionsmethoden haben eine relativ kurze Wirkungsdauer und können Schmerzen verursachen, die bei Patienten Angst auslösen18. Die mikrometergroße Länge der Mikronadel minimiert das Gewebetrauma und verhindert die Nervenstimulation, wodurch Schmerzen beseitigt und die Compliance des Patienten verbessertwerden 19. Darüber hinaus ermöglicht die Benutzerfreundlichkeit der Mikronadeln den Patienten, die Behandlung selbst durchzuführen, ohne dass spezialisiertes Personal erforderlich ist16. Neben der Haut können Mikronadeln auch in Geweben wie den Augen20, der Mundschleimhaut21, dem Herzen22 und den Blutgefäßen23 eingesetzt werden. Der Einsatz von Mikronadeln für die klinische Verabreichung von Exosomen stellt eine vielversprechende und prospektive Strategie dar.
Daher führen wir ein Exosom-geladenes Mikronadelpflaster (exo@MN) ein und legen dessen Herstellungsmethode offen. Die Mikronadelpflaster wurden in einem zweistufigen Gießverfahren hergestellt, zusammen mit Zentrifugation und Vakuumtrocknung, wodurch die Aggregation von Exosomen an den Mikronadelspitzen gefördert und dadurch die Verabreichungseffizienz verbessert wird. Sowohl die Nadelspitzen als auch die Rückseite wurden aus Materialien hergestellt, die eine hervorragende Biokompatibilität und Wasserlöslichkeit aufweisen. Trehalose und Hyaluronsäure (HA) wurden als Spitzenmaterialien eingearbeitet, um die Exosomen zu schützen, und Polyvinylpyrrolidon (PVP), gelöst in absolutem Ethanol, wurde als Trägermaterial gewählt. Die Morphologie des Mikronadelpflasters wurde mittels Mikroskopie und Rasterelektronenmikroskop (REM) charakterisiert. Die mechanische Prüfung der Mikronadel wurde mit einem Zugmessgerät bewertet, um ihre Fähigkeit zu bestätigen, die Haut zu durchdringen, und die Freisetzungsrate auf Schweinehaut wurde mit 60 s untersucht. Darüber hinaus wurden die Morphologie, die Größe und der Proteingehalt sowohl von frischen Exosomen als auch von Exosomen in exo@MN mittels Transmissionselektronenmikroskop (TEM), Nanopartikel-Tracking-Analyse (NTA) und Western Blotting (WB) charakterisiert. Die Internalisierung von Exosomen durch dendritische Zellen (DCs) wurde mit Hilfe des konfokalen Laser-Scanning-Mikroskops (CLSM) charakterisiert und die Reifung der DCs mittels Durchflusszytometrie untersucht. Die morphologische Charakterisierung und die biologischen Funktionen der beiden Arten von Exosomen sind im Wesentlichen konsistent.
Protokoll
Für diese Studie ist keine ethische Freigabe erforderlich, da die Schweinehaut, die für die in Abschnitt 3 beschriebenen Versuche verwendet wurde, als essbare Schweineohren auf dem Markt gekauft und nicht von Versuchstieren bezogen wurde.
1. Isolierung von Exosomen
- Zellkultur
- Kultivieren Sie Eierstockepithelkarzinomzellen ID8 von Maus in Dulbeccos modifiziertem Eagle-Medium (DMEM) Kulturmedium, das 10 % fötales Rinderserum und 1 % Penicillin-Streptomycin-Lösung (100×) enthält (siehe Materialtabelle) in Petrischalen mit einem Durchmesser von 15 cm.
- Inkubieren Sie ID8-Zellen in einem CO2 -Inkubator (siehe Materialtabelle) bei 37 °C und 5 % CO2 , bis die Zelldichte 90 % erreicht.
- Isolierung von Exosomen
- Nehmen Sie das Nährmedium aus den Petrischalen und waschen Sie es zweimal mit Dulbecco-Phosphat-gepufferter Kochsalzlösung (DPBS). Fügen Sie 20 ml DMEM ohne fötales Rinderserum (siehe Materialtabelle) und Penicillin-Streptomycin-Lösung (siehe Materialtabelle) hinzu. Die Inkubation bei 37 °C und 5 % CO2 für 48 h fortsetzen.
- Sammeln Sie den Zellkulturüberstand aus 20 Petrischalen mit einem Durchmesser von 15 cm. Bei 300 x g für 10 min bei 4 °C zentrifugieren und den Überstand zur Entnahme freier Zellen auffangen.
- Zentrifugieren Sie bei 2000 x g für 10 min 4 °C und sammeln Sie den Überstand zur Entfernung von Zelltrümmern.
- Verbinden Sie das 0,22 μm Einweg-Vakuumfiltersystem (siehe Materialtabelle) mit der Umwälzwasser-Vakuumpumpe (siehe Materialtabelle). Erzeugen Sie ein Vakuum, damit der Überstand durch die 0,22 μm Polyethersulfonmembran in die untere Kammer des Filtrationssystems gelangen kann, wodurch Vesikel oder Verunreinigungen, die größer als 0,22 μm sind, effektiv aus dem Überstand entfernt werden.
- Um die Vakuumpumpe anzuschließen, schalten Sie den Pumpenschalter ein und schließen Sie ihn dann an den Lufteinlass des Vakuumfiltersystems an. Trennen Sie beim Schließen zuerst die Verbindung mit der Pumpe und schalten Sie dann die Vakuumpumpe aus. Dieses Verfahren hilft, einen Rückfluss der Vakuumpumpe und eine Kontamination der Kulturflüssigkeit zu verhindern.
- Geben Sie 15 mL Überstand in das Innenröhrchen des 100 kDa-Ultrafiltrationsröhrchens (siehe Materialtabelle). Bei 3500 x g für 10 min bei 4 °C zentrifugieren und die Flüssigkeit aus dem Außenröhrchen entfernen.
HINWEIS: Partikel, die größer als 100 kDa sind, werden auf der Membran des Innenrohrs zurückgehalten, während Proteine mit weniger als 100 kDa zusammen mit der Lösung in das Außenröhrchen zentrifugiert werden. Die Exosomen waren größer als 100 kDa und wurden auf der Membran des Innenrohrs aggregiert. - Wiederholen Sie die obigen Schritte, bis das Gesamtvolumen der Flüssigkeit innerhalb von 5 ml liegt. Sammeln Sie die Flüssigkeit aus dem Schlauch und fügen Sie 1 mL DPBS hinzu. Verwenden Sie eine Pipette, um wiederholt in das Röhrenröhrchen zu pipettieren, um die Resuspension der angehängten Exosomen in DPBS sicherzustellen, und sammeln Sie sie dann.
- Bei 10000 x g für 60 min bei 4 °C zentrifugieren und den Überstand in ein 6-mL-Schnellschnapp-Zentrifugenröhrchen überführen (siehe Materialtabelle). Verschließen Sie das Rohr mit einem Heißsiegel.
- Zentrifugieren Sie bei 100.000 x g für 2 h 4 °C mit einer Ultrazentrifuge (siehe Materialtabelle). Schneiden Sie das Schnellverschluss-Zentrifugenröhrchen auf, entfernen Sie den Überstand und resuspendieren Sie das Pellet in 100 μl DPBS. Dies ist die Exosomenlösung.
HINWEIS: Während des Resuspendierens des Pellets ist es notwendig, die Röhrchenwand mindestens 200 Mal mit einer Pipette zu pipettieren und zu bewegen.
2. Herstellung von exo@MN
- Vorbereitung der Urform
- Konstruieren Sie mit einer CAD-Software ein Mikronadelmodell mit einem 10 x 10 Array mit konisch geformten Spitzen mit folgenden Parametern: einer Höhe von 1200 μm, einem Basisdurchmesser von 400 μm und einem Abstand (Abstand zwischen benachbarten Mikronadeln) von 900 μm.
- Verwenden Sie HTL-Harz als Material und drucken Sie die Urform der Mikronadel mit einem 3D-Drucker (siehe Materialtabelle).
- Tauchen Sie die Urform 1 h lang in absolutes Ethanol, um jegliches Harz zu entfernen, das an der Oberfläche haftet.
- Setzen Sie die Form 5 Minuten lang ultraviolettem Licht aus, um sie auszuhärten.
- Tauchen Sie die Form noch einmal für 1 h in absolutes Ethanol und trocknen Sie sie anschließend 1 h lang bei 60 °C im Trockenofen. Die Urform ist fertig.
- Vorbereitung der Produktionsform
- A - und B-Komponenten von Polydimethylsiloxan (PDMS, siehe Materialtabelle) im Verhältnis 10:1 mischen. Gut umrühren und die Mischung in eine Urform geben.
- Stellen Sie die PDMS-Form 15 Minuten lang unter einen Druck von 1 psi, um Luftblasen aus der PDMS-Mischung zu entfernen.
- Die PDMS-Form bei 60 °C 2 h lang aushärten und anschließend entformen, um die Produktionsform der Mikronadel zu erhalten.
- Reinigen Sie die Produktionsform vor Gebrauch mit Reinstwasser.
- Herstellung der Lösung
- Quantifizieren Sie den Proteingehalt der Exosomenlösung mit einem BCA-Assay-Kit (siehe Materialtabelle). Fügen Sie eine angemessene Menge DPBS hinzu, um eine Konzentration von 10 μg/μl für die Exosomenlösung zu erreichen.
- Bereiten Sie eine Lösung von 200 mg/ml Trehalose (siehe Materialtabelle) mit DPBS als Lösungsmittel vor. 20 Minuten lang rühren, um eine vollständige Auflösung zu gewährleisten.
- Bereiten Sie eine Lösung von 200 mg/ml Hyaluronsäure (HA, siehe Materialtabelle) mit DPBS als Lösungsmittel vor. Über Nacht umrühren, um eine vollständige Auflösung zu gewährleisten.
- Eine Lösung aus 150 mg/ml Polyvinylpyrrolidon (PVP, siehe Materialtabelle) mit absolutem Ethanol als Lösungsmittel herstellen. Über Nacht umrühren, um eine vollständige Auflösung zu gewährleisten.
- Mischen Sie die Exosomenlösung (10 μg/μL) und die Trehalose-Lösung (200 mg/ml) in einem Volumenverhältnis von 1:1. Fügen Sie dann ein gleiches Volumen HA-Lösung (200 mg/ml) hinzu. Gründlich mischen, um die Spitzenlösung zu erhalten.
- Herstellung von exo@MN
- Bearbeiten Sie die Oberfläche der PDMS-Form mit einem Plasmareiniger (siehe Materialtabelle) 30 s lang in niedriger Qualität, um die Hydrophilie zu verbessern.
- Geben Sie 40 μl der Spitzenlösung in die PDMS-Form. Zentrifugieren Sie bei Raumtemperatur (RT) und 3000 x g für 3 Minuten, um sicherzustellen, dass die Flüssigkeit die Nadelschicht der Form füllt.
- Überschüssige Flüssigkeit aus der Form entfernen und bei RT in einem Vakuumtrockenschrank (siehe Materialtabelle) 1 Tag trocknen.
- Geben Sie 200 μl PVP-Lösung in die PDMS-Form. Zentrifugieren Sie 3000 x g für 3 min bei RT, um sicherzustellen, dass die Flüssigkeit die Trägerschicht der Form füllt.
- Trocknen Sie die Form 1 Tag lang bei RT in einem Trockenofen und entformen Sie sie dann, um das exo@MN Pflaster zu erhalten.
HINWEIS: Bewahren Sie das exo@MN Pflaster bis zur Verwendung in einem Trockenschrank auf.
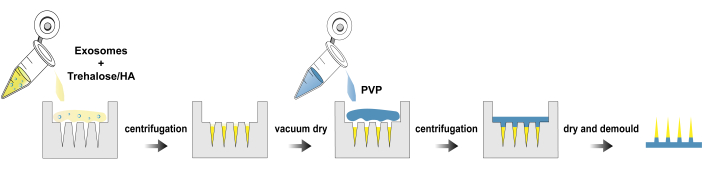
Abbildung 1: Herstellungsprozess von exo@MN Patches. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Charakterisierung von exo@MN Pflastern
- Beobachtung der Morphologie
- Kleben Sie die Rückseite des Pflasters auf eine um 45° geneigte Oberfläche und positionieren Sie es unter einem Stereomikroskop (siehe Materialtabelle).
- Schalten Sie den Illuminator ein und erfassen Sie die Morphologie des Patches mit einem 4-fach-Objektiv.
- Rasterelektronenmikroskopie (REM)
- Befestigen Sie das Pflaster mit leitfähigem Klebstoff auf dem Probentisch und behandeln Sie es 30 s lang mit einem Auto-Fine-Coater (siehe Materialtabelle).
- Nehmen Sie Bilder des exo@MN Patches mit REM (siehe Materialtabelle) mit einer Beschleunigungsspannung von 1 kV auf.
- Mechanische Prüfung
- Schneiden Sie aus dem Pflaster ein 3 x 3 Array aus und legen Sie es mit den Spitzen nach oben auf die starre Plattform eines Zugmessgeräts (siehe Materialtabelle). Stellen Sie die Höhe der Sonde so ein, dass sie nahe an die Nadelspitzen herankommt, ohne sie zu berühren.
- Stellen Sie die Parameter so ein, dass sie automatisch stoppen, wenn der Druck 20 N erreicht. Drücken Sie die Nadelspitzen vertikal mit einer Geschwindigkeit von 0,5 mm/min zusammen und erfassen Sie das Last-Verschiebungs-Profil.
- Auflösung
- Kaufe frische Schweineohren auf dem Markt und schneide sie in Stücke (5 cm x 5 cm x 0,3 cm). Verteilen Sie die Schweinehaut auf einem Tisch und trocknen Sie die Oberflächenfeuchtigkeit mit Papier.
- Bereiten Sie vier trockene Mikronadelpflaster vor, wobei die Nadelspitzen nach unten auf die Schweinehaut zeigen, wobei Sie jedes Pflaster leicht voneinander abhalten. Drücken Sie mit Daumen und Zeigefinger vertikal auf jedes Mikronadelpflaster. Alle 15 s einen Flicken entfernen.
- Legen Sie das entfernte Pflaster sofort in einen Trockenofen und trocknen Sie es 5 Minuten lang. Schneiden Sie eine Säule mit Mikronadelspitzen ab, legen Sie sie horizontal unter ein Mikroskop (siehe Materialtabelle) und verwenden Sie eine 4-fach-Objektivlinse, um das Auflösen der Spitzen zu beobachten.
4. Charakterisierung von Exosomen in exo@MN Pflaster
HINWEIS: Die Mikronadelspitzen von exo@MN werden in 100 μl DPBS-Lösung gelöst, um die folgende Charakterisierung an den freigesetzten Exosomen durchzuführen.
- Transmissionselektronenmikroskopie (TEM)
- Behandeln Sie das Kupfernetz (siehe Materialtabelle) 5 Minuten lang mit einer hydrophilen Behandlung mit einem Ionenreiniger (siehe Materialtabelle).
- Geben Sie 10 μl der Probe auf die Kohlenstoffseite des Kupfergewebes. Lassen Sie es 1 Minute stehen, dann entfernen Sie die Flüssigkeit, indem Sie sie mit Filterpapier von den Rändern abtupfen.
- Geben Sie 10 μl 3 % Uranylacetat (siehe Materialtabelle) in die Probe. 10 s ziehen lassen, dann die Flüssigkeit entfernen, indem man die Ränder mit Filterpapier abtupft.
- Geben Sie 10 μl 3 % Uranylacetat in die Probe. 1 Minute ziehen lassen, dann die Flüssigkeit entfernen, indem man sie mit Filterpapier von den Rändern abtupft und bei RT an der Luft trocknet.
- Aufnahme von Bildern der Exosomen mittels TEM (siehe Materialtabelle) mit einer Beschleunigungsspannung von 80 kV.
- Nanopartikel-Tracking-Analyse (NTA)
- Verdünnen Sie die Exosomenlösung mit DPBS, um eine Partikelkonzentration von 1 x 107 Partikeln/ml zu erreichen. Injizieren Sie langsam 1 ml der Exosomenlösung mit einer 1-ml-Spritze in die Probenkammer des NTA (siehe Materialtabelle).
- Stellen Sie den SOP-Typ (Standard Operating Procedure) des Instruments auf EV-488 ein, um die Größenverteilung der Exosomen zu erkennen.
- Western-Blotting (WB)
- Bereiten Sie den Lysepuffer vor, indem Sie den Lysepuffer des Radioimmunpräzipitationsassays (RIPA) Phenylmethansulfonylfluorid (siehe Materialtabelle) in einem Verhältnis von 100:1 mischen. Lysieren Sie die Exosomen 20 Minuten lang auf Eis und wirbeln Sie sie alle 10 Minuten vortexen.
- Die Lösung bei 12.000 x g für 10 min bei 4 °C zentrifugieren. Sammeln Sie den Überstand, um die Proteinkonzentration zu messen.
- 5x SDS-PAGE Ladepuffer (siehe Materialtabelle) im Volumenverhältnis 1 : 4 in den Überstand geben und gut vermischen. 10 min bei 100 °C erhitzen, um die Proteine zu denaturieren.
- Geben Sie 5 μl eines 180 kDa großen vorgefärbten Proteinmarkers (siehe Materialtabelle) und 10 μg denaturierte Probe zu einem 4 %-20 % vorgefertigten Gel (siehe Materialtabelle). Das Elektrophoresesystem (siehe Materialtabelle) wird 10 min lang mit 60 V und anschließend 50 min mit 140 V betrieben.
- Übertragen Sie die Proteine aus dem Gel auf eine mit Methanol voraktivierte PVDF-Membran (siehe Materialtabelle). Führen Sie das Elektrophoresesystem bei 290 mA für 90 min auf Eis durch.
- Inkubieren Sie die PVDF-Membran 1 h lang in 5%iger Magermilchlösung. Dreimal mit Tris-gepufferter Kochsalzlösung mit Tween (TBST, siehe Materialtabelle) für jeweils 5 min waschen.
- Schneiden Sie die Zielbanden basierend auf der Position des Proteins aus. Die Banden werden mit Anti-Maus-CD63-Antikörpern und Anti-Maus-Alix-Antikörpern (siehe Materialtabelle) inkubiert, die gemäß den Anweisungen des Herstellers auf die entsprechende Konzentration verdünnt sind, und über Nacht bei 4 °C inkubieren.
- Waschen Sie die Bänder dreimal mit TBST. Inkubieren Sie mit HRP-konjugiertem Anti-Kaninchen-IgG (siehe Materialtabelle) bei RT für 1 h. Dann nochmals dreimal mit TBST waschen.
- Tragen Sie ein Super-ECL-Detektionsreagenz (siehe Materialtabelle) auf, um die Oberfläche der Banden abzudecken, und belichten und erfassen Sie die Banden sofort mit einem Gel-Imager (siehe Materialtabelle).
- Konfokale Laser-Scanning-Mikroskopie (CLSM)
- Kultivieren Sie 5 x 105 DCs in einer konfokalen Schale mit 2 mL Roswell Park Memorial Institute 1640 (RPMI 1640) Medium (siehe Materialtabelle). Exosomen oder exo@MN hinzufügen und 24 Stunden bei 37 °C inkubieren.
- Je einen Tropfen Hoechst 33342 in jede Konfokalschale geben und im Dunkeln bei 37 °C 20 min inkubieren.
- Führen Sie die Bildgebung mit einem CLSM (siehe Materialtabelle) unter Verwendung eines 60-fach-Objektivs durch. Tragen Sie einen Tropfen Immersionsöl (siehe Materialtabelle) auf die Linse auf und stellen Sie die Konfokalschale auf den Tisch. Passen Sie die x/y/z-Achsen an, um die entsprechende Fokusebene der Zellen zu lokalisieren.
- Starten Sie das Imaging mit DAPI/TRITC/TD-Kanälen, wählen Sie eine Auflösung von 1024 px und stellen Sie den Schnellmodus auf 1/8 s ein.
- Durchflusszytometrie
- Kultivieren Sie DCs in einer 6-Well-Platte, die jeweils 5 x 105 Zellen und 2 ml 1640-Medium enthält. Es werden gleiche Volumina der Lösung von DPBS, Exosomen, Mikronadeln ohne Exosomen bzw. exo@MN zugegeben und 24 Stunden lang bei 37 °C inkubiert.
- Übertragen Sie das Medium aus jeder Vertiefung in Zentrifugalröhrchen. Bei 300 x g 3 min bei 4 °C zentrifugieren und den Überstand entfernen.
- Fügen Sie 0,5 μl FITC-CD11c-Antikörper, 2,5 μl APC-CD80-Antikörper und 0,5 μl Pacific Blue I-A/I-E-Antikörper (siehe Materialtabelle) zu 100 μl 5%iger BSA-Lösung hinzu (siehe Materialtabelle). Gut mischen, die Zellen resuspendieren und auf einem Shaker in Eis und im Dunkeln 20 Minuten inkubieren.
- 1 ml DPBS zugeben und bei 300 x g 3 min bei 4 °C zentrifugieren, dann den Überstand entfernen. Wiederholen Sie den Waschvorgang zweimal, um ungebundene Antikörper zu entfernen, und fahren Sie dann mit der Analyse der entsprechenden Fluoreszenzkanäle mittels Durchflusszytometrie fort (siehe Materialtabelle).
- Zuerst wird im FSC-A/SSC-A-Streudiagramm die Hauptzellpopulation als P1 eingestuft. Begrenzen Sie im SSC-A/SSC-H-Streudiagramm der P1-Zellpopulation einen quadratischen P2-Bereich entlang der Diagonale, um aggregierte Zellen zu entfernen.
- Führen Sie eine Fluoreszenzanalyse an der P2-Zellpopulation mit den Kanälen FITC, APC und Pacific Blue durch. Legen Sie die Stoppbedingung so fest, dass 10.000 Zellen im P2-Gate erfasst werden.
5. Statistische Analyse
- Geben Sie quantitative Daten als Mittelwert ± Standardabweichungen (SD) aus. Bewerten Sie die statistische Signifikanz mithilfe der t-Test-Analyse unter Verwendung einer geeigneten Datenanalyse-Softwareanwendung. Betrachten Sie p-Werte kleiner als 0,05, um die statistische Signifikanz anzuzeigen. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
Ergebnisse
Hier stellen wir ein Protokoll für die Isolierung von Exosomen, die Herstellung und Charakterisierung exo@MN Pflasters vor. Abbildung 1 veranschaulicht das Prozessablaufdiagramm für die Herstellung exo@MN Pflasters. Die Exosomen wurden mit Trehalose und HA gemischt, und die Mischung wurde dann in die Mikronadelform gegeben und zentrifugiert. Dieser Prozess erleichterte die Aggregation von Exosomen an den Nadelspitzen und förderte eine schnelle Freisetzung. Nach dem Trocknen wurde PVP-Lös...
Diskussion
Zu den derzeit wichtigsten Methoden zur Isolierung von Exosomen gehören die Ultrazentrifugation, die Dichtegradientenzentrifugation, die Ultrafiltration, die Fällung, immunaffine magnetische Kügelchen und die Mikrofluidik24. Aufgrund der begrenzten Belastbarkeit von Mikronadeln, die durch ihren kleinen Nadelspitzenraum verursacht wird, ist es notwendig, die Konzentration der Exosomen zu erhöhen, um mehr zu laden. Daher haben wir uns für die Ultrafiltration entschieden, um den Zellkulturübers...
Offenlegungen
H. C., F.L.Q. und S.J.M. sind Erfinder in einer Patentanmeldung, die auf der Grundlage der Daten in diesem Manuskript eingereicht wurde. H.C. ist der wissenschaftliche Gründer von Medcraft Biotech. Inc.
Danksagungen
F.L.Q. schätzt die Unterstützung durch das Pioneer R&D Program von Zhejiang (2022C03031), das National Key Research and Development Program von China (2021YFA0910103), die National Natural Science Foundation of China (22274141, 22074080), die Natural Science Foundation der Provinz Shandong (ZR2022ZD28) und das Taishan Scholar Program der Provinz Shandong (tsqn201909106). H.C. bedankt sich für die finanzielle Unterstützung durch die National Natural Science Foundation of China (82202329). Die Autoren würdigen die Verwendung von Instrumenten in der Shared Instrumentation Core Facility am Hangzhou Institute of Medicine (HIM) der Chinesischen Akademie der Wissenschaften.
Materialien
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
Referenzen
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten