Method Article
توحيد برنامج شبه أوتوماتيكي جديد لقياس نمو الخلايا العصبية
* These authors contributed equally
In This Article
Summary
توفر مقايسات نمو الخلايا العصبية قيمة كمية حول العمليات العصبية المتجددة. تتمثل ميزة هذا البرنامج شبه التلقائي في أنه يقسم أجسام الخلايا والخلايا العصبية بشكل منفصل عن طريق إنشاء قناع ويقيس معلمات مختلفة مثل طول الخلايا العصبية وعدد نقاط الفروع ومنطقة كتلة جسم الخلية وعدد مجموعات الخلايا.
Abstract
تعد تقنيات التصوير الحي الفعالة ضرورية لتقييم مورفولوجيا الخلايا العصبية من أجل قياس نمو الخلايا العصبية في الوقت الفعلي. كان القياس الصحيح لنمو الخلايا العصبية تحديا طويل الأمد على مر السنين في مجال أبحاث علم الأعصاب. تعمل هذه المعلمة كحجر زاوية في العديد من الإعدادات التجريبية في المختبر ، بدءا من الثقافات المنفصلة والثقافات العضوية إلى خطوط الخلايا. من خلال تحديد طول الخلايا العصبية ، من الممكن تحديد ما إذا كان علاج معين يعمل أو إذا تم تعزيز تجديد محور عصبي في مجموعات تجريبية مختلفة. في هذه الدراسة ، الهدف هو إثبات متانة ودقة برنامج تحليل نمو الخلايا العصبية Incucyte Neurotrack. يتوفر هذا البرنامج شبه التلقائي في نظام الفحص المجهري بفاصل زمني والذي يوفر العديد من المزايا مقارنة بالمنهجيات شائعة الاستخدام في القياس الكمي لطول الخلايا العصبية في صور تباين الطور. تقوم الخوارزمية بإخفاء وقياس العديد من المعلمات في كل صورة وإرجاع مقاييس الخلايا العصبية ، بما في ذلك طول الخلايا العصبية ونقاط الفروع ومجموعات جسم الخلية ومناطق كتلة جسم الخلية. أولا ، تحققنا من متانة ودقة البرنامج من خلال ربط قيمه بقيم NeuronJ اليدوية ، وهو مكون إضافي في فيجي. ثانيا ، استخدمنا الخوارزمية القادرة على العمل على كل من صور تباين الطور وكذلك على صور الكيمياء المناعية. باستخدام علامات عصبية محددة ، تحققنا من جدوى تحليل نمو الخلايا العصبية القائم على التألق على الخلايا العصبية الحسية في الثقافات المختبرية . بالإضافة إلى ذلك ، يمكن لهذا البرنامج قياس طول الخلايا العصبية عبر ظروف البذر المختلفة ، بدءا من الخلايا الفردية إلى الشبكات العصبية المعقدة. في الختام ، يوفر البرنامج منصة مبتكرة وفعالة من حيث الوقت لمقايسات نمو الخلايا العصبية ، مما يمهد الطريق لتقديرات كمية أسرع وأكثر موثوقية.
Introduction
في الأعصاب الوركية ، من الممكن قياس التجديد المحوري1. بالإضافة إلى ذلك ، أظهرت الدراسات في المختبر جدوى مراقبة النمو المحوري 2,3 لفهم مراحله المختلفة ، من تنبت المحور العصبي إلى التنكس المحوري ، في كل من الخلايا العصبية السليمة والمصابة. من خلال تتبع هذه العمليات ، من الممكن قياس معلمات مثل القطبية المحورية ، والبدء ، والاستقرار ، والتفرع. المعلمة الأخيرة حاسمة لفهم إدراك ألم الأعصاب4،5،6. وبالمثل ، يمكن مراقبة التنكس المحوري في الجسم الحي7 أو في المختبر 8,9. أثناء نمو الخلايا العصبية ، تستقر شبكات الأكتين والأنابيب الهيكلية الخلوية أو تتغير وفقا لاحتياجات الخلية10. يعاد تنظيم الهيكل الخلوي للأكتين للسماح بتكوين مخروط النمو المحوري ، وتعيد الأنابيب الدقيقة محاذاة في حزم لتثبيت الخلايا العصبيةالمتنامية 11. من أجل دراسة النمو العصبي للخلايا العصبية المركزية والمحيطية في المختبر ، يتم تحديد ثلاث معلمات شائعة: الطول المحوري الكلي ، والمسافة القصوى ، ونقاط الفرع. تستخدم هذه المعلمات لدراسة استجابة النمو العصبي للعلاج (أي التغذية العصبية ، المركبات ، المثبطات ، حمض الريتينويك ، siRNA ، shRNA) أو في المعدلة وراثيا12،13،14. من أجل تقييم ما إذا كانت الخلايا العصبية تحتوي على خلايا عصبية أكثر استطالة و / أو المزيد من التفرع ، تسمح لنا هذه المعلمات الثلاثة بتقييم مورفولوجيا الخلية العصبية. قياس طول Neurite هو المعلمة ذات الاهتمام الأعلى في العديد من الإعدادات التجريبية في المختبر. من العقد الجذرية الظهرية ، يتم إجراء نوعين أساسيين من الثقافات: منفصلة في الثقافة المختبرية أو الثقافة العضوية لنباتات DRG بأكملها. في كلتا الحالتين ، طول الخلايا العصبية هو معلمة ذهبية لتقييم نتيجة التجربة. في خط الخلية الشبيهة بالخلايا العصبية الحركية (NSC-34) ، يتم قياس النمو المحوري والتفرع بعد التمايز الناجم عن حمض الريتينويك 15,16. في الواقع ، من خلال قياس نمو الخلايا العصبية ، من الممكن تحديد ما إذا كان علاج معين قد نجح17 ، أو معدل النمو18 ، أو قدرة التجديد بعد إجراءالإصابة 19.
شكلت كيفية تقييم نمو الخلايا العصبية بشكل صحيح عددا كبيرا من التحديات على مر السنين في مجال البحث. ومع ذلك ، لا يوجد توحيد لقياسات طول الخلايا العصبية. بعض الطرق الأكثر استخداما لمزارع الخلايا في المختبر هي ، على سبيل المثال ، المكون الإضافي اليدوي NeuronJ على فيجي18,20 أو MetaMorph21,23 وشبه التلقائي Neurolucida23,24. بخلاف المنهجيات اليدوية ، هناك طرق تلقائية أيضا ، مثل المكون الإضافي NeuriteTracer على Fiji25 أو برنامج HCA Vision26,27 أو WIS-NeuroMath 2,28. تعتمد منهجيات أخرى أقل دقة على قياس البعد الكلي للخلايا العصبية. تتضمن هذه الطرق قياس المسافة المتجهة من جسم الخلية إلى قمة أطول محورعصبي 29 أو تحليل شول30. ومع ذلك ، فإن طرق القياس هذه مناسبة للثقافات منخفضة الكثافة أو الخلايا العصبية المفردة. علاوة على ذلك ، يتم استخدام كل هذه المنهجيات بشكل أساسي على الخلايا العصبية الملطخة أو الخلايا العصبية التي تعبر عن الفلوروفورات المشفرة وراثيا (مثل GFP و Venus و mCherry). يؤثر نوع الخلايا العصبية وكثافة ثقافة الخلية بعمق على اختيار منهجية القياس. على سبيل المثال ، يمكن أن يصبح تقسيم الخلايا العصبية يدويا بأشكال معقدة ومعقدة للغاية ، مثل الخلايا العصبية DRG ، مهمة مستحيلة بسهولة. إذا كانت الخلايا العصبية المعقدة تمثل بالفعل تحديا للتجزئة ، فإن الشبكات العصبية بعيدة تماما عن متناول الأساليب اليدوية بسبب تنظيمها المعقد للغاية.
من ناحية ، التجزئة اليدوية دقيقة للغاية لأنها تتم بواسطة العين البشرية والذكاء. من ناحية أخرى ، إنها تستغرق وقتا طويلا حقا. الإنفاق الزمني المرتفع الذي تتطلبه الطرق اليدوية هو العيب الرئيسي. لهذا السبب ، يتم الحصول على عدد قليل فقط من الخلايا العصبية للتحليل ، مما يجعلها أقل دقة وتكلفة من حيث الوقت. من ناحية أخرى ، تقلل الأساليب التلقائية أو شبه التلقائية جزئيا من نفقات الوقت. ومع ذلك ، لديهم أيضا بعض العيوب. يجب تدريب الطرق التلقائية من أجل العمل بشكل صحيح ، وإذا لم يكن البرنامج تفاعليا بدرجة كافية مع المستخدم ، فقد يكون التقسيم خاطئا.
بخلاف قياس نمو الخلايا العصبية ، فإن عدد نقاط الفرع هو أيضا معلومات قيمة. باستخدام التجزئة اليدوية ، يمكن حساب عدد نقاط الفرع ، في حين أن هذا غير ممكن مع مسافة متجهة. باستخدام الطرق التلقائية ، عادة ما يتم توفير عدد نقاط الفرع ، بينما مع تحليل Sholl ، يجب حسابه باستخدام صيغة رياضية.
في ورقة الطرق هذه ، نهدف إلى وصف وظائف وفعالية هذا البرنامج شبه التلقائي في قياس الطول المحوري الكلي والمعلمات الأخرى. تسمح الآلة بالحصول التلقائي على الصور في نقاط زمنية محددة أو لإجراء دراسات طويلة الأجل (أيام ، أسابيع ، شهور) ، مع الحفاظ على بيئة فسيولوجية للخلايا الحية. إن قياس نمو الخلايا العصبية باستخدام تصوير الفاصل الزمني لتباين الطور له فائدة في تمكين المراقبة المستمرة لحركية الخلايا العصبية ونموها. بالإضافة إلى ذلك ، من الممكن أيضا مراقبة موت الخلايا من خلال إضافة أصباغ معينة في الوسائط تستهدف الخلايا الميتة31،32،33. على الرغم من إصدار البرنامج في عام 2012 ، إلا أننا أول من قام بتوحيد هذه المنهجية بطريقة قابلة للتكرار وغير متحيزة من أجل التحديد الكمي الدقيق لنمو الخلايا العصبية. ومع ذلك ، من المهم ملاحظة أن البرنامج غير مضمن في شراء الجهاز. على الرغم من هذه النفقات الإضافية ، فإن استخدامه يوفر مزايا كبيرة في قياس الطول المحوري الكلي والمعلمات الأخرى ، وبالتالي المساهمة في البحث في مجال علم الأعصاب.
Protocol
1. مسح السفينة على الجهاز
ملاحظة: يتم إجراء الكشف بواسطة كاميرا Basler Ace 1920-155 μm المدمجة.
- افتح البرنامج بالنقر فوق الاتصال بالجهاز وتحديد جدولة - للحصول عليها. ثم انقر فوق علامة + .
- حدد ما إذا كان سيتم فحص السفينة بشكل متكرر أو 1x فقط عن طريق تحديد الخيار مسح ضوئي في الجدول أو مسح مرة واحدة الآن ، على التوالي.
- حدد جديد لإنشاء سفينة جديدة تماما لمسحها ضوئيا. إذا لم تتم إضافة سفينة جديدة ، فقم بإنشاء فحص جديد باستخدام أحد الخيارات الموضحة أدناه.
- حدد نسخ التيار لإنشاء سفينة جديدة عن طريق نسخ سفينة من الجدول الحالي. حدد نسخ السابق لإنشاء سفينة جديدة عن طريق نسخ سفينة تم مسحها ضوئيا مسبقا.
- حدد إضافة مسح ضوئي لاستعادة سفينة تم مسحها ضوئيا مسبقا لإجراء عمليات فحص إضافية.
- حدد نوع الفحص بناء على الفحص والتطبيق. للتحليل، حدد قياسي.
- حدد إعدادات المسح الضوئي. اختر أحد خيارات خلية تلو الأخرى، إما لا شيء، خلية ملتصقة بخلية، أو خلية بخلية غير ملتصقة، وحدد قنوات الصورة بناء على جزيئات الفلورسنت المستخدمة. حدد الخيار لا شيء لمزارع الخلايا العصبية الحسية البالغة والجنينية. لخطوط الخلية، حدد خيارات لا شيء أو خلية بخلية ملتصقة .
- حدد هدف المجهر (4x ، 10x ، 20x). اكتساب مع تكبير أعلى (20x) في الثقافات الأولية ، بينما في خطوط الخلية ، يكفي 10x.
- حدد نوع السفينة المراد مسحها ضوئيا من الخيارات المتوفرة. حدد موقع السفينة في الدرج عن طريق تحديد موقعها على الخريطة الافتراضية للدرج.
- حدد نمط المسح الضوئي للحصول على الصورة عن طريق تحديد الآبار المراد مسحها ضوئيا. حدد العدد المطلوب من الصور لكل بئر. سيظهر تقدير لمدة الفحص.
- قدم معلومات حول السفينة عن طريق كتابة الاسم وتحديد خريطة اللوحة بالنقر فوق علامة + .
- انقر فوق التالي. اختر نوع التحليل، وانقر فوق التالي. ستظهر شاشة ملخص للخيارات المحددة. إذا كان هذا صحيحا ، فانقر فوق Scan Now وسيبدأ الفحص.
2. الإعداد لتحليل صورة تباين الطور
ملاحظة: لا يمكن إجراء تحليل المسار العصبي إلا على الصور التي تم الحصول عليها مسبقا بواسطة الجهاز.
- حدد السفينة الممسوحة ضوئيا لتحليلها. حدد تحليل التشغيل. حدد إنشاء تعريف تحليل جديد.
- حدد نيوروتراك. حدد قنوات الصورة. حدد مجموعة تمثيلية من الصور لإجراء التحليل عليها. حدد جميع الصور لكل بئر لتدريب الخوارزمية.
- قم بتحسين إعدادات تعريف التحليل عن طريق ضبط المعلمات التالية.
ملاحظة: بشكل افتراضي ، يتم تقسيم الخلايا العصبية باللون الأرجواني ، بينما يتم تقسيم أجسام الخلايا باللون الأصفر. من الممكن تعديل الألوان حسب الرغبة.- بالنسبة لتجزئة كتلة الخلية والجسم ، اضبط ما يلي كما هو موضح أدناه.
- وضع التجزئة: يتم تجزئة الصور لتمييز أجسام الخلايا عن الخلفية والخلايا العصبية. اختر بين السطوع والملمس. بالنسبة للثقافات الأساسية وخطوط الخلايا ، حدد وضع السطوع.
- ضبط التجزئة: استخدم شريط التمرير لضبط حساسية التجزئة نحو المزيد من الخلفية أو المزيد من الخلايا. يتراوح من 0 (خلفية) إلى 2 (خلايا). يزيد أو يقلل من حجم القناع الأصفر. حرك شريط التمرير نحو 0 (خلفية) بحيث يقلل حجم القناع الأصفر تدريجيا من المساحة المتبقية للقناع الأرجواني. يحدث العكس إذا تم تحريك شريط التمرير نحو 2 (خلايا).
- للتنظيف، اضبط ما يلي كما هو موضح أدناه.
- ملء الثقب (ميكرومتر2): اضبط هذا لإزالة أي ثقب في قناع جسم الخلية أصغر من المنطقة المحددة من قبل المستخدم.
- ضبط الحجم (بكسل): قم بزيادة (إذا كان إيجابيا) أو تقليص (إذا كان سالبا) القناع الأصفر بالعدد المحدد من وحدات البكسل. يتراوح من -10 إلى +10. اضبط هذا لإضافة أو إزالة التجزئة الصفراء على الكائنات عالية التباين مثل الخلايا الميتة والحطام الخلوي.
- الحد الأدنى لعرض الخلية (ميكرومتر): اختر قيمة لتحديد الحجم الذي سيتم فيه اعتبار أجسام الخلايا عصبية.
- بالنسبة لمرشحات مجموعة جسم الخلية، اضبط ما يلي كما هو موضح أدناه.
- المساحة (ميكرومتر2): تعيين الحد الأدنى والحد الأقصى لقيمة مساحة جسم الخلية. لن يتم اعتبار القيم أعلى وأسفل القيم المحددة كأجسام خلوية.
- بالنسبة للمعلمات العصبية ، اضبط ما يلي كما هو موضح أدناه.
- التصفية: يقلل من إخفاء عيوب الأوعية الصغيرة والحطام. اختر من بين خيارات لا شيء وأفضل وأفضل. اختر لا شيء فقط للثقافات والأوعية النظيفة جدا. اختر أفضل لمعالجة أسرع على حساب فقدان اكتشاف الخلايا العصبية الدقيقة جدا. قد يكون كافيا للخلايا ذات الخلايا العصبية السميكة أو عالية التباين. أيضا ، يمكن أن يكون مفيدا للسفن التي بها العديد من العيوب أو الحطام. اختر الأفضل لوقت معالجة أطول ، ولكنه إعداد المرشح الأكثر حساسية لضمان اكتشاف الخلايا العصبية الدقيقة جدا.
- حساسية العصب: تستخدم لضبط حساسية الكشف. زيادة الحساسية للكشف عن الخلايا العصبية الدقيقة. يتراوح من 0.25 (أقل) إلى 0.75 (المزيد).
ملاحظة: يزيد أو يقلل من حساسية البرنامج للتعرف على الخلايا العصبية. إذا تم تحريك شريط التمرير نحو 0.25 (أقل) ، فسيكون البرنامج أكثر صرامة في التعرف على الخلايا العصبية. بدلا من ذلك ، إذا تم تحريك شريط التمرير نحو 0.75 (المزيد) ، فسيكون البرنامج أقل صرامة في هذا الكشف ، وبالتالي ، سيتم اعتبار المزيد من العيوب (مثل حطام الخلايا والأوساخ) عصبية. - عرض الخلايا العصبية (ميكرومتر): استخدمه لضبط الكشف على حجم الخلايا العصبية. يمكن أن يكون 1 أو 2 أو 4. عن طريق زيادته ، لن يتم النظر في الخلايا العصبية أرق. اضبطه على 1 لمزارع الخلايا العصبية الحسية الأولية للبالغين و 2 لخطوط الخلايا ومزارع الخلايا العصبية الحسية الجنينية.
- بالنسبة لتجزئة كتلة الخلية والجسم ، اضبط ما يلي كما هو موضح أدناه.
- انقر معاينة التيار لتصور الصورة المجزأة. سيتم توفير القياسات التالية لكل صورة: طول الخلايا العصبية (مم / مم2) ، نقاط فرع الخلايا العصبية (لكل مم2) ، مجموعات جسم الخلية (لكل مم2) ، ومنطقة كتلة جسم الخلية (مم2 / مم2).
- كرر الخطوتين 2.3 و2.4 لكافة الصور المحددة. انقر فوق التالي.
- حدد وقت الفحص وتحليله جيدا . قم بتعيين اسم تعريف ، وإذا لزم الأمر ، ملاحظات التحليل. انقر فوق التالي > إنهاء.
3. الإعداد لتحليل صور الكيمياء المناعية (ICC)
- اتبع نفس الخطوات الموضحة من 2.1 إلى 2.4. حدد قنوات الصورة للخلايا العصبية والنوى. حدد مجموعة الصور ؛ حدد كل الصور لكل بئر لتدريب الخوارزمية.
- قم بتحسين إعدادات تعريف التحليل عن طريق ضبط المعلمات التالية كما هو موضح أدناه.
ملاحظة: بشكل افتراضي ، يتم تقسيم الخلايا العصبية باللون الأزرق ، بينما تكون أجسام الخلايا أرجوانية. ومع ذلك ، يمكن تعديل الألوان حسب الرغبة.- تجزئة كتلة جسم الخلية: استخدم هذا لتقسيم الصورة إلى كائنات ذات أهمية. قم بتقدير سطوع الخلفية عند كل بكسل في الصورة. بعد العثور على الخلفية، قم بتنفيذ أحد الخيارات التالية.
- بدون طرح في الخلفية: استخدم هذا للتقسيم دون تغيير الصورة الأصلية. اختر بين العتبة التكيفية أو الثابتة. التكيف: يتم استخدام الخلفية للعثور على الأشياء ولكن لا يتم طرحها بشكل صريح ؛ باستخدام هذا الخيار ، من الممكن ضبط تعديل العتبة (GCU). عتبة ثابتة: يتم اكتشاف كائنات أكثر سطوعا من هذه العتبة في الصورة الأصلية ؛ باستخدام هذا الخيار ، من الممكن تعيين العتبة (GCU).
- الطرح في الخلفية: استخدم هذا الخيار لطرح الخلفية من الصورة باستخدام تحويل Top-Hat، ثم قم بتطبيق حد عليها. باستخدام هذا الخيار ، قم بتعيين نصف القطر والعتبة. نصف القطر: يتم استخدام قرص من نصف القطر هذا ؛ يجب أن يكون القرص كبيرا بما يكفي بحيث لا يتناسب تماما مع أي كائن في الصورة. العتبة: يتم اكتشاف الكائنات الأكثر سطوعا من هذا الحد في الصورة المطروحة في الخلفية.
- تنظيف: استخدم الخيار التالي لتنفيذ ذلك.
- ملء الثقب (ميكرومتر2): استخدم هذا لإزالة أي ثقوب في قناع جسم الخلية أصغر من المنطقة المحددة.
- ضبط الحجم (بكسل): استخدم هذا لزيادة (إذا كان إيجابيا) أو تقليص (إذا كان سالبا) القناع الأرجواني بالعدد المحدد من وحدات البكسل. النطاق هو -10 إلى +10. يضيف أو يزيل اللون الأرجواني على الأشياء عالية التباين مثل الخلايا الميتة والحطام الخلوي.
- الحد الأدنى لعرض الخلية (ميكرومتر): استخدم هذا لتحديد الحجم الذي سيتم فيه اعتبار أجسام الخلايا بمثابة خلايا عصبية.
- عوامل تصفية مجموعة جسم الخلية: استخدم الخيار التالي لتطبيق عوامل التصفية.
- المساحة (ميكرومتر2): تعيين الحد الأدنى والحد الأقصى لقيمة مساحة جسم الخلية. لن يتم اعتبار القيم أعلى وأسفل القيم المحددة كأجسام خلوية.
- معلمات Neurite: استخدم الخيار التالي لتعيين هذه.
- حساسية العصفور الخشنة: استخدم هذا لضبط سطوع الخلايا العصبية. يجب زيادة الحساسية إذا كانت شدة مضان الخلايا العصبية منخفضة. يتراوح من 0 (أقل) إلى 10 (أكثر). يزيد أو يقلل من حساسية البرنامج للتعرف على الخلايا العصبية الأقل سطوعا. تتراوح القيم المثلى من 7 إلى 10 ؛ لاحظ أنه إذا تم ضبطه على 10 ، فمن المحتمل جدا أن يتم النظر في الخلفية أيضا في قياس Neurite.
- حساسية الأعصاب الدقيقة: استخدم هذا لضبط حساسية الكشف. يجب زيادة الحساسية للكشف عن الخلايا العصبية الدقيقة. يتراوح من 0.25 (أقل) إلى 0.75 (المزيد). يزيد أو يقلل من حساسية البرنامج للتعرف على الخلايا العصبية الدقيقة والأقل سطوعا. إذا تم تحريك شريط التمرير نحو 0.25 (أقل) ، فلن يأخذ البرنامج في الاعتبار الخلايا العصبية الخافتة. بدلا من ذلك ، إذا تم تحريك شريط التمرير نحو 0.75 (المزيد) ، فسيكتشف البرنامج أيضا الخلايا العصبية الخافتة جدا (الخلفية تقريبا).
- عرض الخلايا العصبية (ميكرومتر): استخدم هذا لضبط الكشف على حجم الخلايا العصبية. يمكن أن يكون 1 أو 2 أو 4. عن طريق زيادته ، لن يتم النظر في الخلايا العصبية أرق. اضبطه على 1 لمزارع الخلايا العصبية الحسية الأولية للبالغين ، على 2 لخطوط الخلايا ومزارع الخلايا العصبية الحسية الجنينية.
- تجزئة كتلة جسم الخلية: استخدم هذا لتقسيم الصورة إلى كائنات ذات أهمية. قم بتقدير سطوع الخلفية عند كل بكسل في الصورة. بعد العثور على الخلفية، قم بتنفيذ أحد الخيارات التالية.
4. تصدير البيانات
- افتح التحليل. انقر على مقاييس الرسم البياني.
- حدد المقياس والنقاط الزمنية والآبار التي تهمك.
- حدد خيار التجميع بين الكل، بلا، الأعمدة، الصفوف، والنسخ المتماثلة لخريطة اللوحة.
- انقر فوق تصدير البيانات وحدد مجلد الوجهة ، وإذا لزم الأمر ، خيارات أخرى. سيتم إنشاء ملف .txt.
ملاحظة: ستوفر الماكينة متوسط قيمة واحدة للمقياس المختار لكل بئر. يلزم تقديم تعليق توضيحي يدوي أثناء التحليل لاسترداد قيم الصورة المفردة.
5. تصدير الصور
- افتح السفينة. انقر فوق تصدير الصور والأفلام.
- حدد نوع التصدير للصور.
- حدد كعرض لتصدير الصور كما هي معروضة. انقر فوق التالي وحدد الصور ذات الأهمية للتصدير. انقر فوق التالي.
- حدد نوع التسلسل بين فيلم واحد أو سلسلة من الصور ونقاط الاهتمام الزمنية. انقر فوق التالي.
- اضبط خيارات التصدير حسب الحاجة وانقر فوق التالي. قم بتعيين مجلد الإخراج وتنسيق الملف واسم الملف، ثم انقر على تصدير.
- حدد كمخزن لتصدير الصور بتنسيق RAW. حدد نوع الصورة.
- حدد النقاط الزمنية والآبار ذات الأهمية. انقر فوق التالي. قم بتعيين مجلد الإخراج وتنسيق الملف واسم الملف ، ثم انقر فوق تصدير.
- حدد كعرض لتصدير الصور كما هي معروضة. انقر فوق التالي وحدد الصور ذات الأهمية للتصدير. انقر فوق التالي.
- تصدير الصور باستخدام أقنعة التجزئة
- افتح التحليل. انقر على أيقونة طبقات الصورة. حدد أقنعة القنوات المطلوبة (المرحلة العصبية وكتلة جسم الخلية الطورية). اتبع الخطوة 5.2.
النتائج
خوارزمية قياس نمو الخلايا العصبية قادرة بقوة على اكتشاف الخلايا العصبية في كل من الشبكات العصبية والخلايا العصبية المفردة. يولد قناعا أصفر يقسم الكائنات ذات التباين العالي ، مثل أجسام الخلايا والحطام الخلوي والخلايا الميتة ونباتات الأنسجة والظلال. بالإضافة إلى ذلك ، يظهر قناع أرجواني على الخلايا العصبية بسماكات مختلفة. يتم توفير قيم طول الخلايا العصبية في مم / مم2 ، مما يشير إلى أن الطول المحوري قد تم تقسيمه على مساحة الصورة ، والتي تبلغ 0.282739 مم2 وثابتة لكل حالة مسح. لذلك ، من أجل الحصول على قيم نقية لطول الخلايا العصبية بالملليمتر ، يجب ضرب الأرقام التي يوفرها البرنامج في مساحة الصورة.
الطريقة شبه التلقائية مقابل الطريقة اليدوية
البرنامج المستخدم هو منهجية شبه أوتوماتيكية لقياس الطول المحوري الكلي. لتقييم دقة البرنامج ، أجرينا قياسات على نفس الخلايا العصبية باستخدام الطريقة اليدوية مع المكون الإضافي NeuronJ أيضا. كما هو موضح في الشكل 1 ، فإن قناع التجزئة على الخلايا العصبية متشابه للغاية بين الطريقتين (الشكل 1 أ).
بالإضافة إلى ذلك ، أجرينا تحليلا إحصائيا للقيم التي تم الحصول عليها لفحص ارتباطها. أسفر تحليل ارتباط سبيرمان عن معامل r مرتفع قدره 0.8526 ، وبالتالي قدم دليلا قويا على دقة ودقة الخوارزمية (الشكل 1 ب). يتطلب القياس التلقائي معايير عالية لجودة الثقافة بناء على نظافتها وكثافتها ونقاوتها. النتائج التي تم الحصول عليها من خلال التجزئة شبه التلقائية قابلة للتكرار ولا تتأثر بالحكم الفردي. تعد قابلية التكرار غير المتحيزة مشكلة بالنسبة للمنهجيات اليدوية.
في بعض الأحيان ، يمكن أن تحدث أخطاء التجزئة شبه التلقائية لأسباب مختلفة. في صور تباين الطور ، يمكن اكتشاف الأوساخ في الثقافة كخلايا عصبية عن طريق التجزئة شبه التلقائية. علاوة على ذلك ، يمكن أن يؤدي وجود أنواع مختلفة من الخلايا إلى إزعاج عملية التجزئة. لا تنشأ مثل هذه المشكلات مع التجزئة اليدوية لأنها تتم بالعين البشرية. ومع ذلك ، إذا ظهرت مثل هذه المشكلات ، فيمكن التغلب عليها باستخدام صور الكيمياء المناعية كعنصر تحكم.
تجزئة الخلايا العصبية
بالنسبة للمزارع الأولية للخلايا العصبية DRG البالغة ، فإن نقطة البداية المثلى لتحليل المرحلة الموثوق به هي الحصول على خلايا عصبية مطلية بشكل موحد في ثقافة جيدة ونظيفة. إذا حدثت أخطاء أثناء البذر وتركزت الخلايا في مكان واحد ، كما هو موضح في الشكل 2A-B ، فستكون القيم تقديرا أكثر من كونها انعكاسا وثيقا للواقع. في مثل هذه الحالات ، سيغطي القناع الأصفر معظم الخلايا العصبية بين الخلايا (الشكل 2A-B) ، مما يؤدي إلى فقدان طول الخلايا العصبية. علاوة على ذلك ، سيكون البرنامج متحيزا بشكل كبير في التعرف على الخلايا العصبية ، ومن المحتمل جدا أن يظهر قناع أرجواني على كائنات ليست عصبية (الشكل 2D). في الصورة المثلى ، يجب أن يكون هناك ما يصل إلى 15 خلية عصبية بتكبير 20x.
عندما تكون الخلايا العصبية مطلية بشكل صحيح وتكون الثقافة نظيفة ، كما هو موضح في الشكل 3A-B ، فمن المستحسن ضبط شريط تمرير التجزئة نحو الخلفية (0.5 - 0.7 ؛ الشكل 3 ج). يساعد ذلك على تقليل المكون الأصفر الذي سيظهر على كائنات عالية التباين في الصورة ، مثل النقاط المتفرعة التي يجب أن تكون باللون الأرجواني. علاوة على ذلك ، إذا كانت الخلايا العصبية جريئة ، فيجب أن تكون حساسية الخلايا العصبية بين 0.4 و 0.5 كافية لتغطية معظمها (الشكل 3C-D).
هناك حالة شائعة أخرى يمكن أن تنشأ وهي الثقافة القذرة التي تحتوي على العديد من بقايا الخلايا والخلايا الميتة ، كما هو موضح في الشكل 4 أ - ب. في مثل هذه الظروف ، هناك العديد من الكائنات عالية التباين. لذلك ، ينصح بزيادة حجم القناع الأصفر عن طريق ضبط شريط تمرير التجزئة باتجاه الخلية أو عن طريق زيادة معلمة حجم الضبط (+1 ، +2 ، وما إلى ذلك ؛ الشكل 4C). ومع ذلك ، سيكون من المفيد أيضا تقليل حساسية الخلايا العصبية قليلا لمنع البرنامج من التعرف بشكل غير صحيح على الكائنات العصبية التي ليست عصبية في حد ذاتها. (الشكل 4C-D).
في بعض الأحيان ، يمكن أن تبدو الخلايا العصبية رقيقة جدا وشاحبة ، كما هو موضح في الشكل 5A-B ، مما يشكل تحديات للبرنامج لتقسيمها بدقة (الشكل 5D). في هذه الحالة ، ينصح بزيادة حساسية الخلايا العصبية إلى 0.6 على الأقل (الشكل 5C). ومع ذلك ، ضع في اعتبارك أنه كلما زادت الحساسية ، زاد احتمال قيام البرنامج بتمييز الكائنات التي ليست عصبية بشكل غير صحيح على هذا النحو (الشكل 5D). يمكن اتخاذ بعض الاحتياطات لمنع تحيز الحساسية من الزيادة أكثر من اللازم ، على سبيل المثال ، عن طريق ضبط شريط تمرير التجزئة نحو الخلايا. ومع ذلك ، إذا كانت الخلايا العصبية رقيقة جدا بحيث لا يمكن اكتشافها بواسطة البرنامج ، فستكون قيم طول الخلايا العصبية متحيزة بغض النظر.
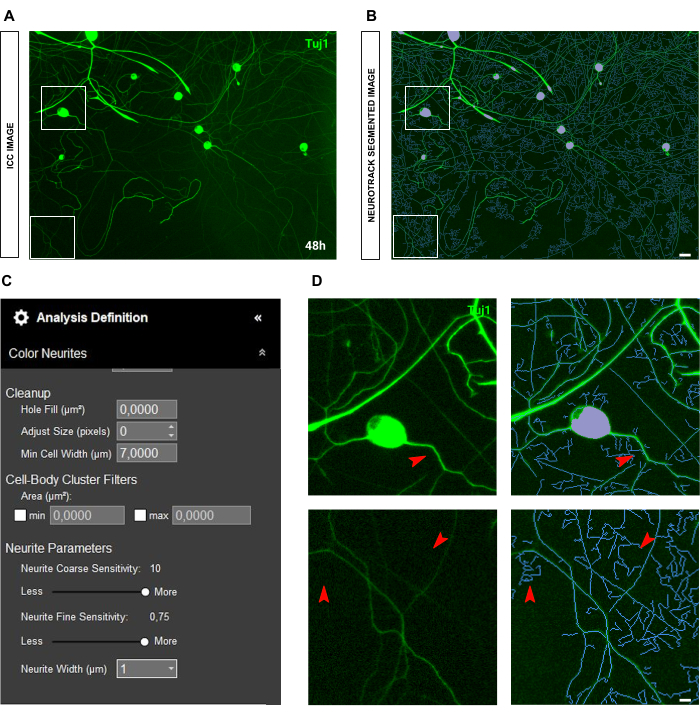
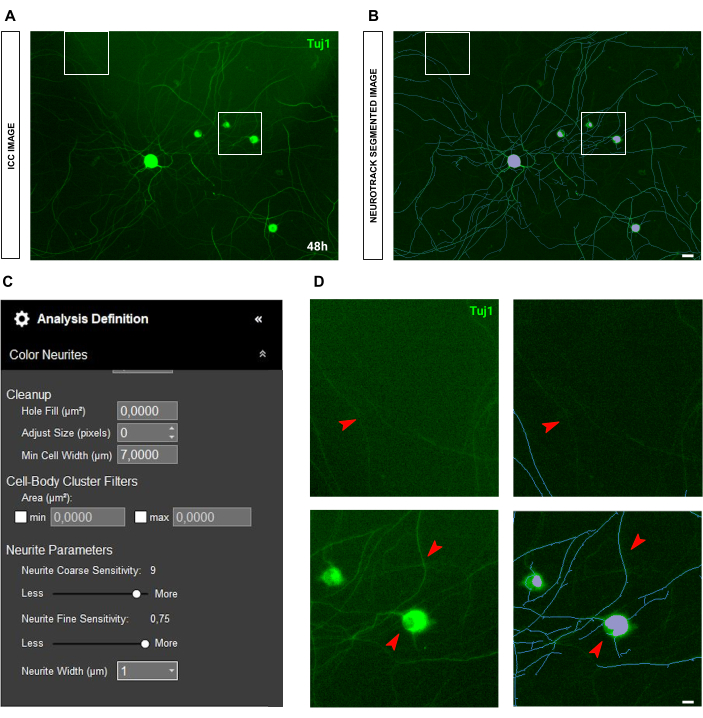
في حالة صور الكيمياء المناعية ، تكمن المشكلة الرئيسية في الخلفية. بصرف النظر عن شروط البذر التي تنطبق عليها القواعد المذكورة أعلاه ، فإن المصدر الأساسي للتحيز هو التألق نفسه. يتعرف البرنامج بشكل فعال على الخلايا العصبية شديدة السطوع بينما تترك الخلايا العصبية الأرق والأقل كثافة (الشكل 6A-B). لمنع فقدان طول الخلايا العصبية ، يمكن زيادة الحساسية الدقيقة للأعصاب حتى 0.75 (الشكل 6C). ومع ذلك ، فمن المستحسن بشدة تقليل الحساسية الخشنة العصبية إلى 8-9 على الأقل لمنع التحيز المفرط للكشف عن طريق النظر في الخلايا العصبية في الخلفية (الشكل 6C-D). إذا لم يتم تقليل الأخير ، تقسيم كل الخلفية ، كما هو موضح في الشكل 7.
مشكلة شائعة في اكتساب التألق هي تشتت الضوء. في كثير من الأحيان ، تقدم صور الكيمياء الخلوية المناعية مصابيح يدوية في الصورة ، مما يؤثر بشكل كبير على جودة ودقة التحليل (الشكل 8A-B). في مثل هذه الحالة ، لا يمكن فعل الكثير لتحسين التحليل ، وستكون القيم أكثر من تقدير. يتداخل تشتت الضوء مع التعرف على الخلايا العصبية بحيث يتم اكتشاف الخلايا العصبية شديدة السطوع فقط (الشكل 8C-D). هناك مشكلة أخرى في صور الكيمياء المناعية وهي جودة التلوين في حد ذاته. في كثير من الأحيان ، بسبب الأخطاء البشرية ، يمكن كسر المحاور العصبية (الشكل 9 أ) ، ويمكن أن تتمزق أجسام الخلايا أثناء الغسيل (الشكل 9 ب). تشكل هذه الأخطاء مشكلة حرجة حيث تفقد قيم طول الخلايا العصبية الدقة والدقة. وبالتالي ، يتم تغيير تفسير البيانات البيولوجية ، مما يؤدي إلى استنتاجات خاطئة.
بالنسبة للثقافات الجنينية ، يختلف الوضع. في هذا النوع من الثقافة ، يكون وجود الخلايا الدبقية هو السائد. وبالتالي ، تزداد الأخطاء بشكل كبير حيث يكتشف البرنامج أيضا بطانات الخلايا الدبقية (الشكل 10A-B). لتقليل هذه المشكلة ، يجب نقل شريط تمرير التجزئة نحو الخلايا ، عادة حول قيم 1.7-2 (الشكل 10C-D). يضمن هذا النهج تغطية معظم الخلايا الدبقية بالقناع الأصفر وبالتالي لا يتم أخذها في الاعتبار في قياس طول الخلايا العصبية. نصيحة أخرى مفيدة هي الحفاظ على عرض الخلايا العصبية عند 2 ، حيث تظهر الخلايا العصبية الجنينية في الثقافة عادة أشكالا ثنائية القطب أو أحادية القطب مع خلايا عصبية سميكة (الشكل 10C-D). يقوم هذا الاحتياط بتصفية معظم بطانات الخلايا الدبقية التي عادة ما تكون رقيقة جدا. أخيرا ، احرص على عدم زيادة حساسية الخلايا العصبية أكثر من اللازم. خلاف ذلك ، سيتم تضمين ما تم تصفيته بواسطة معلمة عرض Neurite مرة أخرى في قياس طول الخلايا العصبية.
في حالة المزارع الجنينية ، حيث يكون مكون الخلية الدبقية هو السائد ، قد تكون الكيمياء الخلوية المناعية هي الخيار الأفضل. من خلال تلطيخ الخلايا العصبية على وجه التحديد ، يتم حل مشكلة تجزئة الخلايا الدبقية لأن الخلايا الدبقية لن تكون ملطخة ، مما يجعل التحليل أسهل بكثير وأكثر دقة (الشكل 11).
أخيرا ، يمكن أيضا استغلال البرنامج لتقييم برنامج التمايز لخطوط الخلايا و / أو iPSCs لتقييم حالة نموها. وبالتالي ، يمكن استخدام تطبيق المعلمات والاحتياطات المماثلة لأهداف مختلفة.
فيما يتعلق بعملية التمايز ، تم إثبات متانة البرنامج في خط الخلايا NSC-34 (خط الخلايا الهجينة الذي يتكون من خلايا الورم الأرومي العصبي للفأر والخلايا العصبية الحركية المشتقة من الحبل الشوكي لأجنة الفئران) أثناء النضج إلى خلايا تشبه الخلايا العصبية المتحركة. أما بالنسبة للثقافات الأولية DRG ، فإن نقطة البداية المثلى للتحليل الجيد هي بذر الخلايا الموحد. يمكن متابعة الخلايا غير المتمايزة والمتمايزة ، عند معالجة حمض الريتينويك ، باستخدام عمليات الاستحواذ خلال فترة الاستزراع بأكملها أو كما هو موضح في الشكل 12 ، في النقطة الزمنية الأخيرة.
في الواقع ، بالإضافة إلى طول الخلايا العصبية ، توفر الخوارزمية أيضا معلمة نقطة الفرع. ومع ذلك ، من المهم ملاحظة أن معلمة نقطة الفرع لا تمثل العدد الدقيق لنقاط الفرع ؛ بدلا من ذلك ، فإنه يشير إلى كثافة التفرع في الصورة كما يتم التعبير عنها في مم / مم2. يتأثر هذا القياس بشكل كبير بالحطام في الاستزراع وتركيز البذر. لذلك ، فإن كثافة الخلايا العصبية في الصورة ونظافة الثقافة هي عوامل حاسمة للحصول على قيم موثوقة. إذا كانت الثقافة تقدم العديد من بقايا الخلايا ، ولم يتم ترشيحها بواسطة القناع الأصفر ، تضمينها في طول الخلايا العصبية وكذلك في قياس نقطة الفرع.
وبالتالي ، يوصى بتطبيع هذه القيم لعدد الخلايا ، حيث يؤثر عدد الخلايا العصبية في الصورة على طول الخلايا العصبية وقياسات نقطة الفرع.
تجزئة أجسام الخلايا
من بين جميع المعلمات التي يوفرها النظام ، هناك مجموعة جسم الخلية ومنطقة كتلة جسم الخلية. ومع ذلك ، لا يمكن الاعتماد على هاتين المعلمتين لاستخدامها كقيم لحساب الخلايا. كما هو موضح في الشكل 4 ، يقوم البرنامج بتقطيع الكائنات عالية التباين في القناع الأصفر ، بما في ذلك الظلال الناتجة عن الحركة المتوسطة في البئر. بالإضافة إلى ذلك ، فإنه يقسم أيضا الخلايا الميتة والحطام الخلوي (الشكل 4). للحصول على عدد خلايا موثوق به من الخلايا العصبية المتنامية ، يمكن استخدام طريقة يدوية ، مثل أداة عداد الخلايا في فيجي (الشكل 13).
ويرد ملخص لبارامترات التحليل المقترحة مرتبة حسب نوع الاستزراع في الجدول 1 لصور الطور والجدول 2 لصور الكيمياء المناعية. علاوة على ذلك ، يتم تقديم ملخص لمعلمات التحليل المقترحة لحل قضايا محددة في الجدول 3.
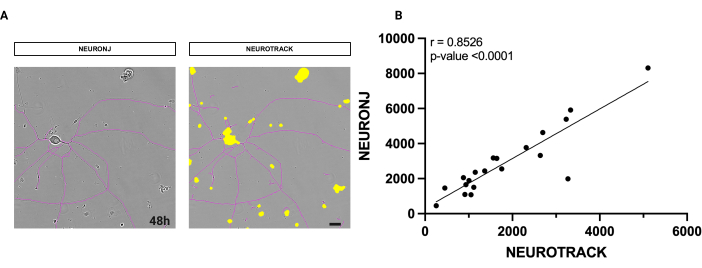
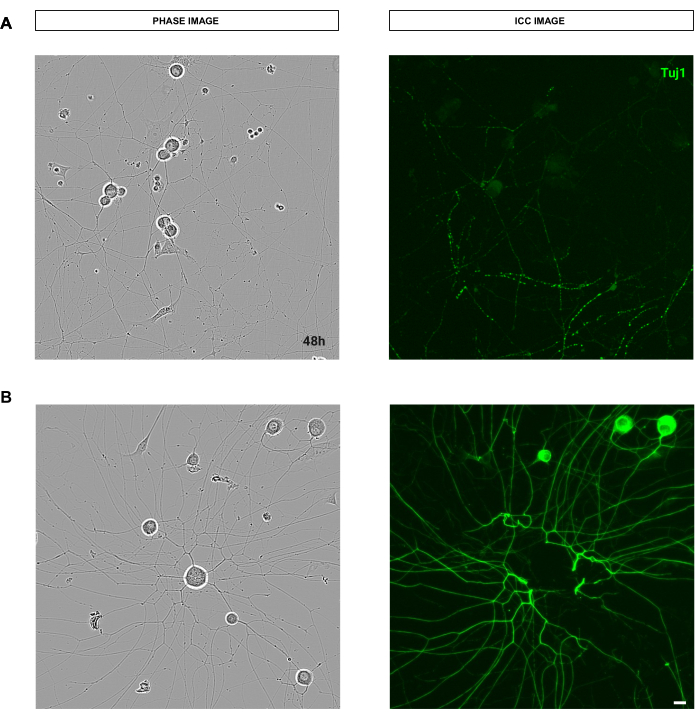
الشكل 1: تحليل الارتباط بين تجزئة الخلايا العصبية اليدوية وشبه التلقائية. (أ) على اليسار، صورة طور تمثيلية لخلية عصبية مجزأة باستخدام المكون الإضافي NeuronJ في فيجي. على اليمين ، يتم تقسيم صورة طور تمثيلية للخلية العصبية باستخدام البرنامج شبه التلقائي. (ب) حلل الانحدار الخطي البسيط على 20 خلية عصبية بالطريقتين اليدوية وشبه الآلية. معامل ارتباط سبيرمان r = 0.8526 ، p **** < 0.0001. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
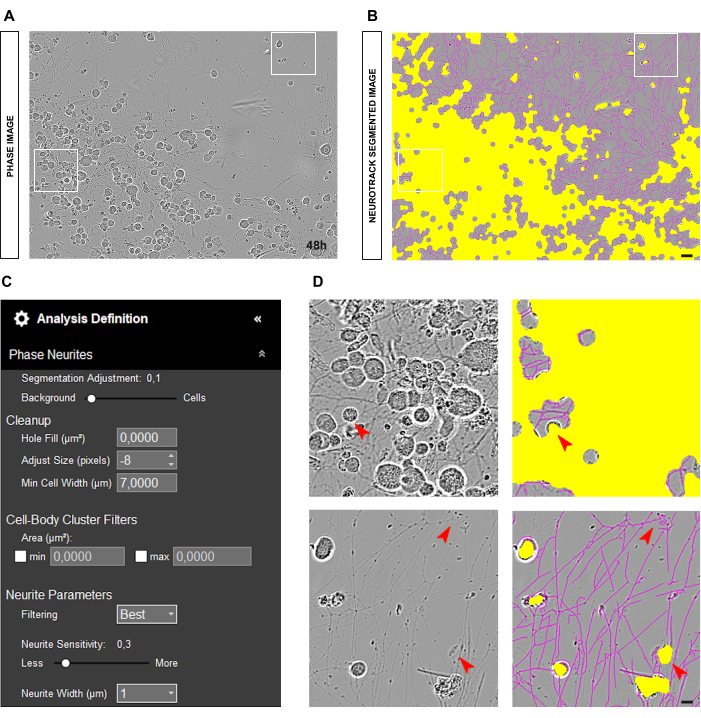
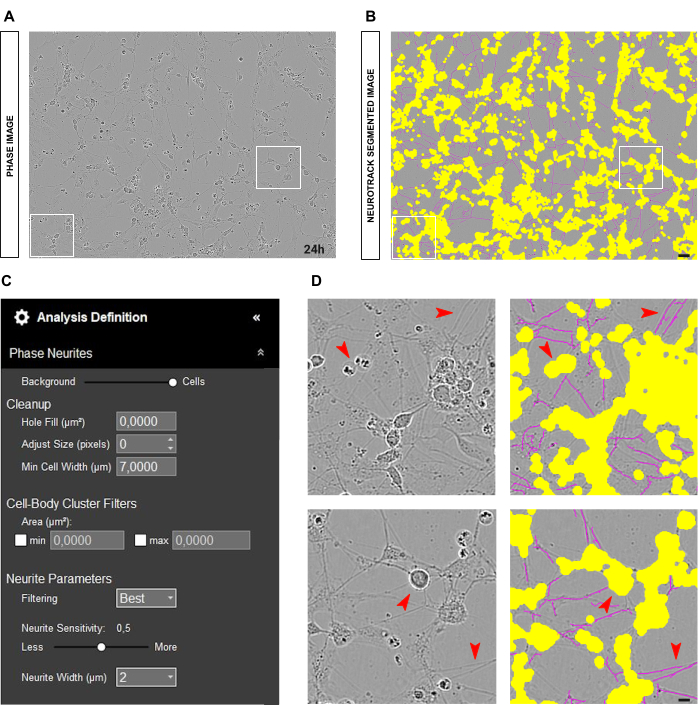
الشكل 2: خطأ البذر في مزرعة الخلايا العصبية الحسية للبالغين. (أ) صورة المرحلة التمثيلية لخطأ البذر. (ب) صورة مجزأة تمثيلية تلقائيا. يقطع القناع الأصفر أجسام الخلايا ، ويقطع القناع الأرجواني الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (د) اللوحة العلوية: تكبير خطأ تجزئة جسم الخلية (القناع الأصفر) بسبب تجمع أجسام الخلايا. اللوحة السفلية: تكبير خطأ تجزئة الخلايا العصبية (قناع أرجواني) بسبب الحطام الخلوي. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
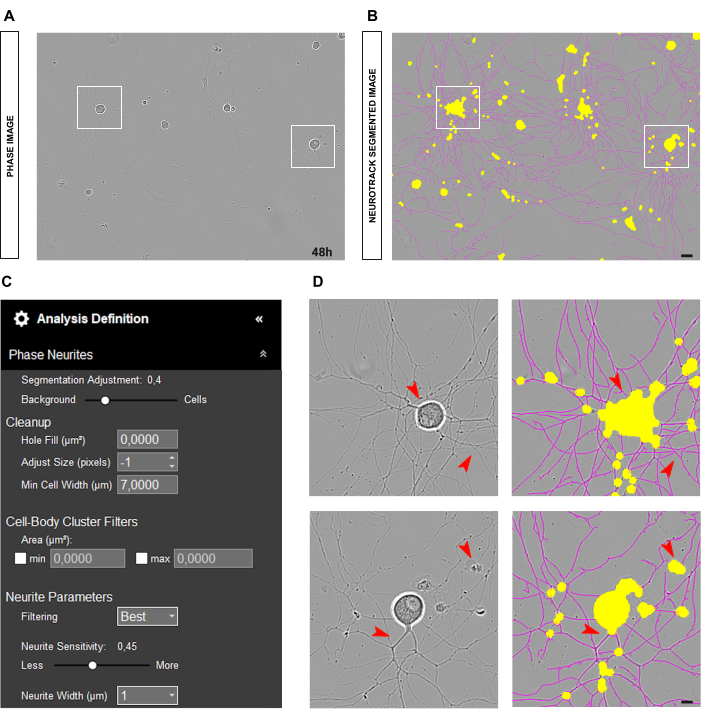
الشكل 3: مزرعة الخلايا العصبية الحسية المثالية للبالغين لتحليل نمو الخلايا العصبية. (أ) صورة طور تمثيلية لحالة بذر مثالية لتحليل نمو الخلايا العصبية. (ب) صورة مجزأة تمثيلية تلقائيا. يقطع القناع الأصفر أجسام الخلايا ، ويقطع القناع الأرجواني الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. د: تكبير تجزئة جسم الخلية (القناع الأصفر) وتجزئة الخلايا العصبية (القناع الأرجواني). تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
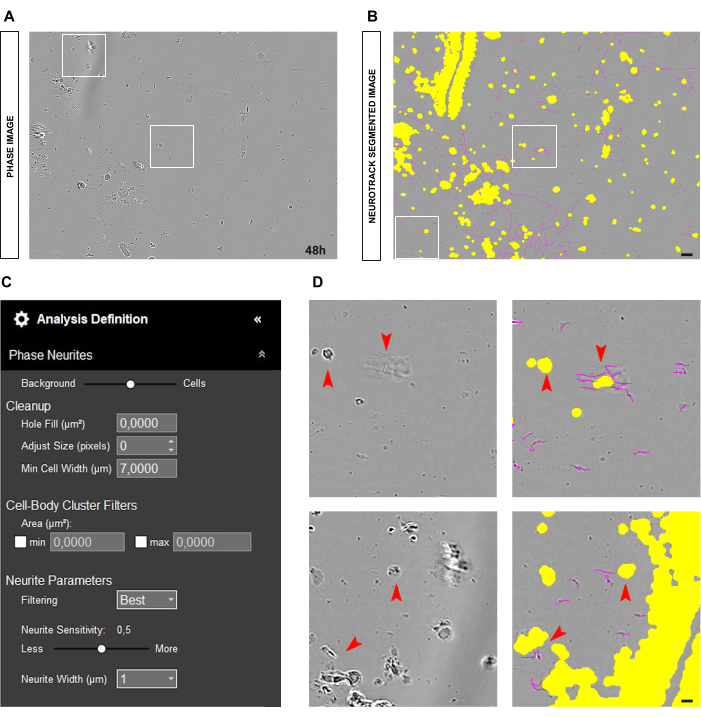
الشكل 4: العناصر المزعجة في تحليل النواتج العصبية في مزرعة الخلايا العصبية الحسية للبالغين. (أ) صورة طور تمثيلية للحطام الخلوي والظلال بسبب الحركات المتوسطة. (ب) صورة مجزأة تمثيلية تلقائيا. يقطع القناع الأصفر أجسام الخلايا ، ويقطع القناع الأرجواني الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (د) تكبير خطأ تجزئة جسم الخلية (القناع الأصفر) وتجزئة الخلايا العصبية (القناع الأرجواني) بسبب حطام الخلية وظلال الوسط المتحرك. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
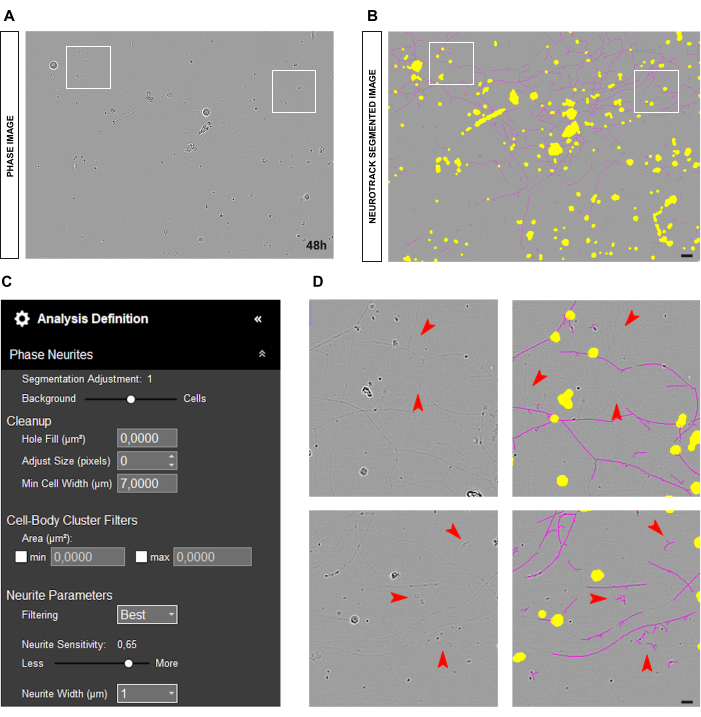
الشكل 5: الخلايا العصبية الرقيقة في تحليل النتوءات العصبية في مزرعة الخلايا العصبية الحسية للبالغين. أ: صورة الطور التمثيلي للخلايا العصبية التي تتميز بخلايا عصبية رقيقة جدا. (ب) صورة مجزأة تمثيلية تلقائيا. يقطع القناع الأصفر أجسام الخلايا ، ويقطع القناع الأرجواني الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (D) اللوحة العلوية: تكبير فقدان طول الخلايا العصبية بسبب حدود الكشف عن تجزئة الخلايا العصبية (قناع أرجواني). اللوحة السفلية: تكبير خطأ تجزئة الخلايا العصبية (قناع أرجواني) على الأجسام الغريبة. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
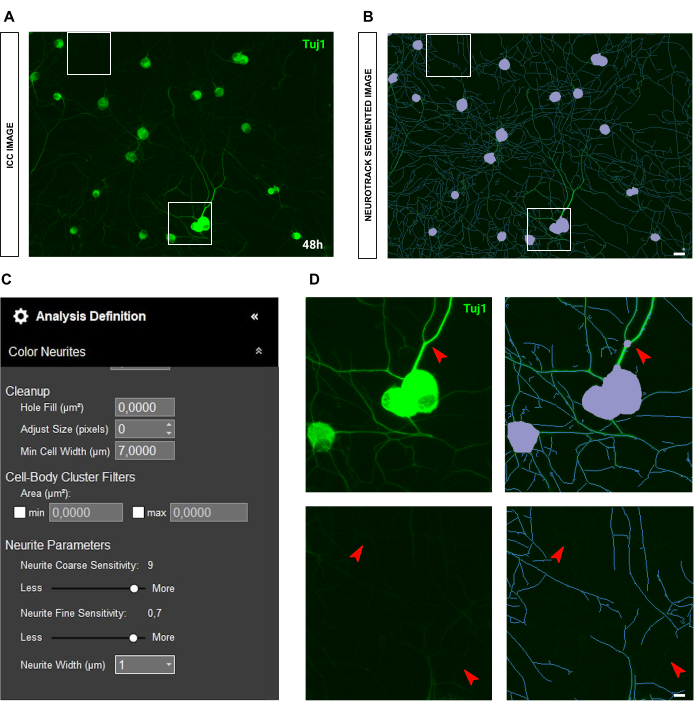
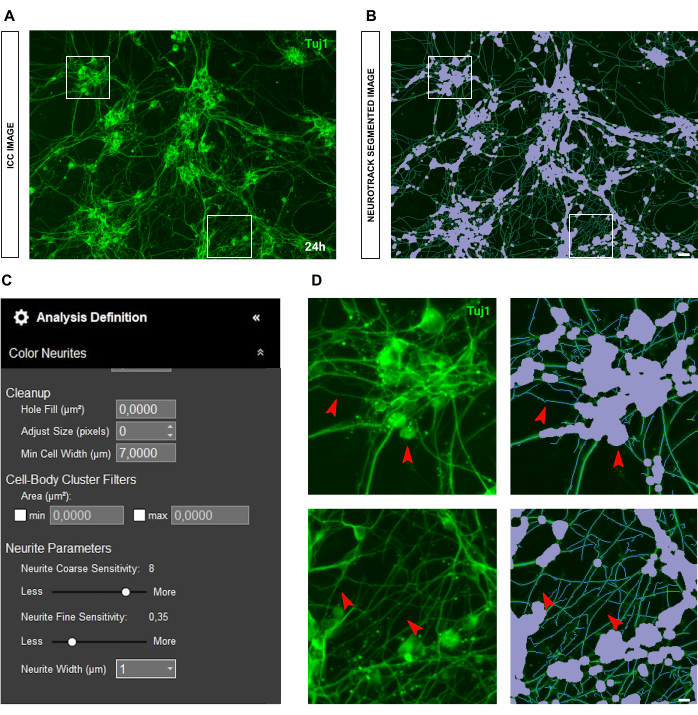
الشكل 6: سطوع الخلايا العصبية في تحليل نتوء الخلايا العصبية في مزرعة الخلايا العصبية الحسية للبالغين. (أ) صورة الكيمياء المناعية التمثيلية (العلامة العصبية Tuj1) للخلايا العصبية التي تتميز بخلايا عصبية ساطعة وسميكة للغاية. (ب) صورة مجزأة تمثيلية تلقائيا. القناع الأرجواني يقطع أجسام الخلايا ، والقناع الأزرق يقطع الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (د) اللوحة العلوية: تكبير خطأ تجزئة جسم الخلية (قناع أرجواني) بسبب سمك الخلايا العصبية. اللوحة السفلية: تكبير فقدان طول الخلايا العصبية بسبب سطوع مضان مكثف للأعصاب السميكة. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 7: مضان الخلفية في تحليل نمو الخلايا العصبية في مزرعة الخلايا العصبية الحسية للبالغين. (أ) صورة الكيمياء المناعية التمثيلية (العلامة العصبية Tuj1) لضوضاء مضان عالية الخلفية. (ب) صورة مجزأة تمثيلية تلقائيا. القناع الأرجواني يقطع أجسام الخلايا ، والقناع الأزرق يقطع الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (د) تكبير خطأ تجزئة الخلايا العصبية (القناع الأزرق) بسبب تداخل مضان الخلفية. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: تشتت الضوء في تحليل نمو الخلايا العصبية لثقافة الخلايا العصبية الحسية البالغة. (أ) صورة الكيمياء المناعية التمثيلية (العلامة العصبية Tuj1) لتشتت الضوء. (ب) صورة مجزأة تمثيلية تلقائيا. القناع الأرجواني يقطع أجسام الخلايا ، والقناع الأزرق يقطع الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. (D) اللوحة العلوية: تكبير فقدان طول الخلايا العصبية بسبب تداخل تشتت الضوء. اللوحة السفلية: تكبير خطأ تجزئة جسم الخلية (قناع أرجواني). تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 9: الأخطاء المؤثرة على الجودة في إجراء التلوين التي تتداخل مع تحليل نمو الخلايا العصبية لثقافة الخلايا العصبية الحسية البالغة. أ: على اليسار، صورة طور تمثيلي للخلايا العصبية الحسية البالغة. على اليمين ، صورة تمثيلية للكيمياء المناعية (علامة الخلايا العصبية Tuj1) للخلايا العصبية المكسورة بسبب الغسيل في إجراء التلطيخ. ب: على اليسار، صورة طور تمثيلية للخلايا العصبية الحسية البالغة. على اليمين ، صورة تمثيلية للكيمياء المناعية (علامة الخلايا العصبية Tuj1) لإزالة جسم الخلية بسبب غسل إجراء التلطيخ. تم الحصول على الصور بعد 48 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 10: زراعة الخلايا العصبية الحسية الجنينية المثالية (E13.5) لتحليل نمو الخلايا العصبية. (أ) صورة طور تمثيلية لحالة بذر مثالية لتحليل نمو الخلايا العصبية في مزرعة الخلايا العصبية الحسية الجنينية. (ب) صورة مجزأة تمثيلية تلقائيا. يقطع القناع الأصفر أجسام الخلايا ، ويقطع القناع الأرجواني الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. د: تكبير تجزئة جسم الخلية (القناع الأصفر) وتجزئة الخلايا العصبية (القناع الأرجواني). تم الحصول على الصور بعد 24 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 11: مزرعة الخلايا العصبية الحسية الجنينية المثالية (E13.5) لتحليل نمو الخلايا العصبية. (أ) صورة الكيمياء المناعية التمثيلية (العلامة العصبية Tuj1) لثقافة الخلايا العصبية الحسية الجنينية المثالية لتحليل نمو الخلايا العصبية. (ب) صورة مجزأة تمثيلية تلقائيا. القناع الأرجواني يقطع أجسام الخلايا ، والقناع الأزرق يقطع الخلايا العصبية. (ج) بارامترات تعريف تحليل نتوء الخلايا العصبية التوضيحية. د: تكبير تجزئة جسم الخلية (القناع الأرجواني) وتجزئة الخلايا العصبية (القناع الأزرق). تم الحصول على الصور بعد 24 ساعة من البذر. التكبير 20x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 12: زادت خلايا NSC-34 المتمايزة من الخلايا العصبية والتفرع مقارنة بالضوابط غير المتمايزة. صور تمثيلية لخلايا NSC-34. اللوحة العلوية: خلايا NSC-34 غير متمايزة (تحكم). اللوحة السفلية: خلايا NSC-34 متمايزة بعد 96 ساعة من العلاج بحمض الريتينويك. على الجانب الأيسر من كلتا اللوحتين ، صور تباين الطور ، بينما على الجانب الأيمن من كلتا اللوحتين ، الصور المجزأة تلقائيا (سوما باللون الأصفر ، الخلايا العصبية باللون الأرجواني). تم الحصول على الصور بعد 96 ساعة من البذر. التكبير 10x. شريط مقياس ، 50 ميكرومتر. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
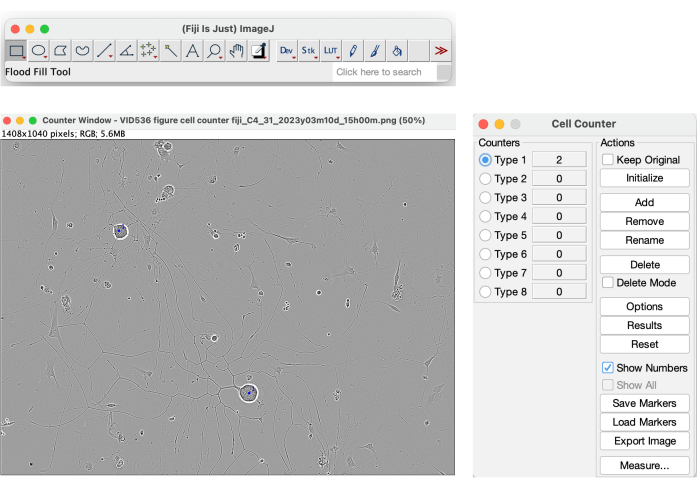
الشكل 13: أداة عداد الخلايا في فيجي. يتم إجراء عدد الخلايا يدويا على صورة طورية لحالة بذر مثالية لتحليل نمو الخلايا العصبية. التكبير 20x. تم إنشاء الرقم باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نوع الثقافة | ثقافة DRG للبالغين (المرحلة) | زراعة DRG الجنينية (المرحلة) | NSC-34 (المرحلة) |
| التكبير | 20 ضعفا | 20 ضعفا | 10 أضعاف |
| وضع التجزئة | وضح | وضح | وضح |
| تعديل التجزئة | 0.5 - 0.7 | 1.7 - 2 | 1 |
| ضبط الحجم (بكسل) | 0, +1, +2 | 0, +1 | 0 |
| تصفيه | أفضل | أفضل | أفضل |
| حساسية الأعصاب | 0.4 - 0.5 | 0.25 - 0.4 | 0.3 - 0.5 |
| عرض العصفور | 1 | 2 | 2 |
الجدول 1: ملخص معلمات تعريف التحليل المقترحة لمزارع الخلايا العصبية الحسية البالغة ، ومزارع الخلايا العصبية الحسية الجنينية (E13.5) ، ومزارع NSC-34 في صور تباين الطور.
| نوع الثقافة | ثقافة DRG للبالغين (ICC) | ثقافة DRG الجنينية (ICC) |
| التكبير | 20 ضعفا | 20 ضعفا |
| وضع التجزئة | وضح | وضح |
| تعديل التجزئة | 0.5 - 0.7 | 1.7 - 2 |
| ضبط الحجم (بكسل) | 0, +1, +2 | 0, +1 |
| تصفيه | أفضل | أفضل |
| حساسية العصفور الخشنة | 8 - 9 | 8 - 9 |
| حساسية الأعصاب الدقيقة | يصل إلى 0.75 | 0.5 - 0.75 |
| عرض العصفور | 1 | 2 |
الجدول 2: ملخص معلمات تعريف التحليل المقترحة لمزارع الخلايا العصبية الحسية البالغة ، ومزارع الخلايا العصبية الحسية الجنينية (E13.5) ، ومزارع NSC-34 في صور الكيمياء المناعية.
| أصدر | اقتراحات |
| ثقافة قذرة | ضبط شريط تمرير التجزئة باتجاه الخلايا |
| زيادة ضبط معلمة الحجم (+1 ، + 2 ...) | |
| انخفاض طفيف في حساسية الأعصاب | |
| الخلايا العصبية الشاحبة / الرقيقة | زيادة حساسية الأعصاب (0.6 على الأقل) |
| اضبط منزلق التجزئة باتجاه الخلايا. | |
| الخلايا العصبية الرقيقة في ICC | زيادة حساسية الأعصاب الدقيقة (حتى 0.75) |
| تقليل الحساسية الخشنة العصبية (على الأقل إلى 8-9) | |
| الخلايا الدبقية | ضبط شريط تمرير التجزئة باتجاه الخلايا (1.7-2) |
| عرض العصبون عند 2 |
الجدول 3: ملخص معلمات تعريف التحليل المقترحة لحل قضايا محددة في أنواع مختلفة من الثقافات.
Discussion
يعد القياس الدقيق لكيفية نمو الخلايا العصبية في الظروف الصحية والمصابة والمريضة معلمة حاسمة في العديد من الإعدادات التجريبية في مجال علم الأعصاب. سواء كان العمل مع الثقافات العضوية لنباتات DRG الكاملة أو الثقافات المنفصلة ، فإن قياس النمو المحوري بشكل صحيح كان تحديا كبيرا على مدار ال 20 عاما الماضية. بدون تقدير كمي موثوق ودقيق لنمو الخلايا العصبية ، من المستحيل تقييم ما إذا كان علاج معين ، مثل حمض الريتينويك (لمدة 4 أيام) لخلايا NSC-3434 أو neurotrophins (لمدة 1-2 أيام) للخلايا العصبية DRG الجنينية 14,35 ، كان فعالا. تظهر الخلايا العصبية عادة نموا مستمرا عندما تكون بصحة جيدة. ومع ذلك ، بعد الإصابة يزيد معدل نمو المحورالعصبي 12,13. التوقيت أمر بالغ الأهمية عند قياس نمو المحور. لذلك ، قبل البدء في التجربة ، من الضروري إجراء اختبار تجريبي لتحديد الوقت الأمثل لتثبيت الخلايا بناء على منحنى هضبة معدل نموها.
يمثل اختيار الطريقة ، يدويا أو تلقائيا ، نقطة تحول من حيث إنفاق الوقت والدقة. تتضمن بعض الطرق اليدوية الأكثر شيوعا NeuronJ18،20 و Metamorph (زائر) 2،22،28. تتطلب الطرق اليدوية من المستخدمين تتبع الخلايا العصبية يدويا ، وهو أمر يستغرق وقتا طويلا للغاية ويتطلب صورا أحادية الخلية. مع التجزئة اليدوية للأعصاب ، تكون الشبكات العصبية بعيدة المنال تماما. عادة ، تقيس هذه المنهجيات أطول محور عصبي فقط أو تستخدم قياس مسافة المتجه ، وبالتالي تفقد معلومات مهمة مثل عدد نقاط الفرع والطول المحوري الإجمالي. يتم توفير بعض التحسن إلى حد ما من خلال تحليل Sholl30 ، والذي يقتصر على أي حال على ظروف الخلية الواحدة. يمثل تحليل الخلية الواحدة العديد من التحديات ، بدءا من بذر الخلايا. يجب طلاء الخلايا العصبية بتركيز منخفض جدا ، والذي قد لا يكون حالة النمو الأنسب لكل نوع من الخلايا. تنشأ مشكلة أخرى من الحصول على الصور. عادة ، يتم استخدام المجهر متحد البؤر للتصوير ، الأمر الذي يتطلب مستخدمين مدربين وخلايا عصبية فلورية وليس فعالا من حيث الوقت ولا التكلفة. باستخدام المجهر متحد البؤر ، يتم الحصول على صور عالية الدقة ، ولكن يتم تصوير عدد قليل جدا من الخلايا العصبية من كل تجربة. يمثل هذا قيدا لأن المزيد من التكرارات البيولوجية ضرورية للوصول إلى عدد كاف من الخلايا العصبية.
بعض المنهجيات التلقائية مثل NeuroMath 2,28 تحل مشكلة تجزئة الأعصاب التي تستغرق وقتا طويلا والتي يتم تنفيذها بطريقة تلقائية.
ومع ذلك ، نظرا لضيق الوقت ، توفر وحدة قياس نمو الخلايا العصبية هذه نتائج أسرع عند التقاط الصور في جهاز الفحص المجهري بفاصل زمني. هذا الأخير ، جنبا إلى جنب مع هذا البرنامج ، يحسن بشكل كبير من الوقت وفعالية التكلفة لكل من الطلاب والباحثين الرئيسيين.
تسمح آلة الاستحواذ بإنشاء خريطة كاملة للبئر ، والحصول على عدد متغير من الصور بناء على قطر البئر. يمثل هذا ميزة كبيرة حيث يتم تصوير خلايا عصبية متعددة في نفس الوقت. ومع ذلك ، فإن الوصول إلى تكبير 20x فقط كاف ومناسب لتحليل الصور باستخدام البرنامج. تعتمد قوتها في قدرتها على التدريب على مجموعة من الصور وإجراء قياس شبه تلقائي لطول المحور العصبي. بالإضافة إلى ذلك ، يمكن للبرنامج العمل على كل من الخلايا العصبية المفردة والشبكات العصبية. البرنامج قادر على تقسيم الخلايا العصبية وأجسام الخلايا باستخدام قناعين مختلفين. يقسم القناع الأصفر كل الكائنات عالية التباين في الصورة، مثل أجسام الخلايا، بقايا الخلايا، والظلال. قناع أرجواني ، بدلا من ذلك ، يقطع الخلايا العصبية. تم إثبات دقة ودقة البرنامج من خلال تجزئة نفس الخلايا العصبية مع كل من البرنامج و NeuronJ. من وجهة نظر التحليل الإحصائي ، ترتبط قيم أطوال الخلايا العصبية بشكل جيد بمعامل ارتباط سبيرمان العالي.
بعد تقييم موثوقية الطريقة ، انتقلنا إلى تحليل ظروف الاختبار المختلفة. للحصول على التحليل الأمثل ، هناك حاجة إلى بعض الاحتياطات. أولا ، يجب زرع الخلايا العصبية بشكل موحد في البئر ، وتجنب البقع ذات التركيز العالي للخلايا. يؤدي تجميع الخلايا العصبية إلى فقدان البرنامج للدقة في اكتشاف الخلايا العصبية. متغير آخر يؤثر على دقة ودقة التحليل هو نظافة الثقافة. يفضل وجود ثقافة نظيفة مع القليل من الحطام الخلوي والخلايا الميتة. ومع ذلك ، فإن البرنامج قادر على تعويض مثل هذه المشكلات عن طريق تعديل حساسية الخلايا العصبية وقناع تجزئة جسم الخلية. كما ذكرنا سابقا ، يقطع القناع الأصفر كائنات عالية التباين ، من بينها أيضا ظلال ناتجة عن حركة الوسط في البئر. قد تغطي الظلال الخلايا العصبية ، مما يؤدي إلى فقدان طول الخلايا العصبية. ومع ذلك ، يمكن حل هذه المشكلة بسهولة عن طريق السماح للوسيط بالاستقرار قبل الحصول على الصورة.
الخوارزمية قادرة على إجراء قياس كمي لطول الخلايا العصبية على كل من صور تباين الطور وصور الكيمياء المناعية. عندما يتعلق الأمر بالتألق ، يجب اتخاذ احتياطات أخرى من أجل الحصول على تحليل موثوق. أولا ، تؤثر جودة التلوين بعمق على نتيجة التحليل. إذا تم كسر الخلايا العصبية أو تجزئتها وتمزقت أجسام الخلايا أثناء الغسيل ، يفقد التحليل قوته وموثوقيته. بالإضافة إلى ذلك ، يمثل التألق نفسه عنصرا مزعجا محتملا للتحليل. نظرا لأن التركيز يتم تنفيذه تلقائيا بواسطة الجهاز ، فإن الهدف يضع على التركيز على الأشياء الساطعة جدا مثل القطع الأثرية أو أجسام الخلايا أو الخلايا العصبية السميكة. نتيجة لذلك ، يتم ترك الخلايا العصبية الأرق والأقل سطوعا ، مما يجعل من الصعب على المستخدم قياس طول الخلايا العصبية بشكل صحيح.
نتيجة لذلك ، قد يكون تحليل صور الطور أكثر صحة مقارنة بتحليل صور الكيمياء المناعية. البرنامج قادر على العمل على العديد من الأشكال العصبية المختلفة من الأكثر تعقيدا وتفصيلا إلى أبسطها ، إما كخلايا مفردة أو في شبكات عصبية. لذلك ، يمكن استخدامه في العديد من مجالات البحث المختلفة ، بدءا من الثقافات الأولية للخلايا العصبية القادمة من الجهاز العصبي المركزي أو المحيطي في مراحل النمو المختلفة إلى الخلايا العصبية المشتقة من iPSC وخطوط الخلايا مثل NSC-34.
على الرغم من الإمكانات الكبيرة للبرنامج ، يمكن ملاحظة بعض القيود. أولا ، دقة تجزئة جسم الخلية دون المستوى الأمثل. وبالتالي ، لا يمكن استخدام معلمات مثل كتلة جسم الخلية ومنطقة كتلة جسم الخلية بشكل موثوق لعد الخلايا. ثانيا ، بالإضافة إلى الاحتياطات اللازمة لتجزئة الخلايا العصبية المثلى ، قد يتم استبعاد محاور عصبية غير سميكة بما فيه الكفاية من قياس طول الخلايا العصبية ، مما يؤدي إلى فقدان البيانات.
تواجه معلمة نقطة الفرع مشكلات تتعلق بكلا النوعين من التجزئة. الظلال أو الخلايا الميتة أو الحطام في الثقافة التي تتمركز على نقاط الفروع تحجبها لأنها مغطاة بتجزئة جسم الخلية. علاوة على ذلك ، في حالة الخلايا العصبية الرقيقة ، تتعرض موثوقية معلمة نقطة الفرع للخطر الشديد مرة أخرى.
علاوة على ذلك ، يمكن أن يكون التركيز التلقائي أثناء الحصول على الصور في بعض الأحيان دون المستوى الأمثل. يقتصر التكبير الأقصى للآلة على 20x ، وهو ما قد يكون غير كاف لمراقبة التفاصيل الدقيقة أو التألق في الهياكل النحيلة مثل الخلايا العصبية. بالإضافة إلى ذلك ، تعمل الماكينة بشكل أفضل مع ركائز بلاستيكية متجانسة. إذا تم إدخال غطاء زجاجي في البئر ، فقد يفشل التركيز على الزجاج ، مما يؤدي إلى صور غير واضحة جزئيا. ومع ذلك ، لا ينطبق هذا البرنامج على الخلايا العصبية فحسب ، بل ينطبق أيضا على مجالات البحث المختلفة تماما ، مثل نمو الفطريات36.
كل الأشياء التي تم وضعها في الاعتبار ، نعتقد أن وحدة قياس نمو الخلايا العصبية هذه هي أداة موثوقة لقياس الخلايا العصبية بسرعة وبشكل غير متحيز وفعال.
Disclosures
يعلن المؤلفون أن البحث قد أجري دون أي علاقات تجارية أو مالية يمكن أن تخلق تضاربا في المصالح.
Acknowledgements
نود أن نشكر أليساندرو فرشيلي على التعليقات النقدية ودعم سارتوريوس الفني للمساعدة. تم دعم بحثنا حول هذه الموضوعات بسخاء من قبل منحة ريتا ليفي مونتالتشيني 2021 (MIUR ، إيطاليا). تم تمويل هذا البحث من قبل وزارة السياحة في جامعة وجامعة ريسيركا MIUR مشروع Dipartimenti di Eccellenza 2023-2027 إلى قسم علم الأعصاب ريتا ليفي مونتالتشيني. تم إجراء بحث DMR أثناء وبدعم من دورة الدكتوراه الوطنية الإيطالية المشتركة بين الجامعات في التنمية المستدامة وتغير المناخ (رابط: www.phd-sdc.it).
Materials
| Name | Company | Catalog Number | Comments |
| Collagenase A | Merck / Roche | 10103586001 | |
| Dispase II (neutral protease, grade II) | Merck / Roche | 4942078001 | |
| Dulbecco's modified eagle's medium | Merck / Sigma | D5796 | |
| Fetal bovin serum | Merck / Sigma | F7524 | |
| Ham's F-12 Nutrient Mix (1X) | ThermoFisher Scientific | 21765029 | |
| Ham's F12 w/ L-Glutamine | Euroclone | ECM0135L | |
| Hanks' Balanced Salt Solution | Euroclone | ECM0507L | |
| HBSS (10X), no calcium, no magnesium, no phenol red | ThermoFisher Scientific | 14185045 | |
| HyClone Characterized Fetal Bovine Serum (U.S.) | Cytiva | SH30071.03 | |
| Incucyte, Neurotrack Analysis Software | Sartorius | 9600-0010 | |
| L-15 Medium (Leibovitz) | Millipore/Sigma | L5520 | |
| Laminin Mouse Protein, Natural | ThermoFisher Scientific | 23017015 | |
| L-Cysteine | Merck / Sigma | C7352 | |
| Leibovitz's L-15 medium w/o L-glutamine | Euroclone | ECB0020L | |
| mouse NGF 2.5S (>95%) | Alomone Labs | N-100 | |
| Neurobasal Medium [-] Glutamine | ThermoFisher Scientific | 21103049 | |
| NSC-34 | CELLutions Biosystems Inc (Ontario, Canada) | CLU140 | |
| Papain from papaya latex | Sigma | P4762 | |
| Penicillin-Streptomycin (5,000 U/mL) | ThermoFisher Scientific | 15070063 | |
| Percoll (Density 1.130 g/mL) | Cytiva | 17089101 | |
| Poly-D-Lysine Solution (1mg/mL) | EMD Millipore/Merck | A-003-E | |
| Poly-L-Lysine Solution (0-01%) | Sigma | P4832 | |
| Recombinant Human NT-3 | PeproTech | 450-03 | |
| Retinoic Acid | Merck / Sigma | R2625 | |
| Trypsin-EDTA solution | Sigma | T3924 | |
| β-Tubulin III (Tuj1) antibody | Merck / Sigma | T8660 |
References
- Terenzio, M., et al. Locally translated mTOR controls axonal local translation in nerve injury. Science. 359, 1416-1421 (2018).
- Marvaldi, L., et al. Enhanced axon outgrowth and improved long-distance axon regeneration in sprouty2 deficient mice. Dev Neurobiol. 75, 217-231 (2015).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. J Cell Biol. 218, 1871-1890 (2019).
- Marvaldi, L., et al. Importin α3 regulates chronic pain pathways in peripheral sensory neurons. Science. 369, 842-846 (2020).
- Gangadharan, V., et al. Neuropathic pain caused by miswiring and abnormal end organ targeting. Nature. 606, 137-145 (2022).
- Testa, L., Dotta, S., Vercelli, A., Marvaldi, L., et al. Communicating pain: emerging axonal signaling in peripheral neuropathic pain. Front Neuroanat. 18, (2024).
- Thongrong, S., et al. Sprouty2 and -4 hypomorphism promotes neuronal survival and astrocytosis in a mouse model of kainic acid induced neuronal damage. Hippocampus. 26, 658-667 (2016).
- Yaron, A., Schuldiner, O. Common and divergent mechanisms in developmental neuronal remodeling and dying back neurodegeneration. Curr Biol. 26, R628-R639 (2016).
- Maor-Nof, M., et al. Axonal degeneration is regulated by a transcriptional program that coordinates expression of pro- and anti-degenerative factors. Neuron. 92, 991-1006 (2016).
- Bromberg, K. D. Regulation of neurite outgrowth by Gi/o signaling pathways. Front Biosci. 13, 4544-4557 (2008).
- Girouard, M. P., et al. Collapsin response mediator protein 4 (CRMP4) facilitates wallerian degeneration and axon regeneration following Sciatic nerve injury. eNeuro. 7, 0479-0419 (2020).
- van Erp, S., et al. Age-related loss of axonal regeneration is reflected by the level of local translation. Exp Neurol. 339, 113594 (2021).
- Wang, X., et al. Driving axon regeneration by orchestrating neuronal and non-neuronal innate immune responses via the IFNγ-cGAS-STING axis. Neuron. 111, 236-255.e7 (2023).
- Kaselis, A., Treinys, R., Vosyliūtė, R., Šatkauskas, S. DRG axon elongation and growth cone collapse rate induced by Sema3A are differently dependent on NGF concentration. Cell Mol Neurobiol. 34, 289-296 (2014).
- Maier, O., et al. Differentiated NSC-34 motoneuron-like cells as experimental model for cholinergic neurodegeneration. Neurochem Int. 62, 1029-1038 (2013).
- Nango, H., et al. Highly efficient conversion of motor neuron-like NSC-34 cells into functional motor neurons by Prostaglandin E2. Cells. 9, 1741 (2020).
- Kim, H. W., Caspar, T., Shah, S. B., Hsieh, A. H. Effects of proinflammatory cytokines on axonal outgrowth from adult rat lumbar dorsal root ganglia using a novel three-dimensional culture system. Spine J. 15, 1823-1831 (2015).
- Frey, E., et al. An in vitro assay to study induction of the regenerative state in sensory neurons. Exp Neurol. 263, 350-363 (2015).
- Zhang, Z., et al. Cerebellar injury and impaired function in a rabbit model of maternal inflammation induced neonatal brain injury. Neurobiol Learn Mem. 165, 106901 (2019).
- Pemberton, K., Mersman, B., Xu, F. Using ImageJ to assess neurite outgrowth in mammalian cell cultures: Research data quantification exercises in undergraduate neuroscience lab. J Undergrad Neurosci Educ. 16, A186-A194 (2018).
- Marvaldi, L., Hausott, B., Auer, M., Leban, J., Klimaschewski, L. A Novel DRAK inhibitor, SC82510, promotes axon branching of adult sensory neurons in vitro. Neurochem Res. 39, 403-407 (2014).
- Quarta, S., et al. Peripheral nerve regeneration and NGF-dependent neurite outgrowth of adult sensory neurons converge on STAT3 phosphorylation downstream of neuropoietic cytokine receptor gp130. J Neurosci. 34, 13222-13233 (2014).
- Woitke, F., et al. Adult hippocampal neurogenesis poststroke: More new granule cells but aberrant morphology and impaired spatial memory. PLoS One. 12, e0183463 (2017).
- Xiao, X., et al. Automated dendritic spine detection using convolutional neural networks on maximum intensity projected microscopic volumes. J Neurosci Meth. 309, 25-34 (2018).
- Pool, M., Thiemann, J., Bar-Or, A., Fournier, A. E. NeuriteTracer: A novel ImageJ plugin for automated quantification of neurite outgrowth. J Neurosci Meth. 168, 134-139 (2008).
- Wang, D., et al. HCA-Vision: Automated neurite outgrowth analysis. SLAS Disc. 15, 1165-1170 (2010).
- Whitlon, D. S., et al. Novel high content screen detects compounds that promote neurite regeneration from cochlear spiral ganglion neurons. Sci Rep. 5, 15960 (2015).
- Rishal, I., et al. WIS-neuromath enables versatile high throughput analyses of neuronal processes. Dev Neurobiol. 73, 247-256 (2013).
- Smith, D. S., Pate Skene, J. H. A Transcription-dependent switch controls competence of adult neurons for distinct modes of axon growth. J Neurosci. 17, 646-658 (1997).
- Gardiner, N. J., et al. Preconditioning injury-induced neurite outgrowth of adult rat sensory neurons on fibronectin is mediated by mobilisation of axonal α5 integrin. Mol Cell Neurosci. 35, 249-260 (2007).
- Hauck, J. S., et al. Heat shock factor 1 directly regulates transsulfuration pathway to promote prostate cancer proliferation and survival. Commun Biol. 7, 9 (2024).
- Zhu, Y., et al. Loss of WIPI4 in neurodegeneration causes autophagy-independent ferroptosis. Nat Cell Biol. 26, 542-551 (2024).
- Reggiani, F., et al. BET inhibitors drive Natural Killer activation in non-small cell lung cancer via BRD4 and SMAD3. Nat Commun. 15, 2567 (2024).
- Ackerman, H. D., Gerhard, G. S. Bile acids induce neurite outgrowth in NSC-34 cells via TGR5 and a distinct transcriptional profile. Pharmaceuticals. 16, 174 (2023).
- Tuttle, R., Matthew, W. D. Neurotrophins affect the pattern of DRG neurite growth in a bioassay that presents a choice of CNS and PNS substrates. Development. 121, 1301-1309 (1995).
- Wurster, S., et al. Live monitoring and analysis of fungal growth, viability, and mycelial morphology using the IncuCyte NeuroTrack processing module. mBio. 10 (3), e00673-e00619 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved