Method Article
神経突起伸長測定のための新しい半自動ソフトウェアの標準化
* これらの著者は同等に貢献しました
要約
神経突起伸長アッセイは、再生ニューロンプロセスに関する定量的な値を提供します。この半自動ソフトウェアの利点は、マスクを作成することで細胞体と神経突起を別々にセグメント化し、神経突起の長さ、分岐点の数、細胞体クラスター面積、細胞クラスター数などのさまざまなパラメータを測定できることです。
要約
神経突起の伸長をリアルタイムで測定するためには、神経細胞の形態を評価するために、効果的なライブイメージング技術が不可欠です。神経突起伸長の適切な測定は、神経科学研究分野で長年にわたる課題でした。このパラメータは、解離培養や器官型培養から細胞株に至るまで、数多くの in vitro 実験セットアップの基礎として機能します。神経突起の長さを定量化することにより、特定の治療が機能したかどうか、または軸索再生がさまざまな実験グループで促進されたかどうかを判断することができます。この研究では、Incucyte Neurotrack 神経突起伸長解析ソフトウェアの堅牢性と精度を実証することを目的としています。この半自動ソフトウェアは、位相差画像の神経突起長の定量化において一般的に使用される方法論に比べていくつかの利点を提供するタイムラプス顕微鏡システムで利用できます。このアルゴリズムは、各画像内のいくつかのパラメーターをマスクして定量化し、神経突起の長さ、分岐点、細胞体クラスター、細胞体クラスター領域などのニューロン細胞メトリクスを返します。まず、ソフトウェアの堅牢性と精度を、フィジーのプラグインである手動のNeuronJの値と相関させることで検証しました。次に、位相差画像と免疫細胞化学画像の両方で機能できるアルゴリズムを使用しました。特異的なニューロンマーカーを用いて、感覚ニューロンの in vitro 培養における蛍光ベースの神経突起伸長解析の実現可能性を検証しました。さらに、このソフトウェアは、個々の細胞から複雑なニューロンネットまで、さまざまな播種条件で神経突起の長さを測定できます。結論として、このソフトウェアは、神経突起伸長アッセイのための革新的で時間効率の良いプラットフォームを提供し、より迅速で信頼性の高い定量への道を開きます。
概要
坐骨神経では、軸索再生1を測定することが可能です。さらに、in vitro研究は、健康なニューロンと損傷したニューロンの両方において、軸索発芽から軸索変性までのさまざまな段階を理解するために、軸索伸長2,3を監視することの実現可能性を示しています。これらのプロセスを追跡することにより、軸索の極性、開始、安定性、分岐などのパラメータを測定することができます。最後のパラメータは、神経障害性疼痛の知覚を理解するために重要です4,5,6。同様に、軸索変性はin vivo7 またはin vitro 8,9で監視できます。神経突起伸長中、アクチンおよび微小管の細胞骨格ネットワークは、細胞10の必要性に応じて安定化または変化する。アクチン細胞骨格は、軸索成長円錐の形成を可能にするために再編成され、微小管は、成長する神経突起を安定させるために束に再整列する11。in vitroで中枢ニューロンと末梢ニューロンの神経突起伸長を研究するために、3つの一般的なパラメータ(総軸索長、最大距離、分岐点)が定量化されます。これらのパラメータは、治療(すなわち、ニューロトロフィン、化合物、阻害剤、レチノイン酸、siRNA、shRNA)または遺伝子組み換え動物12,13,14に対するニューロン伸長反応を研究するために使用される。ニューロンがより細長い神経突起および/またはより多くの分岐を持っているかどうかを評価するために、これらの3つのパラメータにより、ニューロンの形態を評価できます。神経突起長の測定は、いくつかのin vitro実験セットアップで最も重要なパラメータです。後根神経節からは、主に2種類の培養が行われます:解離したin vitro培養または全DRG外植片の器官型培養。いずれの場合も、神経突起の長さは実験の結果を評価するためのゴールドパラメータです。運動ニューロン様細胞株(NSC-34)では、レチノイン酸15,16による分化後に軸索伸長と分枝が測定されます。実際、神経突起伸長を測定することにより、特定の治療が効いたかどうか17、成長速度18、または傷害処置19後の再生能力を決定することが可能である。
神経突起の成長を適切に評価する方法は、研究分野で長年にわたって多くの課題を提起してきました。ただし、神経突起の長さの測定には標準化されていません。in vitro細胞培養に最も利用されている方法には、例えば、Fiji18,20またはMetaMorph21,23の手動NeuronJプラグイン、および半自動のNeurolucida23,24があります。手動の方法以外にも、Fiji25のNeuriteTracerプラグイン、HCA Visionソフトウェア26,27、WIS-NeuroMath 2,28などの自動的な方法もあります。他の精度の低い方法論は、ニューロンの全体的な寸法の測定に依存しています。これらの方法には、細胞体から最も長い軸索29の先端までのベクトル距離の測定、またはショール解析30が含まれる。ただし、これらの測定方法は、非常に低密度の培養物や単一のニューロンに適しています。さらに、これらの方法論はすべて、主に染色されたニューロンまたは遺伝的にコードされた蛍光色素(GFP、Venus、mCherryなど)を発現するニューロンに利用されます。ニューロンの種類と細胞培養の密度は、測定方法の選択に深く影響します。たとえば、DRGニューロンなど、非常に複雑で複雑な形態を持つニューロンを手動でセグメント化することは、簡単に不可能な作業になる可能性があります。畳み込みニューロンがすでにセグメンテーションが課題となっている場合、ニューラルネットは非常に複雑な組織であるため、手動のアプローチでは完全に手の届かないものです。
一方では、手動セグメンテーションは人間の目と知性によって実行されるため、非常に正確です。一方で、それは本当に時間がかかります。手動の方法による時間の浪費が主な欠点です。このため、解析のために取得されるニューロンはごくわずかであり、精度が低く、時間的にコストがかかります。一方、自動または半自動のアプローチは、時間の消費を部分的に削減します。ただし、いくつかの欠点もあります。自動的な手法を適切に機能させるには、トレーニングが必要であり、ソフトウェアがユーザーと十分に対話できなければ、セグメンテーションが間違っている可能性があります。
神経突起伸長の測定以外にも、分岐点の数も貴重な情報です。手動セグメンテーションでは、分岐点の数を計算できますが、ベクトル距離では計算できません。自動的な方法では、通常、分岐点の数が提供されますが、ショール分析では、数式で計算する必要があります。
このメソッドペーパーでは、軸索の全長とその他のパラメーターを測定する際のこの半自動ソフトウェアの機能と有効性を説明することを目的としています。この機械は、定義された時点での画像の自動取得や、生細胞の生理学的環境を維持しながら、長期研究(数日、数週間、数ヶ月)の実施を可能にします。位相コントラストタイムラプスイメージングを使用して神経突起の成長を測定すると、神経突起の動態と成長を継続的に監視できるという利点があります。さらに、死細胞31,32,33を標的とする特異的な色素を培地に添加することにより、細胞死をモニターすることも可能である。このソフトウェアは2012年にリリースされましたが、神経突起伸長の正確な定量化のために、再現性のある偏りのない方法でこの方法論を標準化した最初のソフトウェアです。ただし、ソフトウェアはマシンの購入に含まれていないことに注意することが重要です。この追加費用にもかかわらず、その使用は、総軸索長およびその他のパラメータを測定する上で大きな利点を提供し、それによって神経科学の分野の研究に貢献します。
プロトコル
1.機械で容器をスキャンする
注:検出は、内蔵のBasler Ace 1920-155 μmカメラによって行われます。
- 「 Connect to Device 」をクリックし、「 Schedule - To Acquire」を選択して、プログラムを開きます。次に、 + 記号をクリックします。
- 船舶を繰り返しスキャンするか、1回のみスキャンするかを指定するには、それぞれ「 スケジュールに従ってスキャン 」または「 今すぐ1回スキャン」オプションを選択します。
- 新規 を選択して、スキャンする新しい船舶を作成します。新しい船舶が追加されていない場合は、以下で説明するオプションのいずれかを使用して新しいスキャンを作成します。
- [ 現在の コピー]を選択し、現在のスケジュールから船舶をコピーして新しい船舶を作成します。「 Copy Previous 」を選択して、以前にスキャンした船舶をコピーして新しい船舶を作成します。
- 「スキャンの追加」を選択して、以前にスキャンした船舶を復元し、追加のスキャンを行います。
- アッセイとアプリケーションに基づいてスキャンタイプを選択します。分析には、「 標準」を選択します。
- スキャン設定を指定します。Cell-by-Cellオプション(None、Adherent Cell-by-Cell、Non-adherent Cell-by-Cell)のいずれかを選択し、使用する蛍光分子に応じて画像チャンネルを指定します。成体および胚性感覚ニューロン培養の 「なし 」オプションを選択します。細胞株の場合は、「 なし」または「Adherent Cell-by-Cell 」オプションを選択します。
- 顕微鏡の対物レンズ(4倍、10倍、20倍)を選択します。初代培養では高倍率(20倍)で取得しますが、細胞株では10倍で十分です。
- 表示されるオプションから、スキャンする船舶のタイプを選択します。引き出し内の容器の位置を示すには、引き出しの仮想マップ上でその位置を選択します。
- スキャンするウェルを選択して、画像取得のスキャンパターンを指定します。ウェルごとに必要な画像数を選択します。スキャン時間の見積もりが表示されます。
- 名前を入力して船舶に関する情報を提供し、 + 記号をクリックしてプレートマップを指定します。
- 「次へ」をクリックします。[解析タイプ] を選択し、[次へ] をクリックします。選択したオプションの概要画面が表示されます。正しければ、[今すぐスキャン]をクリックすると、スキャンが開始されます。
2. 位相差画像解析のセットアップ
注:Neurotrack解析は、マシンによって以前に取得された画像に対してのみ実行できます。
- 分析する スキャンした容器 を選択します。 [Launch Analysis] を選択します。 「新規分析定義の作成」を選択します。
- [ニューロトラック] を選択します。「画像チャンネル」を選択します。解析を実行する代表的な画像セットを選択します。各ウェルのすべての画像を選択して、アルゴリズムをトレーニングします。
- 次のパラメータを調整して、解析定義の設定を調整します。
注:デフォルトでは、神経突起はマゼンタでセグメント化され、細胞体は黄色でセグメント化されます。必要に応じて色を変更することが可能です。- 細胞-体クラスターのセグメンテーションについては、以下で説明するように以下を調整します。
- セグメンテーションモード:画像のセグメンテーションは、細胞体を背景や神経突起と区別するために行われます。明るさとテクスチャのどちらかを選択します。初代培養および細胞株の場合は、 輝度モードを選択します。
- セグメンテーションの調整: スライダーを使用して、より多くの背景またはより多くのセルに対するセグメンテーションの感度を調整します。範囲は 0 (バックグラウンド) から 2 (セル) です。黄色のマスクのサイズを拡大または縮小します。スライダーを 0 (背景) の方向に動かすと、黄色のマスクのサイズが徐々に縮小され、マゼンタ マスクのスペースが残ります。スライダーを 2 (セル) の方向に動かすと、逆になります。
- クリーンアップするには、以下で説明するように以下を調整します。
- 穴埋め(μm2):これを調整して、ユーザーが指定した領域よりも小さいセルボディマスクの穴を削除します。
- サイズ (ピクセル) の調整: 黄色のマスクを指定したピクセル数だけ増やす (正の場合) か縮小する (負の場合) します。範囲は -10 から +10 です。これを調整して、死んだ細胞や細胞の破片などのコントラストの高いオブジェクトの黄色のセグメンテーションを追加または削除します。
- 最小細胞幅(μm):値を選択して、細胞体が神経突起と見なされるサイズを定義します。
- セルボディクラスターフィルターの場合は、以下で説明するように以下を調整します。
- 面積(μm2):細胞本体面積の最小値と最大値を設定します。設定値の上下の値は、セル本体とは見なされません。
- 神経突起パラメータについては、以下で説明するように以下を調整します。
- フィルタリング:小さな容器の欠陥や破片のマスキングを減らします。なし、改善、および最善のオプションから選択します。非常にきれいな培養物と容器の場合にのみ 、なし を選択します。Betterを選択すると、非常に細かい神経突起の検出が失われるという犠牲を払って、より 高速 な処理が可能になります。神経突起が厚い細胞やコントラストの高い神経突起を持つ細胞には十分な場合があります。また、欠陥や破片が多い船舶にも役立ちます。処理時間が長くなるには 最適 を選択しますが、非常に細かい神経突起を確実に検出するための最も感度の高いフィルター設定です。
- 神経突起感度:検出感度を調整するために使用します。感度を上げて、より細かい神経突起を検出します。範囲は 0.25 (小さい) から 0.75 (多い) です。
注:神経突起を認識するためのソフトウェアの感度が増減します。スライダーを0.25(小さい)に近づけると、ソフトウェアは神経突起の認識が厳しくなります。代わりに、スライダーを0.75(詳細)に近づけると、この検出の厳密さが弱くなるため、より多くの欠陥(細胞の破片、汚れなど)は神経突起と見なされます。 - 神経突起幅(μm):これを使用して、ニューロンのサイズに合わせて検出を調整します。1、2、または 4 を指定できます。それを増やすことにより、より細い神経突起は考慮されなくなります。一次成体感覚ニューロン培養の場合は1、細胞株および胚性感覚ニューロン培養の場合は2に設定します。
- 細胞-体クラスターのセグメンテーションについては、以下で説明するように以下を調整します。
- [ 現在のプレビュー ] をクリックして、セグメント化されたイメージを視覚化します。各画像について、神経突起の長さ (mm/mm2)、神経突起分岐点 (Per mm2)、細胞体クラスター (Per mm2)、および細胞体クラスター面積 (mm2/mm2) の測定値が提供されます。
- 選択したすべての画像に対して、手順2.3と2.4を繰り返します。 「次へ」をクリックします。
- 分析するスキャン時間とウェルを選択します。「定義名」と、必要に応じて「分析ノート」を割り当てます。[次へ] をクリックして> [完了] をクリックします。
3. 免疫細胞化学(ICC)画像解析のセットアップ
- 2.1 から 2.4 に示したのと同じ手順に従います。神経突起と核の 画像チャンネル を選択します。 画像のセットを選択します。各ウェルの [すべての画像 ] を選択して、アルゴリズムをトレーニングします。
- 以下で説明するように、次のパラメータを調整して、解析定義の設定を調整します。
注:デフォルトでは、神経突起は青色でセグメント化され、細胞体は紫色でセグメント化されています。ただし、色は必要に応じて変更できます。- 細胞体クラスターのセグメンテーション:これを使用して、画像を関心のあるオブジェクトにセグメント化します。画像内のすべてのピクセルで背景の明るさを推定します。背景が見つかったら、次のいずれかのオプションを実行します。
- 背景の減算なし:これを使用して、元の画像を変更せずにセグメント化します。[適応しきい値] または [固定しきい値] から選択します。適応型:背景はオブジェクトの検索に使用されますが、明示的に減算されません。このオプションを使用すると、しきい値調整(GCU)を設定できます。固定しきい値:このしきい値よりも明るいオブジェクトが元の画像で検出されます。このオプションを使用すると、しきい値(GCU)を設定できます。
- 背景の減算: このオプションを使用して、Top-Hat 変換を使用して画像から背景を減算し、それにしきい値を適用します。このオプションでは、[半径] と [しきい値] を設定します。半径:この半径のディスクが使用されます。ディスクは、イメージ内のどのオブジェクトにも完全に収まらないほど十分な大きさにする必要があります。しきい値:このしきい値よりも明るいオブジェクトは、背景から差し引かれた画像で検出されます。
- クリーンアップ: これを実行するには、次のオプションを使用します。
- 穴埋め (μm2): これを使用して、指定した領域よりも小さいセル本体マスクの穴をすべて削除します。
- サイズ (ピクセル) の調整: これを使用して、指定したピクセル数だけ紫色のマスクを拡大 (正の場合) または縮小 (負の場合) します。範囲は -10 〜 +10 です。死んだ細胞や細胞の破片などのコントラストの高いオブジェクトに紫色を追加または削除します。
- 最小細胞幅 (μm): これを使用して、細胞体が神経突起と見なされるサイズを定義します。
- セル本体クラスターフィルター: フィルターを適用するには、次のオプションを使用します。
- 面積(μm2):細胞本体面積の最小値と最大値を設定します。設定値の上下の値は、セル本体とは見なされません。
- 神経突起パラメータ: これらを設定するには、次のオプションを使用します。
- 神経突起粗い感度:これを使用して、神経突起の明るさを調整します。神経突起の蛍光強度が低い場合は、感度を上げる必要があります。範囲は 0 (小さい) から 10 (多い) です。これにより、ソフトウェアが明るさの低い神経突起を認識する感度が増減します。最適な値の範囲は 7 から 10 です。10に設定すると、神経突起の測定で背景も考慮される可能性が非常に高いことに注意してください。
- 神経突起の微細感度:検出感度を調整するために使用します。より微細な神経突起を検出するには、感度を上げる必要があります。範囲は 0.25 (小さい) から 0.75 (多い) です。これにより、ソフトウェアが細かい神経突起と明るさの低い神経突起を認識する感度が増減します。スライダーを0.25(小さい)に近づけると、ソフトウェアはかすかな神経突起を考慮しません。代わりに、スライダーを0.75(More)に近づけると、ソフトウェアは非常に暗い(ほとんど背景の)神経突起も検出します。
- 神経突起幅(μm):これを使用して、検出をニューロンのサイズに合わせて調整します。1、2、または 4 を指定できます。それを増やすことにより、より細い神経突起は考慮されなくなります。初代成体感覚ニューロン培養の場合は1、細胞株および胚性感覚ニューロン培養の場合は2に設定します。
- 細胞体クラスターのセグメンテーション:これを使用して、画像を関心のあるオブジェクトにセグメント化します。画像内のすべてのピクセルで背景の明るさを推定します。背景が見つかったら、次のいずれかのオプションを実行します。
4. データのエクスポート
- 解析を開きます。 「グラフメトリクス」をクリックします。
- 対象のメトリック、タイムポイント、ウェルを選択します。
- グループ化オプションを「すべて」、「なし」、「列」、「行」、および「プレートマップレプリケート」から選択します。
- [ データのエクスポート ]をクリックして、宛先のフォルダを選択し、必要に応じて他のオプションを選択します。.txtファイルが作成されます。
注:マシンは、各ウェルについて選択したメトリックの単一の平均値を提供します。解析中に 1 つの画像値を取得するには、手動アノテーションが必要です。
5.画像のエクスポート
- 容器を開けます。「画像とムービーのエクスポート 」をクリックします。
- 画像のエクスポートタイプを選択します。
- 「 表示どおり 」を選択すると、表示どおりに画像がエクスポートされます。 「次へ 」をクリックし、エクスポートする 対象の画像 を選択します。 「次へ」をクリックします。
- 1 つのムービーまたは一連の画像と関心のある時点の間の シーケンスタイプ を選択します。 「次へ」をクリックします。
- 必要に応じてエクスポートオプションを調整し、[ 次へ]をクリックします。出力フォルダ、ファイル形式、およびファイルの名前を設定し、[ エクスポート]をクリックします。
- 「 保存時」 を選択すると、画像が raw 形式でエクスポートされます。 画像の種類を選択します。
- 目的の タイムポイント と ウェルを選択します。 「次へ」をクリックします。出力フォルダ、ファイル形式、およびファイルの名前を設定し、[ エクスポート]をクリックします。
- 「 表示どおり 」を選択すると、表示どおりに画像がエクスポートされます。 「次へ 」をクリックし、エクスポートする 対象の画像 を選択します。 「次へ」をクリックします。
- セグメンテーションマスクを使用した画像のエクスポート
- 解析を開きます。 画像レイヤーのアイコンをクリックします。 目的のチャネルマスク (Phase NeuriteおよびPhase Cell-Body Cluster)を選択します。手順 5.2 に従います。
結果
神経突起伸長測定アルゴリズムは、ニューラルネットワークと単一ニューロンの両方で神経突起を強力に検出できます。これは、細胞体、細胞の破片、死んだ細胞、組織外植片、影など、コントラストの高いオブジェクトをセグメント化する黄色のマスクを生成します。さらに、マゼンタのマスクは、さまざまな厚さの神経突起に現れます。神経突起の長さの値はmm/mm2で提供され、軸索の長さが画像の面積(0.282739 mm2 )で割られ、すべてのスキャン条件で一定であることを示しています。したがって、神経突起の長さ(mm)の純粋な値を取得するには、ソフトウェアによって提供される数値に画像の面積を掛ける必要があります。
半自動方式と手動方式
使用されるソフトウェアは、軸索の全長を測定するための半自動方法論です。ソフトウェアの精度を評価するために、NeuronJプラグインを使用した手動法を使用して、同じニューロンで測定を行いました。 図1に示すように、ニューロンのセグメンテーションマスクは、2つの方法間で非常に類似しています(図1A)。
また、得られた値について統計分析を行い、その相関関係を検討しました。スピアマン相関分析では、0.8526という高い係数rが得られ、アルゴリズムの精度と精度の強力な証拠が得られました(図1B)。自動測定には、その清浄度、密度、純度に基づく高水準の培養品質が必要です。半自動セグメンテーションで得られた結果は再現性があり、個々の判断に影響されません。偏りのない再現性は、手動分析法の問題です。
場合によっては、さまざまな原因が原因で半自動セグメンテーションエラーが発生することがあります。位相差画像では、半自動セグメンテーションにより、培養物中の汚れを神経突起として検出することができました。さらに、異なる細胞タイプが存在すると、セグメンテーションプロセスが妨げられる可能性があります。このような問題は、手動セグメンテーションでは人間の目によって実行されるため、発生しません。しかし、このような問題が発生した場合は、免疫細胞化学画像をコントロールとして用いることで克服することができます。
神経突起のセグメンテーション
成体DRGニューロンの初代培養では、信頼性の高い相解析の最適な出発点は、ニューロンをウェルでクリーンな培養物に均一にプレーティングすることです。図2A-Bに示すように、播種中にエラーが発生し、細胞が1つの場所に集中すると、値は現実を厳密に反映しているというよりも推定値になります。このような状況では、黄色のマスクが細胞間の神経突起の大部分を覆い(図2A-B)、神経突起の長さが失われます。さらに、ソフトウェアは神経突起の認識に大きく偏り、神経突起ではないオブジェクトにマゼンタのマスクが表示される可能性が非常に高くなります(図2D)。最適な画像では、20倍の倍率で最大15個のニューロンが存在する必要があります。
図3A-Bに示すように、ニューロンが正しくプレーティングされ、培養物がクリーンな場合は、セグメンテーションスライダーを背景に向かって調整することをお勧めします(0.5 - 0.7;図3C)。これにより、画像内のコントラストの高いオブジェクトに表示される黄色の成分 (マゼンタであるべき分岐点など) を減らすことができます。さらに、神経突起が太字の場合、神経突起感度は0.4〜0.5で、神経突起のほとんどをカバーするのに十分です(図3C-D)。
発生する可能性のある別の一般的な状況は、図4A-Bに示すように、多くの細胞破片と死細胞を含む汚れた培養です。このような状況では、コントラストの高いオブジェクトがたくさんあります。したがって、セグメンテーション スライダーをセルに向かって調整するか、サイズ調整パラメーター (+1、+2 など) を増やして、黄色のマスクのサイズを大きくすることをお勧めします。図 4C)。それにもかかわらず、ソフトウェアが神経突起ではないオブジェクトを誤って神経突起として識別するのを防ぐために、神経突起感度をわずかに下げることも有用です。(図4C-D)。
図5A-Bに示すように、神経突起は非常に薄くて青白く見えることがあり、ソフトウェアが神経突起を正確にセグメント化するのが難しくなります(図5D)。この場合、神経突起感度を少なくとも0.6に上げることをお勧めします(図5C)。ただし、感度が高いほど、ソフトウェアが神経突起ではないオブジェクトを誤ってマークする可能性が高くなることに注意してください (図 5D)。感度バイアスが過度に増加しないように、セグメンテーションスライダーをセルに合わせて調整するなど、いくつかの予防措置を講じることができます。ただし、神経突起が薄すぎてソフトウェアで検出できない場合、神経突起の長さの値は関係なく偏ります。
免疫細胞化学画像の場合、主な問題は背景にあります。前述のルールが適用される播種条件とは別に、バイアスの主な原因は蛍光自体です。このソフトウェアは、非常に明るい神経突起を効果的に認識し、薄くて強度の低い神経突起は取り残されます(図6A-B)。神経突起の長さの損失を防ぐために、神経突起の微細感度を最大0.75まで高めることができます(図6C)。ただし、バックグラウンドで神経突起を考慮して過度の検出バイアスを防ぐために、神経突起の粗い感度を少なくとも8〜9に下げることを強くお勧めします(図6C-D)。後者を縮小しない場合は、図 7 に示すように、すべての背景がセグメント化されます。
蛍光取得の一般的な問題は、光の散乱です。多くの場合、免疫細胞化学画像は画像内に懐中電灯を示し、分析の品質と精度に大きく影響します(図8A-B)。このような状況では、分析を改善するためにできることはあまりなく、値は推定値になります。光散乱は神経突起の認識を妨げるため、非常に明るい神経突起のみが検出されます(図8C-D)。免疫細胞化学画像におけるもう一つの問題は、染色自体の品質です。多くの場合、人為的ミスにより、軸索が壊れたり(図9A)、洗浄中に細胞体が引き裂かれたりすることがあります(図9B)。これらの間違いは、神経突起の長さの値が精度と精度を失うため、重大な問題を引き起こします。その結果、生物学的データの解釈が変わり、誤った結論を導きます。
胚培養では、状況が異なります。このタイプの培養では、グリア細胞の存在が優勢です。その結果、ソフトウェアがグリア細胞の内層も検出するため、エラーが大幅に増加します(図10A-B)。この問題を最小限に抑えるには、セグメンテーション スライダーをセルの方向 (通常は 1.7-2 の値付近) に移動する必要があります (図 10C-D)。このアプローチにより、ほとんどのグリア細胞が黄色のマスクで覆われているため、神経突起の長さの測定では考慮されません。別の有用なヒントは、培養中の胚性ニューロンは通常、厚い神経突起を持つ双極または単極性の形状を示すため、神経突起の幅を2に保つことです(図10C-D)。この予防措置は、通常非常に薄いグリア細胞のほとんどの内層をろ過します。最後に、神経突起の感度を上げすぎないように注意してください。そうしないと、神経突起の幅パラメータによって除外されたものが神経突起の長さの測定値に再び含まれます。
グリア細胞成分が優勢な胚培養の場合、免疫細胞化学がより良い選択肢となる可能性があります。ニューロンを特異的に染色することにより、グリアが染色されないため、グリアのセグメンテーションの問題が解決され、分析がはるかに容易かつ正確になります(図11)。
最後に、このソフトウェアを利用して、細胞株やiPS細胞の分化プログラムを評価し、その成長状態を評価することもできます。したがって、同様のパラメータと予防措置の適用は、異なる目標に使用できます。
分化プロセスについては、NSC-34細胞株(マウス神経芽腫細胞とマウス胚の脊髄由来の運動ニューロンからなるハイブリッド細胞株)において、運動ニューロン様細胞に成熟する過程で、ソフトウェアの堅牢性が証明されています。DRG初代培養に関しては、良好な分析のための最適な出発点は、均一な細胞播種です。未分化細胞および分化細胞は、レチノイン酸処理後、全培養期間中の捕捉を使用して、 または図12に示すように、最後の時点で追跡できます。
実際、このアルゴリズムは神経突起の長さに加えて、分岐点パラメータも提供します。ただし、分岐ポイント パラメーターは分岐ポイントの正確な数を表していないことに注意してください。むしろ、画像内の分岐の密度を mm/mm2 で表します。この測定値は、培養物中の破片と播種濃度に大きく影響されます。したがって、画像内のニューロンの密度と培養の清浄度は、信頼性の高い値を得るための重要な要素です。培養物に多くの細胞破片が提示され、黄色のマスクによってろ過されていない場合、それらは神経突起の長さと分岐点の測定に含まれます。
したがって、画像内のニューロンの数が神経突起の長さと分岐点の測定値に影響を与えるため、細胞数に対してこれらの値を正規化することをお勧めします。
細胞体のセグメンテーション
システムによって提供されるすべてのパラメータの中には、細胞体クラスターと細胞体クラスター領域があります。ただし、これら 2 つのパラメーターは、セル カウントの値として使用するには信頼性がありません。 図 4 に示すように、ソフトウェアは、ウェル内の中程度の動きによって生じる影を含む、黄色のマスク内の高コントラストのオブジェクトをセグメント化します。さらに、死んだ細胞や細胞の破片もセグメント化します(図4)。成長するニューロンの信頼性の高い細胞数を得るために、フィジーのCell Counterツール(図13)などの手動方法を利用できます。
培養の種類別にソートされた推奨分析パラメータの要約は、位相画像については 表1 、免疫細胞化学画像については 表2 に記載されています。さらに、特定の問題を解決するために推奨される分析パラメータの要約を 表3に示します。
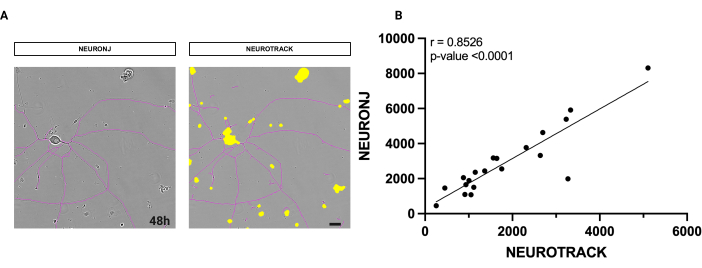
図1:手動神経突起セグメンテーションと半自動神経突起セグメンテーションの相関分析。(A) 左側は、フィジーのNeuronJプラグインでセグメント化されたニューロンの代表的な位相画像。右側では、ニューロンの代表的な位相画像が半自動ソフトウェアでセグメント化されています。 (B) 20個のニューロンに対して実行した単純な線形回帰を、手動および半自動の両方の方法で分析しました。スピアマン相関係数 r = 0.8526、p**** < 0.0001。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
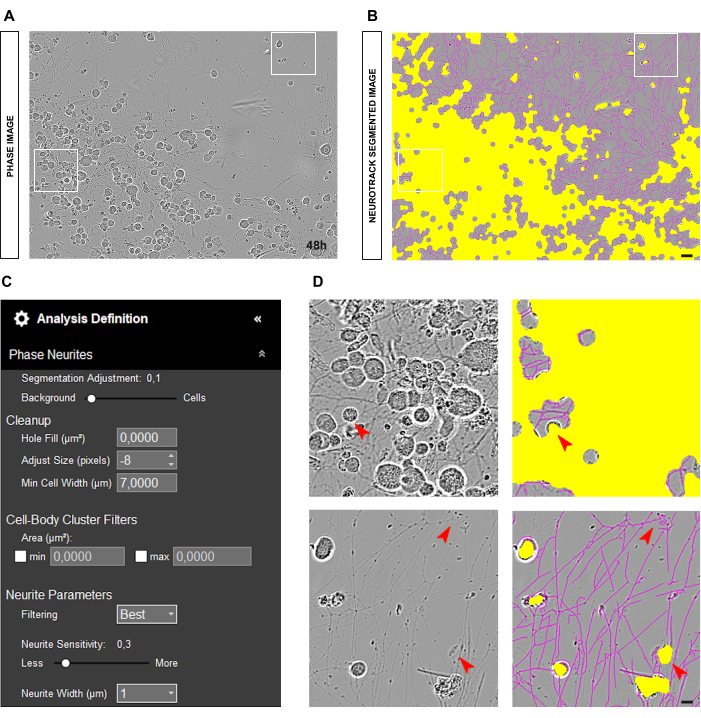
図2:成体感覚ニューロン培養における播種エラー。(A) シードエラーの代表フェーズ画像。 (B) 代表自動セグメント化された画像。黄色のマスクは細胞体をセグメント化し、マゼンタのマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) トップパネル:細胞体のクラスタリングによる細胞体のセグメンテーションの誤差(黄色のマスク)を拡大します。下部パネル:細胞の破片による神経突起のセグメンテーション(マゼンタマスク)のエラーにズームインします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
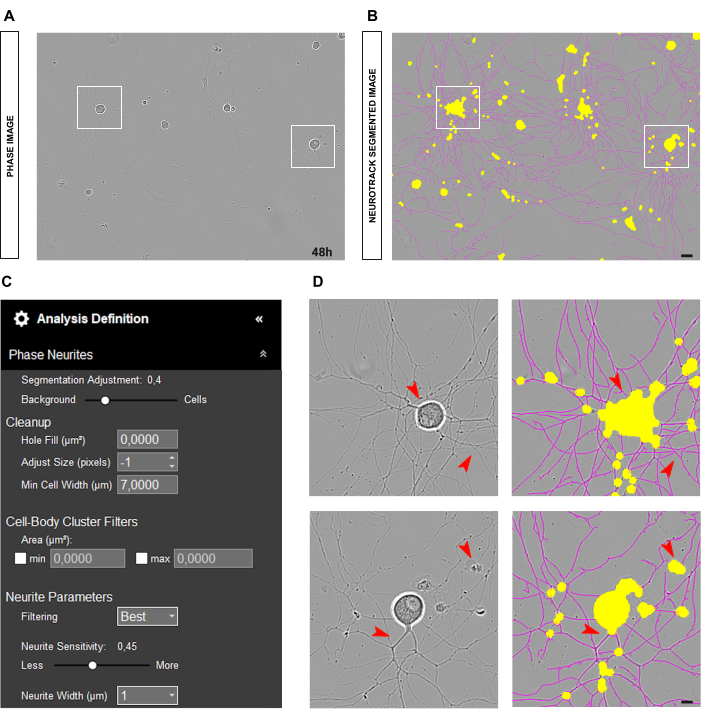
図3:神経突起伸長解析のための理想的な成体感覚ニューロン培養。(A) 神経突起伸長解析のための理想的な播種条件の代表相イメージ。 (B) 代表自動セグメント化された画像。黄色のマスクは細胞体をセグメント化し、マゼンタのマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) 細胞体のセグメンテーション(黄色のマスク)と神経突起のセグメンテーション(マゼンタマスク)にズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
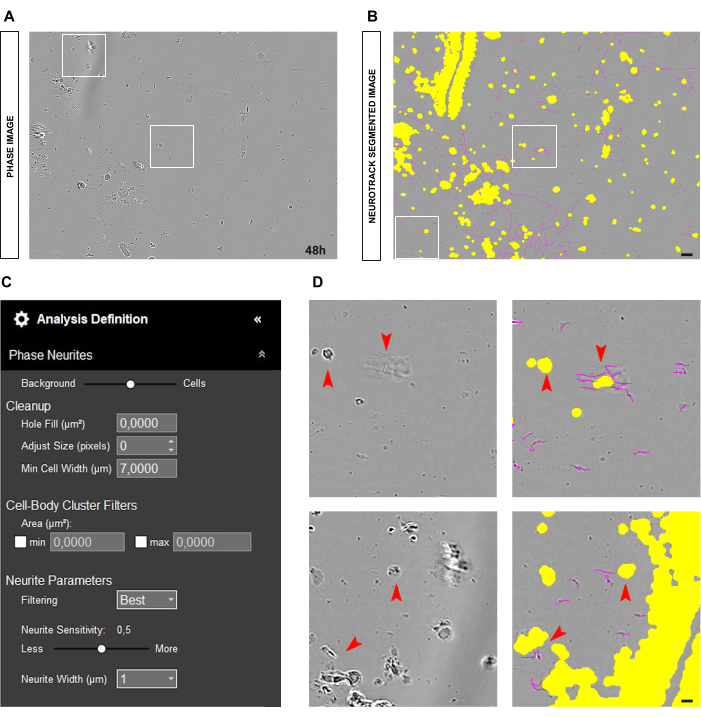
図4:成体感覚ニューロン培養における神経突起伸長解析における撹乱要素。(A) 媒体の動きによる細胞の破片と影の代表的な位相画像。 (B) 代表自動セグメント化された画像。黄色のマスクは細胞体をセグメント化し、マゼンタのマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) 細胞の破片や移動培地の影による細胞体のセグメンテーション(黄色のマスク)と神経突起のセグメンテーション(マゼンタマスク)のエラーにズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
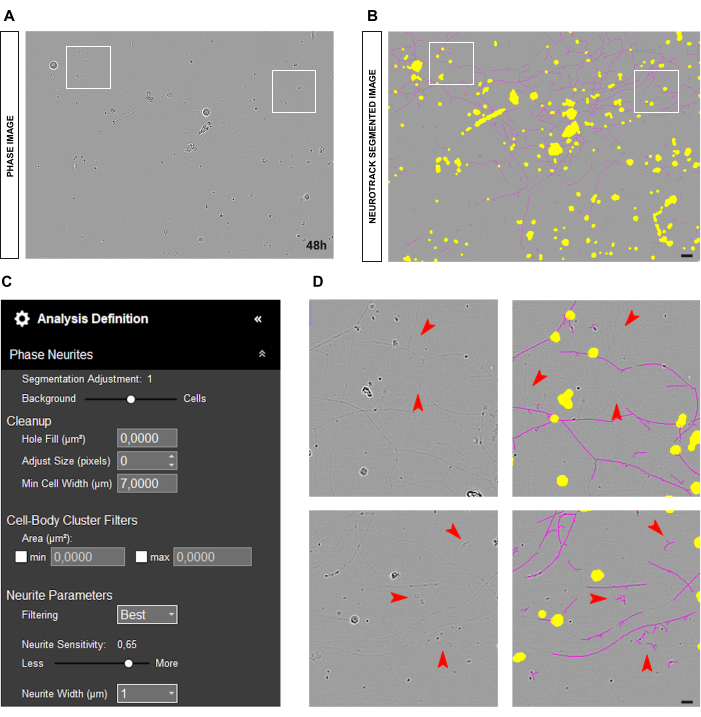
図5:成体感覚ニューロン培養における神経突起伸長解析における細い神経突起。(A) 非常に細い神経突起を特徴とするニューロンの代表的な位相像。 (B) 代表自動セグメント化された画像。黄色のマスクは細胞体をセグメント化し、マゼンタのマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) トップパネル:神経突起のセグメンテーションの検出限界による神経突起の長さの損失にズームします(マゼンタマスク)。下部パネル:異物の神経突起セグメンテーション(マゼンタマスク)のエラーにズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
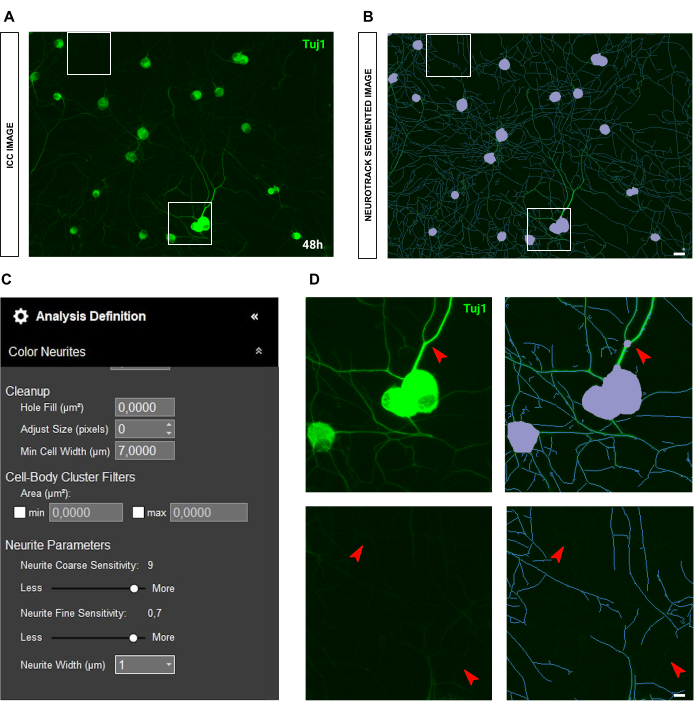
図6:成体感覚ニューロン培養における神経突起伸長解析における神経突起の明るさ。(A) 非常に明るく太い神経突起を特徴とするニューロンの代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。 (B) 代表自動セグメント化された画像。紫色のマスクは細胞体をセグメント化し、青色のマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) トップパネル:神経突起の厚さによる細胞体のセグメンテーションエラー(紫色のマスク)にズームします。底面パネル:厚い神経突起の強い蛍光輝度による神経突起の長さの損失にズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
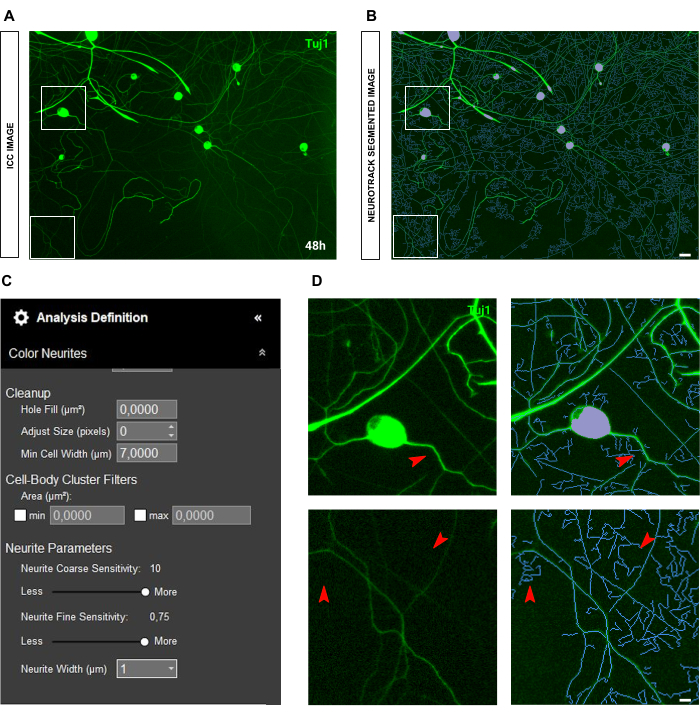
図7:成体感覚ニューロン培養における神経突起伸長解析におけるバックグラウンド蛍光。(A) 高バックグラウンド蛍光ノイズの代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。 (B) 代表自動セグメント化された画像。紫色のマスクは細胞体をセグメント化し、青色のマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) 背景蛍光の干渉による神経突起セグメンテーションエラー(ブルーマスク)にズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
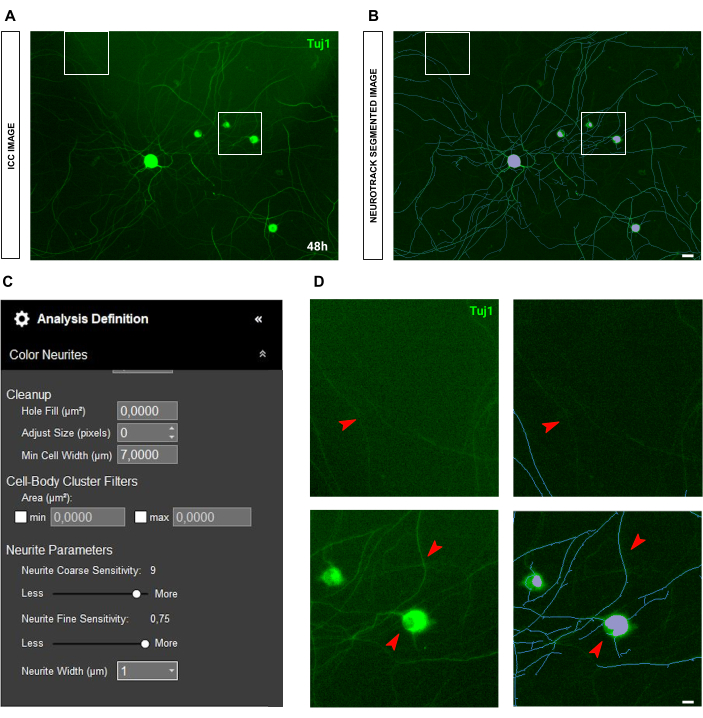
図8:成体感覚ニューロン培養の神経突起伸長解析における光散乱。(A) 光散乱の代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。 (B) 代表自動セグメント化された画像。紫色のマスクは細胞体をセグメント化し、青色のマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) トップパネル:光散乱の干渉による神経突起の長さの損失にズームします。下部パネル:セル本体のセグメンテーションエラー(紫色のマスク)にズームします。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
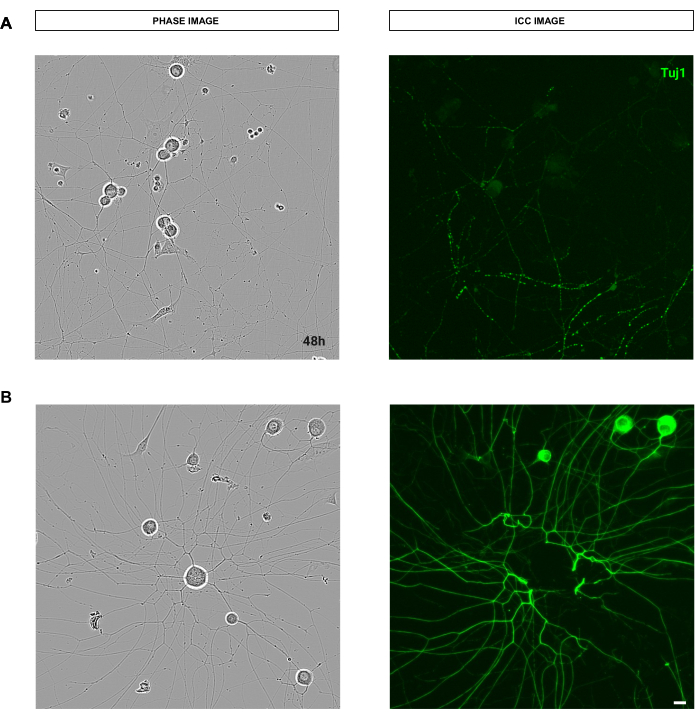
図9:成体感覚ニューロン培養の神経突起伸長解析を妨げる染色手順の品質に影響を与えるエラー。(A) 左は、成体感覚ニューロンの代表的な位相像。右側は、染色手順での洗浄による神経突起の破壊の代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。 (B) 左は、成体感覚ニューロンの代表的な位相画像。右側は、染色手順の洗浄による細胞体の除去の代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。画像は播種後48時間で取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
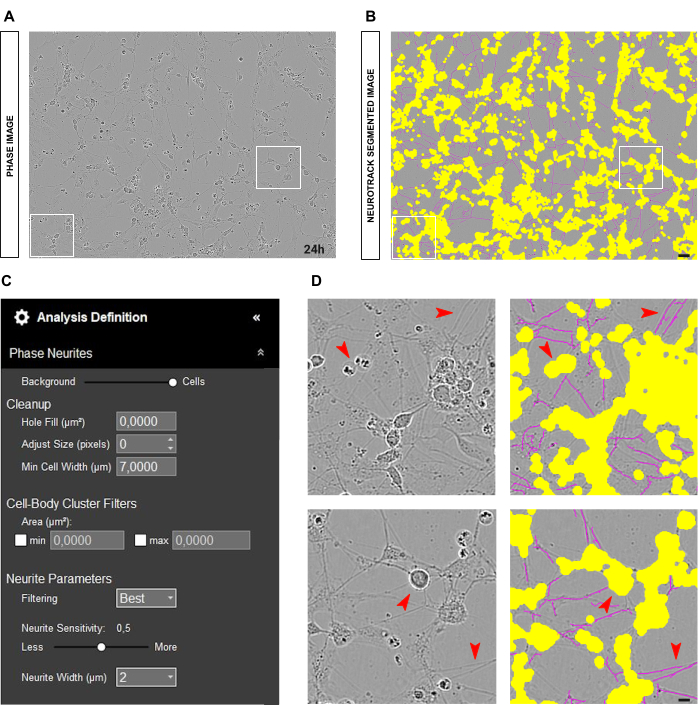
図10:神経突起伸長解析のための理想的な胚性(E13.5)感覚ニューロン培養。(A) 胚性感覚ニューロン培養における神経突起伸長解析のための理想的な播種条件の代表的位相イメージ。 (B) 代表自動セグメント化された画像。黄色のマスクは細胞体をセグメント化し、マゼンタのマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) 細胞体のセグメンテーション(黄色のマスク)と神経突起のセグメンテーション(マゼンタマスク)にズームします。画像は播種から24時間後に取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
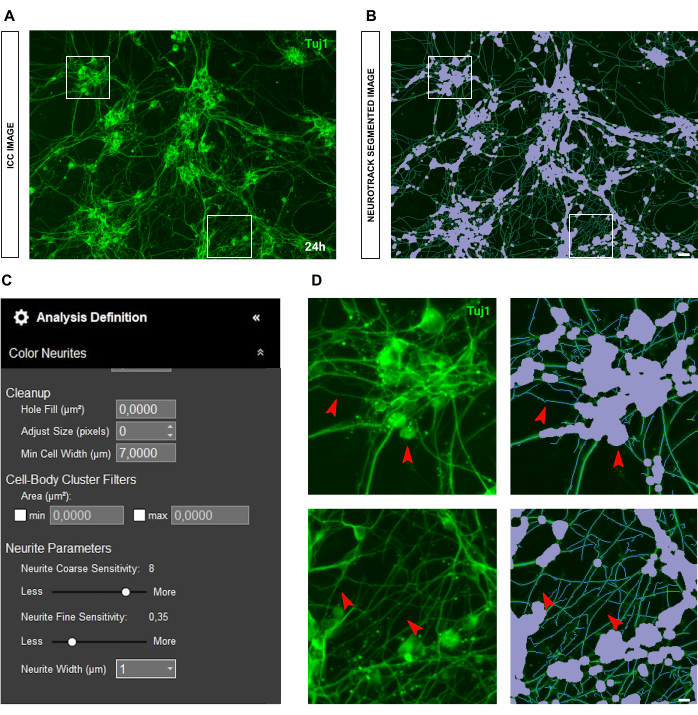
図11:神経突起伸長解析のための理想的な胚性(E13.5)感覚ニューロン培養。(A) 神経突起伸長解析のための理想的な胚性感覚ニューロン培養の代表的な免疫細胞化学画像(ニューロンマーカーTuj1)。 (B) 代表自動セグメント化された画像。紫色のマスクは細胞体をセグメント化し、青色のマスクは神経突起をセグメント化します。 (C) 例示的な神経突起伸長分析の定義パラメータ。 (D) 細胞体のセグメンテーション(紫色のマスク)と神経突起のセグメンテーション(青いマスク)にズームします。画像は播種から24時間後に取得しました。倍率20倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。

図12:分化したNSC-34細胞は、未分化のコントロールと比較して、神経突起と分岐が増加しています。 NSC-34細胞の代表的な画像。トップパネル:未分化NSC-34細胞(コントロール)。下面:レチノイン酸処理の96時間後の分化したNSC-34細胞。両方のパネルの左側には位相差画像があり、両方のパネルの右側には、自動的にセグメント化された画像(黄色の体細胞、マゼンタの神経突起)があります。画像は播種後96時間で取得しました。倍率10倍。スケールバー、50 μm。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
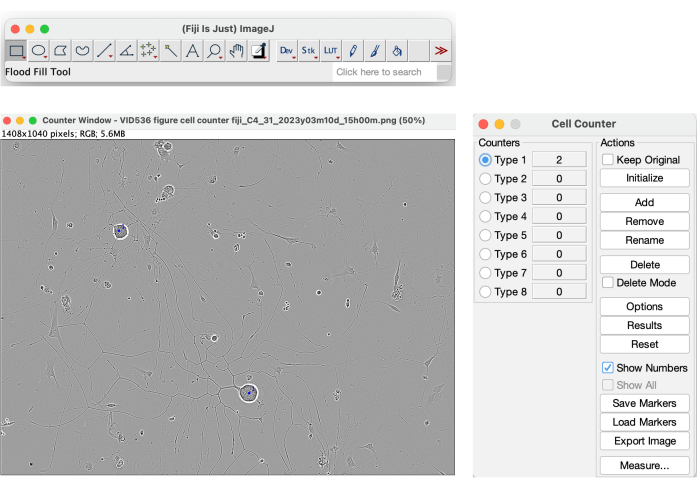
図13:フィジーのセルカウンターツール。 神経突起伸長解析のための理想的な播種条件の位相像に対して行われた手動細胞カウント。倍率20倍。フィギュアはBioRenderで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
| 文化の種類 | 成体DRG培養(フェーズ) | 胚性DRG培養(Phase) | NSC-34(フェーズ) |
| 拡大 | 20倍 | 20倍 | 10倍 |
| セグメンテーションモード | 明るさ | 明るさ | 明るさ |
| セグメンテーション調整 | 0.5 - 0.7 | 1.7 - 2 | 1 |
| サイズの調整 (ピクセル) | 0, +1, +2 | 0, +1 | 0 |
| フィルタリング | 最良 | 最良 | 最良 |
| 神経突起感度 | 0.4 - 0.5 | 0.25 - 0.4 | 0.3 - 0.5 |
| 神経突起幅 | 1 | 2 | 2 |
表1:位相差画像における成体感覚ニューロン培養、胚性(E13.5)感覚ニューロン培養、およびNSC-34培養の推奨解析定義パラメータの要約。
| 文化の種類 | アダルトDRGカルチャー(ICC) | 胚性DRG培養(ICC) |
| 拡大 | 20倍 | 20倍 |
| セグメンテーションモード | 明るさ | 明るさ |
| セグメンテーション調整 | 0.5 - 0.7 | 1.7 - 2 |
| サイズの調整 (ピクセル) | 0, +1, +2 | 0, +1 |
| フィルタリング | 最良 | 最良 |
| 神経突起粗い感度 | 8 - 9 | 8 - 9 |
| 神経突起ファイン感度 | 0.75まで | 0.5 - 0.75 |
| 神経突起幅 | 1 | 2 |
表2:免疫細胞化学画像における成体感覚ニューロン培養物、胚性(E13.5)感覚ニューロン培養物、およびNSC-34培養物について提案された分析定義パラメータの要約。
| 発行 | 提案 |
| 汚い文化 | セグメンテーションスライダーをセル方向に調整します |
| サイズ調整パラメータを大きくします (+1,+2...) | |
| 神経突起感度をわずかに下げます | |
| 淡い/細い神経突起 | 神経突起感度を上げる(0.6以上) |
| セグメンテーション スライダーをセル方向に調整します。 | |
| ICCの細い神経突起 | 微細な神経突起の感度を向上(最大0.75) |
| 神経突起の粗い感度を下げます(少なくとも8-9まで) | |
| グリア細胞 | セグメンテーション スライダーをセル (1.7-2) に合わせて調整します。 |
| 神経突起の幅は 2 です |
表3:さまざまなタイプの文化における特定の問題を解決するために推奨される分析定義パラメータの要約。
ディスカッション
健康な状態、負傷した状態、および病気の状態でニューロンがどのように成長するかを正確に測定することは、神経科学分野の多くの実験設定において重要なパラメーターです。DRG外植片全体の器官型培養物を扱う場合でも、解離した培養物を扱う場合でも、軸索伸長を適切に測定することは、過去20年間にわたる大きな課題でした。神経突起伸長の信頼性と精度の定量化がなければ、NSC-34細胞34に対するレチノイン酸(4日間)や胚性DRGニューロン14,35に対するニューロトロフィン(1〜2日間)などの特定の治療が有効であったかどうかを評価することは不可能である。ニューロンは通常、健康なときに継続的な成長を示します。ただし、損傷後、軸索の成長率は増加します 12,13。軸索の成長を測定する際には、タイミングが重要です。そのため、実験を始める前に、増殖速度のプラトー曲線に基づいて細胞を固定する最適な時間を決定するための試行試験を行うことが不可欠です。
手動または自動の方法を選択することで、時間支出と精度の点で分岐点となります。最も一般的な手動方法には、NeuronJ18,20 や Metamorph (Visitron)2,22,28 などがあります。手動による方法では、神経突起を手動でトレースする必要があり、これは非常に時間がかかり、シングルセルの画像が必要です。神経突起を手動でセグメンテーションすると、ニューラルネットワークは完全に手の届かないものになります。通常、これらの方法論は、最も長い軸索のみを測定するか、ベクトル距離測定を使用するため、分岐点の数や軸索の全長などの重要な情報が失われます。ショール分析30によっていくらかの改善がもたらされるが、これはいずれにせよシングルセル条件に限定される。シングルセル解析には、細胞の播種をはじめとするいくつかの課題があります。ニューロンは非常に低濃度でプレーティングする必要があり、これはすべての細胞タイプに最適な増殖条件であるとは限りません。画像取得には、もう一つ問題があります。通常、共焦点顕微鏡はイメージングに使用されますが、これには訓練を受けたユーザーと蛍光ニューロンが必要であり、時間もコスト効率も高くありません。共焦点顕微鏡では高解像度の画像が得られますが、各実験から画像化されるニューロンはほとんどありません。これは、適切な数のニューロンに到達するためにより多くの生物学的複製が必要であるため、制限を表しています。
NeuroMath 2,28などの一部の自動方法論は、自動的な方法で実行される時間のかかる神経突起セグメンテーションの問題を解決します。
ただし、時間の制約により、この神経突起伸長測定モジュールは、タイムラプス顕微鏡装置で画像を取得するときにより高速な結果を提供します。後者をこのソフトウェアと組み合わせることで、学生と主任研究者の両方の時間とコスト効率が大幅に向上します。
取得機は、井戸の直径に基づいて可変数の画像を取得し、井戸のかなり完全なマップを作成することができます。これは、複数のニューロンが同時に画像化されるため、大きな利点となります。ただし、20倍の倍率に達するだけで十分であり、ソフトウェアで画像を分析するのに適しています。その力は、一連の画像で学習し、軸索の全長を半自動で測定する能力に依存しています。さらに、このソフトウェアは、単一のニューロンとニューロンネットワークの両方で機能します。このソフトウェアは、2つの異なるマスクで神経突起と細胞体をセグメント化することができます。黄色のマスクは、セル本体、セルの破片、影など、画像内のすべてのコントラストの高いオブジェクトをセグメント化します。代わりに、マゼンタのマスクは神経突起をセグメント化します。ソフトウェアの精度と精度は、ソフトウェアとNeuronJの両方で同じニューロンをセグメンテーションすることで証明されました。統計分析の観点からは、神経突起の長さの値は、高いスピアマン相関係数とうまく相関していました。
分析法の信頼性を評価した後、さまざまな試験条件の分析に移りました。最適な分析を行うには、いくつかの注意点が必要です。まず、ニューロンはウェルに均一に播種され、細胞濃度の高いスポットを避ける必要があります。ニューロンのクラスタリングにより、ソフトウェアは神経突起の検出精度を失います。分析の精度と精度に影響を与える別の変数は、文化の清潔さです。細胞の破片や死んだ細胞が少ないクリーンな培養が望ましいです。しかし、このソフトウェアは、神経突起感度と細胞体セグメンテーションマスクの変調によって、このような問題を補償することができます。前述のように、黄色のマスクはコントラストの高いオブジェクトをセグメント化し、その中には井戸内の媒体の動きによって引き起こされる影もあります。影が神経突起を覆う可能性があり、その結果、神経突起の長さが失われます。しかし、このような問題は、画像取得前に媒体を落ち着かせることで簡単に解決できます。
このアルゴリズムは、位相コントラスト画像と免疫細胞化学画像の両方で神経突起長の定量化を行うことができます。蛍光が関与する場合、信頼性の高い分析を得るためには、他の予防措置を講じる必要があります。まず、染色の品質は分析結果に大きく影響します。洗浄中に神経突起が壊れたり、セグメント化されたりして細胞体が引き裂かれると、分析の強度と信頼性が失われます。さらに、蛍光自体が分析の邪魔になる可能性のある要素です。フォーカスは機械によって自動的に実行されるため、対物レンズはアーティファクト、細胞体、または厚い神経突起などの非常に明るいオブジェクトに焦点を合わせます。その結果、細くて明るさの少ない神経突起が取り残され、ユーザーが神経突起の長さを適切に測定することが難しくなります。
結果として、位相画像の解析は、免疫細胞化学画像の解析と比較して、より根拠がある可能性があります。このソフトウェアは、最も複雑で精巧なものから最も単純なものまで、単一細胞またはニューロンネットワークのいずれかで、さまざまなニューロンの形態に取り組むことができます。そのため、様々な発生段階の中枢神経系や末梢神経系に由来する神経細胞の初代培養から、iPS細胞由来の神経細胞やNSC-34などの細胞株まで、さまざまな研究分野で活用されています。
ソフトウェアの大きな可能性にもかかわらず、いくつかの制限に注意することができます。まず、細胞体のセグメンテーションの精度が最適ではありません。そのため、細胞体クラスターや細胞体クラスター面積などのパラメータは、細胞カウントに確実に使用することはできません。第二に、最適な神経突起セグメンテーションに必要な予防措置に加えて、厚さが不十分な軸索は神経突起長測定から除外され、データ損失につながる可能性があります。
分岐ポイント パラメーターでは、両方のタイプのセグメンテーションに関連する問題が発生します。分枝点に局在する培養物中の影、死んだ細胞、または破片は、細胞体のセグメンテーションによって覆われるため、それらを不明瞭にします。さらに、細い神経突起の場合、分岐点パラメータの信頼性は再び大幅に損なわれます。
さらに、画像取得中の自動フォーカスは、最適ではないことがあります。本機の最大倍率は20倍に制限されており、神経突起などの細い構造の細部や蛍光を観察するには不十分な場合があります。さらに、この機械は均質なプラスチック基板で最高の性能を発揮します。ウェルにガラスカバースリップを挿入すると、ガラスへのピントが合わず、画像が部分的にぼやけることがあります。しかし、このソフトウェアはニューロンだけでなく、真菌の増殖36など、まったく異なる研究分野にも適用できます。
すべてを考慮すると、この神経突起伸長測定モジュールは、神経突起を迅速、公平、効率的に測定するための信頼できるツールであると信じています。
開示事項
著者らは、この研究は、利益相反を引き起こす可能性のある商業的または金銭的関係なしに行われたと宣言しています。
謝辞
批判的なコメントをくださったAlessandro Vercelli氏と、支援してくれたSartoriusの技術サポートに感謝します。これらのトピックに関する私たちの研究は、Rita-Levi Montalcini Grant 2021(MIUR、イタリア)の寛大な支援を受けています。この研究は、Ministero dell'Istruzione dell'Università e della Ricerca MIUR project Dipartimenti di Eccellenza 2023-2027 から Department of Neuroscience Rita Levi Montalcini に資金提供されました。D.M.R.の研究は、持続可能な開発と気候変動に関するイタリア国立大学間博士課程(リンク:www.phd-sdc.it)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Collagenase A | Merck / Roche | 10103586001 | |
| Dispase II (neutral protease, grade II) | Merck / Roche | 4942078001 | |
| Dulbecco's modified eagle's medium | Merck / Sigma | D5796 | |
| Fetal bovin serum | Merck / Sigma | F7524 | |
| Ham's F-12 Nutrient Mix (1X) | ThermoFisher Scientific | 21765029 | |
| Ham's F12 w/ L-Glutamine | Euroclone | ECM0135L | |
| Hanks' Balanced Salt Solution | Euroclone | ECM0507L | |
| HBSS (10X), no calcium, no magnesium, no phenol red | ThermoFisher Scientific | 14185045 | |
| HyClone Characterized Fetal Bovine Serum (U.S.) | Cytiva | SH30071.03 | |
| Incucyte, Neurotrack Analysis Software | Sartorius | 9600-0010 | |
| L-15 Medium (Leibovitz) | Millipore/Sigma | L5520 | |
| Laminin Mouse Protein, Natural | ThermoFisher Scientific | 23017015 | |
| L-Cysteine | Merck / Sigma | C7352 | |
| Leibovitz's L-15 medium w/o L-glutamine | Euroclone | ECB0020L | |
| mouse NGF 2.5S (>95%) | Alomone Labs | N-100 | |
| Neurobasal Medium [-] Glutamine | ThermoFisher Scientific | 21103049 | |
| NSC-34 | CELLutions Biosystems Inc (Ontario, Canada) | CLU140 | |
| Papain from papaya latex | Sigma | P4762 | |
| Penicillin-Streptomycin (5,000 U/mL) | ThermoFisher Scientific | 15070063 | |
| Percoll (Density 1.130 g/mL) | Cytiva | 17089101 | |
| Poly-D-Lysine Solution (1mg/mL) | EMD Millipore/Merck | A-003-E | |
| Poly-L-Lysine Solution (0-01%) | Sigma | P4832 | |
| Recombinant Human NT-3 | PeproTech | 450-03 | |
| Retinoic Acid | Merck / Sigma | R2625 | |
| Trypsin-EDTA solution | Sigma | T3924 | |
| β-Tubulin III (Tuj1) antibody | Merck / Sigma | T8660 |
参考文献
- Terenzio, M., et al. Locally translated mTOR controls axonal local translation in nerve injury. Science. 359, 1416-1421 (2018).
- Marvaldi, L., et al. Enhanced axon outgrowth and improved long-distance axon regeneration in sprouty2 deficient mice. Dev Neurobiol. 75, 217-231 (2015).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. J Cell Biol. 218, 1871-1890 (2019).
- Marvaldi, L., et al. Importin α3 regulates chronic pain pathways in peripheral sensory neurons. Science. 369, 842-846 (2020).
- Gangadharan, V., et al. Neuropathic pain caused by miswiring and abnormal end organ targeting. Nature. 606, 137-145 (2022).
- Testa, L., Dotta, S., Vercelli, A., Marvaldi, L., et al. Communicating pain: emerging axonal signaling in peripheral neuropathic pain. Front Neuroanat. 18, (2024).
- Thongrong, S., et al. Sprouty2 and -4 hypomorphism promotes neuronal survival and astrocytosis in a mouse model of kainic acid induced neuronal damage. Hippocampus. 26, 658-667 (2016).
- Yaron, A., Schuldiner, O. Common and divergent mechanisms in developmental neuronal remodeling and dying back neurodegeneration. Curr Biol. 26, R628-R639 (2016).
- Maor-Nof, M., et al. Axonal degeneration is regulated by a transcriptional program that coordinates expression of pro- and anti-degenerative factors. Neuron. 92, 991-1006 (2016).
- Bromberg, K. D. Regulation of neurite outgrowth by Gi/o signaling pathways. Front Biosci. 13, 4544-4557 (2008).
- Girouard, M. P., et al. Collapsin response mediator protein 4 (CRMP4) facilitates wallerian degeneration and axon regeneration following Sciatic nerve injury. eNeuro. 7, 0479-0419 (2020).
- van Erp, S., et al. Age-related loss of axonal regeneration is reflected by the level of local translation. Exp Neurol. 339, 113594 (2021).
- Wang, X., et al. Driving axon regeneration by orchestrating neuronal and non-neuronal innate immune responses via the IFNγ-cGAS-STING axis. Neuron. 111, 236-255.e7 (2023).
- Kaselis, A., Treinys, R., Vosyliūtė, R., Šatkauskas, S. DRG axon elongation and growth cone collapse rate induced by Sema3A are differently dependent on NGF concentration. Cell Mol Neurobiol. 34, 289-296 (2014).
- Maier, O., et al. Differentiated NSC-34 motoneuron-like cells as experimental model for cholinergic neurodegeneration. Neurochem Int. 62, 1029-1038 (2013).
- Nango, H., et al. Highly efficient conversion of motor neuron-like NSC-34 cells into functional motor neurons by Prostaglandin E2. Cells. 9, 1741 (2020).
- Kim, H. W., Caspar, T., Shah, S. B., Hsieh, A. H. Effects of proinflammatory cytokines on axonal outgrowth from adult rat lumbar dorsal root ganglia using a novel three-dimensional culture system. Spine J. 15, 1823-1831 (2015).
- Frey, E., et al. An in vitro assay to study induction of the regenerative state in sensory neurons. Exp Neurol. 263, 350-363 (2015).
- Zhang, Z., et al. Cerebellar injury and impaired function in a rabbit model of maternal inflammation induced neonatal brain injury. Neurobiol Learn Mem. 165, 106901 (2019).
- Pemberton, K., Mersman, B., Xu, F. Using ImageJ to assess neurite outgrowth in mammalian cell cultures: Research data quantification exercises in undergraduate neuroscience lab. J Undergrad Neurosci Educ. 16, A186-A194 (2018).
- Marvaldi, L., Hausott, B., Auer, M., Leban, J., Klimaschewski, L. A Novel DRAK inhibitor, SC82510, promotes axon branching of adult sensory neurons in vitro. Neurochem Res. 39, 403-407 (2014).
- Quarta, S., et al. Peripheral nerve regeneration and NGF-dependent neurite outgrowth of adult sensory neurons converge on STAT3 phosphorylation downstream of neuropoietic cytokine receptor gp130. J Neurosci. 34, 13222-13233 (2014).
- Woitke, F., et al. Adult hippocampal neurogenesis poststroke: More new granule cells but aberrant morphology and impaired spatial memory. PLoS One. 12, e0183463 (2017).
- Xiao, X., et al. Automated dendritic spine detection using convolutional neural networks on maximum intensity projected microscopic volumes. J Neurosci Meth. 309, 25-34 (2018).
- Pool, M., Thiemann, J., Bar-Or, A., Fournier, A. E. NeuriteTracer: A novel ImageJ plugin for automated quantification of neurite outgrowth. J Neurosci Meth. 168, 134-139 (2008).
- Wang, D., et al. HCA-Vision: Automated neurite outgrowth analysis. SLAS Disc. 15, 1165-1170 (2010).
- Whitlon, D. S., et al. Novel high content screen detects compounds that promote neurite regeneration from cochlear spiral ganglion neurons. Sci Rep. 5, 15960 (2015).
- Rishal, I., et al. WIS-neuromath enables versatile high throughput analyses of neuronal processes. Dev Neurobiol. 73, 247-256 (2013).
- Smith, D. S., Pate Skene, J. H. A Transcription-dependent switch controls competence of adult neurons for distinct modes of axon growth. J Neurosci. 17, 646-658 (1997).
- Gardiner, N. J., et al. Preconditioning injury-induced neurite outgrowth of adult rat sensory neurons on fibronectin is mediated by mobilisation of axonal α5 integrin. Mol Cell Neurosci. 35, 249-260 (2007).
- Hauck, J. S., et al. Heat shock factor 1 directly regulates transsulfuration pathway to promote prostate cancer proliferation and survival. Commun Biol. 7, 9 (2024).
- Zhu, Y., et al. Loss of WIPI4 in neurodegeneration causes autophagy-independent ferroptosis. Nat Cell Biol. 26, 542-551 (2024).
- Reggiani, F., et al. BET inhibitors drive Natural Killer activation in non-small cell lung cancer via BRD4 and SMAD3. Nat Commun. 15, 2567 (2024).
- Ackerman, H. D., Gerhard, G. S. Bile acids induce neurite outgrowth in NSC-34 cells via TGR5 and a distinct transcriptional profile. Pharmaceuticals. 16, 174 (2023).
- Tuttle, R., Matthew, W. D. Neurotrophins affect the pattern of DRG neurite growth in a bioassay that presents a choice of CNS and PNS substrates. Development. 121, 1301-1309 (1995).
- Wurster, S., et al. Live monitoring and analysis of fungal growth, viability, and mycelial morphology using the IncuCyte NeuroTrack processing module. mBio. 10 (3), e00673-e00619 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved