Method Article
用于神经突生长测量的新型半自动软件的标准化
* 这些作者具有相同的贡献
摘要
神经突生长测定提供了有关再生神经元过程的定量值。这种半自动软件的优点是它通过创建掩码分别分割细胞体和神经突,并测量各种参数,例如神经突长度、分支点数量、细胞体簇面积和细胞簇数量。
摘要
有效的实时成像技术对于评估神经元形态以实时测量神经突生长至关重要。多年来,正确测量神经突生长物一直是神经科学研究领域的一个长期挑战。该参数是许多 体外 实验设置的基础,范围从解离培养物和器官型培养物到细胞系。通过量化神经突长度,可以确定特定治疗是否有效,或者不同实验组中的轴突再生是否增强。本研究旨在证明 Incucyte® Neurotrack 神经突生长分析软件的稳健性和准确性。这种半自动软件可用于延时显微镜系统,与常用方法相比,它在量化相差图像中的神经突长度方面具有多项优势。该算法对每张图像中的多个参数进行屏蔽和量化,并返回神经元细胞指标,包括神经突长度、分支点、细胞-体簇和细胞-体簇区域。首先,我们通过将软件的值与斐济插件手动 NeuronJ 的值相关联,验证了该软件的稳健性和准确性。其次,我们使用的算法能够同时处理相差图像和免疫细胞化学图像。使用特异性神经元标志物,我们验证了在 体外 培养中感觉神经元上基于荧光的神经突生长分析的可行性。此外,该软件可以测量各种接种条件下的神经突长度,从单个细胞到复杂的神经元网。总之,该软件为神经突生长测定提供了一个创新且高效的平台,为更快、更可靠的定量铺平了道路。
引言
在坐骨神经中,可以测量轴突再生1 (axonal regenerations)。此外,体外研究表明,在健康和受伤神经元中监测轴突生长 2,3 以理解其各个阶段(从轴突发芽到轴突变性)的可行性。通过跟踪这些过程,可以测量轴突极性、起始、稳定性和分支等参数。最后一个参数对于理解神经性疼痛感知至关重要 4,5,6。同样,轴突变性可以在体内7 或体外监测 8,9。在神经突生长过程中,肌动蛋白和微管细胞骨架网络稳定或根据细胞的需要发生变化10。肌动蛋白细胞骨架重组以允许形成轴突生长锥,微管重新排列成束以稳定生长的神经突11。为了在体外研究中枢和外周神经元的神经突生长,量化了三个常见参数:总轴突长度、最大距离和分支点。这些参数用于研究神经元生长对治疗(即神经营养因子、化合物、抑制剂、视黄酸、siRNA、shRNA)或转基因动物的反应 12,13,14。为了评估神经元是否具有更细长的神经突和/或更多的分支,这三个参数使我们能够评估神经元的形态。神经突长度测量是几种体外实验装置中最受关注的参数。从背根神经节,主要进行两种类型的培养:解离体外培养或整个 DRG 外植体的器官型培养。在任何一种情况下,神经突长度都是评估实验结果的黄金参数。在运动神经元样细胞系 (NSC-34) 中,在视黄酸诱导分化后测量轴突生长和分支15,16。事实上,通过测量神经突生长物,可以确定特定治疗是否有效17、生长速率18 或受伤手术后的再生能力19。
多年来,如何正确评估神经突生长在研究领域带来了大量挑战。然而,神经突长度测量没有标准化。体外细胞培养的一些最常用的方法是,例如,Fiji18,20 或 MetaMorph21,23 上的手动 NeuronJ 插件以及半自动 Neurolucida23,24。除了手动方法外,还有自动方法,例如 Fiji25 上的 NeuriteTracer 插件、HCA Vision 软件26,27 或 WIS-NeuroMath 2,28。其他不太准确的方法依赖于对神经元整体维度的测量。这些方法包括测量从细胞体到最长轴突尖端的矢量距离29 或 Sholl 分析30。然而,这些测量方法适用于非常低密度的培养物或单个神经元。此外,所有这些方法主要用于染色神经元或表达遗传编码荧光团(即 GFP、Venus、mCherry)的神经元。神经元的类型和细胞培养物的密度会严重影响测量方法的选择。例如,手动分割形态非常复杂和复杂的神经元,例如 DRG 神经元,很容易成为一项不可能完成的任务。如果说复杂多曲折的神经元已经是一个难以分割的挑战,那么由于神经网络的组织高度复杂,手动方法完全无法实现。
一方面,人工分割非常精确,因为它是由人眼和智能执行的;另一方面,它真的很耗时。手动方法需要增加的时间消耗是主要缺点。因此,仅获取少量神经元进行分析,使其准确性较低且时间成本较高。另一方面,自动或半自动方法部分减少了时间消耗。但是,它们也有一些缺点。需要训练自动方法才能正常工作,如果软件与用户的交互性不够,则分割可能会出错。
除了神经突生长测量外,分支点的数量也是有价值的信息。使用手动分割,可以计算分支点的数量,而使用矢量距离则无法计算。使用自动方法,通常会提供分支点的数量,而使用 Sholl 分析,则必须使用数学公式进行计算。
在该方法论文中,我们旨在描述这种半自动软件在测量总轴突长度和其他参数方面的功能和有效性。该机器允许在定义的时间点自动采集图像或进行长期研究(几天、几周、几个月),为活细胞保留生理环境。使用相差延时成像测量神经突生长的好处是可以连续监测神经突动力学和生长。此外,还可以通过在培养基中添加靶向死细胞的特异性染料来监测细胞死亡 31,32,33。尽管该软件已于 2012 年发布,但我们是第一个以可重复和无偏见的方式标准化该方法以准确量化神经突生长的公司。但是,请务必注意,该软件不包含在购买机器中。尽管有这笔额外的费用,但它的使用在测量总轴突长度和其他参数方面具有显着优势,从而有助于神经科学领域的研究。
研究方案
1. 扫描机器上的容器
注意:检测由内置的 Basler Ace 1920-155 μm 相机执行。
- 单击 Connect to Device 并选择 Schedule - To Acquire,打开程序。然后点击 + 号。
- 通过分别选择选项 Scan on Schedule (按计划扫描 ) 或 Scan Once Now (立即扫描一次) 来指定船舶是重复扫描还是仅扫描 1 次。
- 选择 New (新建 ) 以创建一个全新的容器进行扫描。如果未添加新容器,请使用下述选项之一创建新扫描。
- 选择 Copy Current (复制当前 ) 以通过从当前计划中复制船只来创建新船舶。选择 Copy Previous (复制上一个 ) 以通过复制之前扫描的容器来创建新容器。
- 选择 Add Scan(添加扫描 )以恢复之前扫描的船只以进行其他扫描。
- 根据检测和应用选择扫描类型。对于分析,请选择 Standard(标准)。
- 指定扫描设置。选择 Cell-by-Cell 选项之一,即 None、Adherent Cell-by-Cell 或 Non-peritent Cell-by-Cell,并根据所使用的荧光分子指定图像通道。为成人和胚胎感觉神经元培养选择 None 选项。对于细胞系,请选择 None 或 Adherent Cell-by-Cell 选项。
- 选择显微镜物镜(4x、10x、20x)。在原代培养物中以更高的放大倍数 (20x) 采集,而在细胞系中,10 倍就足够了。
- 从提供的选项中选择要扫描的船只类型。通过在抽屉的虚拟地图上选择船只的位置来指示船只在抽屉中的位置。
- 通过选择要扫描的孔来指定图像采集的扫描模式。选择每个孔所需的图像数量。将显示扫描持续时间的估计值。
- 通过键入名称提供有关船舶的信息,并通过单击 + 号指定板图。
- 单击 Next。选择 Analysis Type(分析类型),然后单击 Next(下一步)。将显示所选选项的摘要屏幕。如果正确,请单击 Scan Now 扫描,扫描将开始。
2. 相差图像分析的设置
注意:Neurotrack 分析只能对机器之前采集的图像进行。
- 选择要分析的 Scanned Vessel。选择 Launch Analysis。选择 Create New Analysis Definition。
- 选择 Neurotrack。选择 Image Channels。选择要执行分析的代表性图像集。选择每个井的所有图像以训练算法。
- 通过调整以下参数来优化 Analysis Definition 设置。
注意:默认情况下,神经突以洋红色分割,而细胞体为黄色。可以根据需要修改颜色。- 对于单元-体簇分割,请按如下所述调整以下内容。
- 分割模式:图像的分割是为了区分细胞体与背景和神经突。在 Brightness 和 Texture 之间进行选择。对于原代培养物和细胞系,选择 Brightness mode(亮度模式)。
- 分段调整:使用滑块调整分段敏感度,使其向更多背景或更多单元格倾斜。它的范围从 0 (背景) 到 2 (单元格)。它会增加或减小黄色蒙版的大小。将滑块向 0 (背景) 移动,以便黄色蒙版的大小逐渐减小,为洋红色蒙版留出空间。如果将滑块向 2 (Cells) 移动,则情况正好相反。
- 对于清理,请按照如下所述调整以下内容。
- 孔填充 (μm2):调整此选项以删除细胞体掩码中小于用户指定区域的任何孔。
- 调整大小(像素):按指定的像素数增加(如果为正)或缩小(如果为负)黄色蒙版。它的范围从 -10 到 +10。调整此选项可在高对比度对象(如死细胞和细胞碎片)上添加或删除黄色分段。
- 最小细胞宽度 (μm):选择一个值以定义细胞体将被视为神经突的大小。
- 对于单元格-体群集筛选器,请按照如下所述调整以下内容。
- 面积 (μm2):设置细胞体面积的最小值和最大值。高于和低于设定值的值将不被视为单元体。
- 对于神经突参数,请按如下所述调整以下内容。
- 过滤:它减少了小容器缺陷和碎屑的掩盖。在 无、更好和 最佳 选项之间进行选择。仅对非常干净的培养物和容器选择 None(无 )。选择 Better (更好 ) 以加快处理速度,但代价是丢失对非常细小的神经突的检测。对于具有较厚或高对比度神经突的细胞,它可能就足够了;此外,它对于具有许多缺陷或碎屑的容器也很有用。选择 Best (最佳 ) 可获得较长的处理时间,但这是最灵敏的过滤器设置,可确保检测非常细小的神经突。
- 神经突灵敏度:用于调整检测灵敏度。提高灵敏度以检测更细小的神经突。它的范围从 0.25 (Less) 到 0.75 (More)。
注意:它会增加或降低软件识别神经突的灵敏度。如果滑块向 0.25 (Less) 移动,则软件对神经突的识别将更加严格。相反,如果滑块向 0.75 (更多) 移动,则软件在此检测中将不那么严格,因此,更多的缺陷(即细胞碎片、污垢)将被视为神经突。 - 神经突宽度 (μm):使用它来调整检测以适应神经元的大小。它可以是 1、2 或 4。通过增加它,将不考虑较薄的神经突。对于原代成人感觉神经元培养物,将其设置为 1,对于细胞系和胚胎感觉神经元培养物,将其设置为 2。
- 对于单元-体簇分割,请按如下所述调整以下内容。
- 单击 Preview Current 以可视化分割的图像。将为每个图像提供以下测量值:神经突长度 (mm/mm2)、神经突分支点(每 mm2)、细胞-体簇(每 mm2)和细胞-体簇面积 (mm2/mm2)。
- 对所有选定的图像重复步骤 2.3 和 2.4。单击 Next。
- 选择 Scan time (扫描时间 ) 和 well (井 ) 进行分析。分配 定义名称 ,并根据需要分配 分析注释 。单击 Next > Finish。
3. 免疫细胞化学 (ICC) 图像分析设置
- 按照 2.1 到 2.4 中所示的相同步骤进行操作。选择神经突和细胞核的图像 通道 。选择 集图像;选择 All images for each well 以训练算法。
- 通过调整以下参数来优化 Analysis Definition 设置,如下所述。
注意:默认情况下,神经突以蓝色分割,而细胞体为紫色。但是,可以根据需要修改颜色。- Cell-body cluster segmentation(单元-体簇分割):使用此选项可将图像分割为感兴趣的对象。估计图像中每个像素的背景亮度。找到背景后,执行以下选项之一。
- 无背景减法:使用此选项可在不更改原始图片的情况下进行分割。在 Adaptive (自适应) 或 Fixed Threshold (固定阈值) 之间进行选择。自适应:背景用于查找对象,但不明确减去;使用此选项,可以设置阈值调整 (GCU)。固定阈值:在原始图像中检测到比此阈值更亮的物体;使用此选项,可以设置 阈值 (GCU)。
- 背景减法:使用此选项可使用 Top-Hat 变换从图像中减去背景,然后对其应用阈值。使用此选项,设置 Radius 和 Threshold。Radius:使用这个半径的圆盘;磁盘应足够大,使其不能完全容纳在映像中的任何对象中。阈值:在减去背景的图像中检测到比此阈值更亮的对象。
- Cleanup:使用以下选项执行此操作。
- 孔填充 (μm2):使用此选项可删除细胞体掩模中小于指定区域的任何孔。
- 调整大小(像素):使用此选项可将紫色蒙版增加(如果为正)或缩小(如果为负)指定的像素数。范围为 -10 到 +10。它可以在高对比度对象(如死细胞和细胞碎片)上添加或删除紫色。
- 最小细胞宽度 (μm):用于定义细胞体将被视为神经突的大小。
- Cell-body cluster filters(单元格-主体群集筛选器):使用以下选项应用筛选器。
- 面积 (μm2):设置细胞体面积的最小值和最大值。高于和低于设定值的值将不被视为单元体。
- 神经突参数:使用以下选项来设置这些参数。
- 神经突粗调敏感性:使用此选项可调整神经突亮度。如果神经突的荧光强度较低,则应提高灵敏度。它的范围从 0 (更少) 到 10 (更多)。它增加或降低软件识别不太亮的神经突的灵敏度。最佳值范围为 7 到 10;请注意,如果设置为 10,则很可能在 NERVEITE 测量中也会考虑 BACKGROUND。
- 神经突精细灵敏度:使用此选项可调整检测灵敏度。应提高敏感性以检测较细的神经突。它的范围从 0.25 (Less) 到 0.75 (More)。它增加或降低软件识别细小和较不亮的神经突的灵敏度。如果滑块向 0.25 (Less) 移动,则软件不会考虑微弱的神经突。相反,如果滑块向 0.75(更多)移动,软件也会检测到非常微弱(几乎是背景)的神经突。
- 神经突宽度 (μm):使用它来调整检测以适应神经元的大小。它可以是 1、2 或 4。通过增加它,将不考虑较薄的神经突。对于原代成体感觉神经元培养物,将其设置为 1,对于细胞系和胚胎感觉神经元培养物,将其设置为 2。
- Cell-body cluster segmentation(单元-体簇分割):使用此选项可将图像分割为感兴趣的对象。估计图像中每个像素的背景亮度。找到背景后,执行以下选项之一。
4. 数据导出
- 打开分析。单击 Graph Metrics(图形指标)。
- 选择 Metric、Timepoints 和 Wells 感兴趣的。
- 在全部、无、列、行和板图仿行之间选择分组选项。
- 单击 Export Data 并选择目标文件夹,如果需要,还可以选择其他选项。将创建一个 .txt 文件。
注意:机器将为每个孔提供所选指标的单个平均值。在分析过程中需要手动注释才能检索单个图像值。
5. 图片导出
- 打开容器。点击 导出图像 和 电影.
- 选择图像的导出类型。
- 选择 As Displayed (按显示方式 ) 以将图像导出为显示的图像。单击 下一步 并选择要导出 的感兴趣图像 。单击 Next。
- 在 Single Movie 或 Series of Images 和感兴趣的时间点之间选择 Sequence Type 。单击 Next。
- 根据需要调整导出选项,然后单击 Next。设置文件的输出文件夹、文件格式和名称,然后单击 导出.
- 选择 As Stored 以 Raw 格式导出图像。选择 Image Type。
- 选择感兴趣的 Timepoints 和 Wells。单击 Next。设置输出文件夹、文件格式和文件名,然后单击 导出.
- 选择 As Displayed (按显示方式 ) 以将图像导出为显示的图像。单击 下一步 并选择要导出 的感兴趣图像 。单击 Next。
- 使用分割蒙版导出图像
- 打开分析。点击 Image Layers 的图标。选择 所需的通道掩码 (Phase Neurite 和 Phase Cell-Body Cluster)。按照步骤 5.2 进行操作。
结果
神经突生长测量算法能够稳健地检测神经网络和单个神经元中的神经突。它生成一个黄色遮罩,用于分割具有高对比度的对象,例如细胞体、细胞碎片、死细胞、组织外植体和阴影。此外,洋红色面具出现在不同厚度的神经突上。神经突长度值以 mm/mm2 为单位提供,表示轴突长度已除以图像面积,即 0.282739 mm2 并且对于每个扫描条件都是恒定的。因此,为了获得以 mm 为单位的神经突长度的纯值,需要将软件提供的数字乘以图像的面积。
半自动与手动方法
使用的软件是一种半自动测量轴突总长度的方法。为了评估软件的准确性,我们还使用带有 NeuronJ 插件的手动方法对相同的神经元进行了测量。如图 1 所示,两种方法之间神经元上的分割掩码高度相似(图 1A)。
此外,我们对获得的值进行了统计分析,以检查它们的相关性。Spearman 相关分析产生了 0.8526 的高系数 r,因此为算法的准确性和精密度提供了强有力的证据(图 1B)。自动测量需要根据其清洁度、密度和纯度达到高标准的培养质量。使用半自动分割获得的结果是可重复的,并且不受个人判断的影响。无偏差的可重复性是手动方法的一个问题。
有时,由于不同的原因,可能会出现半自动分割错误。在相差图像中,培养物中的污垢可以通过半自动分割检测为神经突。此外,不同细胞类型的存在会干扰分割过程。手动分割不会出现此类问题,因为它是由人眼执行的。尽管如此,如果出现此类问题,可以通过使用免疫细胞化学图像作为对照来克服它们。
神经突分割
对于成人 DRG 神经元原代培养物,可靠相位分析的最佳起点是将神经元均匀接种在孔和清洁培养物中。如果在接种过程中出现错误并且细胞集中在一个点,如图 2A-B 所示,则这些值将更像是一种估计,而不是现实的密切反映。在这种情况下,黄色面膜将覆盖细胞之间的大部分神经突(图 2A-B),从而导致神经突长度的损失。此外,该软件在识别神经突方面会明显偏倚,并且很可能在不是神经突的物体上出现洋红色掩码(图 2D)。在最佳图像中,最多应该有 15 个放大倍率为 20 倍的神经元。
如图 3A-B 所示,当神经元正确接种且培养物干净时,建议将分割滑块调整为背景 (0.5 - 0.7;图 3C)。这有助于减少图像中高对比度对象上出现的黄色分量,例如应为洋红色的分支点。此外,如果神经突粗体,则 0.4 到 0.5 之间的神经突敏感性应该足以覆盖其中的大部分(图 3C-D)。
可能出现的另一种常见情况是具有许多细胞碎片和死细胞的肮脏培养物,如图 4A-B 所示。在这种情况下,有许多高对比度的对象。因此,建议通过调整单元格的分段滑块或增加调整大小参数(+1、+2 等)来增加黄色蒙版的大小;图 4C)。尽管如此,稍微降低神经突敏感性以防止软件错误地将不是神经突的对象识别为神经突对象也很有用。(图 4C-D)。
有时,神经突会显得非常薄和苍白,如图 5A-B 所示,这给软件准确分割它们带来了挑战(图 5D)。在这种情况下,建议将神经突敏感性提高到至少 0.6(图 5C)。但是,请记住,灵敏度越高,软件错误标记不是神经突的物体的可能性就越大(图 5D)。可以采取一些预防措施来防止敏感度偏差增加太多,例如,通过调整 Segmentation 滑块来朝向单元格。但是,如果神经突太薄而无法被软件检测到,则神经突长度值无论如何都会出现偏差。
在免疫细胞化学图像的情况下,主要问题在于背景。除了上述规则适用的种子条件外,主要偏差来源是荧光本身。该软件可以有效地识别非常亮的神经突,而留下较薄、强度较低的神经突(图 6A-B)。为防止神经突长度的损失,神经突精细敏感性可以提高到 0.75(图 6C)。然而,强烈建议将神经突粗敏感性降低到至少 8-9,以防止通过考虑背景中的神经突来产生过多的检测偏差(图 6C-D)。如果后者没有减少,则所有背景都将被分割,如图 7 所示。
荧光采集的一个常见问题是光的散射。通常,免疫细胞化学图像在图像中显示手电筒,这会显着影响分析的质量和精度(图 8A-B)。在这种情况下,无法做太多事情来改进分析,值将更多地是一种估计。光散射会干扰神经突识别,因此只会检测到非常亮的神经突(图 8C-D)。免疫细胞化学图像中的另一个问题是染色本身的质量。通常,由于人为错误,轴突可能会断裂(图 9A),并且细胞体可能会在洗涤过程中被撕裂(图 9B)。这些错误会带来一个关键问题,因为神经突长度值会失去精度和准确度。因此,对生物数据的解释被改变,导致错误的结论。
对于胚胎培养物,情况有所不同。在这种类型的培养中,神经胶质细胞的存在占主导地位。因此,由于软件还检测到神经胶质细胞的衬里,因此误差显着增加(图 10A-B)。为了最大限度地减少这个问题,应将分割滑块移向单元格,通常约为 1.7-2 的值(图 10C-D)。这种方法确保大多数神经胶质细胞被黄色掩码覆盖,因此在神经突长度测量中不考虑。另一个有用的提示是将神经突宽度保持在 2,因为培养中的胚胎神经元通常表现出双极或单极形状和厚的神经突(图 10C-D)。这种预防措施可以过滤掉通常非常薄的神经胶质细胞的大部分衬里。最后,注意不要过多地增加神经突敏感性;否则,由 Neurite Width 参数过滤掉的内容将再次包含在 Neurite Length 测量中。
在神经胶质细胞成分占主导地位的胚胎培养物的情况下,免疫细胞化学可能是更好的选择。通过特异性对神经元进行染色,解决了神经胶质细胞分割的问题,因为神经胶质细胞不会被染色,使分析变得更加容易和准确(图 11)。
最后,该软件还可用于评估细胞系和/或 iPSC 的分化程序,以评估其生长状态。因此,相似参数和预防措施的应用可用于不同的目标。
关于分化过程,该软件的稳健性已在 NSC-34 细胞系(由小鼠神经母细胞瘤细胞和源自小鼠胚胎脊髓的运动神经元构成的杂交细胞系)成熟为运动神经元样细胞的过程中得到证明。对于 DRG 原代培养物,良好分析的最佳起点是均匀的细胞接种。在视黄酸处理后,可以在整个培养期间或如图 12 所示,在最后一个时间点使用采集来跟踪未分化和分化的细胞。
事实上,除了神经突长度之外,该算法还提供了 branch point 参数。但是,请务必注意,分支点参数并不表示分支点的确切数量;相反,它表示图像中分支的密度,因为它以 mm/mm2 表示。该测量值受培养物和接种浓度中的碎片的显著影响。因此,图像中神经元的密度和培养物的清洁度是获得可靠值的关键因素。如果培养物中存在许多细胞碎片,未被黄色掩模过滤掉,则它们将包含在神经突长度以及分支点测量中。
因此,建议对细胞计数的这些值进行标准化,因为图像中神经元的数量会影响神经突长度和分支点测量值。
细胞体分割
在系统提供的所有参数中,有 cell-body cluster 和 cell-body cluster area。但是,这两个参数不能可靠地用作单元格计数的值。如图 4 所示,软件在黄色掩模中分割高对比度对象,包括由井中介质移动引起的阴影。此外,它还分割死细胞和细胞碎片(图 4)。为了获得生长神经元的可靠细胞计数,可以使用手动方法,例如斐济的 Cell Counter 工具(图 13)。
表 1 中提供了按培养类型排序的建议分析参数摘要,表 2 中提供了免疫细胞化学图像。此外,表 3 还总结了解决特定问题的建议分析参数。
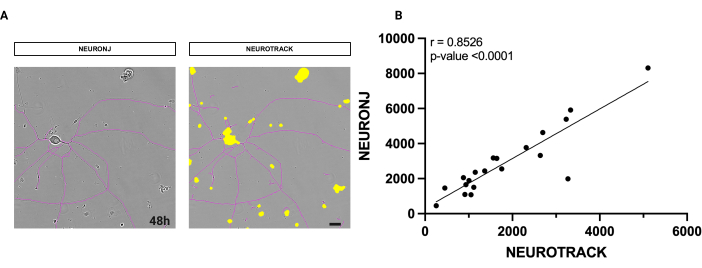
图 1:手动和半自动神经突分割之间的相关性分析。(A) 左侧是斐济使用 NeuronJ 插件分割的神经元的代表性相位图像。在右侧,神经元的代表性相位图像是用半自动软件分割的。 (B) 用手动和半自动方法对 20 个神经元进行简单的线性回归分析。斯皮尔曼相关系数 r = 0.8526,p**** < 0.0001。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
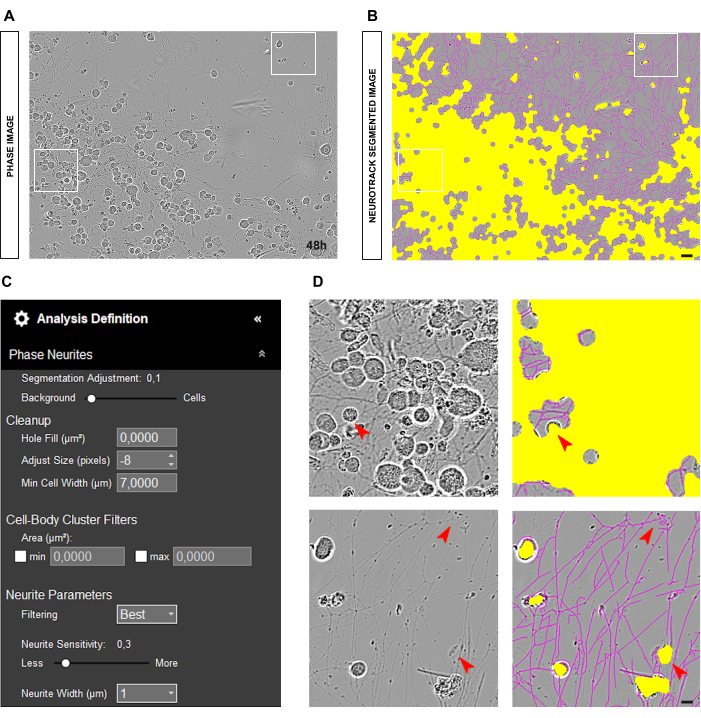
图 2:成人感觉神经元培养中的接种错误。(A) 晶型误差的代表性相位图像。 (B) 代表性的自动分割图像。黄色遮罩分割细胞体,洋红色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 上图:放大由于细胞体聚集而导致的细胞体分割(黄色掩码)误差。底部面板:放大由于细胞碎片引起的神经突分割(洋红色掩码)的误差。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
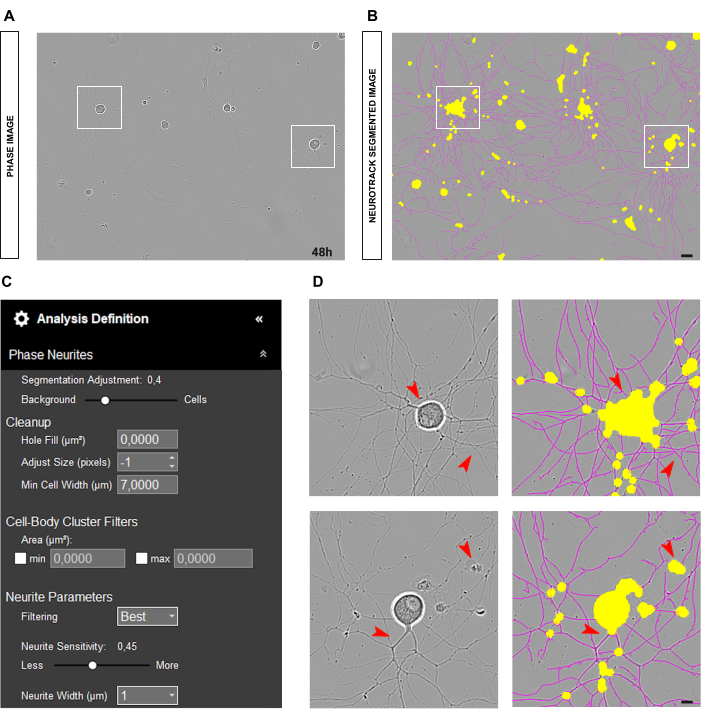
图 3:用于神经突生长分析的理想成体感觉神经元培养物。(A) 用于神经突生长分析的理想晶种条件的代表性相位图像。 (B) 代表性的自动分割图像。黄色遮罩分割细胞体,洋红色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 放大细胞体分割(黄色掩码)和神经突分割(洋红色掩码)。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
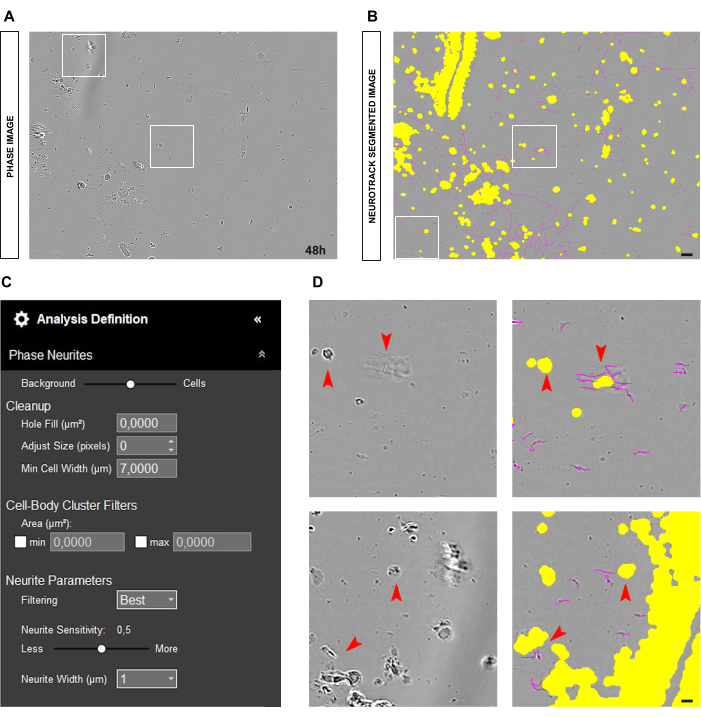
图 4:成人感觉神经元培养物中神经突生长分析中的干扰因素。(A) 由于介质移动引起的细胞碎片和阴影的代表性相位图像。 (B) 代表性的自动分割图像。黄色遮罩分割细胞体,洋红色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 放大由于细胞碎片和移动介质的阴影而导致的细胞体分割(黄色掩码)和神经突分割(品红色掩码)的误差。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
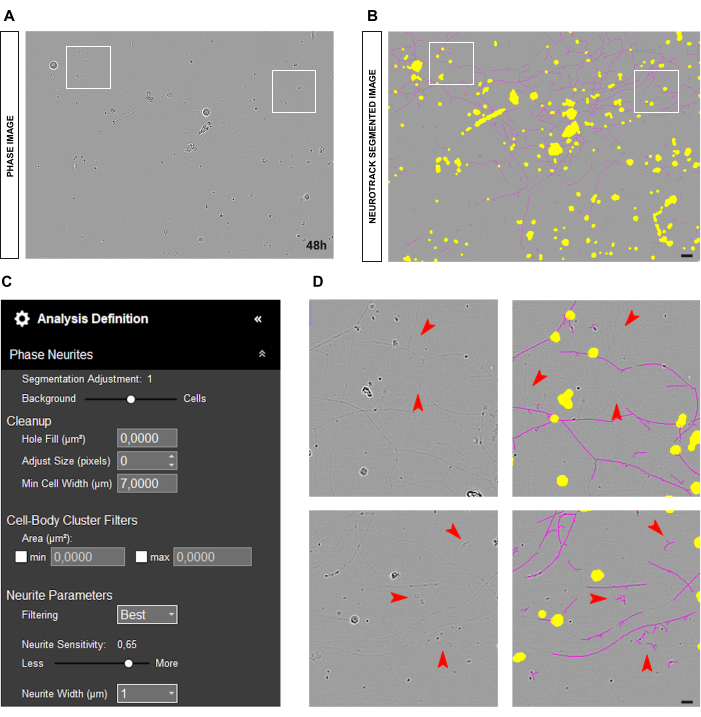
图 5:成人感觉神经元培养物中神经突生长分析中的薄神经突。(A) 以非常薄的神经突为特征的神经元的代表性相位图像。 (B) 代表性的自动分割图像。黄色遮罩分割细胞体,洋红色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 顶部面板:放大由于神经突分割的检测限(洋红色掩码)而导致的神经突长度损失。底部面板:放大异物上神经突分割(洋红色掩码)的误差。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
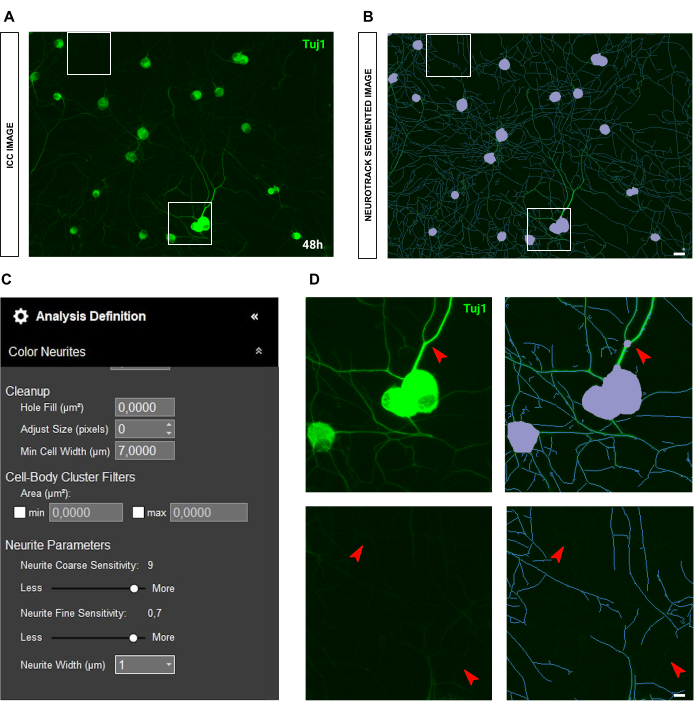
图 6:成体感觉神经元培养物中神经突生长分析中的神经突亮度。(A) 神经元的代表性免疫细胞化学图像(神经元标志物 Tuj1),其特征是非常明亮和厚的神经突。 (B) 代表性的自动分割图像。紫色遮罩分割细胞体,蓝色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 上图:放大由于神经突厚度引起的细胞体分割误差(紫色掩码)。下图:放大由于厚神经突的强烈荧光亮度而导致的神经突长度损失。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
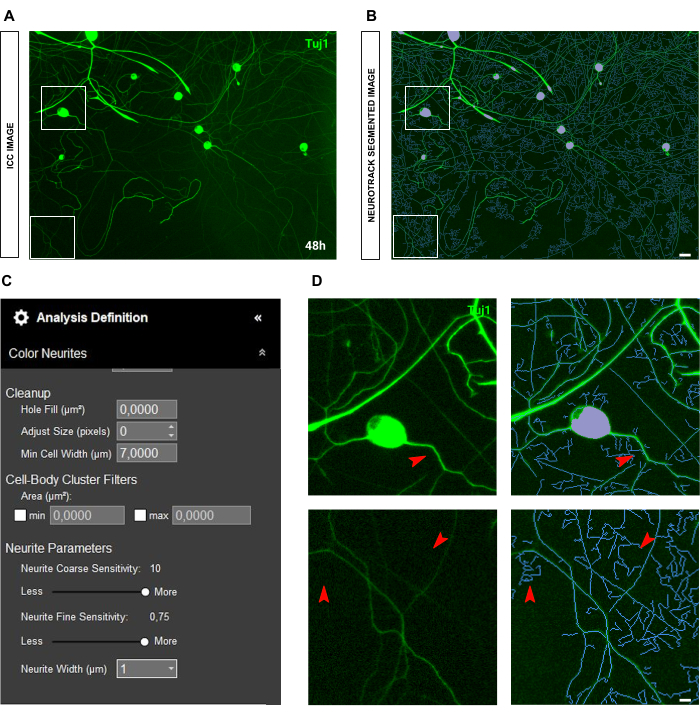
图 7:成人感觉神经元培养物中神经突生长分析中的背景荧光。(A) 高背景荧光噪声的代表性免疫细胞化学图像(神经元标志物 Tuj1)。 (B) 代表性的自动分割图像。紫色遮罩分割细胞体,蓝色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 放大由于背景荧光干扰引起的神经突分割误差(蓝色掩码)。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
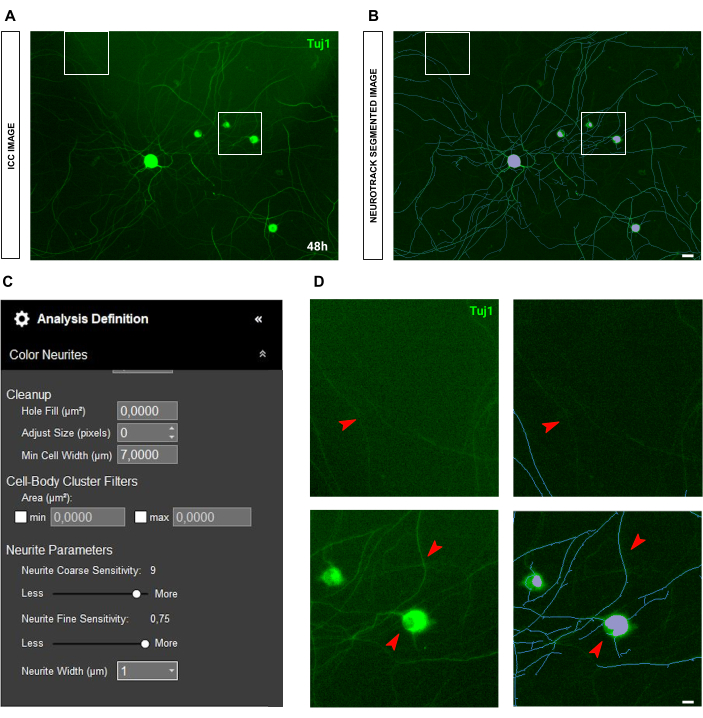
图 8:成体感觉神经元培养物的神经突生长分析中的光散射。(A) 光散射的代表性免疫细胞化学图像(神经元标志物 Tuj1)。 (B) 代表性的自动分割图像。紫色遮罩分割细胞体,蓝色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 上图:放大由于光散射干扰而导致的神经突长度损失。底部面板:放大细胞体分割错误(紫色掩码)。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
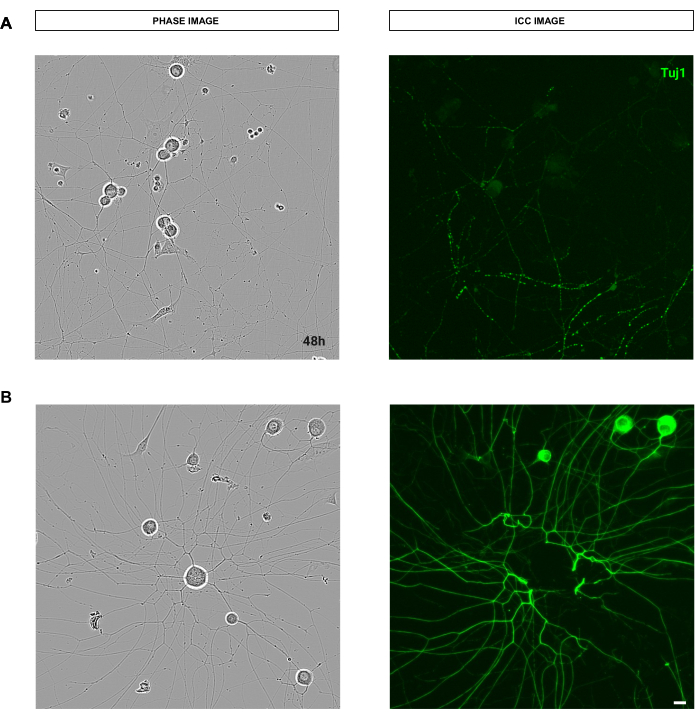
图 9:染色程序的质量影响错误干扰成人感觉神经元培养的神经突生长分析。(A) 左侧是成人感觉神经元的代表性相位图像。右图是染色过程中由于洗涤而断裂的神经突的代表性免疫细胞化学图像(神经元标志物 Tuj1)。 (B) 左侧是成人感觉神经元的代表性相位图像。右图是染色程序洗涤后细胞体去除的代表性免疫细胞化学图像(神经元标志物 Tuj1)。接种后 48 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
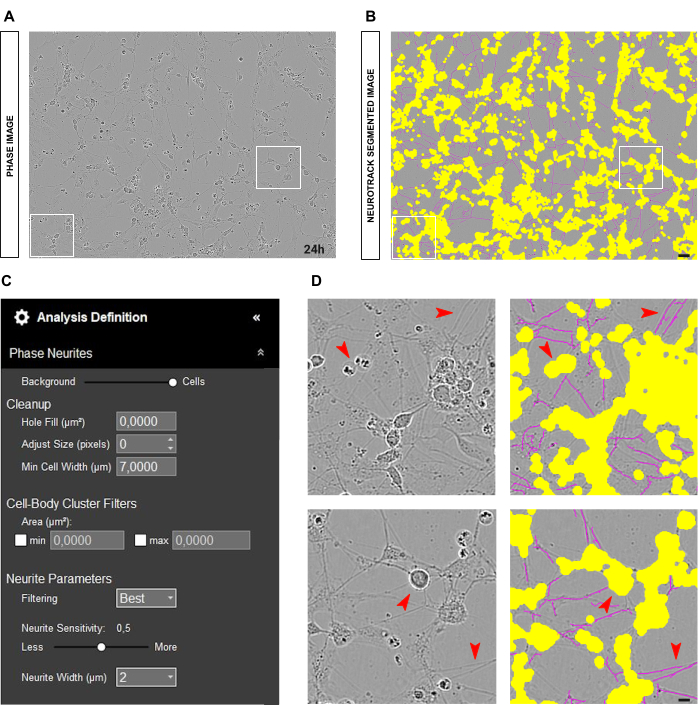
图 10:用于神经突生长分析的理想胚胎 (E13.5) 感觉神经元培养物。(A) 胚胎感觉神经元培养中神经突生长分析的理想接种条件的代表性相图。 (B) 代表性的自动分割图像。黄色遮罩分割细胞体,洋红色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 放大细胞体分割(黄色掩码)和神经突分割(洋红色掩码)。接种后 24 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
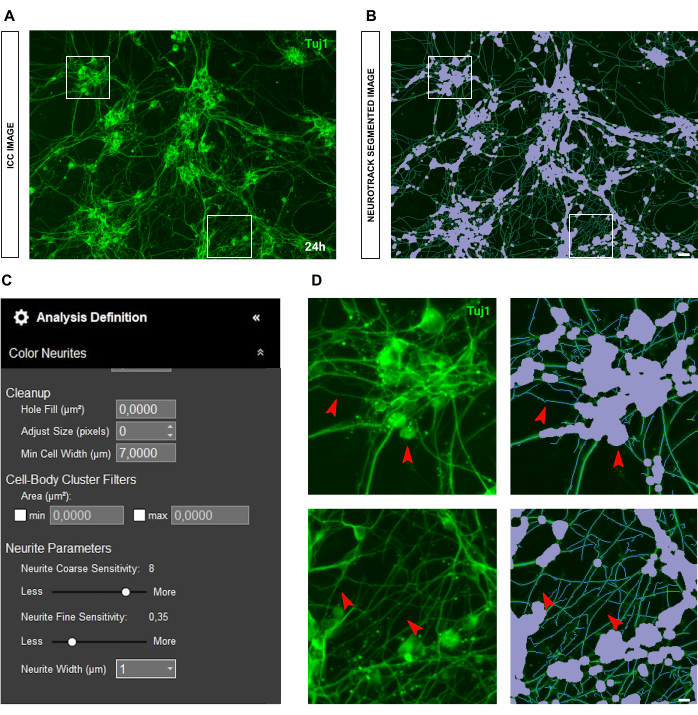
图 11:用于神经突生长分析的理想胚胎 (E13.5) 感觉神经元培养物。(A) 用于神经突生长分析的理想胚胎感觉神经元培养物的代表性免疫细胞化学图像(神经元标志物 Tuj1)。 (B) 代表性的自动分割图像。紫色遮罩分割细胞体,蓝色遮罩分割神经突。 (C) 说明性神经突生长分析定义参数。 (D) 放大细胞体分割(紫色掩码)和神经突分割(蓝色掩码)。接种后 24 小时获取图像。放大倍数 20 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。

图 12:与未分化对照相比,分化的 NSC-34 细胞的神经突和分支增加。 NSC-34 细胞的代表性图像。上图:未分化的 NSC-34 细胞(对照)。下图:视黄酸处理 96 小时后分化的 NSC-34 细胞。在两个面板的左侧,相差图像,而在两个面板的右侧,自动分割图像(体细胞为黄色,神经突为品红色)。接种后 96 小时获取图像。放大倍数 10 倍。比例尺,50 μm。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
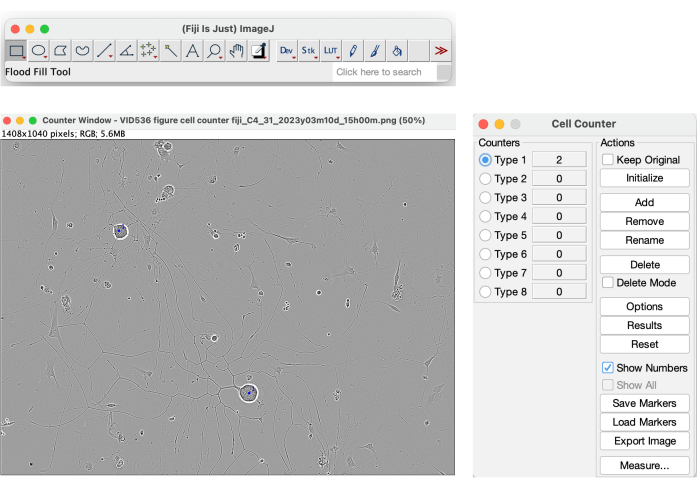
图 13:斐济的细胞计数仪工具。 在理想接种条件的相位图像上进行手动细胞计数,以进行神经突生长分析。放大倍数 20 倍。该图是使用 BioRender 创建的。 请单击此处查看此图的较大版本。
| 文化类型 | 成人 DRG 培养(阶段) | 胚胎 DRG 培养(阶段) | NSC-34 (阶段) |
| 放大 | 20 倍 | 20 倍 | 10 倍 |
| 分段模式 | 亮度 | 亮度 | 亮度 |
| 分段调整 | 0.5 - 0.7 | 1.7 - 2 | 1 |
| 调整大小 (像素) | 0, +1, +2 | 0, +1 | 0 |
| 滤波 | 最好 | 最好 | 最好 |
| 神经突敏感性 | 0.4 - 0.5 | 0.25 - 0.4 | 0.3 - 0.5 |
| 神经突宽度 | 1 | 2 | 2 |
表 1:相差图像中成人感觉神经元培养物、胚胎 (E13.5) 感觉神经元培养物和 NSC-34 培养物的建议分析定义参数摘要。
| 文化类型 | 成人 DRG 培养 (ICC) | 胚胎 DRG 培养 (ICC) |
| 放大 | 20 倍 | 20 倍 |
| 分段模式 | 亮度 | 亮度 |
| 分段调整 | 0.5 - 0.7 | 1.7 - 2 |
| 调整大小 (像素) | 0, +1, +2 | 0, +1 |
| 滤波 | 最好 | 最好 |
| 神经突粗调敏感性 | 8 - 9 | 8 - 9 |
| 神经突精细灵敏度 | 最高 0.75 | 0.5 - 0.75 |
| 神经突宽度 | 1 | 2 |
表 2:免疫细胞化学图像中成人感觉神经元培养物、胚胎 (E13.5) 感觉神经元培养物和 NSC-34 培养物的建议分析定义参数摘要。
| 问题 | 建议 |
| 脏污培养 | 朝单元格调整分段滑块 |
| 增加调整大小参数 (+1,+2...) | |
| 略微降低神经突敏感性 | |
| 苍白/薄的神经突 | 增加神经突敏感性(至少 0.6) |
| 朝向单元格调整分段滑块。 | |
| ICC 中的薄神经突 | 提高细神经突敏感性(高达 0.75) |
| 降低神经突粗敏感性(至少降低到 8-9) | |
| 神经胶质细胞 | 朝向单元格调整分段滑块 (1.7-2) |
| 2 时的神经突宽度 |
表 3:用于解决不同类型文化中特定问题的建议分析定义参数摘要。
讨论
准确测量神经元在健康、受伤和患病条件下的生长情况是神经科学领域内许多实验装置的关键参数。无论是使用整个 DRG 外植体的器官型培养物还是解离培养物,正确测量轴突生长在过去 20 年中都是一项重大挑战。如果没有可靠和准确的神经突生长定量,就无法评估特定治疗是否有效,例如针对 NSC-34 细胞34 的视黄酸(4 天)或胚胎 DRG 神经元的神经营养因子(1-2 天)14,35。神经元在健康时通常表现出持续生长;然而,受伤后轴突生长速率增加12,13。测量轴突生长时,时间至关重要;因此,在开始实验之前,必须进行试验测试,以根据细胞的生长速率平台曲线确定固定细胞的最佳时间。
方法的选择,手动或自动,标志着时间消耗和准确性的分水岭。一些最常见的手动方法包括 NeuronJ18,20 和 Metamorph (Visitron)2,22,28。手动方法需要用户手动追踪神经突,非常耗时,并且需要单细胞图像。通过手动分割神经突,神经网络完全遥不可及。通常,这些方法仅测量最长轴突或使用矢量距离测量,从而丢失重要信息,例如分支点的数量和轴突总长度。Sholl 分析30 提供了一些改进,无论如何,它仅限于单细胞条件。单细胞分析存在一些挑战,首先是细胞接种。神经元必须以非常低的浓度接种,这可能不是最适合每种细胞类型的生长条件。另一个问题来自图像采集。通常,共聚焦显微镜用于成像,这需要训练有素的用户和荧光神经元,既不省时也不省钱。使用共聚焦显微镜可以获得高分辨率图像,但每次实验都能获得极少的神经元成像。这代表了一个限制,因为需要更多的生物重复才能达到足够数量的神经元。
一些自动方法(如 NeuroMath 2,28)解决了以自动方式执行的耗时的神经突分割问题。
然而,由于时间限制,这种神经突生长测量模块在延时显微镜机器上采集图像时可提供更快的结果。后者与该软件一起,显着提高了学生和主要研究人员的时间和成本效率。
采集机可以创建相当完整的井图,根据井的直径采集可变数量的图像。这代表了一个显着的优势,因为多个神经元可以同时成像。但是,仅达到 20 倍的放大倍率就足够了,并且适合使用软件分析图像。它的能力在于它能够训练一组图像并对总轴突长度进行半自动测量。此外,该软件可以在单个神经元和神经元网络上工作。该软件能够用两种不同的掩码分割神经突和细胞体。黄色蒙版可分割图像中的所有高对比度对象,如单元体、单元碎片和阴影。相反,洋红色掩码会分割神经突。该软件的精度和准确性通过使用软件和 NeuronJ 对相同的神经元进行分割而得到证明。从统计分析的角度来看,神经突长度的值与较高的 Spearman 相关系数密切相关。
在评估了该方法的可靠性后,我们开始分析各种测试条件。为了获得最佳分析,需要采取一些预防措施。首先,神经元必须均匀地接种在孔中,避免细胞浓度高的斑点。神经元的聚集导致软件在神经突检测中失去精度。影响分析准确性和精密度的另一个变量是培养物的清洁度。最好使用细胞碎片和死细胞较少的干净培养物。然而,该软件能够通过调节神经突敏感性和细胞体分割掩码来补偿这些问题。如前所述,黄色遮罩分割了高对比度的物体,其中也有介质在井中移动引起的阴影。阴影可能覆盖神经突,从而导致神经突长度的损失。然而,通过在图像采集之前让介质沉淀下来,这个问题很容易解决。
该算法能够在相差图像和免疫细胞化学图像上进行神经突长度定量。当涉及荧光时,必须采取其他预防措施才能获得可靠的分析。首先,染色的质量对分析结果有很大影响。如果神经突断裂或分段,并且在洗涤过程中细胞体被撕裂,则分析将失去强度和可靠性。此外,荧光本身是分析的潜在干扰因素。由于对焦是由机器自动执行的,因此物镜会聚焦非常亮的物体,例如伪影、细胞体或厚神经突。结果,留下了较薄和较不亮的神经突,使用户难以正确测量神经突长度。
因此,与免疫细胞化学图像的分析相比,相位图像的分析可能更有根据。该软件能够处理许多不同的神经元形态,从最复杂和最简单的神经元形态,无论是单细胞还是神经元网络。因此,它可用于许多不同的研究领域,从来自不同发育阶段的中枢或周围神经系统的神经元的原代培养物到 iPSC 衍生的神经元和细胞系,如 NSC-34。
尽管该软件具有巨大的潜力,但可以注意到一些局限性。首先,细胞体分割的精度不理想。因此,细胞体簇和细胞体簇面积等参数不能可靠地用于细胞计数。其次,除了最佳神经突分割的必要预防措施外,神经突长度测量中可能会排除不够厚的轴突,从而导致数据丢失。
分支点参数会遇到与这两种类型的分段相关的问题。培养物中位于分支点的阴影、死细胞或碎片在被细胞体分割覆盖时会掩盖它们。此外,在薄神经突的情况下,分支点参数的可靠性再次受到严重损害。
此外,图像采集过程中的自动对焦有时可能不是最佳的。机器的最大放大倍率限制为 20 倍,这可能不足以观察细长结构(如神经突)中的更精细细节或荧光。此外,该机器在处理均质塑料基材时性能最佳。如果将玻璃盖玻片插入孔中,玻璃上的聚焦可能会失败,从而导致图像部分模糊。然而,该软件不仅适用于神经元,也适用于完全不同的研究领域,例如真菌生长36。
综上所述,我们相信这款神经突生长测量模块是快速、无偏、高效地测量神经突的可靠工具。
披露声明
作者声明,该研究是在没有任何可能造成利益冲突的商业或财务关系的情况下进行的。
致谢
我们要感谢 Alessandro Vercelli 的批评意见和 Sartorius 的技术支持。我们对这些主题的研究得到了 2021 年 Rita-Levi Montalcini Grant(意大利 MIUR)的慷慨支持。这项研究由 Ministero dell'Istruzione dell'Università e della Ricerca MIUR 项目 Dipartimenti di Eccellenza 2023-2027 资助给神经科学系 Rita Levi Montalcini。D.M.R. 的研究是在意大利国家可持续发展和气候变化大学间博士课程(链接:www.phd-sdc.it)期间并得到其支持。
材料
| Name | Company | Catalog Number | Comments |
| Collagenase A | Merck / Roche | 10103586001 | |
| Dispase II (neutral protease, grade II) | Merck / Roche | 4942078001 | |
| Dulbecco's modified eagle's medium | Merck / Sigma | D5796 | |
| Fetal bovin serum | Merck / Sigma | F7524 | |
| Ham's F-12 Nutrient Mix (1X) | ThermoFisher Scientific | 21765029 | |
| Ham's F12 w/ L-Glutamine | Euroclone | ECM0135L | |
| Hanks' Balanced Salt Solution | Euroclone | ECM0507L | |
| HBSS (10X), no calcium, no magnesium, no phenol red | ThermoFisher Scientific | 14185045 | |
| HyClone Characterized Fetal Bovine Serum (U.S.) | Cytiva | SH30071.03 | |
| Incucyte, Neurotrack Analysis Software | Sartorius | 9600-0010 | |
| L-15 Medium (Leibovitz) | Millipore/Sigma | L5520 | |
| Laminin Mouse Protein, Natural | ThermoFisher Scientific | 23017015 | |
| L-Cysteine | Merck / Sigma | C7352 | |
| Leibovitz's L-15 medium w/o L-glutamine | Euroclone | ECB0020L | |
| mouse NGF 2.5S (>95%) | Alomone Labs | N-100 | |
| Neurobasal Medium [-] Glutamine | ThermoFisher Scientific | 21103049 | |
| NSC-34 | CELLutions Biosystems Inc (Ontario, Canada) | CLU140 | |
| Papain from papaya latex | Sigma | P4762 | |
| Penicillin-Streptomycin (5,000 U/mL) | ThermoFisher Scientific | 15070063 | |
| Percoll (Density 1.130 g/mL) | Cytiva | 17089101 | |
| Poly-D-Lysine Solution (1mg/mL) | EMD Millipore/Merck | A-003-E | |
| Poly-L-Lysine Solution (0-01%) | Sigma | P4832 | |
| Recombinant Human NT-3 | PeproTech | 450-03 | |
| Retinoic Acid | Merck / Sigma | R2625 | |
| Trypsin-EDTA solution | Sigma | T3924 | |
| β-Tubulin III (Tuj1) antibody | Merck / Sigma | T8660 |
参考文献
- Terenzio, M., et al. Locally translated mTOR controls axonal local translation in nerve injury. Science. 359, 1416-1421 (2018).
- Marvaldi, L., et al. Enhanced axon outgrowth and improved long-distance axon regeneration in sprouty2 deficient mice. Dev Neurobiol. 75, 217-231 (2015).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. J Cell Biol. 218, 1871-1890 (2019).
- Marvaldi, L., et al. Importin α3 regulates chronic pain pathways in peripheral sensory neurons. Science. 369, 842-846 (2020).
- Gangadharan, V., et al. Neuropathic pain caused by miswiring and abnormal end organ targeting. Nature. 606, 137-145 (2022).
- Testa, L., Dotta, S., Vercelli, A., Marvaldi, L., et al. Communicating pain: emerging axonal signaling in peripheral neuropathic pain. Front Neuroanat. 18, (2024).
- Thongrong, S., et al. Sprouty2 and -4 hypomorphism promotes neuronal survival and astrocytosis in a mouse model of kainic acid induced neuronal damage. Hippocampus. 26, 658-667 (2016).
- Yaron, A., Schuldiner, O. Common and divergent mechanisms in developmental neuronal remodeling and dying back neurodegeneration. Curr Biol. 26, R628-R639 (2016).
- Maor-Nof, M., et al. Axonal degeneration is regulated by a transcriptional program that coordinates expression of pro- and anti-degenerative factors. Neuron. 92, 991-1006 (2016).
- Bromberg, K. D. Regulation of neurite outgrowth by Gi/o signaling pathways. Front Biosci. 13, 4544-4557 (2008).
- Girouard, M. P., et al. Collapsin response mediator protein 4 (CRMP4) facilitates wallerian degeneration and axon regeneration following Sciatic nerve injury. eNeuro. 7, 0479-0419 (2020).
- van Erp, S., et al. Age-related loss of axonal regeneration is reflected by the level of local translation. Exp Neurol. 339, 113594 (2021).
- Wang, X., et al. Driving axon regeneration by orchestrating neuronal and non-neuronal innate immune responses via the IFNγ-cGAS-STING axis. Neuron. 111, 236-255.e7 (2023).
- Kaselis, A., Treinys, R., Vosyliūtė, R., Šatkauskas, S. DRG axon elongation and growth cone collapse rate induced by Sema3A are differently dependent on NGF concentration. Cell Mol Neurobiol. 34, 289-296 (2014).
- Maier, O., et al. Differentiated NSC-34 motoneuron-like cells as experimental model for cholinergic neurodegeneration. Neurochem Int. 62, 1029-1038 (2013).
- Nango, H., et al. Highly efficient conversion of motor neuron-like NSC-34 cells into functional motor neurons by Prostaglandin E2. Cells. 9, 1741 (2020).
- Kim, H. W., Caspar, T., Shah, S. B., Hsieh, A. H. Effects of proinflammatory cytokines on axonal outgrowth from adult rat lumbar dorsal root ganglia using a novel three-dimensional culture system. Spine J. 15, 1823-1831 (2015).
- Frey, E., et al. An in vitro assay to study induction of the regenerative state in sensory neurons. Exp Neurol. 263, 350-363 (2015).
- Zhang, Z., et al. Cerebellar injury and impaired function in a rabbit model of maternal inflammation induced neonatal brain injury. Neurobiol Learn Mem. 165, 106901 (2019).
- Pemberton, K., Mersman, B., Xu, F. Using ImageJ to assess neurite outgrowth in mammalian cell cultures: Research data quantification exercises in undergraduate neuroscience lab. J Undergrad Neurosci Educ. 16, A186-A194 (2018).
- Marvaldi, L., Hausott, B., Auer, M., Leban, J., Klimaschewski, L. A Novel DRAK inhibitor, SC82510, promotes axon branching of adult sensory neurons in vitro. Neurochem Res. 39, 403-407 (2014).
- Quarta, S., et al. Peripheral nerve regeneration and NGF-dependent neurite outgrowth of adult sensory neurons converge on STAT3 phosphorylation downstream of neuropoietic cytokine receptor gp130. J Neurosci. 34, 13222-13233 (2014).
- Woitke, F., et al. Adult hippocampal neurogenesis poststroke: More new granule cells but aberrant morphology and impaired spatial memory. PLoS One. 12, e0183463 (2017).
- Xiao, X., et al. Automated dendritic spine detection using convolutional neural networks on maximum intensity projected microscopic volumes. J Neurosci Meth. 309, 25-34 (2018).
- Pool, M., Thiemann, J., Bar-Or, A., Fournier, A. E. NeuriteTracer: A novel ImageJ plugin for automated quantification of neurite outgrowth. J Neurosci Meth. 168, 134-139 (2008).
- Wang, D., et al. HCA-Vision: Automated neurite outgrowth analysis. SLAS Disc. 15, 1165-1170 (2010).
- Whitlon, D. S., et al. Novel high content screen detects compounds that promote neurite regeneration from cochlear spiral ganglion neurons. Sci Rep. 5, 15960 (2015).
- Rishal, I., et al. WIS-neuromath enables versatile high throughput analyses of neuronal processes. Dev Neurobiol. 73, 247-256 (2013).
- Smith, D. S., Pate Skene, J. H. A Transcription-dependent switch controls competence of adult neurons for distinct modes of axon growth. J Neurosci. 17, 646-658 (1997).
- Gardiner, N. J., et al. Preconditioning injury-induced neurite outgrowth of adult rat sensory neurons on fibronectin is mediated by mobilisation of axonal α5 integrin. Mol Cell Neurosci. 35, 249-260 (2007).
- Hauck, J. S., et al. Heat shock factor 1 directly regulates transsulfuration pathway to promote prostate cancer proliferation and survival. Commun Biol. 7, 9 (2024).
- Zhu, Y., et al. Loss of WIPI4 in neurodegeneration causes autophagy-independent ferroptosis. Nat Cell Biol. 26, 542-551 (2024).
- Reggiani, F., et al. BET inhibitors drive Natural Killer activation in non-small cell lung cancer via BRD4 and SMAD3. Nat Commun. 15, 2567 (2024).
- Ackerman, H. D., Gerhard, G. S. Bile acids induce neurite outgrowth in NSC-34 cells via TGR5 and a distinct transcriptional profile. Pharmaceuticals. 16, 174 (2023).
- Tuttle, R., Matthew, W. D. Neurotrophins affect the pattern of DRG neurite growth in a bioassay that presents a choice of CNS and PNS substrates. Development. 121, 1301-1309 (1995).
- Wurster, S., et al. Live monitoring and analysis of fungal growth, viability, and mycelial morphology using the IncuCyte NeuroTrack processing module. mBio. 10 (3), e00673-e00619 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。