Method Article
Padronização de um novo software semiautomático para medição de crescimento de neuritos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os ensaios de crescimento de neuritos fornecem um valor quantitativo sobre os processos neuronais regenerativos. A vantagem deste software semiautomático é que ele segmenta corpos celulares e neurites separadamente, criando uma máscara e mede vários parâmetros, como comprimento de neurites, número de pontos de ramificação, área de aglomerado de células-corpo e número de aglomerados de células.
Resumo
Técnicas eficazes de imagem ao vivo são cruciais para avaliar a morfologia neuronal, a fim de medir o crescimento de neuritos em tempo real. A medição adequada do crescimento de neuritos tem sido um desafio de longa data ao longo dos anos no campo de pesquisa em neurociência. Este parâmetro serve como uma pedra angular em várias configurações experimentais in vitro , variando de culturas dissociadas e culturas organotípicas a linhagens celulares. Ao quantificar o comprimento dos neuritos, é possível determinar se um tratamento específico funcionou ou se a regeneração axonal é aumentada em diferentes grupos experimentais. Neste estudo, o objetivo é demonstrar a robustez e precisão do software de análise de crescimento de neuritos Incucyte Neurotrack. Este software semi-automático está disponível em um sistema de microscopia de lapso de tempo que oferece várias vantagens sobre as metodologias comumente usadas na quantificação do comprimento do neurite em imagens de contraste de fase. O algoritmo mascara e quantifica vários parâmetros em cada imagem e retorna métricas de células neuronais, incluindo comprimento de neuritos, pontos de ramificação, aglomerados de corpos celulares e áreas de aglomerados de corpos celulares. Em primeiro lugar, validamos a robustez e precisão do software correlacionando seus valores com os do NeuronJ manual, um plug-in de Fiji. Em segundo lugar, usamos o algoritmo que é capaz de trabalhar tanto em imagens de contraste de fase quanto em imagens imunocitoquímicas. Usando marcadores neuronais específicos, validamos a viabilidade da análise de crescimento de neuritos baseada em fluorescência em neurônios sensoriais em culturas in vitro . Além disso, este software pode medir o comprimento dos neuritos em várias condições de semeadura, desde células individuais até redes neuronais complexas. Em conclusão, o software fornece uma plataforma inovadora e eficaz em termos de tempo para ensaios de crescimento de neuritos, abrindo caminho para quantificações mais rápidas e confiáveis.
Introdução
Nos nervos ciáticos, é possível medir a regeneração axonal1. Além disso, estudos in vitro mostraram a viabilidade de monitorar o crescimento axonal 2,3 para compreender suas várias fases, desde o brotamento axonal até a degeneração axonal, em neurônios saudáveis e lesionados. Ao rastrear esses processos, é possível medir parâmetros como polaridade axonal, iniciação, estabilidade e ramificação. Este último parâmetro é crucial para entender a percepção da dor neuropática 4,5,6. Da mesma forma, a degeneração axonal pode ser monitorada in vivo7 ou in vitro 8,9. Durante o crescimento dos neuritos, as redes de citoesqueleto de actina e microtúbulos se estabilizam ou mudam de acordo com as necessidades da célula10. O citoesqueleto de actina se reorganiza para permitir a formação do cone de crescimento axonal, e os microtúbulos se realinham em feixes para estabilizar o neurite em crescimento11. Para estudar o crescimento de neuritos de neurônios centrais e periféricos in vitro, três parâmetros comuns são quantificados: comprimento axonal total, distância máxima e pontos de ramificação. Esses parâmetros são usados para estudar a resposta do crescimento neuronal ao tratamento (ou seja, neurotrofinas, compostos, inibidores, ácido retinóico, siRNA, shRNA) ou em animais geneticamente modificados 12,13,14. Para avaliar se os neurônios têm neurites mais alongados e/ou mais ramificações, esses três parâmetros nos permitem avaliar a morfologia de um neurônio. A medição do comprimento de neuritos é o parâmetro de maior interesse em várias configurações experimentais in vitro. A partir dos gânglios da raiz dorsal, são realizados principalmente dois tipos de culturas: cultura in vitro dissociada ou cultura organotípica de explantes DRG inteiros. Em ambos os casos, o comprimento dos neuritos é um parâmetro ouro para avaliar o resultado do experimento. Em uma linhagem celular semelhante a neurônios motores (NSC-34), o crescimento axonal e a ramificação são medidos após a diferenciação induzida pelo ácido retinóico15,16. De fato, medindo o crescimento dos neuritos, é possível determinar se um tratamento específico funcionou17, a taxa de crescimento18 ou a capacidade de regeneração após um procedimento de lesão19.
Como avaliar adequadamente o crescimento de neuritos apresentou um número significativo de desafios ao longo dos anos no campo da pesquisa. No entanto, não há padronização das medições do comprimento dos neuritos. Alguns dos métodos mais utilizados para culturas de células in vitro são, por exemplo, o plug-in manual NeuronJ em Fiji18,20 ou MetaMorph21,23 e o semiautomático Neurolucida23,24. Além das metodologias manuais, também existem métodos automáticos, como o plug-in NeuriteTracer no Fiji25, o software HCA Vision26,27 ou o WIS-NeuroMath 2,28. Outras metodologias menos precisas dependem da medição da dimensão geral dos neurônios. Esses métodos incluem a medição da distância do vetor do corpo celular até a ponta do axônio mais longo29 ou a análise de Sholl30. No entanto, esses métodos de medição são adequados para culturas de densidade muito baixa ou neurônios únicos. Além disso, todas essas metodologias são utilizadas principalmente em neurônios corados ou neurônios que expressam fluoróforos geneticamente codificados (ou seja, GFP, Vênus, mCherry). O tipo de neurônio e a densidade da cultura de células afetam profundamente a escolha da metodologia de medição. Por exemplo, segmentar manualmente neurônios com morfologias muito intrincadas e complicadas, como neurônios DRG, pode facilmente se tornar uma tarefa impossível. Se os neurônios complicados já são um desafio para segmentar, as redes neurais estão completamente fora do alcance de abordagens manuais devido à sua organização altamente complexa.
Por um lado, a segmentação manual é muito precisa porque é realizada pelos olhos e pela inteligência humana; por outro lado, é realmente demorado. O elevado gasto de tempo exigido pelos métodos manuais é a principal desvantagem. Por esse motivo, apenas alguns neurônios são adquiridos para análise, tornando-a menos precisa e dispendiosa em termos de tempo. As abordagens automáticas ou semiautomáticas, por outro lado, reduzem parcialmente o gasto de tempo. No entanto, eles também têm algumas desvantagens. Os métodos automáticos precisam ser treinados para funcionar corretamente e, se o software não for interativo o suficiente com o usuário, a segmentação pode estar errada.
Além da medição do crescimento de neuritos, o número de pontos de ramificação também é uma informação valiosa. Com a segmentação manual, o número de pontos de ramificação pode ser calculado, enquanto isso não é possível com uma distância vetorial. Com métodos automáticos, o número de pontos de ramificação geralmente é fornecido, enquanto com a análise de Sholl, ele deve ser calculado com uma fórmula matemática.
Neste artigo de métodos, pretendemos descrever a funcionalidade e eficácia deste software semiautomático na medição do comprimento axonal total e outros parâmetros. A máquina permite a aquisição automática de imagens em pontos de tempo definidos ou a realização de estudos de longo prazo (dias, semanas, meses), preservando um ambiente fisiológico para células vivas. A medição do crescimento de neuritos usando imagens de lapso de tempo com contraste de fase tem o benefício de permitir o monitoramento contínuo da cinética e do crescimento dos neuritos. Além disso, também é possível monitorar a morte celular por meio da adição no meio de corantes específicos que têm como alvo as células mortas 31,32,33. Embora o software tenha sido lançado em 2012, somos os primeiros a padronizar essa metodologia de forma reprodutível e imparcial para a quantificação precisa do crescimento de neuritos. No entanto, é importante observar que o software não está incluído na compra da máquina. Apesar desse gasto adicional, seu uso oferece vantagens significativas na medição do comprimento axonal total e outros parâmetros, contribuindo assim para a pesquisa no campo da neurociência.
Protocolo
1. Escaneando o recipiente na máquina
NOTA: A detecção é realizada pela câmera Basler Ace 1920-155 μm integrada.
- Abra o programa clicando em Conectar ao dispositivo e selecionando Agendar - Adquirir. Em seguida, clique no sinal + .
- Especifique se a embarcação será escaneada repetidamente ou apenas 1x escolhendo a opção Scan on Schedule ou Scan Once Now, respectivamente.
- Selecione Novo para criar um novo recipiente para escanear. Se um novo recipiente não for adicionado, crie um novo escaneamento usando uma das opções descritas abaixo.
- Selecione Copiar atual para criar uma nova embarcação copiando uma embarcação da programação atual. Selecione Copiar anterior para criar um novo recipiente copiando um recipiente digitalizado anteriormente.
- Selecione Adicionar Verificação para restaurar um recipiente verificado anteriormente para verificações adicionais.
- Selecione o tipo de varredura com base no ensaio e na aplicação. Para a análise, selecione Padrão.
- Especifique as configurações de varredura. Escolha uma das opções Célula por Célula, Nenhuma, Célula Aderente por Célula ou Célula por Célula Não Aderente e especifique os canais de imagem dependendo das moléculas fluorescentes utilizadas. Selecione a opção Nenhum para culturas de neurônios sensoriais adultos e embrionários. Para linhas celulares, selecione as opções Nenhum ou Aderente Célula por Célula .
- Selecione a objetiva do microscópio (4x, 10x, 20x). Adquira com a maior ampliação (20x) em culturas primárias, enquanto em linhagens celulares, 10x é suficiente.
- Selecione o tipo de embarcação a ser escaneada entre as opções fornecidas. Indique a localização da embarcação na gaveta, selecionando sua posição no mapa virtual da gaveta.
- Especifique o padrão de varredura para a aquisição da imagem selecionando os poços a serem digitalizados. Selecione o número desejado de imagens por poço. Uma estimativa da duração da varredura aparecerá.
- Forneça informações sobre a embarcação digitando o nome e especifique o mapa da placa clicando no sinal + .
- Clique em Avançar. Escolha o Tipo de análise e clique em Avançar. Uma tela de resumo das opções selecionadas aparecerá. Se estiver correto, clique em Verificar agora e a verificação será iniciada.
2. Configuração para análise de imagem de contraste de fase
NOTA: A análise do Neurotrack só pode ser realizada em imagens previamente adquiridas pela máquina.
- Selecione o Recipiente Escaneado para analisar. Selecione Iniciar Análise. Selecione Criar nova definição de análise.
- Selecione Neurotrack. Selecione Canais de imagem. Selecione um conjunto representativo de imagens para executar a análise. Selecione todas as imagens de cada poço para treinar o algoritmo.
- Refine as configurações de Definição de análise ajustando os seguintes parâmetros.
NOTA: Por padrão, os neuritos são segmentados em magenta, enquanto os corpos celulares em amarelo. É possível modificar as cores conforme desejado.- Para segmentação de cluster de corpo celular, ajuste o seguinte conforme descrito abaixo.
- Modo de segmentação: A segmentação das imagens é feita para distinguir corpos celulares de fundo e neurites. Escolha entre Brilho e Textura. Para culturas primárias e linhagens celulares, selecione o modo Brilho.
- Ajuste de segmentação: use o controle deslizante para ajustar a sensibilidade de segmentação em direção a mais plano de fundo ou mais células. Varia de 0 (Plano de fundo) a 2 (Células). Aumenta ou diminui o tamanho da máscara amarela. Mova o controle deslizante para 0 (Plano de fundo) para que o tamanho da máscara amarela reduza gradualmente, deixando espaço para a máscara magenta. O oposto ocorre se o controle deslizante for movido para 2 (Células).
- Para limpeza, ajuste o seguinte conforme descrito abaixo.
- Preenchimento de orifício (μm2): Ajuste para remover qualquer orifício na máscara do corpo celular menor do que a área especificada pelo usuário.
- Ajustar tamanho (pixels): Aumente (se positivo) ou diminua (se negativo) a máscara amarela pelo número especificado de pixels. Varia de -10 a +10. Ajuste isso para adicionar ou remover segmentação amarela nos objetos de alto contraste, como células mortas e detritos celulares.
- Largura mínima da célula (μm): Escolha um valor para definir o tamanho no qual os corpos celulares serão considerados neuritos.
- Para filtros de cluster de corpo celular, ajuste o seguinte conforme descrito abaixo.
- Área (μm2): Defina um valor mínimo e máximo da área do corpo celular. Valores acima e abaixo dos valores definidos não serão considerados como corpos celulares.
- Para parâmetros neurite, ajuste o seguinte conforme descrito abaixo.
- Filtragem: Reduz o mascaramento de imperfeições e detritos de pequenos vasos. Escolha entre as opções Nenhum, Melhor e Melhor. Escolha Nenhum apenas para culturas e vasos muito limpos. Escolha Melhor para um processamento mais rápido às custas da perda de detecção de neuritos muito finos. Pode ser suficiente para células com neurites espessos ou de alto contraste; Além disso, pode ser útil para embarcações com muitas imperfeições ou detritos. Escolha Melhor para um tempo de processamento mais longo, mas é a configuração de filtro mais sensível para garantir a detecção de neurites muito finos.
- Sensibilidade de neurite: Use para ajustar a sensibilidade de detecção. Aumente a sensibilidade para detectar neurites mais finos. Varia de 0,25 (Menos) a 0,75 (Mais).
NOTA: Aumenta ou diminui a sensibilidade do software para reconhecer neurites. Se o controle deslizante for movido para 0,25 (Menos), o software será mais rigoroso no reconhecimento de neurites. Em vez disso, se o controle deslizante for movido para 0,75 (Mais), o software será menos rigoroso nessa detecção e, portanto, mais imperfeições (ou seja, detritos celulares, sujeira) serão consideradas neurites. - Largura do neurite (μm): Use-o para ajustar a detecção ao tamanho dos neurônios. Pode ser 1, 2 ou 4. Ao aumentá-lo, os neuritos mais finos não serão considerados. Defina-o como 1 para culturas primárias de neurônios sensoriais adultos e 2 para linhagens celulares e culturas de neurônios sensoriais embrionários.
- Para segmentação de cluster de corpo celular, ajuste o seguinte conforme descrito abaixo.
- Clique em Visualizar atual para visualizar a imagem segmentada. As seguintes medições serão fornecidas para cada imagem: Comprimento de Neurite (mm/mm2), Pontos de Ramificação de Neurite (Por mm2), Aglomerados de Células-Corpo (Por mm2) e Área de Aglomerado de Células-Corpo (mm2/mm2).
- Repita as etapas 2.3 e 2.4 para todas as imagens selecionadas. Clique em Avançar.
- Selecione o tempo de varredura e poço para analisar. Atribua um Nome de Definição e, se necessário, Notas de Análise. Clique em Avançar > Concluir.
3. Configuração para análise de imagem de imunocitoquímica (ICC)
- Siga as mesmas etapas ilustradas de 2.1 a 2.4. Selecione os canais de imagem para neuritos e núcleos. Selecione o Conjunto de imagens; selecione Todas as imagens para cada poço para treinar o algoritmo.
- Refine as configurações de Definição de análise ajustando os seguintes parâmetros, conforme descrito abaixo.
NOTA: Por padrão, os neuritos são segmentados em azul, enquanto os corpos celulares são roxos. No entanto, as cores podem ser modificadas conforme desejado.- Segmentação de cluster de corpo celular: use isso para segmentar a imagem em objetos de interesse. Estime o brilho do plano de fundo em cada pixel da imagem. Depois que o plano de fundo for encontrado, execute uma das seguintes opções.
- Sem subtração de fundo: use para segmentar sem alterar a imagem original. Escolha entre Limite Adaptável ou Fixo. Adaptativo: o plano de fundo é usado para encontrar objetos, mas não explicitamente subtraído; com esta opção, é possível definir o Ajuste de Limite (GCU). Limite fixo: objetos mais brilhantes que esse limite são detectados na imagem original; com esta opção, é possível definir o Limite (GCU).
- Subtração do plano de fundo: use essa opção para subtrair o plano de fundo da imagem usando uma transformação de cartola e aplique um limite a ela. Com esta opção, defina Raio e Limiar. Raio: um disco deste raio é usado; O disco deve ser grande o suficiente para não caber inteiramente em nenhum objeto na imagem. Limiar: objetos mais brilhantes que esse limite são detectados na imagem subtraída em segundo plano.
- Limpeza: use a opção a seguir para fazer isso.
- Preenchimento de orifício (μm2): Use para remover quaisquer orifícios na máscara do corpo celular que sejam menores do que a área especificada.
- Ajustar tamanho (pixels): Use isso para aumentar (se positivo) ou diminuir (se negativo) a máscara roxa pelo número especificado de pixels. O intervalo é de -10 a +10. Ele adiciona ou remove roxo em objetos de alto contraste, como células mortas e detritos celulares.
- Largura mínima da célula (μm): Use isso para definir o tamanho no qual os corpos celulares serão considerados neuritos.
- Filtros de cluster de corpo celular: use a opção a seguir para aplicar os filtros.
- Área (μm2): Defina um valor mínimo e máximo da área do corpo celular. Valores acima e abaixo dos valores definidos não serão considerados como corpos celulares.
- Parâmetros de neurite: Use a seguinte opção para defini-los.
- Sensibilidade grosseira de neurite: Use isso para ajustar o brilho do neurite. A sensibilidade deve ser aumentada se a intensidade de fluorescência dos neuritos for baixa. Varia de 0 (Menos) a 10 (Mais). Aumenta ou diminui a sensibilidade do software para reconhecer neurites menos brilhantes. Os valores ideais variam de 7 a 10; Observe que, se for definido como 10, é muito provável que também o fundo seja considerado na medição do neurite.
- Sensibilidade fina de neurite: Use isso para ajustar a sensibilidade de detecção. A sensibilidade deve ser aumentada para detectar neuritos mais finos. Varia de 0,25 (Menos) a 0,75 (Mais). Aumenta ou diminui a sensibilidade do software para reconhecer neuritos finos e menos brilhantes. Se o controle deslizante for movido para 0,25 (Menos), o software não considerará neuritos fracos. Em vez disso, se o controle deslizante for movido para 0,75 (Mais), o software detectará também neuritos muito fracos (quase de fundo).
- Largura do neurite (μm): Use isso para ajustar a detecção ao tamanho dos neurônios. Pode ser 1, 2 ou 4. Ao aumentá-lo, os neuritos mais finos não serão considerados. Defina-o em 1 para culturas primárias de neurônios sensoriais adultos, em 2 para linhagens celulares e culturas de neurônios sensoriais embrionários.
- Segmentação de cluster de corpo celular: use isso para segmentar a imagem em objetos de interesse. Estime o brilho do plano de fundo em cada pixel da imagem. Depois que o plano de fundo for encontrado, execute uma das seguintes opções.
4. Exportação de dados
- Abra a análise. Clique em Métricas do gráfico.
- Selecione a Métrica, os Pontos de Tempo e os Poços de interesse.
- Selecione a opção de agrupamento entre Todos, Nenhum, Colunas, Linhas e Replicações de mapa de placas.
- Clique em Exportar dados e selecione a pasta de destino e, se necessário, outras opções. Um arquivo .txt será criado.
NOTA: A máquina fornecerá um único valor médio da métrica escolhida para cada poço. A anotação manual é necessária durante a análise para recuperar valores de imagem única.
5. Exportação de imagens
- Abra o recipiente. Clique em Exportar imagens e filmes.
- Selecione o tipo de exportação para as imagens.
- Selecione Como exibido para exportar as imagens conforme exibidas. Clique em Avançar e selecione as Imagens de interesse para exportação. Clique em Avançar.
- Selecione o Tipo de sequência entre um único filme ou série de imagens e os pontos de tempo de interesse. Clique em Avançar.
- Ajuste as opções de exportação conforme necessário e clique em Avançar. Defina a pasta de saída, o formato do arquivo e o nome do arquivo e clique em Exportar.
- Selecione Como armazenado para exportar imagens no formato raw. Selecione o Tipo de imagem.
- Selecione os pontos de tempo e poços de interesse. Clique em Avançar. Defina a pasta de saída, o formato do arquivo e o nome do arquivo e clique em Exportar.
- Selecione Como exibido para exportar as imagens conforme exibidas. Clique em Avançar e selecione as Imagens de interesse para exportação. Clique em Avançar.
- Exportação de imagem com as máscaras de segmentação
- Abra a análise. Clique no ícone de camadas de imagem. Selecione as máscaras de canais desejadas (fase neurite e fase cluster célula-corpo). Siga o passo 5.2.
Resultados
O algoritmo de medição de crescimento de neuritos é robustamente capaz de detectar neuritos em redes neurais e neurônios individuais. Ele gera uma máscara amarela que segmenta objetos com alto contraste, como corpos celulares, detritos celulares, células mortas, explantes de tecidos e sombras. Além disso, uma máscara magenta aparece em neurites de várias espessuras. Os valores de comprimento do neurite são fornecidos em mm/mm2, indicando que o comprimento axonal foi dividido pela área da imagem, que é 0,282739 mm2 e constante para cada condição de varredura. Portanto, para obter valores puros de comprimento de neurite em mm, os números fornecidos pelo software precisam ser multiplicados pela área da imagem.
Método semiautomático versus manual
O software utilizado é uma metodologia semiautomática para medir o comprimento axonal total. Para avaliar a precisão do software, realizamos medições nos mesmos neurônios usando o método manual com o plug-in NeuronJ também. Conforme ilustrado na Figura 1, a máscara de segmentação nos neurônios é altamente semelhante entre os dois métodos (Figura 1A).
Além disso, realizamos análises estatísticas sobre os valores obtidos para examinar sua correlação. A análise de correlação de Spearman produziu um alto coeficiente r de 0,8526, fornecendo fortes evidências da exatidão e precisão do algoritmo (Figura 1B). A medição automática requer altos padrões de qualidade da cultura com base em sua limpeza, densidade e pureza. Os resultados obtidos com a segmentação semiautomática são reprodutíveis e não são afetados pelo julgamento individual. A reprodutibilidade imparcial é um problema para metodologias manuais.
Às vezes, erros de segmentação semiautomáticos podem ocorrer devido a diferentes causas. Em imagens de contraste de fase, a sujeira na cultura pode ser detectada como neuritos pela segmentação semiautomática. Além disso, a presença de diferentes tipos de células pode atrapalhar o processo de segmentação. Esses problemas não surgem com a segmentação manual porque ela é realizada por olhos humanos. No entanto, se tais problemas surgirem, eles podem ser superados usando imagens imunocitoquímicas como controle.
Segmentação de neuritos
Para culturas primárias de neurônios DRG adultos, o ponto de partida ideal para uma análise de fase confiável é ter neurônios uniformemente plaqueados na cultura limpa e poço. Se ocorrerem erros durante a semeadura e as células se concentrarem em um ponto, conforme ilustrado na Figura 2A-B, os valores serão mais uma estimativa do que um reflexo próximo da realidade. Em tais situações, a máscara amarela cobrirá a maioria dos neuritos entre as células ( Figura 2A-B ), resultando na perda do comprimento dos neuritos. Além disso, o software será significativamente tendencioso no reconhecimento de neurites, e é muito provável que uma máscara magenta apareça em objetos que não são neurites (Figura 2D). Em uma imagem ideal, deve haver até 15 neurônios com ampliação de 20x.
Quando os neurônios estão corretamente plaqueados e a cultura está limpa, conforme ilustrado na Figura 3A-B, é aconselhável ajustar o controle deslizante de segmentação em direção ao fundo (0,5 - 0,7; Figura 3C). Isso ajuda a reduzir o componente amarelo que aparecerá em objetos de alto contraste na imagem, como pontos de ramificação que devem estar em magenta. Além disso, se os neuritos estiverem em negrito, uma sensibilidade dos neuritos entre 0,4 e 0,5 deve ser suficiente para cobrir a maioria deles (Figura 3C-D).
Outra situação comum que pode surgir é uma cultura suja com muitos restos celulares e células mortas, como mostrado na Figura 4A-B. Em tais condições, existem muitos objetos de alto contraste. Portanto, é aconselhável aumentar o tamanho da máscara amarela ajustando o controle deslizante de segmentação em direção à célula ou aumentando o parâmetro de ajuste de tamanho (+1, +2 e assim por diante; Figura 4C). No entanto, também seria útil diminuir ligeiramente a sensibilidade dos neuritos para evitar que o software identifique incorretamente como neurites objetos que não são neurites como tais. (Figura 4C-D).
Às vezes, os neuritos podem parecer muito finos e pálidos, como mostrado na Figura 5A-B, apresentando desafios para o software segmentá-los com precisão (Figura 5D). Nesse caso, é aconselhável aumentar a sensibilidade dos neuritos para pelo menos 0,6 (Figura 5C). No entanto, lembre-se de que quanto maior a sensibilidade, maior a probabilidade de o software marcar incorretamente objetos que não são neurites como tal (Figura 5D). Algumas precauções podem ser tomadas para evitar que o viés de sensibilidade aumente muito, por exemplo, ajustando o controle deslizante de segmentação em direção às células. No entanto, se os neuritos forem muito finos para serem detectados pelo software, os valores de comprimento dos neuritos serão tendenciosos independentemente.
No caso de imagens imunocitoquímicas, a questão principal está em segundo plano. Além das condições de semeadura para as quais as regras acima mencionadas se aplicam, a principal fonte de viés é a própria fluorescência. O software reconhece efetivamente neuritos muito brilhantes enquanto neuritos mais finos e menos intensos são deixados para trás (Figura 6A-B). Para evitar a perda de comprimento do neurite, a sensibilidade fina do neurite pode ser aumentada em até 0,75 ( Figura 6C ). No entanto, é altamente recomendável reduzir a sensibilidade grosseira dos neuritos para pelo menos 8-9 para evitar viés de detecção excessivo, considerando os neuritos em segundo plano (Figura 6C-D). Se este último não for reduzido, todo o plano de fundo será segmentado, conforme ilustrado na Figura 7.
Um problema comum com a aquisição de fluorescência é a dispersão da luz. Muitas vezes, as imagens imunocitoquímicas apresentam lanternas na imagem, o que afeta significativamente a qualidade e a precisão da análise (Figura 8A-B). Em tal situação, não há muito que possa ser feito para melhorar a análise, e os valores serão mais uma estimativa. O espalhamento de luz interfere no reconhecimento de neuritos, de modo que apenas neuritos muito brilhantes serão detectados (Figura 8C-D). Outra questão nas imagens de imunocitoquímica é a qualidade da coloração em si. Freqüentemente, devido a erros humanos, os axônios podem ser quebrados ( Figura 9A ) e os corpos celulares podem ser arrancados durante as lavagens ( Figura 9B ). Esses erros representam um problema crítico, pois os valores de comprimento dos neuritos perdem precisão e exatidão. Consequentemente, a interpretação dos dados biológicos é alterada, levando a conclusões erradas.
Para culturas embrionárias, a situação é diferente. Nesse tipo de cultura, a presença de células gliais é predominante. Consequentemente, os erros aumentam significativamente à medida que o software também detecta os revestimentos das células gliais (Figura 10A-B). Para minimizar esse problema, o controle deslizante de segmentação deve ser movido em direção às células, normalmente em torno de valores de 1,7-2 (Figura 10C-D). Essa abordagem garante que a maioria das células gliais seja coberta pela máscara amarela e, portanto, não seja considerada na medição do comprimento dos neuritos. Outra dica útil é manter a largura do neurite em 2, pois os neurônios embrionários em cultura normalmente exibem formas bipolares ou unipolares com neurites espessos (Figura 10C-D). Essa precaução filtra a maioria dos revestimentos das células gliais que geralmente são muito finos. Por fim, tome cuidado para não aumentar muito a sensibilidade dos neuritos; caso contrário, o que foi filtrado pelo parâmetro de largura do neurite será incluído novamente na medição do comprimento do neurite.
No caso de culturas embrionárias, onde o componente de células gliais é predominante, a imunocitoquímica pode ser a melhor opção. Ao colorir especificamente os neurônios, a questão da segmentação da glia é resolvida, pois a glia não será corada, tornando a análise muito mais fácil e precisa (Figura 11).
Por fim, o software também pode ser explorado para avaliar o programa de diferenciação de linhagens celulares e/ou iPSCs para avaliar seu estado de crescimento. Assim, a aplicação de parâmetros e precauções semelhantes pode ser utilizada para diferentes objetivos.
No que diz respeito ao processo de diferenciação, a robustez do software foi comprovada na linhagem celular NSC-34 (linhagem celular híbrida constituída por células de neuroblastoma de camundongo e motoneurônios derivados da medula espinhal de embriões de camundongos) durante a maturação em células semelhantes a motoneurônios. Quanto às culturas primárias DRG, o ponto de partida ideal para uma boa análise é a semeadura uniforme de células. As células indiferenciadas e diferenciadas, após o tratamento com ácido retinóico, podem ser acompanhadas por meio de aquisições durante todo o período de cultura ou como mostrado na Figura 12, no último momento.
De fato, além do comprimento do neurite, o algoritmo também fornece o parâmetro do ponto de ramificação. No entanto, é importante observar que o parâmetro de ponto de ramificação não representa o número exato de pontos de ramificação; em vez disso, indica a densidade de ramificação na imagem expressa em mm/mm2. Essa medida é significativamente influenciada pelos detritos na cultura e na concentração de semeadura. Portanto, a densidade de neurônios na imagem e a limpeza da cultura são fatores cruciais para a obtenção de valores confiáveis. Se a cultura apresentar muitos restos celulares, não filtrados pela máscara amarela, eles serão incluídos no comprimento do neurito, bem como na medição do ponto de ramificação.
Consequentemente, recomenda-se normalizar esses valores para a contagem de células, pois o número de neurônios na imagem influencia o comprimento dos neuritos e as medições do ponto de ramificação.
Segmentação de corpos celulares
Dentre todos os parâmetros fornecidos pelo sistema, estão o aglomerado célula-corpo e a área do aglomerado célula-corpo. No entanto, esses dois parâmetros não são confiáveis para uso como valores para contagem de células. Conforme ilustrado na Figura 4, o software segmenta objetos de alto contraste na máscara amarela, incluindo sombras causadas pelo movimento médio no poço. Além disso, também segmenta células mortas e detritos celulares (Figura 4). Para obter uma contagem confiável de células dos neurônios em crescimento, um método manual, como a ferramenta Cell Counter em Fiji (Figura 13), pode ser utilizado.
Um resumo dos parâmetros de análise sugeridos classificados por tipo de cultura é fornecido na Tabela 1 para imagens de fase e na Tabela 2 para imagens imunocitoquímicas. Além disso, um resumo dos parâmetros de análise sugeridos para resolver problemas específicos é fornecido na Tabela 3.
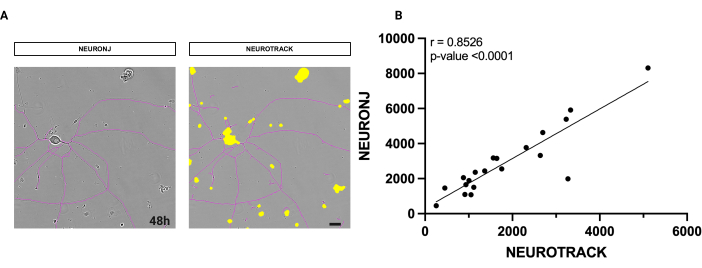
Figura 1: Análise de correlação entre segmentação manual e semiautomática de neuritos. (A) À esquerda, uma imagem de fase representativa de um neurônio segmentado com o plug-in NeuronJ em Fiji. À direita, uma imagem de fase representativa de um neurônio é segmentada com o software semiautomático. (B) Uma regressão linear simples executada em 20 neurônios foi analisada com métodos manuais e semiautomáticos. Coeficiente de correlação de Spearman r = 0,8526, p**** < 0,0001. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
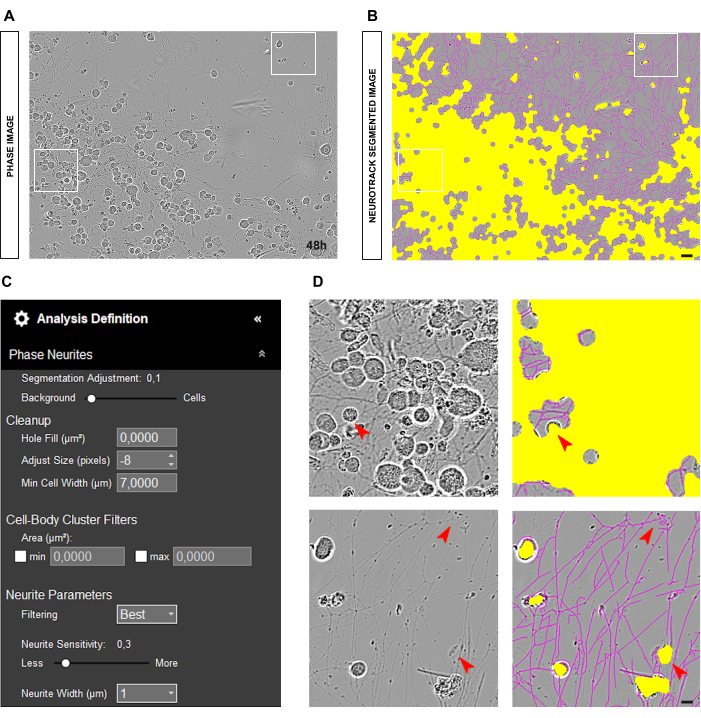
Figura 2: Erro de semeadura em cultura de neurônios sensoriais adultos. (A) Imagem de fase representativa do erro de semeadura. (B) Imagem representativa segmentada automaticamente. A máscara amarela segmenta os corpos celulares, a máscara magenta segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Painel superior: amplie o erro de segmentação do corpo celular (máscara amarela) devido ao agrupamento de corpos celulares. Painel inferior: amplie o erro de segmentação de neurites (máscara magenta) devido a detritos celulares. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
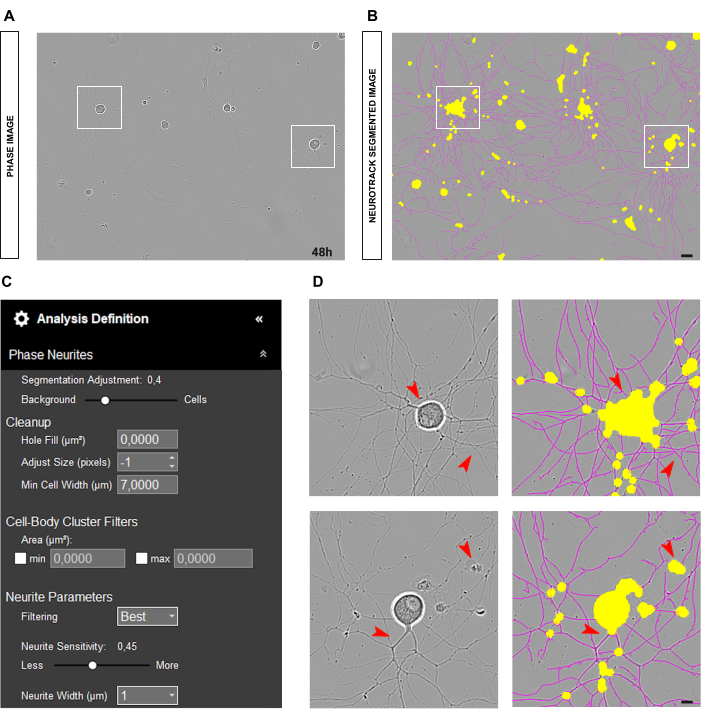
Figura 3: Cultura de neurônios sensoriais adultos ideal para análise de crescimento de neuritos. (A) Imagem de fase representativa de uma condição de semeadura ideal para análise de crescimento de neuritos. (B) Imagem representativa segmentada automaticamente. A máscara amarela segmenta os corpos celulares, a máscara magenta segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Zoom na segmentação do corpo celular (máscara amarela) e na segmentação de neuritos (máscara magenta). As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
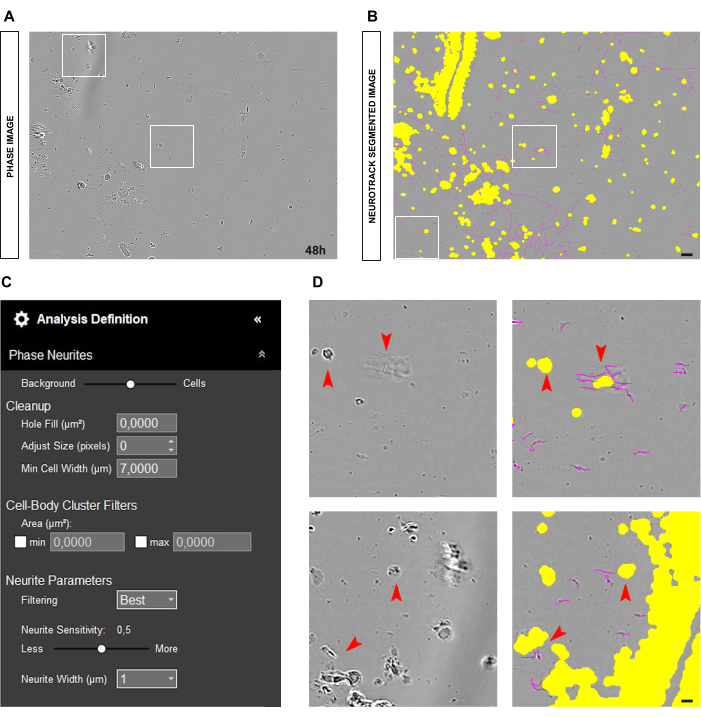
Figura 4: Elementos perturbadores na análise do crescimento de neuritos em cultura de neurônios sensoriais adultos. (A) Imagem de fase representativa de detritos celulares e sombras devido a movimentos médios. (B) Imagem representativa segmentada automaticamente. A máscara amarela segmenta os corpos celulares, a máscara magenta segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Amplie o erro de segmentação do corpo celular (máscara amarela) e segmentação de neuritos (máscara magenta) devido a detritos celulares e sombras do meio móvel. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
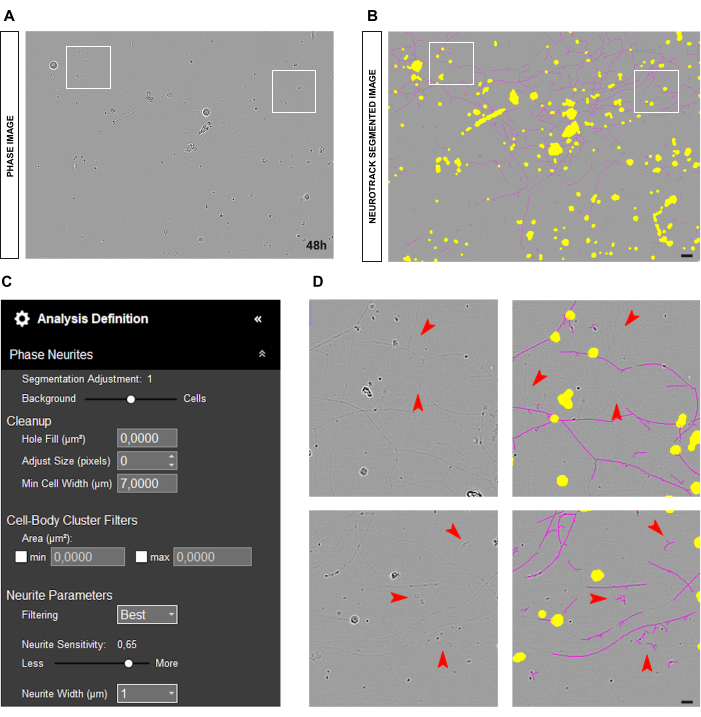
Figura 5: Neuritos finos na análise de crescimento de neuritos em cultura de neurônios sensoriais adultos. (A) Imagem de fase representativa de neurônios caracterizados por neuritos muito finos. (B) Imagem representativa segmentada automaticamente. A máscara amarela segmenta os corpos celulares, a máscara magenta segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Painel superior: amplie a perda de comprimento dos neuritos devido aos limites de detecção da segmentação dos neuritos (máscara magenta). Painel inferior: amplie o erro de segmentação de neurite (máscara magenta) em objetos estranhos. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
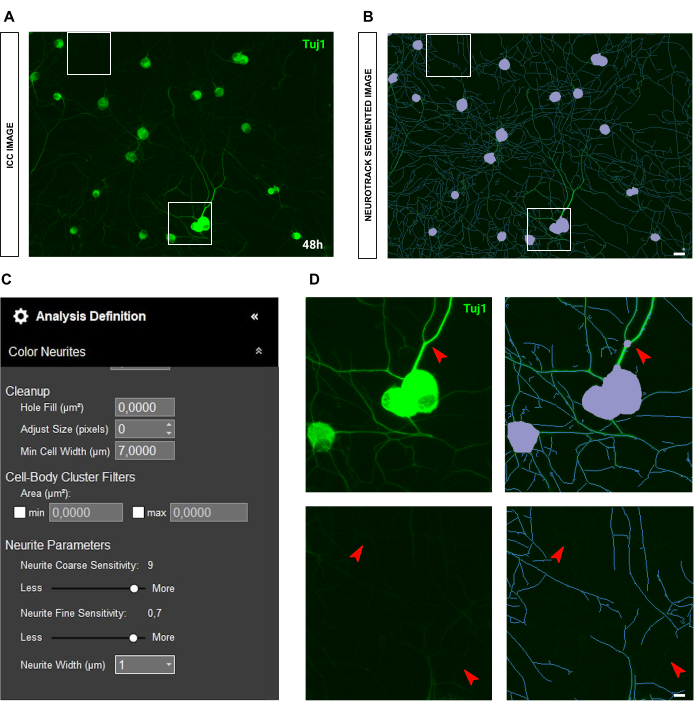
Figura 6: Brilho dos neuritos na análise do crescimento de neuritos em cultura de neurônios sensoriais adultos. (A) Imagem imunocitoquímica representativa (marcador neuronal Tuj1) de neurônios caracterizados por neuritos muito brilhantes e espessos. (B) Imagem representativa segmentada automaticamente. A máscara roxa segmenta os corpos celulares, a máscara azul segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Painel superior: zoom no erro de segmentação do corpo celular (máscara roxa) devido à espessura dos neuritos. Painel inferior: amplie a perda de comprimento dos neuritos devido ao intenso brilho de fluorescência dos neuritos espessos. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
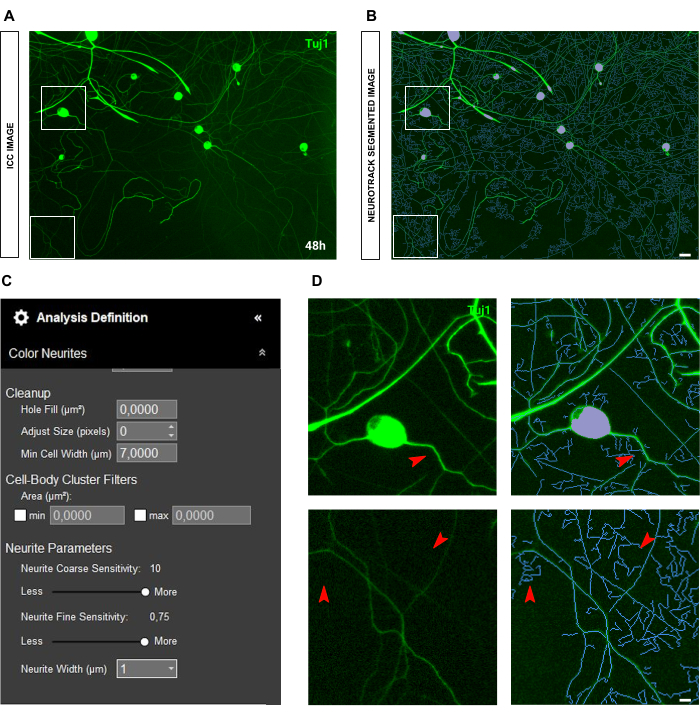
Figura 7: Fluorescência de fundo na análise de crescimento de neuritos em cultura de neurônios sensoriais adultos. (A) Imagem imunocitoquímica representativa (marcador neuronal Tuj1) de alto ruído de fluorescência de fundo. (B) Imagem representativa segmentada automaticamente. A máscara roxa segmenta os corpos celulares, a máscara azul segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Zoom no erro de segmentação de neurite (máscara azul) devido à interferência da fluorescência de fundo. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
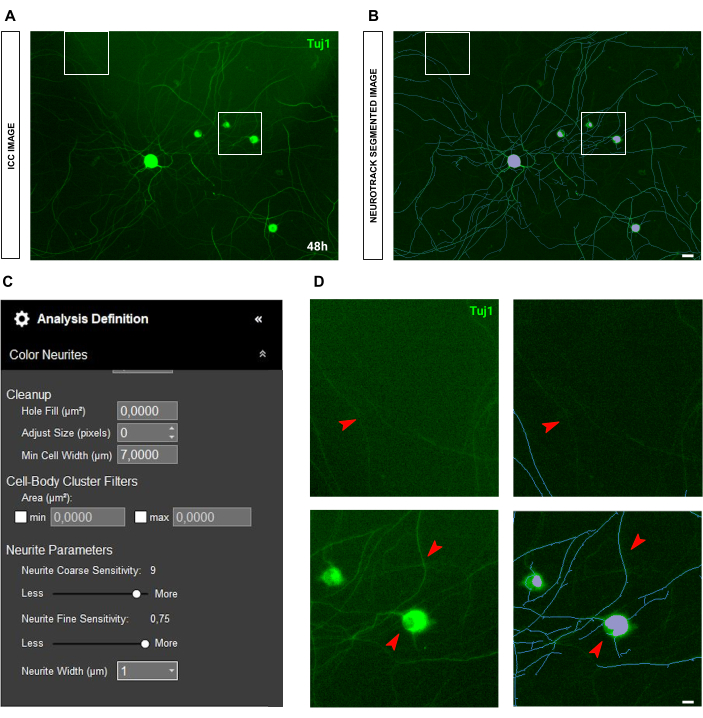
Figura 8: Espalhamento de luz na análise de crescimento de neuritos de cultura de neurônios sensoriais adultos. (A) Imagem imunocitoquímica representativa (marcador neuronal Tuj1) do espalhamento de luz. (B) Imagem representativa segmentada automaticamente. A máscara roxa segmenta os corpos celulares, a máscara azul segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Painel superior: amplie a perda de comprimento do neurite devido à interferência do espalhamento da luz. Painel inferior: amplie o erro de segmentação do corpo celular (máscara roxa). As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
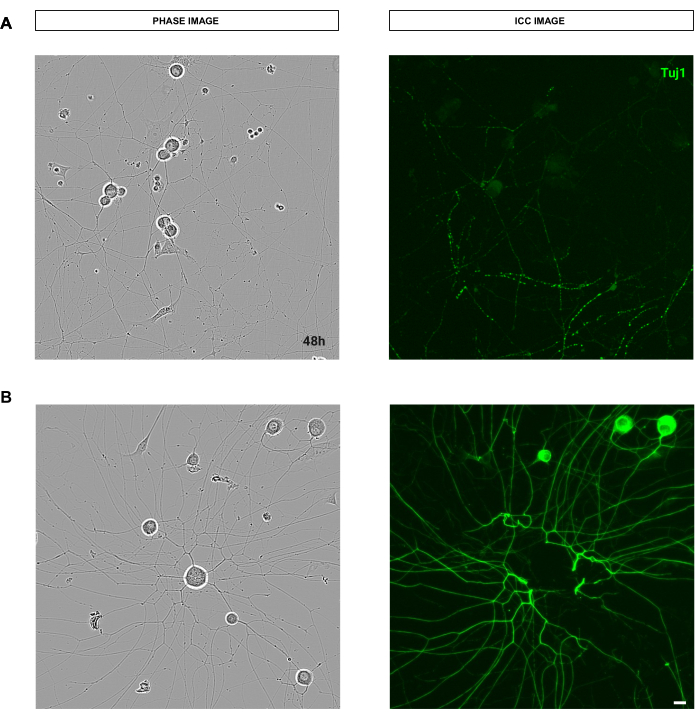
Figura 9: Erros que afetam a qualidade do procedimento de coloração que interferem na análise do crescimento de neuritos da cultura de neurônios sensoriais adultos. (A) À esquerda, uma imagem de fase representativa de neurônios sensoriais adultos. À direita, uma imagem imunocitoquímica representativa (marcador neuronal Tuj1) de neuritos quebrados devido à lavagem no procedimento de coloração. (B) À esquerda, uma imagem de fase representativa de neurônios sensoriais adultos. À direita, uma imagem imunocitoquímica representativa (marcador neuronal Tuj1) da remoção do corpo celular devido a lavagens do procedimento de coloração. As imagens foram adquiridas 48 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
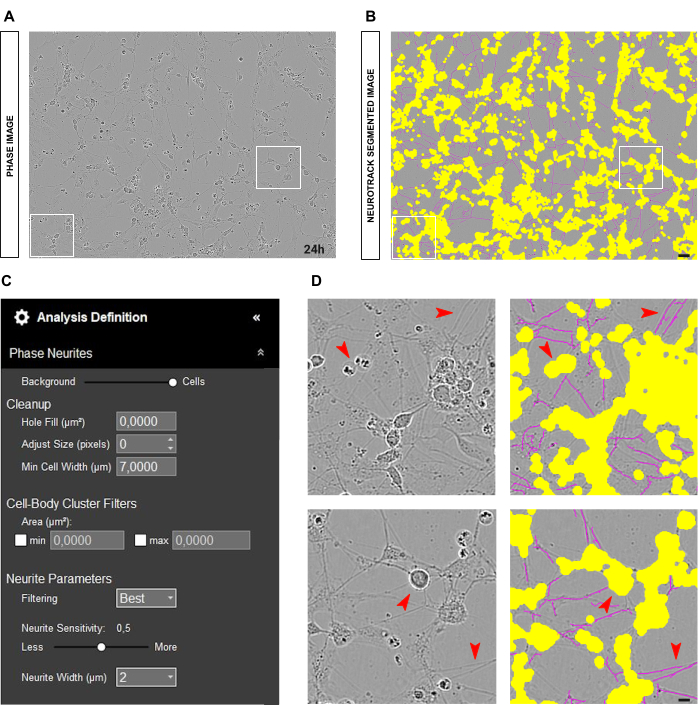
Figura 10: Cultura de neurônios sensoriais embrionários ideais (E13.5) para análise de crescimento de neuritos. (A) Imagem de fase representativa de uma condição de semeadura ideal para análise de crescimento de neuritos em cultura de neurônios sensoriais embrionários. (B) Imagem representativa segmentada automaticamente. A máscara amarela segmenta os corpos celulares, a máscara magenta segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Zoom na segmentação do corpo celular (máscara amarela) e na segmentação de neuritos (máscara magenta). As imagens foram adquiridas 24 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
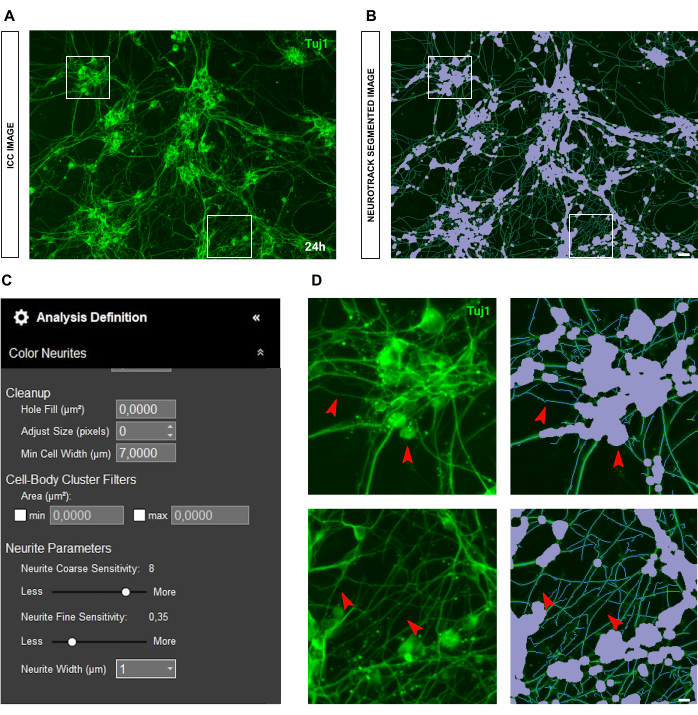
Figura 11: Cultura de neurônios sensoriais embrionários ideais (E13.5) para análise de crescimento de neuritos. (A) Imagem imunocitoquímica representativa (marcador neuronal Tuj1) de uma cultura de neurônios sensoriais embrionários ideais para análise de crescimento de neuritos. (B) Imagem representativa segmentada automaticamente. A máscara roxa segmenta os corpos celulares, a máscara azul segmenta os neuritos. (C) Parâmetros ilustrativos de definição de análise de crescimento de neuritos. (D) Zoom na segmentação do corpo celular (máscara roxa) e na segmentação de neuritos (máscara azul). As imagens foram adquiridas 24 h após a semeadura. Ampliação 20x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.

Figura 12: As células NSC-34 diferenciadas têm neurites e ramificações aumentadas em comparação com controles indiferenciados. Imagens representativas de células NSC-34. Painel superior: células NSC-34 indiferenciadas (controle). Painel inferior: células NSC-34 diferenciadas após 96 horas de tratamento com ácido retinóico. No lado esquerdo de ambos os painéis, imagens de contraste de fase, enquanto no lado direito de ambos os painéis, imagens segmentadas automaticamente (soma em amarelo, neurites em magenta). As imagens foram adquiridas 96 h após a semeadura. Ampliação 10x. Barra de escala, 50 μm. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
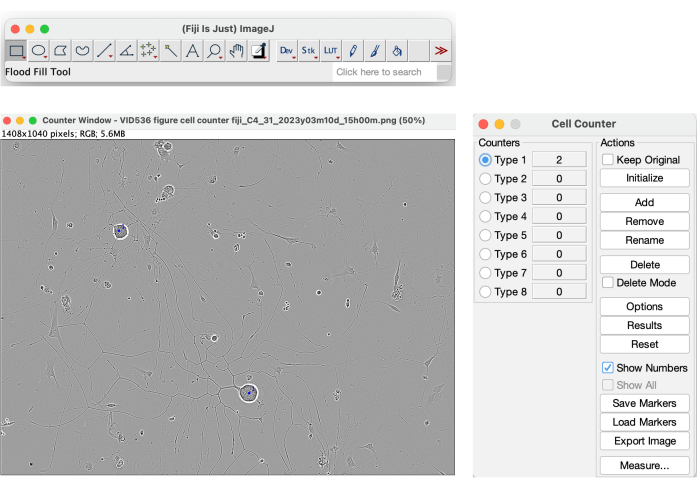
Figura 13: Ferramenta Contador de células em Fiji. Contagem manual de células realizada em uma imagem de fase de uma condição de semeadura ideal para análise de crescimento de neuritos. Ampliação 20x. A figura foi criada com BioRender. Clique aqui para ver uma versão maior desta figura.
| Tipo de cultura | Cultura de DRG adulto (Fase) | Cultura embrionária DRG (Fase) | NSC-34 (Fase) |
| Ampliação | 20 vezes | 20 vezes | 10x |
| Modo de segmentação | Brilho | Brilho | Brilho |
| Ajuste de segmentação | 0.5 - 0.7 | 1.7 - 2 | 1 |
| Ajustar tamanho (pixels) | 0, +1, +2 | 0, +1 | 0 |
| Filtragem | Melhor | Melhor | Melhor |
| Sensibilidade de neurite | 0.4 - 0.5 | 0.25 - 0.4 | 0.3 - 0.5 |
| Largura do neurite | 1 | 2 | 2 |
Tabela 1: Resumo dos parâmetros de definição de análise sugeridos para culturas de neurônios sensoriais adultos, culturas de neurônios sensoriais embrionários (E13.5) e culturas NSC-34 em imagens de contraste de fase.
| Tipo de cultura | Cultura de DRG adulto (ICC) | Cultura embrionária de DRG (ICC) |
| Ampliação | 20 vezes | 20 vezes |
| Modo de segmentação | Brilho | Brilho |
| Ajuste de segmentação | 0.5 - 0.7 | 1.7 - 2 |
| Ajustar tamanho (pixels) | 0, +1, +2 | 0, +1 |
| Filtragem | Melhor | Melhor |
| Neurite Sensibilidade grosseira | 8 - 9 | 8 - 9 |
| Neurite Sensibilidade Fina | até 0,75 | 0.5 - 0.75 |
| Largura do neurite | 1 | 2 |
Tabela 2: Resumo dos parâmetros de definição de análise sugeridos para culturas de neurônios sensoriais adultos, culturas de neurônios sensoriais embrionários (E13.5) e culturas NSC-34 em imagens imunocitoquímicas.
| QUESTÃO | SUGESTÕES |
| Cultura suja | Ajuste o controle deslizante de segmentação em direção às células |
| Aumente o parâmetro de ajuste de tamanho (+1,+2...) | |
| Diminua ligeiramente a sensibilidade dos neuritos | |
| Neuritos pálidos / finos | Aumentar a sensibilidade dos neuritos (pelo menos 0,6) |
| Ajuste o controle deslizante de segmentação em direção às células. | |
| Neuritos finos em ICC | Aumentar a sensibilidade das neurites finas (até 0,75) |
| Reduza a sensibilidade grosseira dos neuritos (pelo menos para 8-9) | |
| Células gliais | Ajuste o controle deslizante de segmentação em direção às células (1.7-2) |
| Largura do neurite em 2 |
Tabela 3: Resumo dos parâmetros de definição de análise sugeridos para resolver questões específicas em diferentes tipos de culturas.
Discussão
Medir com precisão como os neurônios crescem em condições saudáveis, feridas e doentes é um parâmetro crítico em muitas configurações experimentais no campo da neurociência. Seja trabalhando com culturas organotípicas de explantes DRG inteiros ou culturas dissociadas, medir adequadamente o crescimento axonal tem sido um desafio significativo nos últimos 20 anos. Sem uma quantificação confiável e precisa do crescimento de neuritos, é impossível avaliar se um tratamento específico, como ácido retinóico (por 4 dias) para células NSC-3434 ou neurotrofinas (por 1-2 dias) para neurônios DRG embrionários 14,35, foi eficaz. Os neurônios geralmente exibem crescimento contínuo quando saudáveis; no entanto, após a lesão, a taxa de crescimento axonal aumenta12,13. O tempo é crucial ao medir o crescimento axonal; Portanto, antes de iniciar um experimento, é essencial realizar um teste experimental para determinar o momento ideal para fixar as células com base em sua curva de platô de taxa de crescimento.
A escolha do método, manual ou automático, marca um divisor de águas em termos de gasto de tempo e precisão. Alguns dos métodos manuais mais comuns incluem NeuronJ18,20 e Metamorph (Visitron)2,22,28. Os métodos manuais exigem que os usuários rastreiem manualmente os neurites, o que é extremamente demorado e requer imagens de uma única célula. Com a segmentação manual de neurites, as redes neurais estão completamente fora de alcance. Normalmente, essas metodologias medem apenas o axônio mais longo ou usam a medição da distância do vetor, perdendo informações importantes, como o número de pontos de ramificação e o comprimento axonal total. Um pouco de melhoria é fornecida pela análise de Sholl30, que de qualquer forma é limitada a condições de célula única. A análise de célula única apresenta vários desafios, começando com a semeadura de células. Os neurônios devem ser plaqueados em uma concentração muito baixa, o que pode não ser a condição de crescimento mais adequada para todos os tipos de células. Outra questão surge da aquisição de imagens. Normalmente, o microscópio confocal é utilizado para imagens, o que requer usuários treinados e neurônios fluorescentes e não é eficiente em termos de tempo nem custo. Com o microscópio confocal, imagens de alta resolução são obtidas, mas muito poucos neurônios são fotografados de cada experimento. Isso representa uma limitação, pois mais réplicas biológicas são necessárias para atingir um número adequado de neurônios.
Algumas metodologias automáticas, como a NeuroMath 2,28, resolvem a questão da demorada segmentação de neuritos, que é realizada de forma automática.
No entanto, devido a restrições de tempo, este módulo de medição de crescimento de neurite fornece resultados mais rápidos ao adquirir imagens na máquina de microscopia de lapso de tempo. Este último, juntamente com este software, melhora significativamente a eficiência de tempo e custo para alunos e pesquisadores principais.
A máquina de aquisição permite a criação de um mapa bastante completo do poço, adquirindo um número variável de imagens com base no diâmetro do poço. Isso representa uma vantagem significativa, pois vários neurônios são fotografados ao mesmo tempo. No entanto, atingir apenas uma ampliação de 20x é suficiente e adequado para analisar as imagens com o software. Seu poder depende de sua capacidade de treinar em um conjunto de imagens e realizar uma medição semiautomática do comprimento axonal total. Além disso, o software pode funcionar tanto em neurônios individuais quanto em redes neuronais. O software é capaz de segmentar neurites e corpos celulares com duas máscaras diferentes. Uma máscara amarela segmenta todos os objetos de alto contraste na imagem, como corpos celulares, detritos celulares e sombras. Uma máscara magenta, em vez disso, segmenta neurites. A precisão e exatidão do software foram comprovadas pela segmentação dos mesmos neurônios com o software e o NeuronJ. Do ponto de vista da análise estatística, os valores dos comprimentos dos neuritos se correlacionaram bem com um alto coeficiente de correlação de Spearman.
Depois de avaliar a confiabilidade do método, passamos para a análise de várias condições de teste. Para uma análise ideal, alguns cuidados são necessários. Primeiro, os neurônios devem ser uniformemente semeados no poço, evitando pontos com alta concentração de células. O agrupamento de neurônios faz com que o software perca precisão na detecção dos neurites. Outra variável que influencia a exatidão e precisão da análise é a limpeza da cultura. Uma cultura limpa com poucos detritos celulares e células mortas é preferível. No entanto, o software é capaz de compensar esses problemas pela modulação da sensibilidade dos neuritos e da máscara de segmentação do corpo celular. Como mencionado anteriormente, a máscara amarela segmenta objetos de alto contraste, entre os quais também há sombras causadas pelo movimento do meio no poço. As sombras podem cobrir neurites, resultando na perda do comprimento dos neuritos. No entanto, esse problema é facilmente resolvido permitindo que o meio se acalme antes da aquisição da imagem.
O algoritmo é capaz de realizar a quantificação do comprimento do neurite em imagens de contraste de fase e imagens imunocitoquímicas. Quando se trata de fluorescência, devem ser tomadas outras precauções para obter uma análise fiável. Em primeiro lugar, a qualidade da coloração influencia profundamente o resultado da análise. Se os neuritos forem quebrados ou segmentados e os corpos celulares forem arrancados durante as lavagens, a análise perde força e confiabilidade. Além disso, a própria fluorescência representa um elemento potencialmente perturbador para a análise. Como o foco é realizado automaticamente pela máquina, a objetiva coloca em foco objetos muito brilhantes, como artefatos, corpos celulares ou neurites espessos. Como resultado, neuritos mais finos e menos brilhantes são deixados para trás, tornando difícil para o usuário medir adequadamente o comprimento do neurite.
Como consequência, a análise de imagens de fase pode ser mais bem fundamentada em comparação com a análise de imagens imunocitoquímicas. O software é capaz de trabalhar em muitas morfologias neuronais diferentes, desde as mais intrincadas e elaboradas até as mais simples, seja como células únicas ou em redes neuronais. Portanto, é utilizável em muitos campos de pesquisa diferentes, desde culturas primárias de neurônios provenientes do sistema nervoso central ou periférico de vários estágios de desenvolvimento até neurônios derivados de iPSC e linhagens celulares, como NSC-34.
Apesar do potencial significativo do software, algumas limitações podem ser observadas. Em primeiro lugar, a precisão da segmentação do corpo celular é subótima. Consequentemente, parâmetros como agrupamento de corpos celulares e área de agrupamento de corpos celulares não podem ser usados de forma confiável para contagem de células. Em segundo lugar, além das precauções necessárias para a segmentação ideal dos neuritos, axônios insuficientemente espessos podem ser excluídos da medição do comprimento dos neuritos, resultando em perda de dados.
O parâmetro de ponto de ramificação encontra problemas relacionados a ambos os tipos de segmentação. Sombras, células mortas ou detritos na cultura que se localizam em pontos de ramificação os obscurecem à medida que são cobertos pela segmentação do corpo celular. Além disso, no caso de neuritos finos, a confiabilidade do parâmetro do ponto de ramificação é novamente severamente comprometida.
Além disso, o foco automático durante a aquisição da imagem às vezes pode ser abaixo do ideal. A ampliação máxima da máquina é limitada a 20x, o que pode ser inadequado para observar detalhes mais finos ou fluorescência em estruturas delgadas, como neurites. Além disso, a máquina tem melhor desempenho com substratos plásticos homogêneos. Se uma lamínula de vidro for inserida no poço, o foco no vidro pode falhar, resultando em imagens parcialmente borradas. No entanto, este software não se aplica apenas aos neurônios, mas também a campos de pesquisa completamente diferentes, como o crescimento de fungos36.
Considerando tudo, acreditamos que este módulo de medição de crescimento de neuritos é uma ferramenta confiável para medir neuritos de forma rápida, imparcial e eficiente.
Divulgações
Os autores declaram que a pesquisa foi conduzida sem quaisquer relações comerciais ou financeiras que pudessem criar um conflito de interesses.
Agradecimentos
Queremos agradecer a Alessandro Vercelli pelos comentários críticos e ao suporte técnico da Sartorius pela ajuda. Nossa pesquisa sobre esses tópicos foi generosamente apoiada pela Bolsa Rita-Levi Montalcini 2021 (MIUR, Itália). Esta pesquisa foi financiada pelo Ministero dell'Istruzione dell'Università e della Ricerca MIUR project Dipartimenti di Eccellenza 2023-2027 para o Departamento de Neurociência Rita Levi Montalcini. A pesquisa do DMR foi conduzida durante e com o apoio do curso nacional italiano de doutorado interuniversitário em Desenvolvimento Sustentável e Mudanças Climáticas (link: www.phd-sdc.it).
Materiais
| Name | Company | Catalog Number | Comments |
| Collagenase A | Merck / Roche | 10103586001 | |
| Dispase II (neutral protease, grade II) | Merck / Roche | 4942078001 | |
| Dulbecco's modified eagle's medium | Merck / Sigma | D5796 | |
| Fetal bovin serum | Merck / Sigma | F7524 | |
| Ham's F-12 Nutrient Mix (1X) | ThermoFisher Scientific | 21765029 | |
| Ham's F12 w/ L-Glutamine | Euroclone | ECM0135L | |
| Hanks' Balanced Salt Solution | Euroclone | ECM0507L | |
| HBSS (10X), no calcium, no magnesium, no phenol red | ThermoFisher Scientific | 14185045 | |
| HyClone Characterized Fetal Bovine Serum (U.S.) | Cytiva | SH30071.03 | |
| Incucyte, Neurotrack Analysis Software | Sartorius | 9600-0010 | |
| L-15 Medium (Leibovitz) | Millipore/Sigma | L5520 | |
| Laminin Mouse Protein, Natural | ThermoFisher Scientific | 23017015 | |
| L-Cysteine | Merck / Sigma | C7352 | |
| Leibovitz's L-15 medium w/o L-glutamine | Euroclone | ECB0020L | |
| mouse NGF 2.5S (>95%) | Alomone Labs | N-100 | |
| Neurobasal Medium [-] Glutamine | ThermoFisher Scientific | 21103049 | |
| NSC-34 | CELLutions Biosystems Inc (Ontario, Canada) | CLU140 | |
| Papain from papaya latex | Sigma | P4762 | |
| Penicillin-Streptomycin (5,000 U/mL) | ThermoFisher Scientific | 15070063 | |
| Percoll (Density 1.130 g/mL) | Cytiva | 17089101 | |
| Poly-D-Lysine Solution (1mg/mL) | EMD Millipore/Merck | A-003-E | |
| Poly-L-Lysine Solution (0-01%) | Sigma | P4832 | |
| Recombinant Human NT-3 | PeproTech | 450-03 | |
| Retinoic Acid | Merck / Sigma | R2625 | |
| Trypsin-EDTA solution | Sigma | T3924 | |
| β-Tubulin III (Tuj1) antibody | Merck / Sigma | T8660 |
Referências
- Terenzio, M., et al. Locally translated mTOR controls axonal local translation in nerve injury. Science. 359, 1416-1421 (2018).
- Marvaldi, L., et al. Enhanced axon outgrowth and improved long-distance axon regeneration in sprouty2 deficient mice. Dev Neurobiol. 75, 217-231 (2015).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. J Cell Biol. 218, 1871-1890 (2019).
- Marvaldi, L., et al. Importin α3 regulates chronic pain pathways in peripheral sensory neurons. Science. 369, 842-846 (2020).
- Gangadharan, V., et al. Neuropathic pain caused by miswiring and abnormal end organ targeting. Nature. 606, 137-145 (2022).
- Testa, L., Dotta, S., Vercelli, A., Marvaldi, L., et al. Communicating pain: emerging axonal signaling in peripheral neuropathic pain. Front Neuroanat. 18, (2024).
- Thongrong, S., et al. Sprouty2 and -4 hypomorphism promotes neuronal survival and astrocytosis in a mouse model of kainic acid induced neuronal damage. Hippocampus. 26, 658-667 (2016).
- Yaron, A., Schuldiner, O. Common and divergent mechanisms in developmental neuronal remodeling and dying back neurodegeneration. Curr Biol. 26, R628-R639 (2016).
- Maor-Nof, M., et al. Axonal degeneration is regulated by a transcriptional program that coordinates expression of pro- and anti-degenerative factors. Neuron. 92, 991-1006 (2016).
- Bromberg, K. D. Regulation of neurite outgrowth by Gi/o signaling pathways. Front Biosci. 13, 4544-4557 (2008).
- Girouard, M. P., et al. Collapsin response mediator protein 4 (CRMP4) facilitates wallerian degeneration and axon regeneration following Sciatic nerve injury. eNeuro. 7, 0479-0419 (2020).
- van Erp, S., et al. Age-related loss of axonal regeneration is reflected by the level of local translation. Exp Neurol. 339, 113594 (2021).
- Wang, X., et al. Driving axon regeneration by orchestrating neuronal and non-neuronal innate immune responses via the IFNγ-cGAS-STING axis. Neuron. 111, 236-255.e7 (2023).
- Kaselis, A., Treinys, R., Vosyliūtė, R., Šatkauskas, S. DRG axon elongation and growth cone collapse rate induced by Sema3A are differently dependent on NGF concentration. Cell Mol Neurobiol. 34, 289-296 (2014).
- Maier, O., et al. Differentiated NSC-34 motoneuron-like cells as experimental model for cholinergic neurodegeneration. Neurochem Int. 62, 1029-1038 (2013).
- Nango, H., et al. Highly efficient conversion of motor neuron-like NSC-34 cells into functional motor neurons by Prostaglandin E2. Cells. 9, 1741 (2020).
- Kim, H. W., Caspar, T., Shah, S. B., Hsieh, A. H. Effects of proinflammatory cytokines on axonal outgrowth from adult rat lumbar dorsal root ganglia using a novel three-dimensional culture system. Spine J. 15, 1823-1831 (2015).
- Frey, E., et al. An in vitro assay to study induction of the regenerative state in sensory neurons. Exp Neurol. 263, 350-363 (2015).
- Zhang, Z., et al. Cerebellar injury and impaired function in a rabbit model of maternal inflammation induced neonatal brain injury. Neurobiol Learn Mem. 165, 106901 (2019).
- Pemberton, K., Mersman, B., Xu, F. Using ImageJ to assess neurite outgrowth in mammalian cell cultures: Research data quantification exercises in undergraduate neuroscience lab. J Undergrad Neurosci Educ. 16, A186-A194 (2018).
- Marvaldi, L., Hausott, B., Auer, M., Leban, J., Klimaschewski, L. A Novel DRAK inhibitor, SC82510, promotes axon branching of adult sensory neurons in vitro. Neurochem Res. 39, 403-407 (2014).
- Quarta, S., et al. Peripheral nerve regeneration and NGF-dependent neurite outgrowth of adult sensory neurons converge on STAT3 phosphorylation downstream of neuropoietic cytokine receptor gp130. J Neurosci. 34, 13222-13233 (2014).
- Woitke, F., et al. Adult hippocampal neurogenesis poststroke: More new granule cells but aberrant morphology and impaired spatial memory. PLoS One. 12, e0183463 (2017).
- Xiao, X., et al. Automated dendritic spine detection using convolutional neural networks on maximum intensity projected microscopic volumes. J Neurosci Meth. 309, 25-34 (2018).
- Pool, M., Thiemann, J., Bar-Or, A., Fournier, A. E. NeuriteTracer: A novel ImageJ plugin for automated quantification of neurite outgrowth. J Neurosci Meth. 168, 134-139 (2008).
- Wang, D., et al. HCA-Vision: Automated neurite outgrowth analysis. SLAS Disc. 15, 1165-1170 (2010).
- Whitlon, D. S., et al. Novel high content screen detects compounds that promote neurite regeneration from cochlear spiral ganglion neurons. Sci Rep. 5, 15960 (2015).
- Rishal, I., et al. WIS-neuromath enables versatile high throughput analyses of neuronal processes. Dev Neurobiol. 73, 247-256 (2013).
- Smith, D. S., Pate Skene, J. H. A Transcription-dependent switch controls competence of adult neurons for distinct modes of axon growth. J Neurosci. 17, 646-658 (1997).
- Gardiner, N. J., et al. Preconditioning injury-induced neurite outgrowth of adult rat sensory neurons on fibronectin is mediated by mobilisation of axonal α5 integrin. Mol Cell Neurosci. 35, 249-260 (2007).
- Hauck, J. S., et al. Heat shock factor 1 directly regulates transsulfuration pathway to promote prostate cancer proliferation and survival. Commun Biol. 7, 9 (2024).
- Zhu, Y., et al. Loss of WIPI4 in neurodegeneration causes autophagy-independent ferroptosis. Nat Cell Biol. 26, 542-551 (2024).
- Reggiani, F., et al. BET inhibitors drive Natural Killer activation in non-small cell lung cancer via BRD4 and SMAD3. Nat Commun. 15, 2567 (2024).
- Ackerman, H. D., Gerhard, G. S. Bile acids induce neurite outgrowth in NSC-34 cells via TGR5 and a distinct transcriptional profile. Pharmaceuticals. 16, 174 (2023).
- Tuttle, R., Matthew, W. D. Neurotrophins affect the pattern of DRG neurite growth in a bioassay that presents a choice of CNS and PNS substrates. Development. 121, 1301-1309 (1995).
- Wurster, S., et al. Live monitoring and analysis of fungal growth, viability, and mycelial morphology using the IncuCyte NeuroTrack processing module. mBio. 10 (3), e00673-e00619 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados