A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توليد الخلايا التائية التنظيمية لمستقبلات المستضد الخيمري البشري
In This Article
Summary
يوفر هذا البروتوكول سير عمل مبسطا لإنشاء واختبار الخلايا التائية التنظيمية لمستقبلات المستضد الخيمري البشري (CAR Tregs).
Abstract
أعاد العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CAR) تشكيل وجه علاج السرطان ، مما أدى إلى معدلات مغفرة قياسية في سرطانات الدم غير القابلة للشفاء سابقا. حفزت هذه النجاحات الاهتمام بتكييف منصة CAR مع مجموعة فرعية صغيرة ولكنها محورية من خلايا CD4 + T المسؤولة بشكل أساسي عن تنظيم وتثبيط الاستجابة المناعية ، الخلايا التائية التنظيمية (Tregs). إن القدرة على إعادة توجيه نشاط Tregs المثبط للمناعة إلى أي هدف خارج الخلية لها آثار هائلة على إنشاء علاجات خلوية لأمراض المناعة الذاتية ، ورفض زرع الأعضاء ، ومرض الكسب غير المشروع مقابل المضيف. هنا ، نصف بالتفصيل منهجيات عزل Treg حسن النية عن الدم المحيطي البشري ، والتعديل الجيني ل Tregs البشري باستخدام إما فيروس العدسات أو CRISPR / Cas9 بمساعدة ضربة قوية باستخدام تسليم قالب الإصلاح الموجه المتماثل بوساطة الفيروس المرتبط بالفيروسات الغدية (HDR) ، والتوسع خارج الجسم الحي ل CAR Tregs البشرية المستقرة. أخيرا ، نصف تقييم استقرار النمط الظاهري ل CAR Treg البشري والوظيفة القمعية في المختبر ، والتي توفر رؤى حول كيفية تصرف CAR Tregs البشرية في التطبيقات قبل السريرية والسريرية.
Introduction
أحدثت علاجات الخلايا التائية لمستقبلات المستضد الخيمري (CAR) ثورة في علاج الأورام الخبيثة الدموية ، وحققت معدلات مغفرة عالية بشكل ملحوظ في السرطانات التي لم يكن من الممكن علاجهاسابقا 1،2. يسلط تشجيع النتائج المبكرة باستخدام الخلايا التائية المستضدة المستضدة المستضدة للرضاعة لعلاج الورم الأرومي الدبقي3،4،5 الضوء على تعدد استخدامات تقنية CAR وإمكاناتها المستقبلية لاستهداف مجموعة واسعة من الأورام الخبيثة. بينما يستكشف المجال المزيد من تطبيقات CARs ، ظهرت الخلايا التائية التنظيمية (Tregs) كنوع واعد. تلعب Tregs دورا مهما في الحفاظ على التوازن المناعي ، وتنظيم الاستجابات المناعية من خلال عدة آليات ، بما في ذلك عزل IL-2 ، وإفراز السيتوكينات المثبطة للمناعة ، وتعديل الخلايا العارضة للمستضد6،7.
باستخدام تقنية CAR ، يمكن الاستفادة من Tregs لعلاج رفض زراعة الأعضاء وأمراض المناعة الذاتية والاضطرابات الالتهابية مثل الحساسية والربو6،8،9. يمكن أن يؤدي CAR Tregs إلى تحسينات كبيرة في نتائج المرضى ونوعية حياتهم من خلال تقليل استخدام الأدوية المثبطة للمناعة ، والتي تثبط جهاز المناعة ككل وترتبط بآثار جانبية ضارة10،11. أظهرت النماذج قبل السريرية نتائج واعدة في ترجمة تقنية CAR إلى Tregs ، مع تطبيقات ناجحة في أمراض مثل مرض السكري من النوع 1 ، والتصلب المتعدد ، ومرض الكسب غير المشروع مقابل المضيف ، ومرض التهاب الأمعاء9،12،13،14،15. في العيادة ، يتم حاليا استكشاف CAR Tregs لمنع رفض زرع الأعضاء الصلبة16.
تقدم هذه المقالة منهجية مفصلة لتوليد الخلايا التائية التنظيمية لمستقبلات المستضد الخيمري البشري (CAR Tregs). يتضمن هذا البروتوكول عزل Tregs عن الدم المحيطي البشري وتعديلها وراثيا باستخدام تقنيات مثل نقل الفيروسات العدسية وضربة الجينات الدقيقة باستخدام تحرير الجينات CRISPR / Cas9 ونواقل الفيروسات المرتبطة بالغدة (AAV). نصف أيضا تقييم استقرار النمط الظاهري لهذه Tregs المصممة هندسيا ووظيفتها القمعية ، وهي خطوات حاسمة للتحقق من صحة إمكاناتها العلاجية17،18،19. يعمل هذا النهج على تبسيط التصميم والاختبار المبكر لعلاجات CAR Treg ، والتي تنطوي على القدرة على توسيع التأثير التحويلي للعلاج بالخلايا التائية CAR لتنظيم جهاز المناعة. من خلال مشاركة منهجيتنا ، نأمل في إلهام المزيد من البحث والابتكار في مساحة العلاج المزدهرة CAR Treg 9,20.
Protocol
1. عزلة Treg البشرية
- معالجة Leukopak
- انقل محتويات leukopak إلى أنبوب مخروطي سعة 50 مل. أضف كمية متساوية من محلول ملحي مخزن بالفوسفات (DPBS) + 2٪ من مصل بقري الجنين (FBS) من Dulbecco عن طريق الخلط برفق باستخدام ماصة.
- تدور عند 300 × جم لمدة 10 دقائق في درجة حرارة الغرفة (RT). شفط بعناية الطافف. أعد تكوين حبيبات الخلية في 2 مل من DPBS + 2٪ FBS. أضف 8 مل من محلول كلوريد الأمونيوم بواسطة الماصة إلى معلق الخلية بنسبة 4: 1 ، واخلطه عن طريق الانعكاس اللطيف ، واترك تحلل خلايا الدم الحمراء المتبقية على الجليد لمدة 15 دقيقة.
- قم بالدوران عند 300 × جم لمدة 10 دقائق في RT. استنشق المادة الطافية بعناية. أضف 30 مل من DPBS + 2٪ FBS لغسل الخلايا. مع إيقاف تشغيل الفرامل ، قم بتدوير الخلايا المغسولة عند 150 × جم لمدة 10 دقائق في RT. أعد تعليق حبيبات الخلية في 30 مل من DPBS + 2٪ FBS.
- احسب خلايا الدم المحيطية أحادية النواة المعزولة الآن (PBMCs) باللون الأزرق التربان بنسبة 1: 1.
- بسبب ارتفاع تركيز الخلية ، قم في البداية بتخفيف 10 ميكرولتر من الخلايا 1: 100 باستخدام DPBS. بعد ذلك ، امزج 10 ميكرولتر من الخلايا المخففة 1: 100 مع 10 ميكرولتر من محلول التريبان الأزرق لهذا التخفيف النهائي 1: 1. عند استخدام عداد الخلايا الآلي ، قم بتصحيح عدد الخلايا ليعكس التخفيف بمقدار 200 ضعف عن طريق ضرب التركيز المبلغ عنه في 100 ، حيث تفترض معظم العدادات تخفيفا بمقدار 2 ضعفا. توقع العائد 1-2.5 × 109 PBMC من 1/10 leukopak.
- عزل الخلايا التائية CD4 + (التحديد السلبي)
- قم بتدوير 108-10 9 PBMCs عند 500 × جم لمدة 5 دقائق في RT وإعادة التعليق في المخزن المؤقت لفصل الخلايا (DPBS + 1 ملي مولار EDTA + 2٪ FBS) عند 5 × 107 خلايا / مل.
ملاحظة: للحصول على ما يكفي من Tregs البشري للتعديل الجيني ، نوصي بالبدء ب 1 × 109 PBMCs. - قم بإجراء الفصل المغناطيسي وفقا لتعليمات الشركة المصنعة لمجموعة تخصيب الخلايا التائية CD4 + .
- حدد كمية خلايا CD4 + T المعزولة عن طريق العد باستخدام التريبان الأزرق (10 ميكرولتر من الخلايا + 10 ميكرولتر من التربان الأزرق).
- قم بتدوير 108-10 9 PBMCs عند 500 × جم لمدة 5 دقائق في RT وإعادة التعليق في المخزن المؤقت لفصل الخلايا (DPBS + 1 ملي مولار EDTA + 2٪ FBS) عند 5 × 107 خلايا / مل.
- عزل الخلايا التائية CD8 + (التحديد السلبي)
- قم بالدوران 5 × 107 PBMCs عند 500 × جم لمدة 5 دقائق في RT. إعادة التعليق في المخزن المؤقت لفصل الخلايا (DPBS + 1 ملي EDTA + 2٪ FBS) عند 5 × 107 خلايا / مل.
ملاحظة: نوصي بالبدء ب 5 × 107 PBMC للحصول على 2-5 × 106 خلايا CD8 + T. - قم بإجراء الفصل المغناطيسي وفقا لتعليمات الشركة المصنعة لمجموعة تخصيب الخلايا التائية CD8 + .
- حدد عدد خلايا CD8 + T المعزولة عن طريق العد باستخدام التريبان الأزرق (10 ميكرولتر من الخلايا + 10 ميكرولتر من التريبان الأزرق).
- قم بالدوران 5 × 107 PBMCs عند 500 × جم لمدة 5 دقائق في RT. إعادة التعليق في المخزن المؤقت لفصل الخلايا (DPBS + 1 ملي EDTA + 2٪ FBS) عند 5 × 107 خلايا / مل.
- فرز الخلايا بمساعدة التألق Treg (FACS)
- عزل خلايا CD4 + T كما هو موضح في الخطوة 1.2 وتخزينها طوال الليل في DPBS مع 2٪ FBS عند 4 درجات مئوية (الحد الأدنى من الخسارة في عدد الخلايا وقابليتها للبقاء) ل FACS في اليوم التالي. حدد عدد خلايا CD4 + T من الخطوة 1.2 عن طريق العد باستخدام تريبان الأزرق (10 ميكرولتر من الخلايا + 10 ميكرولتر من التريبان الأزرق).
- قم بتدوير خلايا CD4 + بوزن 500 × جم لمدة 5 دقائق. إعادة تكوين الخلايا في 200 ميكرولتر من DPBS.
- لكل 1 × 106 خلايا ، أضف 1 ميكرولتر من CD4 FITC المضاد للإنسان ، و 1 ميكرولتر من CD25 APC المضاد للإنسان ، و 1 ميكرولتر من CD127 PE المضاد للبشر. دوامة برفق وضعها في الثلاجة المظلمة 4 درجات مئوية لمدة 30 دقيقة.
- اغسل الخلايا ب 10 مل من DPBS مع 2٪ FBS. تدور في 500 × جم لمدة 5 دقائق. أعد تعليق الخلايا الملطخة برفق عند 1.5 × 107 خلايا / مل في DPBS مع 2٪ FBS. هذا هو تركيز الخلية الموصى به للفرز عن طريق فرز الخلايا المنشطة بالفلورة (FACS).
- مرر تعليق الخلية الملونة من خلال غطاء مرشح 40 ميكرومتر إلى أنابيب FACS ، ثم احتفظ بالأنابيب على الجليد.
- قم بإعداد أنابيب تجميع سعة 15 مل تحتوي على 3 مل من وسط RPMI10 وضعها على الثلج.
ملاحظة: يتكون هذا الوسيط من RPMI1640 وسط قاعدي ، و 10٪ FBS ، و 1x بنسلين - ستربتومايسين ، و 1x L-alanyl-L-glutamine ، و 1x أحماض أمينية غير أساسية ، و 1x بيروفات الصوديوم ، و 1x HEPES. - قم بفرز CD4 + CD25عاليةCD127- الخلايا التائية التنظيمية (Tregs) و CD4 + CD25منخفضةCD127 + الخلايا التائية التقليدية (Tconv) باستخدام FACS كما هو موضح في الشكل 1 أ.
- تحديد إنتاجية الخلية وقابليتها للحياة. ثم تابع التحليل النهائي أو تنشيط الخلايا التائية.
2. تنشيط الخلايا التائية
- عد الخلايا التائية المعزولة باستخدام التريبان الأزرق (10 ميكرولتر من الخلايا + 10 ميكرولتر من التريبان الأزرق).
- اغسل 25 ميكرولتر من الخرز المضاد ل CD3 / CD28 (106 خرز) لكل 1 × 10 6 خلايا T تم الحصول عليها ، مع الحفاظ على نسبة 1: 1 من الخرزات إلى الخلايا التائية. اغسل الخرزات المضادة ل CD3 / CD28 عن طريق إضافة DPBS ، واحتضانها على مغناطيس لمدة 3 دقائق ، وإزالة المخزن المؤقت للحبة المضادة ل CD3 / CD28 المخفف الآن ، والذي يمكن أن يكون ساما للخلايا.
- قم بإزالة الأنبوب من المغناطيس وأعد تعليق الخرزات المغسولة في وسط RPMI10 للحصول على 1 × 106 حبات / 1 مل من RPMI10.
- قم بتعليق الخلايا التائية بخرز مضاد ل CD3 / CD28 في وسط RPMI10 بتركيز 1 × 106 خلايا T / مل. ثم أضف 1,000 وحدة دولية / مل من IL-2 إلى خلايا Treg ، و 100 وحدة دولية / مل من IL-2 إلى خلايا CD4 + Tconv ، و 300 وحدة دولية / مل من IL-2 إلى خلايا CD8 + T.
- زراعة الخلايا التائية في 1 × 106 خلايا لكل بئر من صفيحة 24 بئرا بكميات مختلفة من الخرز المضاد ل CD3 / CD28 و IL-2. ضع اللوحة المكونة من 24 بئرا في حاضنة زراعة الأنسجة 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 .
- قم بتوسيع الخلايا التائية المنشطة لمدة 9-12 يوما في وجود IL-2 حتى يتم استخدامها في التجارب أو إعادة التنشيط باستخدام حبات مضادة ل CD3 / CD28 لمزيد من التوسع. استبدل الوسائط كل 2-3 أيام وأضف IL-2 في كل مرة يتم فيها إضافة وسيط جديد. حافظ على كثافة خلايا Tregs عند 5 × 105 إلى 1 × 106 خلايا لكل مل أثناء التمدد عن طريق عد الخلايا أو عن طريق الفحص البصري قبل الانقسام.
3. نقل الفيروسات البشرية Treg
- قم بتعليق وعد Tregs بعد 48 ساعة من التنشيط. تدور عند 500 × جم لمدة 5 دقائق في RT. أعد تعليق Tregs في RPMI10 عند 1.25 ×10 6 خلايا / مل مع 1,000 وحدة دولية / مل من IL-2.
- قم بتسخين جهاز الطرد المركزي إلى 32 درجة مئوية.
- قم بإذابة تركيبة CAR المحتوية على فيروس العدسات على الجليد.
ملاحظة: نقوم بتخزين حصصات فيروس العدسات ذات الاستخدام الواحد مع ما يكفي من فيروس العدسات لنقل 2.5 × 105 خلايا في وزارة الداخلية 1 عند -80 درجة مئوية. - أضف كل حصة من فيروس العدسات إلى 2.5 × 105 Tregs في 200 ميكرولتر في أنبوب طرد مركزي دقيق ، يشير كل أنبوب إلى تفاعل. قم بتقطيع الدوران عند 1,000 × جم لمدة ساعة واحدة عند 32 درجة مئوية.
- انقل كل تفاعل 200 ميكرولتر إلى صفيحة 24 بئرا. تأكد من أن الوسائط تغطي البئر بأكمله. احتضان الصفيحة المكونة من 24 بئرا مع Tregs المنقولة في حاضنة زراعة الأنسجة بين عشية وضحاها (16-18 ساعة). قم بتعبئة كل بئر إلى 2 مل بوسط RPMI10 مع تركيز IL-2 النهائي 1,000 وحدة دولية / مل.
- استمر في توسيع Tregs المنقولة بعد 9-12 يوما من التنشيط عن طريق تقسيم الخلايا واستكمالها ب RPMI10 و IL-2 الطازجة المسخنة مسبقا حسب الحاجة (كل 2-3 أيام). التركيز المثالي للخلايا هو 5 × 105-1 × 106 خلايا / مل.
- قم بتقييم كفاءة تعديل الجينات باستخدام قياس التدفق الخلوي كما هو موضح في الشكل 2.
ملاحظة: تحتوي تركيبات CAR الفيروسية العدسية الخاصة بنا على علامة Myc-tag على الطرف N لجين CAR وجين مراسل GFP مرتبط بجين CAR بواسطة ببتيد 2A ، مما يسمح بقياس كفاءة التنبيغ دون تلطيخ الأجسام المضادة (GFP) وتأكيد التعبير السطحي ل CAR (Myc-tag). نقوم بتقييم كفاءة تعديل الجينات بعد 5 أيام من النقل. يمكن أن تتراوح كفاءات التحويل بين 30٪ و 70٪ اعتمادا على المتبرع وبنية CAR المستخدمة. يمكن فرز خلايا CAR+ إذا رغبت في ذلك. - تأكد من أن Tregs المعدلة تكمل دورة التنشيط (9-12 يوما) وتستريح لمدة 24 ساعة في حالة عدم وجود IL-2 قبل استخدامها في أي تجارب.
4. ضربة الجينات بوساطة CRISPR / Cas9 في Tregs البشري
- قم بتعليق Tregs ونقله إلى أنبوب مخروطي 15 مل بعد 48 ساعة من التنشيط. احتضان تعليق الخلية في مغناطيس لمدة 3 دقائق.
- أثناء وجودك في المغناطيس ، انقل الخلايا الموجودة في الوسط عبر الماصة إلى أنبوب جديد. ستظل الخرزات المضادة ل CD3 / CD28 متصلة بجدار الأنبوب. اسمح ل Tregs منزوعة الطرز بالراحة في RPMI10 لمدة ساعتين بعد إزالة الخرزة للتعافي من الضغط الفوري للفك ، مما يعزز كفاءة التحويل المستقبلي والتعافي من التثقيب الكهربائي.
- عد Tregs منزوعة الطرز مع التربان الأزرق.
- قم بتسخين وسط المصل المخفض بدون FBS إلى 37 درجة مئوية.
- قم بإعداد صفيحة من 6 آبار تحتوي على 2.5 مل من وسط RPMI10 بدون مضادات حيوية (البنسلين والستربتومايسين) وب 1,000 وحدة دولية / مل IL-2 لكل بئر. قم بتسخين الطبق مسبقا إلى 37 درجة مئوية في حاضنة زراعة الأنسجة.
- قم بإذابة قالب الإصلاح الموجه بالتماثل (HDR) المحتوي على الفيروس الغدي (AAV) على الجليد.
ملاحظة: نقوم بتخزين حصص الاستخدام الواحد مع ما يكفي من AAV لإصابة 4 × 106 خلايا في وزارة الداخلية 20,000 عند -80 درجة مئوية. - تدور Tregs عند 500 × جم لمدة 5 دقائق. بعد صب المادة الطافية ، أعد تعليق الخلايا في وسط مصل مخفضل مسخن مسبقا عند 4 × 107 خلايا / مل.
- خلايا Aliquot في 100 ميكرولتر في أنابيب طرد مركزي منخفضة البروتين 1.5 مل. أضف CAR AAV في وزارة الداخلية 20,000 إلى كل عينة وقم بإعادة التعليق. احتضان أنابيب التفاعل في حاضنة زراعة الأنسجة لمدة 1 ساعة.
- أثناء الحضانة لمدة ساعة واحدة ، قم بإعداد وتجميع مجمعات البروتين النووي الريبي CRISPR / Cas9 (RNP) عن طريق إضافة 8.3 ميكرولتر من بروتين Cas9 ببطء (مخزون 1 مجم / مل) إلى 2.5 ميكرولتر من sgRNA الذي يستهدف موضع جين TRAC (مخزون 100 ميكرومتر) لنسبة مولية من Cas9 إلى sgRNA تبلغ 1: 1 وحجم إجمالي RNP يبلغ 10.8 ميكرولتر لكل عينة. قم بسحب الماصة برفق لأعلى ولأسفل للخلط. احتضان خليط RNP لمدة 15 دقيقة عند 37 درجة مئوية في حاضنة زراعة الأنسجة.
ملاحظة: يمكن أن تظل مجمعات RNP في RT بعد ذلك حتى تصبح جاهزة للاستخدام. - املأ أنبوب التثقيب الكهربائي الجديد (الأنبوب E) ب 3 مل من المخزن المؤقت للتثقيب الكهربائي عالي الأسمولية. أدخل الأنبوب E المملوء في محطة الماصة لنظام التثقيب الكهربائي حتى تسمع نقرة. اضبط ظروف التثقيب الكهربائي على 2,200 فولت ، 20 مللي ثانية ، نبضة واحدة في نظام التثقيب الكهربائي.
- عند اكتمال الحضانة لمدة 1 ساعة مع AAV ، قم بتدوير الخلايا مع AAV عند 300 × جم لمدة 5 دقائق في RT. قم بشفط المادة الطافية بعناية وأعد تعليق حبيبات الخلية في 100 ميكرولتر من المخزن المؤقت لإعادة تعليق الخلية الذي يوفره نظام التثقيب الكهربائي لكل عينة.
ملاحظة: اعمل بسرعة وتجنب ترك الخلايا في المخزن المؤقت لمدة تزيد عن 15 دقيقة. تجنب تكوين الفقاعات. - أضف 10.8 ميكرولتر من مركب RNP لكل عينة. تخلط جيدا مع ماصة دون تكوين فقاعات.
- أدخل طرف التثقيب الكهربائي سعة 100 ميكرولتر عن طريق دفع الماصة إلى محطتها الثانية لفتح المشبك. ضع الرأس العلوي للماصة في طرف التثقيب الكهربائي حتى يعشبك المشبك بإحكام مع جذع تثبيت المكبس. حرر الزر تدريجيا مع الحفاظ على الضغط الهابط على الماصة لضمان ملاءمة الطرف بشكل مريح دون أي فجوات.
- اضغط على الماصة حتى المحطة الأولى واغمر طرف التثقيب الكهربائي في خليط الخلية-RNP. اسحب العينة برفق إلى الماصة دون أي فقاعات.
ملاحظة: لا يمكن أن توجد فقاعات داخل الطرف أثناء التثقيب الكهربائي. - أدخل الماصة بطرف التثقيب الكهربائي المركب الذي يحتوي على العينة عموديا في الأنبوب E حتى يسمع صوت نقرة. تجنب تكوين الفقاعات.
- تأكد من إدخال الإعدادات المثلى ل Tregs البشرية (2,200 فولت ، 20 مللي ثانية ، 1 نبضة) واضغط على ابدأ على شاشة اللمس لتثقيب الخلايا بالكهرباء.
- انتظر حتى تظهر شاشة اللمس كاملة عند الانتهاء من التثقيب الكهربائي. قم بإزالة الماصة برفق وانقل العينة على الفور إلى الصفيحة المعدة المكونة من 6 آبار تحتوي على 2.5 مل من وسط RPMI10 المسخن مسبقا والخالي من المضادات الحيوية مع 1,000 وحدة دولية / مل من IL-2 لكل بئر. كرر مع العينات المتبقية. هز اللوحة برفق بحركات خطية (من اليسار إلى اليمين ، من أعلى إلى أسفل) لضمان التوزيع المتساوي للخلايا في كل بئر ووضعها في حاضنة زراعة الأنسجة.
ملاحظة: إعادة استخدام طرف التثقيب الكهربائي مقبول حتى 3x إذا كانت نفس الخلايا ومركب RNP قيد الاستخدام. اسمح بفترة تعافي مدتها 30 دقيقة قبل عد الخلايا أو إزعاجها بأي شكل من الأشكال مثل إضافة محسن HDR إذا رغبت في ذلك. - في اليوم التالي ، بعد 16-18 ساعة ، استبدل الوسائط بوسائط تحتوي على المضادات الحيوية ، واحسب Tregs المثقف بالكهرباء باللون الأزرق ، وزرع عند 106 خلايا / مل مع 1,000 وحدة دولية / مل IL-2. استمر في توسيع Tregs الكهربائي عن طريق تقسيم الخلايا واستكمال RPMI10 و IL-2 الطازج كما هو موضح في الخطوة 2.6.
- احتفظ بالعينات على الجليد لتحليلها عن طريق قياس التدفق الخلوي.
- قم بإعداد عناصر التحكم في التعويض أحادي اللون وقم بتطبيقه على ملف التجربة.
- اقرأ العينة غير الملوثة أولا لضبط مكاسب FSC و SSC بحيث تكون مجموعة الخلايا الليمفاوية في منتصف مخطط نقطة "جميع الأحداث".
- قم بإعداد استراتيجية بوابات الخلايا الليمفاوية إلى خلايا غير حطام / مفردة إلى خلايا قابلة للحياة في خلايا CD4 + ، كما هو موضح في الشكل 3C.
- تقييم كفاءة تعديل الجينات باستخدام قياس التدفق الخلوي.
ملاحظة: تحتوي تركيبات AAV CAR الخاصة بنا ، بالإضافة إلى أذرع تماثل موضع TRAC ، على جين مراسل مستقبلات عامل نمو البشرة المقطوع (EGFRt) مرتبط بجين CAR بواسطة ببتيد 2A كما هو موضح في الشكل 3. يتم تحديد كفاءة ضربة الجينات من خلال تلطيخ السطح ل CD3 ، والذي يشير فقدانه إلى فقدان التعبير السطحي TCR ، وبالتالي الاستهداف الناجح لموضع TRAC باستخدام CRISPR / Cas9 ، و EGFRt ، الذي يشير تعبيره إلى التكامل الناجح للجين المعدل CAR. CAR knock-in Tregs هي خلايا CD3-EGFRt +. نقوم بتقييم كفاءة تعديل الجينات بعد 5 أيام من التثقيب الكهربائي. - تأكد من أن Tregs المعدلة تكمل دورة التنشيط (9-12 يوما) وتستريح لمدة 24 ساعة في حالة عدم وجود IL-2 قبل استخدامها في أي تجارب.
5. تنشيط Human CAR Treg
- إعداد الثقافة المشتركة (اليوم 0)
- اجمع خط الخلايا المستهدف الذي يعبر عن مستضد CAR في أنبوب مخروطي الشكل.
ملاحظة: نستخدم خلايا K562 ، وهي خط خلايا ابيضاض الدم النقوي البشري يفتقر إلى تعبير HLA و CD80 و CD86 كخلايا مستهدفة لتنشيط CAR Treg. تستخدم خلايا K562 الأبوية كعنصر تحكم سلبي وتستخدم K562 التي تعبر عن مستضد CAR لتنشيط CAR Tregs17،21. - قم بتشعيع خطوط الخلايا المستهدفة ب 4,000 راد في جهاز تشعير السيزيوم 137 أو الأشعة السينية. في حالة عدم الوصول إلى المشعع ، قم بإجراء علاج الميتومايسين سي لوقف تكاثر الخلايا مع الحفاظ على تعبير المستضد السطحي في الخلاياالمستهدفة 22.
- إذا لم يتم القيام بذلك بالفعل ، فقم بإزالة Tregs عن طريق تعليق Tregs المرتبطة بخرز CD3 / CD28 المضادة ونقلها إلى أنبوب مخروطي سعة 15 مل. احتضان تعليق الخلية في مغناطيس لمدة 3-5 دقائق. أثناء وجودك في المغناطيس ، انقل الخلايا الموجودة في الوسط عبر الماصة إلى أنبوب جديد ؛ ستظل الخرزات المضادة ل CD3 / CD28 متصلة بجدار الأنبوب.
- حدد الخلية المستهدفة المشعة وتركيزات CAR Treg منزوعة المزروعة باستخدام التريبان الأزرق.
- قم بتدوير الخلايا المستهدفة المشعة و CAR Tregs عند 500 × جم لمدة 5 دقائق. أعد التعليق باستخدام RPMI10 الدافئ مسبقا عند 106 خلايا / مل في أنابيبها المنفصلة. أضف IL-2 إلى CAR Tregs بتركيز 2,000 وحدة دولية / مل.
ملاحظة: سيتم تخفيف هذه الكمية من IL-2 2 مرة بمجرد دمج CAR Tregs مع الخلايا المستهدفة للحصول على تركيز نهائي ل IL-2 يبلغ 1,000 وحدة دولية / مل. - الاستزراع المشترك 1 × 105 CAR Tregs (100 ميكرولتر) مع 1 × 105 (100 ميكرولتر) مستضد CAR سالبة للإشعاع ، خلايا مستهدفة مشعة (تحكم سلبي للتنشيط) ، 1 × 105 ( 100 ميكرولتر) CAR إيجابية مستضد ، خلايا مستهدفة مشعة (تجربة) ، أو 2.5 ميكرولتر من حبات مضادة ل CD3 / CD28 (تحكم إيجابي للتنشيط) و 97.5 ميكرولتر من وسط RPMI10 في صفيحة سفلية مستديرة من 96 بئر. ضع اللوحة في حاضنة زراعة الأنسجة 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 لمدة 48 ساعة.
ملاحظة: الحجم النهائي لكل بئر هو 200 ميكرولتر. تأكد من أن كل حالة تحتوي على ثلاث تكرارات.
- اجمع خط الخلايا المستهدف الذي يعبر عن مستضد CAR في أنبوب مخروطي الشكل.
- قراءة قياس التدفق الخلوي
- ما لم تستخدم قارئ لوحة ، قم بتعليق محتويات كل بئر من اللوحة المستديرة القاع 96 ونقلها إلى أنبوب FACS. تدور في 500 × جم لمدة 5 دقائق. صب المادة الطافية ودوامة الخلية برفق.
- قم بإعداد مزيج رئيسي للأجسام المضادة لقياس التدفق الخلوي: 100 ميكرولتر / عينة تحتوي على DPBS ، ومضاد للإنسان CD4 PE / Cy7 1: 200 ، ومضاد للإنسان CD71 PE 1: 100 ، وصبغ Ghost Viability BV510 1: 2000.
ملاحظة: تعمل هذه اللوحة بشكل جيد إذا كان جين مراسل CAR هو GFP. إذا قام جين المراسل بتشفير بروتين سطحي يتطلب تلطيخ الأجسام المضادة ، مثل EGFRt ، فيمكن استخدام جسم مضاد مترافق مع FITC ، على سبيل المثال. - تمزج الماصة 100 ميكرولتر من الأجسام المضادة الرئيسية في كل عينة ، وتخلط بلطف ، وتحتضن لمدة 30 دقيقة في الثلاجة 4 درجات مئوية.
- يغسل ب 500 ميكرولتر من DPBS عن طريق الدوران عند 500 × جم لمدة 5 دقائق. أعد تعليق حبيبات الخلية في 200 ميكرولتر من DPBS.
- احتفظ بالعينات على الجليد لتحليلها عن طريق قياس التدفق الخلوي.
- قم بإعداد عناصر التحكم في التعويض أحادي اللون وقم بتطبيقه على ملف تدفق التجربة.
- اقرأ العينات غير الملوثة لضبط مكاسب SSC و FSC بحيث يكون عدد الخلايا الليمفاوية في منتصف مخطط نقطة "جميع الأحداث".
- قم بإعداد استراتيجية بوابات الخلايا الليمفاوية إلى خلايا غير حطامية / مفردة إلى خلايا قابلة للحياة في خلايا CD4 + ، كما هو موضح في الشكل 3C (استخدام الفلوروفورات المختلفة).
- اقرأ العينات بمعدل حدث يبلغ حوالي 1,500 حدث / ثانية لتقييم تنشيط Treg.
ملاحظة: النتيجة المتوقعة هي تنظيم التعبير السطحي CD71 في CAR Tregs في وجود مستضد CAR كما هو موضح في الشكل 4. إذا لم يلاحظ التنظيم الإضافي في وجود مستضد CAR ، فقد تكون الإشارات المنشطة موجودة.
6. استقرار الإنسان CAR Treg
- إعداد وتوسيع الثقافة المشتركة (الأيام 0-9)
- قم بإعداد الثقافات المشتركة لتنشيط CAR Tregs كما هو موضح في الخطوة 5.1.
- بعد 48 ساعة ، انقل الزراعة المشتركة من كل صفيحة مستديرة القاع مكونة من 96 بئرا إلى بئر صفيحة 24 بئرا تحتوي على 2 مل من RPMI10 مع 1,000 وحدة دولية / مل IL-2 للسماح بتوسيع الخلية.
- أضف RPMI10 الطازج المسخن مسبقا مع 1,000 وحدة دولية / مل IL-2 وقم بتقسيمه إلى ألواح إضافية من 24 بئرا حسب الحاجة.
- قراءة قياس التدفق الخلوي
- قم بإعادة تعليق ونقل محتويات كل مكرر إلى أنبوب مخروطي 15 مل أو 50 مل. تحديد تركيزات الخلايا.
- نقل بين 5 × 105 و 1 × 106 خلايا إلى أنبوب FACS لكل تكرار. تدور في 500 × جم لمدة 5 دقائق.
- قم بإعداد مزيج رئيسي للأجسام المضادة لقياس التدفق الخلوي لتلوين السطح: 100 ميكرولتر / عينة تحتوي على DPBS ، ومضاد للإنسان CD4 PE / Cy7 1: 200 ، ومضاد للإنسان CD25 APC 1: 200 ، وصبغة بقاء الشبح BV510 1: 2000. قم بتضمين الجسم المضاد المترافق مع FITC لبروتين مراسل CAR إذا لزم الأمر.
- صب المادة الطافية من الخطوة 6.2.2 وقم بدوامة حبيبات الخلية برفق. ماصة 100 ميكرولتر من المزيج الرئيسي للأجسام المضادة الملطخة للسطح لكل أنبوب FACS. دوامة لفترة وجيزة وضعها في ثلاجة 4 درجات مئوية لمدة 30 دقيقة في الظلام.
- باستخدام مجموعة المخزن المؤقت لتلوين عامل النسخ ، قم بإعداد المخزن المؤقت للتثبيت / النفاذية عن طريق إضافة 3 مجلدات من مخفف التثبيت / النفاذية إلى حجم واحد من تركيز التثبيت / النفاذية. تتطلب كل عينة 100 ميكرولتر من المخزن المؤقت للتثبيت / النفاذية.
- اغسل الخلايا الملطخة بالسطح ب 500 ميكرولتر من DPBS. تدور في 500 × جم لمدة 5 دقائق وصب المادة الطافية. ماصة 100 ميكرولتر من المخزن المؤقت للتثبيت / النفاذية المحضر لكل أنبوب. دوامة لفترة وجيزة والسماح للتثبيت بحدوث 4 درجات مئوية لمدة 30-60 دقيقة في الظلام.
- باستخدام مجموعة عازلة تلطيخ عامل النسخ ، قم بإعداد 1x مخزن مؤقت للنفاذية عن طريق إضافة 9 أحجام من الماء المقطر إلى حجم واحد من مركز 10x Buffer للنفاذية. تتطلب كل عينة 1,000 ميكرولتر من مخزن النفاذية للغسيل و 100 ميكرولتر من المخزن المؤقت للنفاذية للتلطيخ بالأجسام المضادة التي تستهدف البروتينات داخل الخلايا.
- اغسل الخلايا الثابتة / المنفذة بإضافة 500 ميكرولتر من 1x المخزن المؤقت للنفاذية. تدور عند 500 × جم لمدة 5 دقائق في RT.
- قم بإعداد مزيج رئيسي للأجسام المضادة للتلطيخ داخل الخلايا مع 1x المخزن المؤقت للنفاذية ، و FOXP3 eFluor 450 1:50 المضاد للإنسان ، و HELIOS PE المضاد للإنسان 1:50 ، و CTLA-4 PerCP-e710 المضاد للإنسان 1:50. ستتطلب كل عينة 100 ميكرولتر من مزيج الأجسام المضادة الرئيسية.
ملاحظة: تعمل هذه اللوحة إذا كان جين مراسل CAR هو GFP أو إذا كان بروتين مراسل CAR (على سبيل المثال ، EGFRt) ملطخا بجسم مضاد مترافق مع FITC. - صب المادة الطافية من الخطوة 6.2.8. أضف 100 ميكرولتر من مزيج الأجسام المضادة داخل الخلايا ، ودوامة لفترة وجيزة ، واحتضن في RT لمدة 30 دقيقة في الظلام.
- اغسل الخلايا الثابتة / المنفذة الملطخة بإضافة 500 ميكرولتر من 1x المخزن المؤقت للنفاذية. تدور في 500 × جم لمدة 5 دقائق. صب المادة الطافية ، وأعد تعليق حبيبات الخلية في 300 ميكرولتر من DPBS ، وقم بتخزينها على الثلج.
- تحليل عن طريق قياس التدفق الخلوي كما هو موضح في الشكل 5. والنتيجة المتوقعة هي أن معظم CAR Tregs ستكون خلايا FOXP3 + HELIOS + . استخدم خلايا CD4 + Tconv كعنصر تحكم سلبي لتلوين FOXP3 و HELIOS.
7. قمع الإنسان CAR Treg
- تلطيخ صبغة تتبع الخلايا التائية المستجيبة (Tresp) وتنشيطه بين عشية وضحاها
- اجمع خلايا CAR Treg الموسعة ، وخلايا CD4 + Tconv المعزولة حديثا ، وخلايا CD8 + T المعزولة حديثا في أنابيب مخروطية منفصلة سعة 15 مل وخرز مزيل المضادة ل CD3 / CD28 إذا لم يتم ذلك بالفعل.
- تحضير الخلايا المستهدفة التي تعبر عن مستضد CAR المشعة كما هو موضح في الخطوة 5.1.
- تحديد تركيزات الخلايا التائية غير المنشطة والخلايا المستهدفة المشععة.
- اجمع بين 5 × 106 خلايا CD4 + Tconv مع 5 × 106 خلايا CD8 + T (نسبة 1: 1). هذه هي الخلايا التائية المستجيبة (Tresp) التي يجب تثبيطها بواسطة CAR Tregs في المقايس. قم بتدوير خلايا Tresp عند 500 × جم لمدة 5 دقائق في RT. قم بشفط المادة الطافية بعناية وأعد تعليق خلايا Tresp في 1 مل من DPBS.
- أضف 1 مل من صبغة CellTrace Violet (CTV) سعة 5 ملي مولار المعاد تشكيلها في DMSO إلى 107 خلايا Tresp في 1 مل من DPBS للحصول على تركيز نهائي يبلغ 5 ميكرومتر CTV. ضعها في حمام مائي على حرارة 37 درجة مئوية لمدة 20 دقيقة. في 10 دقائق ، قم بالدوامة برفق لإعادة توزيع CTV المستقرة.
- يغسل ب 9 مل من الوسط الكامل RPMI10 المسخن مسبقا. تدور في 500 × جم لمدة 5 دقائق. أعد التعليق في 5 مل من الوسط الكامل RPMI10 المسخن مسبقا.
- تحديد تركيز خلية Tresp المسمى CTV. أضف 5 × 104 خلايا Tresp غير المنشطة المسماة CTV في 200 ميكرولتر من وسط RPMI10 في 3-6 آبار من صفيحة ذات قاع دائري مكون من 96 بئرا كحد أدنى لضوابط الانتشار.
- قم بتنشيط خلايا Tresp المسماة CTV بخرز مضاد ل CD3 / CD28 بنسبة 1:10 حبة إلى خلية Tresp بدون IL-2 في وسط RPM10. قم بتوزيع 106 خلايا Tresp تحمل علامة CTV في 1 مل من وسط RPMI10 لكل بئر من صفيحة 24 بئرا في حاضنة زراعة الأنسجة طوال الليل.
- في موازاة ذلك ، احصل على 106 CAR+ Tregs. يغطي هذا المبلغ ثلاث نسخ من أربع نسب CAR Treg: Tresp ، 1: 1 ، 1: 2 ، 1: 4 ، 1: 8 ، عند 5 × 104 خلايا مستهدفة لكل 96 بئر من اللوحة المستديرة السفلية ، مثل 5 × 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 105 CAR Tregs ، عبر شرطين لتنشيط CAR Treg: الخلايا المستهدفة سالبة مستضد CAR المشعة (التحكم السلبي ، عدم التنشيط) ، والخلايا المستهدفة الإيجابية لمستضد CAR المشعة (التجربة ، تنشيط CAR).
- اجمع بين 3 × 105 CAR Tregs مع 3 × 105 خلايا سالبة لمستضد CAR مشعة (نسبة 1: 1) و 3 × 105 CAR Tregs مع 3 × 105 خلايا مستهدفة إيجابية لمستضد CAR مشعة (نسبة 1: 1) ، في أنبوبين مخروطيين منفصلين سعة 15 مل وتدور عند 500 × جم لمدة 5 دقائق في RT.
- أعد تعليق الحبيبات في كل أنبوب من الخطوة 7.1.10 في 600 ميكرولتر من وسط RPMI10 الدافئ مسبقا. ينتج عن هذا 200 ميكرولتر لكل من النسخ الثلاثية 1: 1 Treg: Tresp. قم بإجراء التخفيف التسلسلي على لوحة مستديرة القاع سعة 96 بئرا على النحو التالي:
- من 600 ميكرولتر المحضرة من تعليق الخلية المستهدفة Treg + ، ماصة 200 ميكرولتر من تعليق الخلية في كل من الآبار بنسبة 3 1: 1.
- أضف 100 ميكرولتر من الوسط الكامل RPMI10 المسخن مسبقا في كل من الآبار الفارغة بنسبة 1: 2 و 1: 4 و 1: 8.
- لكل من النسخ الثلاثية ، ماصة 100 ميكرولتر من تعليق الخلية من الآبار 1: 1 إلى الآبار المرتبطة بنسبة 1: 2.
- لكل من النسخ الثلاثية ، ماصة 100 ميكرولتر من تعليق الخلية ، من الآبار 1: 2 ، إلى الآبار ذات النسبة 1: 4 المرتبطة بها.
- لكل من النسخ الثلاثية ، ماصة 100 ميكرولتر من تعليق الخلية ، من الآبار 1: 4 ، إلى الآبار ذات نسبة 1: 8 المرتبطة بها.
- ماصة 100 ميكرولتر المتبقية من معلق الخلية من الآبار نسبة 1: 8 في حاوية نفايات.
ملاحظة: يجب أن يحتوي كل بئر على 100 ميكرولتر من تعليق الخلية إما مع 5 × 104 (1: 1) أو 2.5 × 104 (1: 2) أو 1.25 × 104 (1: 4) أو 0.625 × 104 (1: 8) CAR Tregs وعدد متساو من الخلايا المستهدفة المشععة.
- حضانة خلية CAR Treg و Tresp المشتركة
- بعد 16-18 ساعة من التنشيط ، اجمع خلايا Tresp المنشطة من الصفيحة المكونة من 24 بئرا في أنبوب مخروطي الشكل وقم بإزالة الخرز المضاد ل CD3 / CD28 عبر المغناطيس.
- تحديد عدد خلايا Tresp المسماة CTV المنزوعة .
- اغسل وقم بتدوير 2 × 106 خلايا Tresp عند 500 × جم لمدة 5 دقائق. شفط بعناية الطافف. أعد تعليق الخلايا في 4 مل من الوسط الكامل RPMI10.
- أضف 100 ميكرولتر من معلق الخلية التائية (5 × 104 خلايا T) إلى كل بئر مع CAR Tregs ، وكذلك إلى 3-6 آبار مع 100 ميكرولتر من وسط RPMI10 وحده لأقصى قدر من التحكم في الانتشار. ضع اللوحة في حاضنة لزراعة الأنسجة 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 لمدة 72 ساعة.
ملاحظة: تحتوي اللوحة المستديرة القاعية المكونة من 96 بئرا الآن على 3-6 آبار مع خلايا Tresp غير المنشطة وحدها (الحد الأدنى من التحكم في الانتشار) ، و 3-6 آبار مع خلايا Tresp المنشطة وحدها (الحد الأقصى للتحكم في الانتشار) وخلايا Tresp المنشطة في وجود أعداد متناقصة من CAR Tregs.
- قراءة قياس التدفق الخلوي
- قم بإعادة تعليق ونقل محتويات كل صفيحة سفلية مستديرة مكونة من 96 بئرا جيدا إلى أنبوب FACS مسمى. بدلا من ذلك ، قم بالنقل إلى لوحة قاع V سعة 96 بئرا إذا كان مقياس التدفق الخلوي مع وضع قراءة اللوحة متاحا. تدور في 500 × جم لمدة 5 دقائق.
- في غضون ذلك ، قم بإعداد مزيج رئيسي للأجسام المضادة مع DPBS ، و CD4 PE / Cy7 المضاد للإنسان 1: 200 ، و CD8 PerCP 1: 200 المضاد للبشر. ستتطلب كل عينة 100 ميكرولتر من مزيج الأجسام المضادة الرئيسية.
- دوامة خلية بلطف بيليه. ماصة 100 ميكرولتر من الأجسام المضادة الرئيسية مختلطة في كل أنبوب FACS. دوامة لفترة وجيزة واحتضانها عند 4 درجات مئوية لمدة 30 دقيقة في الظلام.
- يغسل ب 500 ميكرولتر من DPBS. اغسل 2x مع 100 ميكرولتر من DPBS إذا كنت تستخدم قاع V 96 بئرا. تدور في 500 × جم لمدة 5 دقائق. صب المادة الطافية ، وأعد تعليق حبيبات الخلية في 200 ميكرولتر من DPBS ، وقم بتخزين الأنابيب على الجليد في الظلام.
- قم بالتحليل عن طريق قياس التدفق الخلوي كما هو موضح في الشكل 6. النتيجة المتوقعة هي خلايا Tresp غير المنشطة وحدها (الحد الأدنى من الانتشار) لعرض ذروة مضان CTV عالية موحدة ، وخلايا Tresp المنشطة وحدها تعرض قمم متعددة لشدة CTV ، واحدة تتوافق مع كل انقسام خلوي (أقصى تكاثر) ، وخلايا CD4 + و CD8 + T المنشطة في وجود CAR Tregs المنشطة التي تعرض انخفاضا في عدد وارتفاع قمم CTV ، ومن ثم ، في الانتشار.
- احسب قمع خلية Treg على النحو التالي:
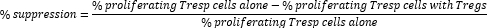
ملاحظة: في حالة استخدام برنامج FlowJo، من الممكن أيضا استخدام نمذجة تكاثر الخلايا لحساب مؤشر الانقسام (DI) لكل عينة وحساب النسبة المئوية للقمع باستخدام DI بدلا من النسبة المئوية للخلايا المتكاثرة في الصيغة أعلاه.
النتائج
يوفر البروتوكول الموصوف هنا خط أنابيب مبسطا وموحدا لتقييم تركيبات مستقبلات المستضد الخيمري الجديدة (CAR) في الخلايا التائية التنظيمية البشرية (Tregs) ، بهدف إنشاء علاجات حية لأمراض المناعة الذاتية ، ومرض الكسب غير المشروع مقابل المضيف ، ورفض زرع الأعضاء ، والحساسية. يوضح
Discussion
يوفر هذا البروتوكول منهجية مبسطة وشاملة لتوليد وتقييم الخلايا التائية التنظيمية لمستقبلات المستضد الخيمري البشري (CAR Tregs). وقد ألهم نجاح تقنية CAR في علاج سرطانات الدم تطبيقها على المجموعة الفرعية المثبطة للمناعة من الخلايا التائية Tregs. على عكس الخلايا التائية التقليدية ?...
Disclosures
LMRF هو مخترع وحصل على إتاوات من براءات الاختراع على الخلايا المناعية المهندسة واستشارات ل Guidepoint Global و McKesson. يعلن المؤلفون الباقون عن عدم وجود مصالح متضاربة.
Acknowledgements
يتم تمويل LMRF من قبل شبكة أبحاث الجزر البشرية (HIRN) الرائدة الناشئة في منحة مرض السكري من النوع 1 U24DK104162-07 ، ومنحة الأبحاث المؤسسية لجمعية السرطان الأمريكية (ACS) IRG-19-137-20 ، ومنحة اكتشاف المشروع التجريبي للأبحاث السريرية والانتقالية في ساوث كارولينا (SCTR) 1TL1TR001451-01 ، ومنحة اتصال أبحاث مرض السكري (DRC) IPF 22-1224 ، ومنحة Swim Across America 23-1579. يتم دعم RWC من خلال منحة التدريب في العلوم الخلوية والكيمياء الحيوية والجزيئية T32GM132055 وزمالة الخريجين في مركز هولينغز للسرطان. تم دعم هذه الدراسة جزئيا من قبل المورد المشترك لقياس التدفق الخلوي وفرز الخلايا ، مركز هولينغز للسرطان ، جامعة ساوث كارولينا الطبية (P30 CA138313). شكر خاص للدكتور Qizhi Tang في جامعة كاليفورنيا ، سان فرانسيسكو (UCSF) على إهداء البلازميدات الطافرة CAR.
Materials
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
References
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved