Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация Т-клеток, регуляторных химерных антигенных рецепторов человека
В этой статье
Резюме
Этот протокол обеспечивает оптимизированный рабочий процесс для создания и тестирования химических антигенных рецепторов регуляторных Т-клеток человека (CAR Tregs).
Аннотация
Терапия Т-клетками с помощью химерных антигенных рецепторов (CAR) изменила подход к лечению рака, что привело к рекордным показателям ремиссии при ранее неизлечимых гематологических опухолях. Эти успехи вызвали интерес к адаптации платформы CAR к небольшому, но ключевому подмножеству CD4+ Т-клеток, в первую очередь ответственных за регуляцию и ингибирование иммунного ответа, регуляторных Т-клеток (Tregs). Способность перенаправлять иммуносупрессивную активность Tregs на любую внеклеточную мишень имеет огромное значение для создания клеточной терапии аутоиммунных заболеваний, отторжения трансплантата органов и реакции «трансплантат против хозяина». В этой статье мы подробно описываем методологии для добросовестного выделения Treg из периферической крови человека, генетической модификации человеческих Tregs с использованием лентивируса или CRISPR/Cas9-подобного ввода с использованием аденоассоциированного вируса, опосредованного гомологичной направленной репарацией (HDR) матрицы, а также ex vivo экспансии стабильных человеческих CAR Tregs. Наконец, мы описываем оценку фенотипической стабильности CAR Treg человека и супрессивной функции in vitro , что дает представление о том, как CAR Treg человека будут вести себя в доклинических и клинических приложениях.
Введение
Терапия Т-клетками с использованием химерных антигенных рецепторов (CAR) произвела революцию в лечении гематологических злокачественных новообразований, достигнув удивительно высоких показателей ремиссии при ранее неизлечимых видах рака. Обнадеживающие первые результаты использования CAR-Т-клеток для лечения глиобластомы 3,4,5 подчеркивают универсальность технологии CAR и будущий потенциал для борьбы с широким спектром злокачественных новообразований. По мере того, как в этой области исследуются дальнейшие применения CAR, регуляторные Т-клетки (Tregs) стали многообещающим типом клеток. Tregs играют решающую роль в поддержании иммунного гомеостаза и регуляции иммунных реакций с помощью нескольких механизмов, включая секвестрацию IL-2, секрецию иммуносупрессивных цитокинов и модуляцию антигенпрезентирующих клеток 6,7.
С помощью технологии CAR Tregs можно использовать для лечения отторжения трансплантата органов, аутоиммунных заболеваний и воспалительных расстройств, таких как аллергия и астма. CAR-Tregs может привести к значительному улучшению результатов лечения пациентов и качества жизни за счет сокращения использования иммуносупрессивных препаратов, которые подавляют иммунную систему в целом и связаны с вредными побочными эффектами10,11. Доклинические модели показали многообещающие результаты в переводе технологии CAR в Tregs, с успешным применением при таких заболеваниях, как диабет 1 типа, рассеянный склероз, реакция «трансплантат против хозяина» и воспалительные заболевания кишечника 9,12,13,14,15. В настоящее время в клинике исследуются CAR Tregs для предотвращения отторжения трансплантата солидных органов16.
В данной статье представлена подробная методика получения химерных антигенных рецепторов регуляторных Т-клеток человека (CAR Tregs). Этот протокол включает в себя выделение Tregs из периферической крови человека и их генетическую модификацию с использованием таких методов, как лентивирусная трансдукция и точное вбивание генов с помощью редактирования генов CRISPR/Cas9 и аденоассоциированных вирусных векторов (AAV). Мы также описываем оценку фенотипической стабильности и супрессивной функции этих сконструированных Tregs, которые являются решающими шагами для подтверждения их терапевтического потенциала 17,18,19. Такой подход оптимизирует разработку и раннее тестирование терапий CAR T-клеток, которые обладают потенциалом для расширения преобразующего воздействия терапии CAR T-клетками на регулирование иммунной системы. Делясь нашей методологией, мы надеемся вдохновить на дальнейшие исследования и инновации в растущем пространстве терапии CAR Treg 9,20.
протокол
1. Изоляция Treg человека
- Переработка лейкопака
- Переложите содержимое лейкопака в коническую пробирку объемом 50 мл. Добавьте равный объем фосфатно-солевого буфера (DPBS) Дульбекко + 2% фетальной бычьей сыворотки (FBS), аккуратно перемешав с помощью пипетки.
- Отжим при 300 × г в течение 10 мин при комнатной температуре (RT). Осторожно отсасывайте надосадочную жидкость. Восстановите клеточную гранулу в 2 мл DPBS + 2% FBS. Добавьте 8 мл раствора хлорида аммония пипеткой в клеточную суспензию в соотношении 4:1, перемешайте путем легкой инверсии и дайте лизису оставшихся эритроцитов на льду в течение 15 минут.
- Вращайте при 300 × г в течение 10 минут в RT. Осторожно аспирируйте надосадочную жидкость. Добавьте 30 мл DPBS + 2% FBS для промывания клеток. При выключенном тормозе отжимайте промытые клетки при 150 × г в течение 10 мин при RT. Осторожно отсасывайте надосадочную жидкость. Ресуспендируйте клеточную гранулу в 30 мл DPBS + 2% FBS.
- Подсчитайте теперь выделенные мононуклеарные клетки периферической крови (PBMC) с трипановым синим в соотношении 1:1.
- Из-за высокой концентрации клеток первоначально разбавляют 10 мкл клеток 1:100 с DPBS; затем смешайте 10 мкл разбавленных ячеек в соотношении 1:100 с 10 мкл раствора трипанового синего для окончательного разведения в соотношении 1:1. При использовании автоматического счетчика ячеек корректируйте количество клеток, чтобы отразить 200-кратное разведение, умножив указанную концентрацию на 100, так как большинство счетчиков предполагают 2-кратное разведение. Ожидайте урожай 1-2,5 × 109 PBMC от лейкопака 1/10.
- Выделение CD4+ Т-клеток (отрицательный отбор)
- Раскрутите 108-10 9 PBMCs при 500 × g в течение 5 мин при RT и ресуспендируйте в буфере для разделения клеток (DPBS + 1 mM EDTA + 2% FBS) при 5 × 107 клеток/мл.
ПРИМЕЧАНИЕ: Чтобы получить достаточное количество человеческих Tregs для генетической модификации, мы рекомендуем начать с 1 ×10 9 PBMC. - Проводите магнитную сепарацию в соответствии с инструкциями производителя для набора для обогащения CD4+ Т-клеток.
- Определить количество выделенных CD4+ Т-клеток путем подсчета с помощью трипанового синего (10 мкл клеток + 10 мкл трипанового синего).
- Раскрутите 108-10 9 PBMCs при 500 × g в течение 5 мин при RT и ресуспендируйте в буфере для разделения клеток (DPBS + 1 mM EDTA + 2% FBS) при 5 × 107 клеток/мл.
- Выделение CD8+ Т-клеток (отрицательный отбор)
- Спин 5 ×10 7 PBMCs при 500 × g в течение 5 мин при RT. Ресуспендирование в буфере для разделения клеток (DPBS + 1 mM EDTA + 2% FBS) при 5 × 107 клеток/мл.
ПРИМЕЧАНИЕ: Мы рекомендуем начинать с 5 × 107 PBMC для получения 2-5 ×10 6 CD8+ Т-клеток. - Проводите магнитную сепарацию в соответствии с инструкциями производителя для набора для обогащения CD8+ Т-клеток.
- Определите количество выделенных CD8+ Т-клеток путем подсчета с помощью трипанового синего (10 мкл клеток + 10 мкл трипанового синего).
- Спин 5 ×10 7 PBMCs при 500 × g в течение 5 мин при RT. Ресуспендирование в буфере для разделения клеток (DPBS + 1 mM EDTA + 2% FBS) при 5 × 107 клеток/мл.
- Флуоресцентная сортировка клеток Treg (FACS)
- Выделите CD4+ Т-клетки, как описано в шаге 1.2, и храните их на ночь в DPBS с 2% FBS при 4 °C (минимальная потеря количества клеток и жизнеспособности) для FACS на следующий день. Определите количество CD4+ Т-клеток с шага 1.2 путем подсчета с помощью трипанового синего (10 мкл клеток + 10 мкл трипанового синего).
- Вращайте CD4+ клетки при 500 × г в течение 5 минут. Восстановите клетки в 200 мкл DPBS.
- На 1 × 106 клеток добавить 1 мкл античеловеческого CD4 FITC, 1 мкл античеловеческого CD25 APC и 1 мкл античеловеческого CD127 PE. Аккуратно перемешайте и поставьте в темный холодильник при температуре 4 °C на 30 минут.
- Промойте клетки 10 мл DPBS с 2% FBS. Вращайте при 500 × г в течение 5 минут. Аккуратно ресуспендируйте окрашенные клетки в концентрации 1,5 ×10 7 клеток/мл в DPBS с 2% FBS. Это рекомендуемая концентрация клеток для сортировки с помощью флуоресцентно-активируемой сортировки клеток (FACS).
- Пропустите окрашенную клеточную суспензию через фильтрующий колпачок 40 мкм в пробирки FACS, а затем держите пробирки на льду.
- Приготовьте 15 мл пробирок для сбора, содержащих 3 мл среды RPMI10, и положите на лед.
ПРИМЕЧАНИЕ: Эта среда состоит из RPMI1640 базальной среды, 10% FBS, 1x пенициллин-стрептомицина, 1x L-аланил-L-глютамина, 1x заменимых аминокислот, 1x пирувата натрия и 1x HEPES. - Отсортируйте CD4+CD25с высокимуровнем CD127-регуляторных Т-клеток (Tregs) и CD4+CD25с низким уровнемCD127+ обычных Т-клеток (Tconv) с помощью FACS, как показано на рисунке 1A.
- Определение выхода и жизнеспособности клеток; затем следует провести анализ или активацию Т-клеток.
2. Активация Т-клеток
- Подсчитайте выделенные Т-клетки с трипановым синим (10 мкл клеток + 10 мкл трипанового синего).
- Промойте 25 мкл анти-CD3/CD28 гранул (106 шариков) на каждые 1 × 106 Т-клеток, поддерживая соотношение гранул и Т-клеток 1:1. Промойте анти-CD3/CD28 гранулы, добавив DPBS, инкубируя на магните в течение 3 минут и удалив теперь уже разбавленный буфер анти-CD3/CD28, который может быть токсичным для клеток.
- Снимите трубку с магнита и снова суспендируйте промытые шарики в среде RPMI10, чтобы получилось 1 × 106 шариков/1 мл RPMI10.
- Ресуспендируйте Т-клетки с анти-CD3/CD28 гранулами в среде RPMI10 в концентрации 1 × 106 Т-клеток/мл. Затем добавьте 1000 МЕ/мл IL-2 к Treg-клеткам, 100 МЕ/мл IL-2 к CD4+ Tconv-клеткам и 300 МЕ/мл IL-2 к CD8+ Т-клеткам.
- Культивирование Т-клеток в 1 × 106 клеток в лунку 24-луночного планшета с различным количеством анти-CD3/CD28 гранул и IL-2. Поместите 24-луночный планшет в инкубатор для культуры тканей с температурой 37 °C и 5% CO2 .
- Расширяйте активированные Т-клетки в течение 9-12 дней в присутствии IL-2 до использования для экспериментов или повторной активации с помощью анти-CD3/CD28 гранул для дополнительной экспансии. Заменяйте среду каждые 2-3 дня и добавляйте IL-2 каждый раз при добавлении свежей среды. Поддерживайте плотность ячеек Tregs на уровне 5 × 10до 1 ×10 6 клеток на мл во время расширения, подсчитывая ячейки или проводя визуальный осмотр перед расщеплением.
3. Лентивирусная трансдукция Treg человека
- Повторная приостановка и подсчет Tregs через 48 часов после активации. Вращать при 500 ×g в течение 5 мин при РТ. Ресуспендировать Tregs в RPMI10 при 1,25 ×10 6 клеток/мл с 1000 МЕ/мл IL-2.
- Разогрейте центрифугу до 32 °C.
- Разморозьте лентивируссодержащую конструкцию CAR на льду.
ПРИМЕЧАНИЕ: Мы храним одноразовые аликвоты лентивируса с достаточным количеством лентивируса для трансдукции 2,5 × 105 клеток при MOI 1 при -80 °C. - Добавить в каждую аликвоту лентивируса по 2,5 ×10 5 Трег по 200 мкл в микроцентрифужную пробирку, каждая пробирка должна указывать на реакцию. Спинокулировать в дозе 1 000 × г в течение 1 ч при 32 °C.
- Переместите каждую реакцию объемом 200 мкл в 24-луночный планшет. Убедитесь, что носитель покрывает всю лунку. Инкубируйте 24-луночный планшет с трансдуцированными Tregs в инкубаторе для тканевых культур в течение ночи (16-18 ч). Доливайте в каждую лунку до 2 мл среду RPMI10 с конечной концентрацией IL-2 1000 МЕ/мл.
- Продолжайте наращивать трансдуцированные Tregs через 9-12 дней после активации, разделяя клетки и добавляя свежие предварительно подогретые RPMI10 и IL-2 по мере необходимости (каждые 2-3 дня). Идеальная концентрация клеток составляет 5 × 105-1 × 106 клеток/мл.
- Оцените эффективность модификации генов с помощью проточной цитометрии, как показано на рисунке 2.
ПРИМЕЧАНИЕ: Наши лентивирусные конструкции CAR содержат Myc-метку на N-конце гена CAR и репортерный ген GFP, связанный с геном CAR пептидом 2A, что позволяет количественно оценить эффективность трансдукции без окрашивания антителами (GFP) и подтвердить поверхностную экспрессию CAR (Myc-метка). Мы оцениваем эффективность модификации генов через 5 дней после трансдукции. Эффективность трансдукции может варьироваться от 30% до 70% в зависимости от донора и используемой конструкции CAR. При желании ячейки CAR+ можно отсортировать. - Убедитесь, что модифицированные Tregs завершают свой цикл активации (9-12 дней) и отдыхают 24 часа в отсутствие IL-2 перед использованием в любых экспериментах.
4. CRISPR/Cas9-опосредованный ген в человеческих Tregs
- Ресуспендировать Tregs и перенести в коническую пробирку объемом 15 мл через 48 ч после активации. Инкубируйте клеточную суспензию в магните в течение 3 минут.
- Находясь в магните, перенесите клетки в среде с помощью пипетки в новую пробирку. Шарики, анти-CD3/CD28, останутся прикрепленными к стенке трубки. Дайте очищенным от бисера отвариться в RPMI10 в течение 2 часов после удаления валика, чтобы восстановиться от непосредственного напряжения при удалении швов, повышая эффективность будущей трансдукции и восстановление после электропорации.
- Посчитайте очищенные от бисера треги с трипановым синим.
- Предварительно подогреть среду с уменьшенной сывороткой без FBS до 37 °C.
- Приготовьте 6-луночный планшет с 2,5 мл среды RPMI10 без антибиотиков (пенициллин-стрептомицин) и с 1000 МЕ/мл ИЛ-2 на лунку. Разогрейте планшет до 37 °C в инкубаторе для тканевых культур.
- Разморозьте на льду шаблон CAR-направленной репарации (HDR), содержащего аденоассоциированный вирус (AAV).
ПРИМЕЧАНИЕ: Мы храним одноразовые аликвоты с достаточным количеством AAV для заражения 4 × 106 клеток при MOI 20 000 при -80 °C. - Отжим при 500 × г в течение 5 минут. После сцеживания надосадочной жидкости ресуспендировать клетки в предварительно подогретую среду с восстановленной сывороткой в концентрации 4 × 107 клеток/мл.
- Аликвотные клетки в 100 мкл в центрифужных пробирках объемом 1,5 мл с низким связыванием белков. Добавьте CAR AAV с MOI 20 000 к каждому образцу и повторите. Инкубировать реакционные пробирки в инкубаторе для тканевых культур в течение 1 ч.
- Во время инкубации в течение 1 ч готовят и собирают комплексы рибонуклеопротеинов (РНП) CRISPR/Cas9 путем медленного добавления 8,3 мкл белка Cas9 (1 мг/мл стока) к 2,5 мкл гРНК, нацеленной на локус гена TRAC (100 мкМ запаса) для получения молярного соотношения Cas9 к sgРНК 1:1 и общего объема РНП 10,8 мкл на образец. Аккуратно пипетируйте вверх и вниз, чтобы перемешать. Инкубировать смесь РНП в течение 15 мин при температуре 37°С в инкубаторе для тканевых культур.
ПРИМЕЧАНИЕ: Комплексы RNP могут оставаться в RT после этого до тех пор, пока они не будут готовы к использованию. - Заполните свежую электропорационную трубку (E-трубку) 3 мл высокоосмолярного электропориционного буфера. Вставьте заполненную E-трубку в пипетную станцию системы электропорации до щелчка. Установите условия электропорации на 2 200 В, 20 мс, 1 импульс в системе электропорации.
- После завершения 1-часовой инкубации с AAV вращайте клетки с AAV при 300 × g в течение 5 мин при RT. Осторожно отасканируйте надосадочную жидкость и ресуспендируйте клеточную гранулу в 100 мкл буфера для ресуспензии клеток, полученного с помощью системы электропорации для каждого образца.
ПРИМЕЧАНИЕ: Работайте быстро и не оставляйте ячейки в буфере дольше 15 минут. Избегайте образования пузырей. - Добавьте 10,8 мкл комплекса РНП на образец. Хорошо перемешайте пипеткой, не создавая пузырьков.
- Вставьте наконечник для электропорации объемом 100 μL, нажав на пипетку до второго упора, чтобы открыть зажим. Поместите верхнюю головку пипетки в наконечник электропорации до тех пор, пока зажим надежно не войдет в зацепление с монтажным стержнем поршня. Постепенно отпускайте кнопку, сохраняя давление на пипетку вниз, чтобы наконечник плотно прилегал к пипетке без зазоров.
- Нажмите на пипетку до первой остановки и погрузите наконечник электропорации в смесь клетка-РНП. Аккуратно потяните образец вверх в пипетку без пузырьков.
ПРИМЕЧАНИЕ: Во время электропорации внутри наконечника не должно быть пузырьков. - Вставьте пипетку с установленным наконечником для электропорации, содержащим образец, вертикально в E Tube до тех пор, пока не раздастся щелчок. Избегайте образования пузырьков.
- Убедитесь, что введены оптимальные настройки для человеческих Tregs (2 200 В, 20 мс, 1 импульс) и нажмите «Пуск » на сенсорном экране, чтобы электропорировать элементы.
- Подождите, пока на сенсорном экране не появится сообщение «Завершено » после завершения электропорации. Аккуратно извлеките пипетку и немедленно переложите образец в подготовленный 6-луночный планшет, содержащий 2,5 мл предварительно подогретой среды RPMI10 без антибиотиков с 1000 МЕ/мл IL-2 на лунку. Повторите то же самое с оставшимися образцами. Осторожно покачивайте планшет линейными движениями (слева направо, сверху вниз), чтобы обеспечить равномерное распределение клеток в каждой лунке, и поместите его в инкубатор для тканевых культур.
ПРИМЕЧАНИЕ: Повторное использование наконечника для электропорации допустимо до 3 раз, если используются одни и те же элементы и комплекс RNP. Подождите 30-минутный период восстановления, прежде чем подсчитывать клетки или нарушать их каким-либо образом, например, при желании добавить усилитель HDR. - На следующий день, через 16-18 ч, замените среду на среду, содержащую антибиотики, подсчитайте электропорированные Tregs трипановым синим и заквашивайте 106 клеток/мл с 1000 МЕ/мл IL-2. Продолжайте наращивать электропорированные Tregs, расщепляя клетки и добавляя свежие RPMI10 и IL-2, как описано в шаге 2.6.
- Держите образцы на льду для анализа с помощью проточной цитометрии.
- Настройте элементы управления одноцветной компенсацией и примените их к файлу эксперимента.
- Сначала прочтите неокрашенный образец, чтобы скорректировать прирост FSC и SSC так, чтобы популяция лимфоцитов находилась в середине точечной диаграммы «Все события».
- Настройте стратегию гейтирования лимфоцитов в не-распадовые/одиночные клетки в жизнеспособные клетки в CD4+ клетки, как показано на рисунке 3C.
- Оценка эффективности модификации генов с помощью проточной цитометрии.
ПРИМЕЧАНИЕ: Наши конструкции AAV CAR содержат, в дополнение к группам гомологии локуса TRAC, репортерный ген рецептора эпидермального фактора роста (EGFRt), связанный с геном CAR пептидом 2A, как показано на рисунке 3. Эффективность нок-ина гена определяется поверхностным окрашиванием CD3, потеря которого указывает на потерю поверхностной экспрессии TCR и, следовательно, на успешное нацеливание на локус TRAC с помощью CRISPR/Cas9, и EGFRt, экспрессия которого указывает на успешную интеграцию трансгена CAR. Вбивные треги CAR представляют собой элементы CD3-EGFRt+. Мы оцениваем эффективность модификации генов через 5 дней после электропорации. - Убедитесь, что модифицированные Tregs завершили свой цикл активации (9-12 дней) и отдохнули 24 часа в отсутствие IL-2 перед использованием в любых экспериментах.
5. Активация Human CAR Treg
- Организация совместного проживания (день 0)
- Соберите линию клеток-мишеней, экспрессирующих антиген CAR, в коническую пробирку.
Примечание: Мы используем клетки K562, линию клеток миелолейкоза человека, в которой отсутствует экспрессия HLA, CD80 и CD86 в качестве клеток-мишеней для активации CAR Treg. Родительские клетки K562 используются в качестве отрицательного контроля, а антиген-экспрессирующие CAR K562 используются для активации CAR Tregs17,21. - Облучайте целевые клеточные линии 4000 рад в цезий-137 или рентгеновском облучателе. В случае отсутствия доступа к облучателю проводят обработку митомицином С для остановки пролиферации клеток с сохранением экспрессии поверхностного антигена в клетках-мишенях22.
- Если вы еще этого не сделали, удалите Tregs, повторно суспендируя Tregs, связанные с анти-CD3/CD28 шариками, и перенесите их в коническую пробирку объемом 15 мл. Инкубируйте клеточную суспензию в магните в течение 3-5 минут. Пока вы еще находитесь в магните, перенесите клетки в среде с помощью пипетки в новую пробирку; шарики, анти-CD3/CD28, останутся прикрепленными к стенке трубки.
- Определите концентрации облученной целевой клетки и обездоленного CAR Treg с помощью трипанового синего.
- Вращать облученные клетки-мишени и CAR Tregs в дозе 500 × g в течение 5 мин. Ресуспендируйте предварительно подогретым RPMI10 при давлении10 6 клеток/мл в отдельных пробирках. Добавляйте IL-2 в CAR Tregs для концентрации 2000 МЕ/мл.
Примечание: Это количество IL-2 будет разбавлено в 2 раза после объединения CAR Tregs с клетками-мишенями для получения конечной концентрации IL-2 1000 МЕ/мл. - Совместное культивирование 1 × 105 CAR Tregs (100 μL) с 1 × 105 ( 100 μL) CAR-антиген-отрицательных, облученных клеток-мишеней (отрицательный контроль для активации), 1 × 105 ( 100 μL) CAR-положительных клеток-мишеней (эксперимент) или 2,5 мкл анти-CD3/CD28 гранул (положительный контроль для активации) и 97,5 μл среды RPMI10 в 96-луночной круглой нижней пластине. Поместите планшет в инкубатор для культур тканей с температурой 37 °C, 5% CO2 на 48 часов.
ПРИМЕЧАНИЕ: Конечный объем на лунку составляет 200 μл. Убедитесь, что каждое условие имеет три повторения.
- Соберите линию клеток-мишеней, экспрессирующих антиген CAR, в коническую пробирку.
- Считывание проточной цитометрии
- Если вы не используете считыватель планшетов, подвешивайте содержимое каждой лунки из пластины с круглым дном 96 лунок и переложите его в трубку FACS. Вращайте при 500 x g в течение 5 минут. Сцедите надосадочную жидкость и аккуратно сделайте вихрь клеточной гранулы.
- Приготовьте мастер-смесь антител для проточной цитометрии: 100 мкл/образец, содержащий DPBS, античеловеческий CD4 PE/Cy7 1:200, античеловеческий CD71 PE 1:100 и краситель Ghost Viability BV510 1:2000.
ПРИМЕЧАНИЕ: Эта панель хорошо работает, если репортерный ген CAR является GFP. Если репортерный ген кодирует поверхностный белок, требующий окрашивания антителами, такой как EGFRt, можно использовать, например, антитело, конъюгированное с FITC. - Внесите пипеткой 100 мкл мастер-смеси антител в каждый образец, аккуратно перемешайте и инкубируйте в течение 30 минут в холодильнике при температуре 4 °C.
- Промыть 500 μл DPBS путем отжима при 500 × г в течение 5 минут. Ресуспендируйте клеточную гранулу в 200 мкл DPBS.
- Держите образцы на льду для анализа с помощью проточной цитометрии.
- Настройте элементы управления одноцветной компенсацией и примените их к файлу потока эксперимента.
- Считайте неокрашенные образцы, чтобы скорректировать прирост SSC и FSC так, чтобы популяция лимфоцитов находилась в середине точечной диаграммы «Все события».
- Настройте стратегию гейтирования лимфоцитов в нераспадувочные клетки/одиночные клетки в жизнеспособные клетки в CD4+ клетки, как показано на рисунке 3C (Используемые различные флуорофоры).
- Чтение образцов с частотой событий примерно 1500 событий/с для оценки активации Treg.
Примечание: Ожидаемым результатом является повышение экспрессии поверхности CD71 в CAR Tregs в присутствии антигена CAR, как показано на рисунке 4. Если повышенная регуляция не наблюдается в присутствии антигена CAR, то может присутствовать тоническая сигнализация.
6. Устойчивость Human CAR Treg
- Создание и расширение кокультуры (дни 0-9)
- Настройте совместные культуры для активации CAR Tregs, как описано в шаге 5.1.
- Через 48 ч перенесите кокультуру из каждой 96-луночной лунки с круглым дном в лунку с 24-луночным планшетом, содержащую предварительно подогретые 2 мл RPMI10 с 1000 МЕ/мл IL-2 для обеспечения расширения клеток.
- Добавьте свежий предварительно подогретый RPMI10 с 1 000 МЕ/мл IL-2 и разделите на дополнительные 24-луночные планшеты по мере необходимости.
- Считывание проточной цитометрии
- Ресуспендируйте и перенесите содержимое каждой реплики в коническую пробирку объемом 15 мл или 50 мл. Определите концентрацию клеток.
- Переносите между 5 × 10,5 и 1 × 106 клеток в пробирку FACS для каждой репликации. Крутите при 500 × г в течение 5 минут.
- Приготовьте мастер-смесь антител для проточной цитометрии для окрашивания поверхности: 100 мкл/образец, содержащий DPBS, античеловеческий CD4 PE/Cy7 1:200, античеловеческий CD25 APC 1:200 и краситель Ghost Viability BV510 1:2000. При необходимости включите конъюгированное с FITC антитело к репортерному белку CAR.
- Сцедите надосадочную жидкость с шага 6.2.2 и аккуратно перебейте гранулу клетки. Пипетка 100 мкл основной смеси поверхностно окрашивающих антител в каждую пробирку FACS. Кратковременно перемешайте и поставьте в холодильник при температуре 4 °C на 30 минут в темноте.
- Используя набор буферов для окрашивания транскрипционного фактора, приготовьте буфер для фиксации/пермеабилизации, добавив 3 объема разбавителя фиксации/пермеабилизации к 1 объему концентрата фиксации/пермеабилизации. Для каждого образца требуется 100 мкл буфера для фиксации/пермеабилизации.
- Поверхностные окрашенные элементы промыть 500 μл DPBS. Вращать при 500 × г в течение 5 минут и сцедить надосадочную жидкость. Пипеткой нанесите 100 мкл подготовленного буфера для фиксации/пермеабилизации в каждую пробирку. Кратковременно переведите вихрь и дайте закрепиться при температуре 4 °C в течение 30-60 минут в темноте.
- Используя набор буферов для окрашивания транскрипционного фактора, приготовьте 1x Permeabilization buffer, добавив 9 объемов дистиллированной воды к 1 объему концентрата Permeabilization Buffer 10x. Для каждого образца требуется 1000 μL Permeabilization buffer для промывки и 100 μL Permeabilization buffer для окрашивания антителами, нацеленными на внутриклеточные белки.
- Промойте фиксированные/пермеабилизированные клетки, добавив 500 мкл 1x пермеабилизационного буфера. Вращайте при 500 × г в течение 5 минут при RT.
- Приготовьте мастер-смесь для внутриклеточного окрашивания антител с 1x буфером для пермеабилизации, античеловеческим FOXP3 eFluor 450 1:50, античеловеческим HELIOS PE 1:50 и античеловеческим CTLA-4 PerCP-e710 1:50. Для каждого образца потребуется 100 мкл мастер-смеси антител.
Примечание: Эта панель работает, если репортерный ген CAR является GFP или если репортерный белок CAR (например, EGFRt) окрашен FITC-конъюгированным антителом. - Сцедите надосадочную жидкость с шага 6.2.8. Добавьте 100 мкл мастер-смеси внутриклеточных окрашивающих антител, кратковременно сделайте вихрь и инкубируйте при ОТ в течение 30 минут в темноте.
- Промойте окрашенные неподвижные/пермеабилизированные клетки, добавив 500 мкл 1x пермеабилизационного буфера. Вращайте при 500 × г в течение 5 минут. Сцедите надосадочную жидкость, повторно суспендируйте клеточную гранулу в 300 мкл DPBS и храните ее на льду.
- Проанализируйте с помощью проточной цитометрии, как показано на рисунке 5. Ожидаемый результат заключается в том, что большинство CAR Tregs будут FOXP3+HELIOS+ ячейками. Используйте клетки CD4+ Tconv в качестве отрицательного контроля для окрашивания FOXP3 и HELIOS.
7. Подавление CAR Treg человека
- Ответчик Т-клеток (Tresp) окрашивание следовым красителем и ночная активация
- Соберите расширенные клетки CAR Treg, свежевыделенные CD4+ Tconv клетки и свежевыделенные CD8+ Т-клетки в отдельные конические пробирки объемом 15 мл и удалите анти-CD3/CD28 гранулы, если это еще не сделано.
- Подготовьте облученные клетки-мишени, экспрессирующие антиген CAR, как описано в шаге 5.1.
- Определение концентраций неактивированных Т-клеток и облученных клеток-мишеней.
- Объедините 5 × 106 CD4+ Tconv клеток с 5 × 106 CD8+ T-клетками (соотношение 1:1). Это Т-клетки-ответчики (Tresp), которые должны быть ингибированы CAR Tregs в анализе. Вращайте клетки Tresp в дозе 500 × г в течение 5 мин в режиме РТ. Осторожно аспирируйте надосадочную жидкость и ресуспендируйте клетки Tresp в 1 мл DPBS.
- Добавьте 1 мл 5 мМ красителя CellTrace Violet (CTV), восстановленного в ДМСО, к 10клеткам 7 Tresp в 1 мл DPBS для получения конечной концентрации 5 мкМ CTV. Поставьте на водяную баню при температуре 37 °C на 20 минут. На 10 мин аккуратно перераспределите осевший CTV.
- Умойтесь 9 мл предварительно подогретой среды RPMI10. Вращать при 500 × г в течение 5 минут. Ресуспендируйте в 5 мл предварительно подогретой среды RPMI10.
- Определите концентрацию меченых CTV клеток Tresp. Добавьте 5 × 104 меченых CTV неактивированных элементов Tresp в 200 мкл среды RPMI10 в 3-6 лунок 96-луночного планшета с круглым дном в качестве минимального контроля пролиферации.
- Активируйте меченые CTV клетки Tresp с помощью анти-CD3/CD28 гранул в соотношении гранул к клеткам Tresp 1:10 без IL-2 в среде RPM10. Диспонируйте 106 меченых CTV клеток Tresp в 1 мл среды RPMI10 на лунку 24-луночного планшета в инкубаторе для тканевых культур на ночь.
- Параллельно получите 106 CAR+ Tregs. Это количество покрывает тройки из четырех соотношений CAR Treg:Tresp, 1:1, 1:2, 1:4, 1:8, при 5 × 104 целевых ячейках на 96-луночный колодец с круглым дном, как 5 × 104 × 3 + 2,5 × 104 × 3 + 1,25 × 104 × 3 + 0,625 × 104 × 3 = 2,81 × 105 CAR Tregs, в двух условиях активации CAR Treg: облученные CAR-антиген-отрицательные клетки-мишени (отрицательный контроль, без активации) и облученные CAR-антиген-положительные клетки-мишени (эксперимент, активация CAR).
- Соедините 3 × 105 CAR Tregs с 3 × 105 облученными CAR антиген-отрицательными клетками (соотношение 1:1) и 3 × 105 CAR Tregs с 3 ×10 5 облученными CAR антиген-положительными клетками-мишенями (соотношение 1:1) в двух отдельных конических пробирках объемом 15 мл и вращайте при 500 × г в течение 5 мин в RT. Тщательно аспирируйте надосадочную жидкость.
- Повторно суспендируйте гранулу в каждой пробирке с шага 7.1.10 в 600 мкл предварительно подогретой среды RPMI10. В результате получается 200 мкл для каждого из трипликаторов Treg:Tresp 1:1. Выполните последовательное разведение на 96-луночном планшете с круглым дном следующим образом:
- Из приготовленных 600 мкл клеточной суспензии Treg + мишени пипетируйте 200 мкл клеточной суспензии в каждую из 3 лунок соотношения 1:1.
- Добавьте 100 мкл предварительно подогретой среды RPMI10 в каждую из пустых лунок с соотношением 1:2, 1:4 и 1:8.
- Для каждого из трипликатов пипетку 100 мкл клеточной суспензии из лунок 1:1 в соответствующие лунки с соотношением 1:2.
- Для каждого из трипликатов пипетку 100 мкл клеточной суспензии из лунок 1:2 в соответствующие лунки с соотношением 1:4.
- Для каждого из трипликатов пипетируйте 100 мкл клеточной суспензии из лунок 1:4 в соответствующие лунки с соотношением 1:8.
- Пипеткой направьте оставшиеся 100 мкл клеточной суспензии из лунок с соотношением 1:8 в контейнер для отходов.
Примечание: Каждая лунка должна содержать 100 мкл клеточной суспензии с 5 × 104 (1:1), 2,5 × 104 (1:2), 1,25 × 104 (1:4), или 0,625 × 104 (1:8) CAR Tregs и равное количество облученных клеток-мишеней.
- Коинкубация клеток CAR Treg и Tresp
- Через 16-18 часов после активации соберите активированные клетки Tresp из 24-луночного планшета в коническую трубку и удалите анти-CD3/CD28 шарики с помощью магнита.
- Определите количество меток Tresp, меченных CTV.
- Промыть и отжать 2 × 106 ячейках Tresp при 500 × г в течение 5 мин. Осторожно отсасывайте надосадочную жидкость. Ресуспендируйте клетки в 4 мл полной среды RPMI10.
- Добавьте 100 мкл суспензии Т-клеток (5 × 104 Т-клеток) в каждую лунку с CAR Tregs, а также в 3-6 лунок с 100 мкл только среды RPMI10 для максимального контроля пролиферации. Поместите планшет в инкубатор для культур тканей с температурой 37 °C и 5%CO2 на 72 часа.
ПРИМЕЧАНИЕ: 96-луночный планшет с круглым дном теперь имеет 3-6 лунок только с неактивированными клетками Tresp (минимальный контроль пролиферации), 3-6 лунок только с активированными клетками Tresp (максимальный контроль пролиферации) и активированные клетки Tresp в присутствии уменьшающегося количества CAR Tregs.
- Считывание проточной цитометрии
- Повторно суспензируйте и перенесите содержимое каждой 96-луночной круглой нижней пластины в пробирку с маркировкой FACS. В качестве альтернативы можно перевести на 96-луночный планшет с V-образным дном, если доступен проточный цитометр с режимом считывания показаний планшета. Отжим при 500 × г в течение 5 мин.
- Тем временем приготовьте мастер-смесь антител с DPBS, античеловеческим CD4 PE/Cy7 1:200 и античеловеческим CD8 PerCP 1:200. Для каждого образца потребуется 100 мкл мастер-смеси антител.
- Аккуратно перебейте клеточную гранулу в вортс. Пипеткой нанесите 100 мкл мастер-смеси антител в каждую пробирку FACS. Кратковременно сделайте вихрь и инкубируйте при температуре 4 °C в течение 30 минут в темноте.
- Вымойте 500 μL DPBS. Промойте 2 раза 100 мкл DPBS при использовании 96-луночного V-образного дна. Вращайте при 500 × г в течение 5 минут. Сцедите надосадочную жидкость, повторно суспендируйте клеточную гранулу в 200 мкл DPBS и храните пробирки на льду в темноте.
- Проанализируйте с помощью проточной цитометрии, как показано на рисунке 6. Ожидаемым результатом являются неактивированные клетки Tresp (минимальная пролиферация) с равномерным высоким пиком флуоресценции CTV, только активированные клетки Tresp с демонстрацией нескольких пиков интенсивности CTV, по одному соответствующему каждому делению клетки (максимальная пролиферация), и активированные CD4+ и CD8+ Т-клетки в присутствии активированных CAR Tregs, демонстрирующие уменьшение количества и высоты пиков CTV. следовательно, в распространении.
- Вычислите подавление Treg-cell следующим образом:
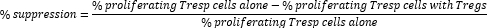
ПРИМЕЧАНИЕ: При использовании программного обеспечения FlowJo также можно использовать моделирование пролиферации клеток для расчета индекса деления (DI) для каждого образца и расчета процента подавления с использованием DI вместо процента пролиферирующих клеток в приведенной выше формуле.
Результаты
Описанный здесь протокол обеспечивает оптимизированный и стандартизированный конвейер для оценки новых конструкций химерных антигенных рецепторов (CAR) в регуляторных Т-клетках человека (Tregs) с целью создания живых терапевтических средств для лечения аутоиммунных з?...
Обсуждение
Этот протокол предоставляет оптимизированную и всестороннюю методологию для генерации и оценки химерных антигенных рецепторов регуляторных Т-клеток человека (CAR Tregs). Успех технологии CAR в лечении гематологических раковых заболеваний вдохновил на ее применение к им?...
Раскрытие информации
LMRF является изобретателем и получает роялти от патентов на сконструированные иммунные клетки, а также консультирует Guidepoint Global и McKesson. Остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
LMRF финансируется грантом Human Islet Research Network (HIRN) «Новый лидер в области диабета 1 типа» U24DK104162-07, грантом Американского онкологического общества (ACS) на институциональные исследования IRG-19-137-20, грантом на открытие пилотного проекта Южной Каролины Clinical and Translational Research (SCTR) 1TL1TR001451-01, грантом Diabetes Research Connection (DRC) IPF 22-1224 и грантом Swim Across America 23-1579. RWC поддерживается грантом на обучение в области клеточных, биохимических и молекулярных наук T32GM132055 и стипендией для выпускников Онкологического центра Холлингса Lowvelo. Это исследование было частично поддержано Общим ресурсом проточной цитометрии и сортировки клеток, Онкологический центр Холлингса, Медицинский университет Южной Каролины (P30 CA138313). Особая благодарность доктору Цичжи Тану из Калифорнийского университета в Сан-Франциско (UCSF) за любезный подарок мутантным плазмидам CAR.
Материалы
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
Ссылки
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены