JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 키메라 항원 수용체 조절 T 세포의 생성
요약
이 프로토콜은 인간 키메라 항원 수용체 조절 T 세포(CAR Tregs)를 생성하고 테스트하기 위한 간소화된 워크플로우를 제공합니다.
초록
키메라 항원 수용체(CAR) T 세포 요법은 암 치료의 양상을 바꾸어 놓았으며, 이전에는 불치의 혈액암에서 기록적인 관해율을 달성했습니다. 이러한 성공은 주로 면역 반응을 조절하고 억제하는 역할을 하는 CD4+ T 세포의 작지만 중추적인 하위 집합인 조절 T 세포(Tregs)에 CAR 플랫폼을 적응시키는 데 대한 관심을 불러일으켰습니다. Tregs의 면역억제 활성을 세포 외 표적으로 리디렉션하는 능력은 자가면역 질환, 장기 이식 거부 반응 및 이식편대숙주질환에 대한 세포 치료법을 만드는 데 엄청난 영향을 미칩니다. 여기에서는 인간 말초 혈액에서 진정한 Treg 분리, 아데노 관련 바이러스 매개 상동 유도 복구(HDR) 템플릿 전달을 사용하여 렌티바이러스 또는 CRISPR/Cas9 보조 knock-in을 사용한 인간 Tregs의 유전자 변형 및 안정적인 인간 CAR Tregs의 생체 외 확장에 대한 방법론을 자세히 설명합니다. 마지막으로, 인간 CAR Treg 표현형 안정성과 체외 억제 기능에 대한 평가를 설명하며, 이를 통해 인간 CAR Tregs가 전임상 및 임상 응용 분야에서 어떻게 작용하는지에 대한 통찰력을 제공합니다.
서문
키메라 항원 수용체(Chimeric antigen receptor, CAR) T 세포 치료법은 혈액 악성 종양 치료에 혁명을 일으켜 이전에는 치료가 불가능했던 암에서 현저하게 높은 관해율을 달성했습니다 1,2. 교모세포종 3,4,5을 치료하기 위해 CAR T 세포를 사용한 고무적인 초기 결과는 광범위한 악성 종양을 표적으로 할 수 있는 CAR 기술의 다양성과 미래 잠재력을 강조합니다. 이 분야에서 CAR의 추가 응용 분야를 탐구함에 따라 조절 T 세포(Tregs)가 유망한 세포 유형으로 부상했습니다. Tregs는 면역 항상성을 유지하고 IL-2 격리, 면역 억제 사이토카인 분비, 항원 제시 세포 조절 등 여러 메커니즘을 통해 면역 반응을 조절하는 데 중요한 역할을 합니다 6,7.
CAR 기술을 통해 Tregs는 장기 이식 거부 반응, 자가면역 질환 및 알레르기 및 천식과 같은 염증성 질환 치료에 활용될 수 있습니다 6,8,9. CAR Tregs는 면역 체계를 전체적으로 억제하고 유해한 부작용과 관련이 있는 면역억제제의 사용을 줄임으로써 환자 결과와 삶의 질을 크게 개선할 수 있습니다10,11. 전임상 모델은 CAR 기술을 Tregs로 변환하는 데 유망한 결과를 보여주었으며 제1형 당뇨병, 다발성 경화증, 이식편대숙주병 및 염증성 장 질환과 같은 질병에 성공적으로 적용되었습니다 9,12,13,14,15. 임상에서는 현재 고형 장기 이식 거부 반응을 예방하기 위해 CAR Tregs를 연구하고 있습니다16.
이 논문은 인간 키메라 항원 수용체 조절 T 세포(CAR Tregs)를 생성하기 위한 자세한 방법론을 제시합니다. 이 프로토콜은 인간 말초 혈액에서 Tregs를 분리하고 CRISPR/Cas9 유전자 편집 및 아데노 관련 바이러스(AAV) 벡터를 사용한 렌티바이러스 형질전환 및 정밀 유전자 넉인(knock-in)과 같은 기술을 사용하여 유전자 변형하는 것을 포함합니다. 우리는 또한 이러한 조작된 Tregs의 표현형 안정성과 억제 기능에 대한 평가를 설명하며, 이는 치료 잠재력을 검증하는 데 중요한 단계입니다 17,18,19. 이 접근 방식은 면역 체계를 조절하기 위해 CAR T 세포 요법의 혁신적인 영향을 확장할 수 있는 잠재력을 가진 CAR Treg 요법의 설계 및 조기 테스트를 간소화합니다. 우리의 방법론을 공유함으로써 급성장하고 있는 CAR Treg 치료 공간 9,20에서 추가 연구와 혁신에 영감을 줄 수 있기를 바랍니다.
프로토콜
1. 인간적인 Treg 고립
- Leukopak 가공
- 류코팩의 내용물을 50mL 원뿔형 튜브에 옮깁니다. 피펫과 부드럽게 혼합하여 Dulbecco의 인산염 완충 식염수(DPBS) +2% 소 태아 혈청(FBS)을 동일한 부피로 추가합니다.
- 실온(RT)에서 300× g에서 10분 동안 회전합니다. 상층액을 조심스럽게 흡인합니다. 2mL의 DPBS + 2% FBS로 세포 펠렛을 재구성합니다. 피펫으로 염화암모늄 용액 8mL를 세포 현탁액에 4:1 비율로 첨가하고 완만한 반전으로 혼합한 다음 얼음 위에서 15분 동안 남은 적혈구를 용해시킵니다.
- RT에서 10 분 동안 300×g으로 회전합니다. 상층액을 조심스럽게 흡입합니다. DPBS 30mL + 2% FBS를 첨가하여 세포를 세척합니다. 브레이크를 끈 상태에서 세척된 세포를 150×g에서 RT에서 10 분 동안 회전 시킵니다. 상층액을 조심스럽게 흡인합니다. 세포 펠릿을 30mL의 DPBS + 2% FBS에 재현탁합니다.
- 현재 분리된 말초 혈액 단핵 세포(PBMC)를 트리판 블루가 있는 세포를 1:1 비율로 계산합니다.
- 세포 농도가 높기 때문에 처음에는 10μL의 세포를 DPBS로 1:100으로 희석합니다. 그런 다음 10μL의 1:100 희석된 세포를 10μL의 트리판 블루 용액과 혼합하여 최종 1:1 희석합니다. 자동 세포 계수기를 사용하는 경우, 대부분의 계수기는 2배 희석을 가정하므로 보고된 농도에 100을 곱하여 200배 희석을 반영하도록 세포 수를 수정하십시오. 1/10 leukopak에서 1-2.5 × 109 PBMC를 산출할 것으로 예상됩니다.
- CD4+ T 세포 분리(음성 선택)
- RT에서 5분 동안 500 × g에서 108-10 9 PBMC를 스핀다운하고 5 × 107 cells/mL에서 세포 분리 버퍼(DPBS + 1mM EDTA + 2% FBS)에 재현탁합니다.
참고: 유전자 변형을 위한 충분한 human Tregs를 얻으려면 1 × 109 PBMCs로 시작하는 것이 좋습니다. - CD4+ T 세포 농축 키트에 대한 제조업체의 지침에 따라 자기 분리를 수행합니다.
- 트리판 블루(10 μL 세포 + 10 μL 트리판 블루)로 계수하여 분리된 CD4+ T 세포의 양을 측정합니다.
- RT에서 5분 동안 500 × g에서 108-10 9 PBMC를 스핀다운하고 5 × 107 cells/mL에서 세포 분리 버퍼(DPBS + 1mM EDTA + 2% FBS)에 재현탁합니다.
- CD8+ T 세포 분리(음성 선택)
- RT에서 5분 동안 500 × g에서 5 × 107 PBMC를 스핀합니다. 5 × 107 cells/mL에서 세포 분리 완충액(DPBS + 1 mM EDTA + 2% FBS)에 재현탁합니다.
참고: 2-5 × 106 CD8+ T 세포를 얻으려면 5 × 107 PBMC로 시작하는 것이 좋습니다. - CD8+ T 세포 농축 키트에 대한 제조업체의 지침에 따라 자기 분리를 수행합니다.
- 트리판 블루(10 μL 세포 + 10 μL 트리판 블루)로 계수하여 분리된 CD8+ T 세포의 수를 측정합니다.
- RT에서 5분 동안 500 × g에서 5 × 107 PBMC를 스핀합니다. 5 × 107 cells/mL에서 세포 분리 완충액(DPBS + 1 mM EDTA + 2% FBS)에 재현탁합니다.
- Treg 형광 보조 세포 분류(FACS)
- 1.2단계에서 설명한 대로 CD4+ T 세포를 분리하고 다음 날 FACS를 위해 4°C에서 2% FBS와 함께 DPBS에 밤새 보관합니다(세포 수 및 생존율의 최소 손실). 트리판 블루(10μL 세포 + 10μL 트리판 블루)로 계수하여 1.2단계의 CD4+ T 세포 수를 측정합니다.
- CD4+ 세포를 500 × g 에서 5분 동안 회전시킵니다. 200μL의 DPBS에서 세포를 재구성합니다.
- 1 × 106 세포당 항-인간 CD4 FITC 1 μL, 항-인간 CD25 APC 1 μL, 항-인간 CD127 PE 1 μL를 첨가합니다. 부드럽게 소용돌이치고 4°C의 어두운 냉장고에 30분 동안 넣습니다.
- 2% FBS가 포함된 10mL의 DPBS로 세포를 세척합니다. 500 × g 에서 5 분 동안 돌립니다. 염색된 세포를 2% FBS를 사용하여 DPBS에서 1.5 × 107 cells/mL로 부드럽게 재현탁합니다. 이는 형광 활성화 세포 분류(FACS)를 통해 분류하기 위해 권장되는 세포 농도입니다.
- 염색된 세포 현탁액을 40μm 필터 캡을 통해 FACS 튜브에 통과시킨 다음 튜브를 얼음 위에 유지합니다.
- RPMI10 배지 3ml가 들어 있는 15mL 수집 튜브를 준비하고 얼음 위에 놓습니다.
참고: 이 배지는 RPMI1640 기초 배지, 10% FBS, 1x 페니실린-스트렙토마이신, 1x L-알라닐-L-글루타민, 1x 비필수 아미노산, 1x 피루브산 나트륨 및 1x HEPES로 구성됩니다. - 그림 1A와 같이 FACS를 사용하여 CD4+CD25높은CD127- 조절 T 세포(Tregs) 및 CD4+CD25낮은CD127+ 기존 T 세포(Tconv)를 정렬합니다.
- 세포 수율 및 생존력을 측정합니다. 그런 다음 다운스트림 분석 또는 T 세포 활성화를 진행합니다.
2. T 세포 활성화
- 트리판 블루(10 μL + 10 μL 트리판 블루)로 분리된 T 세포를 계수합니다.
- 1 × 106 T 세포를 얻을 때마다 25 μL의 anti-CD3/CD28 비드(106 비드)를 세척하여 T 세포에 대한 비드 대 비드를 1:1 비율로 유지합니다. DPBS를 첨가하고, 자석에서 3분 동안 배양하고, 세포에 독성이 있을 수 있는 현재 희석된 anti-CD3/CD28 비드 버퍼를 제거하여 anti-CD3/CD28 비드를 세척합니다.
- 자석에서 튜브를 제거하고 세척된 비드를 RPMI10 배지에 다시 매달아 1 × 106 비드/1mL의 RPMI10을 갖도록 합니다.
- RPMI10 배지에서 항-CD3/CD28 비드로 T 세포를 1 × 106 T cells/mL의 농도로 재현탁합니다. 그런 다음 Treg 세포에 IL-2 1,000IU/mL, IL-2 - CD4+ Tconv 세포 100IU/mL, CD8+ T 세포에 IL-2 300IU/mL를 추가합니다.
- 24웰 플레이트의 웰당 1 × 106 개 세포에서 서로 다른 양의 anti-CD3/CD28 비드와 IL-2를 사용하여 T 세포를 배양합니다. 24웰 플레이트를 37°C, 5% CO2 조직 배양 인큐베이터에 놓습니다.
- 실험에 사용되거나 추가 확장을 위해 anti-CD3/CD28 beads로 재활성화될 때까지 IL-2가 있는 상태에서 9-12일 동안 활성화된 T 세포를 확장합니다. 2-3일마다 배지를 교체하고 새 배지가 추가될 때마다 IL-2를 추가합니다. Tregs의 세포 밀도를 세포를 계수하거나 분할 전에 육안 검사를 통해 확장하는 동안 mL당 5 ×10 5 to 1 × 106 cells로 유지합니다.
3. 인간적인 Treg lentiviral transduction
- 활성화 후 48시간 후에 Tregs를 다시 일시 중단하고 계산합니다. RT에서 5분 동안 500×g 으로 회전합니다. 1,000 IU/mL의 IL-2로 1.25 × 106 cells/mL에서 RPMI10의 Tregs를 재현탁합니다.
- 원심분리기를 32°C로 예열합니다.
- 렌티바이러스가 함유된 CAR 구조체를 얼음 위에서 해동합니다.
참고: 당사는 -80 °C에서 1의 MOI로 2.5 × 105 세포를 형질도입하기에 충분한 렌티바이러스가 포함된 일회용 렌티바이러스 분취액을 보관합니다. - 마이크로 원심분리 튜브에서 200 μL × 2.510 5 Tregs에 각 렌티바이러스 분취액을 첨가하면 각 튜브는 반응을 나타냅니다. 32°C에서 1 시간 동안 1,000×g에서 spinoculate합니다.
- 각 200μL 반응을 24웰 플레이트로 이동합니다. 미디어가 전체 우물을 덮는지 확인하십시오. 조직 배양 인큐베이터에서 형질도입된 Tregs와 함께 24웰 플레이트를 하룻밤(16-18시간) 배양합니다. 최종 IL-2 농도가 1,000IU/mL인 RPMI10 배지로 각 웰을 2mL로 보충합니다.
- 세포를 분리하고 필요에 따라(2-3일마다) 미리 예열된 새로운 RPMI10 및 IL-2를 보충하여 활성화 후 9-12일 후에 형질도입된 Tregs를 계속 확장하십시오. 이상적인 세포 농도는 5 × 105-1 × 106 cells/mL입니다.
- 그림 2와 같이 유세포 분석을 사용하여 유전자 변형 효율을 평가합니다.
참고: 당사의 렌티바이러스 CAR 구조체는 CAR 유전자의 N-말단에 Myc-tag와 2A 펩타이드에 의해 CAR 유전자에 연결된 GFP 리포터 유전자를 포함하고 있어 항체 염색(GFP) 없이 transduction efficiency를 정량화하고 CAR 표면 발현(Myc-tag)을 확인할 수 있습니다. transduction 5일 후 유전자 변형 효율을 평가합니다. 형질 전환 효율은 공여체와 사용된 CAR 구조체에 따라 30%에서 70% 사이로 다양할 수 있습니다. 원하는 경우 CAR+ 셀을 정렬할 수 있습니다. - 변형된 Tregs가 활성화 주기(9-12일)를 완료하고 IL-2가 없는 상태에서 실험에 사용하기 전에 24시간 동안 휴식을 취해야 합니다.
4. 인간적인 Tregs에 있는 CRISPR/Cas9 매개 유전자 knock-in
- Tregs를 재현탁하고 활성화 48시간 후 15mL 코니컬 튜브로 옮깁니다. 세포 현탁액을 자석에 3분 동안 배양합니다.
- 자석에 있는 동안 피펫을 통해 배지의 세포를 새 튜브로 옮깁니다. anti-CD3/CD28 비드는 튜브 벽에 부착된 상태로 유지됩니다. 비드 제거 후 2시간 동안 디비드된 Tregs를 RPMI10에 그대로 두어 디비드의 즉각적인 스트레스를 회복하고 향후 transduction 효율과 electroporation의 회복을 향상시킵니다.
- 트리판 블루로 비즈가 제거된 Tregs를 세십시오.
- FBS가 없는 환원 혈청 배지를 37°C로 예열합니다.
- 항생제(페니실린-스트렙토마이신)가 없는 RPMI10 배지 2.5mL와 웰당 IL-2 1,000IU/mL가 포함된 6웰 플레이트를 준비합니다. 조직 배양 인큐베이터에서 플레이트를 37°C로 예열합니다.
- 아데노 관련 바이러스(AAV)를 함유한 CAR 상동성 유도 복구(HDR) 템플릿을 얼음 위에서 해동합니다.
참고: 당사는 -80 °C에서 20,000의 MOI로 4 × 106 세포를 감염시키기에 충분한 AAV가 있는 일회용 부분 표본을 보관합니다. - 500 × g 에서 5 분 동안 Tregs를 돌립니다. 상층액을 디캔팅한 후 예열된 환원 혈청 배지에서 4 × 107 cells/mL로 세포를 재현탁합니다.
- 단백질 결합이 낮은 1.5mL 원심분리 튜브의 100μL의 부분 표본 세포. MOI 20,000에서 CAR AAV를 각 샘플에 추가하고 재현탁합니다. 조직 배양 인큐베이터에서 반응 튜브를 1시간 동안 배양합니다.
- 1시간 배양 중에 Cas9 대 sgRNA 1:1의 몰비와 샘플당 총 RNP 부피 10.8μL를 위해 TRAC 유전자 자리(100μM 스톡)를 대상으로 하는 2.5μL의 sgRNA에 8.3μL의 Cas9 단백질(1mg/mL 스톡)을 천천히 첨가하여 CRISPR/Cas9 리보핵단백질(RNP) 복합체를 준비하고 조립합니다. 위아래로 부드럽게 피펫을 넣어 섞습니다. 조직 배양 인큐베이터에서 37°C에서 15분 동안 RNP 혼합물을 배양합니다.
참고: RNP 복합체는 나중에 사용할 준비가 될 때까지 RT에 남아 있을 수 있습니다. - 새 electroporation tube(E 튜브)에 3mL의 고삼투압 electroporation buffer를 채웁니다. 딸깍 소리가 날 때까지 채워진 E 튜브를 전기천공 시스템의 피펫 스테이션에 삽입합니다. electroporation 시스템에서 electroporation 조건을 2,200V, 20ms, 1pulse 로 설정합니다.
- AAV를 사용한 1시간 배양이 완료되면 RT에서 5분 동안 300 × g 에서 AAV로 세포를 회전시킵니다. 상등액을 조심스럽게 흡입하고 샘플당 전기천공법 시스템에서 제공하는 세포 재현탁액 100μL에 세포 펠렛을 재현탁합니다.
참고: 신속하게 작업하고 버퍼에 셀을 15분 이상 두지 마십시오. 거품을 만들지 마십시오. - 샘플당 10.8μL의 RNP 복합체를 추가합니다. 거품을 만들지 않고 피펫으로 잘 섞습니다.
- 피펫을 두 번째 스톱으로 밀어 클램프를 열어 100μL 전기천공레이션 팁을 삽입합니다. 클램프가 피스톤의 장착 스템과 단단히 맞물릴 때까지 피펫의 상단 헤드를 전기천공 팁에 배치합니다. 팁이 틈 없이 꼭 맞도록 피펫에 대한 아래쪽 압력을 유지하면서 버튼을 서서히 놓습니다.
- 피펫을 첫 번째 스톱까지 누르고 전기천공법 팁을 cell-RNP 혼합물에 담그십시오. 기포 없이 샘플을 피펫으로 부드럽게 당겨 넣습니다.
알림: electroporation 동안 팁 내부에 기포가 존재할 수 없습니다. - 딸깍 소리가 들릴 때까지 샘플이 들어있는 electroporation 팁이 장착된 피펫을 E 튜브에 수직으로 삽입합니다.기포가 생성되지 않도록 합니다.
- human Tregs에 대한 최적 설정(2,200 V, 20 ms, 1 Pulse)이 입력되었는지 확인하고 터치스크린에서 start 를 눌러 세포를 전기천공합니다.
- electroporation이 완료되면 터치스크린에 Complete(완료 )가 표시될 때까지 기다립니다. 피펫을 부드럽게 제거하고 웰당 1,000IU/mL의 IL-2가 포함된 2.5mL의 예열된 무항생제 RPMI10 배지가 들어 있는 준비된 6웰 플레이트로 샘플을 즉시 옮깁니다. 나머지 샘플에 대해 반복합니다. 플레이트를 직선 동작(왼쪽에서 오른쪽으로, 위에서 아래로)으로 부드럽게 흔들어 각 웰에 세포가 고르게 분포되도록 하고 조직 배양 인큐베이터에 넣습니다.
참고: electroporation tip의 재사용은 동일한 세포와 RNP 복합체를 사용하는 경우 최대 3배까지 허용됩니다. 세포를 세거나 원하는 경우 HDR 인핸서를 추가하는 것과 같은 방식으로 세포를 방해하기 전에 30분의 회복 기간을 허용합니다. - 다음 날, 16-18시간 후, 배지를 항생제 함유 배지로 교체하고, 전기천공된 Tregs를 트리판 블루로 계수하고, 1,000 IU/mL IL-2로 106 cells/mL에서 배양합니다. 2.6단계에서 설명한 대로 세포를 분할하고 새로운 RPMI10 및 IL-2를 보충하여 전기천공된 Treg를 계속 확장합니다.
- 유세포 분석법을 통한 분석을 위해 시료를 얼음 위에 보관하십시오.
- 단색 보정 컨트롤을 설정하고 실험 파일에 적용합니다.
- 먼저 염색되지 않은 샘플을 판독하여 FSC 및 SSC 증가를 조정하여 림프구 집단이 'All events' 점도표의 중간에 있도록 합니다.
- 그림 3C와 같이 림프구를 비파편으로/단일 세포를 생존 가능한 세포로 CD4+ 세포로 게이팅 전략을 설정합니다.
- 유세포 분석을 사용하여 유전자 변형 효율을 평가합니다.
참고: 당사의 AAV CAR 구조체는 TRAC 유전자 좌위 상동성 arm 외에도 그림 3과 같이 2A 펩타이드에 의해 CAR 유전자에 연결된 절단된 표피 성장 인자 수용체(EGFRt) 리포터 유전자를 포함합니다. 유전자 knock-in 효율은 CD3에 대한 표면 염색에 의해 결정되며, CD3의 손실은 TCR 표면 발현의 손실을 나타내므로 CRISPR/Cas9 및 EGFRt를 사용한 TRAC 유전자 자리의 성공적인 표적화를 나타내며, EGFRt의 발현은 CAR 전이유전자의 성공적인 통합을 나타냅니다. CAR knock-in Tregs는 CD3-EGFRt+ 세포입니다. 전기천공법 5일 후 유전자 변형 효율을 평가합니다. - 변형된 Tregs가 활성화 주기(9-12일)를 완료하고 IL-2가 없는 상태에서 24시간 동안 휴식을 취한 후 실험에 사용되는지 확인합니다.
5. 인간적인 CAR Treg 활성화
- 공동 문화 설정(Day 0)
- CAR 항원 발현 표적 세포주를 원뿔형 튜브에 모읍니다.
참고: HLA, CD80 및 CD86 발현이 부족한 인간 골수성 백혈병 세포주인 K562 세포를 CAR Treg 활성화를 위한 표적 세포로 사용합니다. 부모 K562 세포는 음성 대조군으로 사용되며 CAR 항원 발현 K562는 CAR Tregs17,21을 활성화하는 데 사용됩니다. - Cesium-137 또는 X-ray 방사선 조사기에 4,000 rad 의 표적 세포주를 조사합니다. 조사기에 접근할 수 없는 경우, 미토마이신 C 치료를 수행하여 세포 증식을 멈추면서 표적 세포에서 표면 항원 발현을 유지한다22.
- 아직 수행하지 않은 경우 anti-CD3/CD28 비드에 결합된 Tregs를 재현탁하고 15mL 코니컬 튜브로 옮겨 Tregs를 디비드합니다. 세포 현탁액을 자석에 3-5분 동안 배양합니다. 자석에 있는 동안 피펫을 통해 배지의 세포를 새 튜브로 옮깁니다. 안티-CD3/CD28 비드는 튜브 벽에 부착된 상태로 유지됩니다.
- 방사선 조사된 표적 세포와 탈비드된 CAR Treg 농도를 trypan blue로 측정합니다.
- 방사선 조사된 표적 세포와 CAR Tregs를 500 × g 에서 5분 동안 스핀합니다. 예열된 RPMI10을 별도의 튜브에 106 cells/mL로 재현탁합니다. 2,000 IU/mL의 농도를 위해 CAR Tregs에 IL-2를 첨가합니다.
참고: 이 양의 IL-2는 CAR Tregs가 1,000IU/mL의 최종 IL-2 농도를 위해 대상 세포와 결합되면 2배로 희석됩니다. - 1 ×× 105(100 μL) CAR 항원 음성, 방사선 조사 표적 세포(활성화를 위한 음성 대조군), 1 ×10 5(100 μL) CAR 항원 양성, 방사선 조사 표적 세포(실험) 또는 2.5 μL의 항-CD3/CD28 비드(활성화를 위한 양성 대조군) 및 97.5 μL의 RPMI10 배지를 96웰 원형 바닥 플레이트에서 공동 배양합니다. 플레이트를 37°C, 5% CO2 조직 배양 인큐베이터에 48시간 동안 놓습니다.
참고: 웰당 최종 부피는 200μL입니다. 각 조건에 3개의 반복실험이 있는지 확인합니다.
- CAR 항원 발현 표적 세포주를 원뿔형 튜브에 모읍니다.
- 유세포 분석 판독
- 플레이트 리더를 사용하지 않는 한, 96웰 둥근 바닥 플레이트에서 각 웰의 내용물을 다시 매달아 FACS 튜브로 옮깁니다. 500 x g에서 5분 동안 회전합니다. 상층액을 디캔팅하고 세포 펠릿을 부드럽게 와류로 만듭니다.
- 유세포 분석 항체 마스터 믹스 준비: DPBS, 항인간 CD4 PE/Cy7 1:200, 항인간 CD71 PE 1:100 및 Ghost Viability Dye BV510 1:2000을 포함하는 100μL/샘플.
참고: 이 패널은 CAR 리포터 유전자가 GFP인 경우 잘 작동합니다. 리포터 유전자가 EGFRt와 같은 항체 염색이 필요한 표면 단백질을 암호화하는 경우, 예를 들어 FITC-접합 항체를 사용할 수 있습니다. - 100 μL의 항체 마스터 혼합물을 각 샘플에 피펫으로 주입하고, 부드럽게 혼합한 후 4°C 냉장고에서 30분 동안 배양합니다.
- 500 × g 에서 5분 동안 회전하여 500μL의 DPBS로 세척합니다. 세포 펠릿을 200μL의 DPBS에 재현탁합니다.
- 유세포 분석법을 통한 분석을 위해 시료를 얼음 위에 보관하십시오.
- 단색 보정 컨트롤을 설정하고 실험 흐름 파일에 적용합니다.
- 염색되지 않은 샘플을 판독하여 SSC 및 FSC 증가를 조정하여 림프구 집단이 'All events' 점도표의 중간에 있도록 합니다.
- 그림 3C와 같이 림프구를 비파편으로/단일 세포를 생존 세포에서 CD4+ 세포로 게이팅 전략을 설정합니다(다양한 형광단 사용).
- 약 1,500 events/s의 이벤트 속도로 샘플을 판독하여 Treg 활성화를 평가합니다.
참고: 예상되는 결과는 그림 4와 같이 CAR 항원이 있는 경우 CAR Tregs에서 CD71 표면 발현의 상향 조절입니다. CAR 항원이 있는 상태에서 상향 조절이 보이지 않으면 강장제 신호가 존재할 수 있습니다.
6. 인간적인 CAR Treg 안정성
- 공동 문화 설정 및 확장(0-9일차)
- 5.1단계에 설명된 대로 CAR Tregs를 활성화하도록 공동 배양을 설정합니다.
- 48시간 후, 각 96웰 라운드 바닥 플레이트 웰에서 세포 증식을 허용하기 위해 1,000IU/mL IL-2로 예열된 2mL의 RPMI10이 포함된 24웰 플레이트 웰로 공동 배양을 이동합니다.
- 1,000 IU/mL IL-2와 함께 예열된 새 RPMI10을 추가하고 필요에 따라 추가 24웰 플레이트로 분할합니다.
- 유세포 분석 판독
- 각 복제물의 내용물을 15mL 또는 50mL 코니컬 튜브로 재현탁하고 옮깁니다. 세포 농도를 측정합니다.
- 각 복제에 대해 5 × 105 및 1 × 106 세포 사이를 FACS 튜브로 이동합니다. 500 ×g에서 5 분 동안 돌립니다 .
- 표면 염색을 위한 유세포 분석 항체 마스터 믹스 준비: DPBS, anti-human CD4 PE/Cy7 1:200, anti-human CD25 APC 1:200 및 Ghost Viability Dye BV510 1:2000을 포함하는 100μL/샘플. 필요한 경우 CAR 리포터 단백질에 대한 FITC 접합 항체를 포함합니다.
- 6.2.2 단계에서 상등액을 디캔팅하고 세포 펠릿을 부드럽게 와류로 만듭니다. 각 FACS 튜브에 100 μL의 표면 염색 항체 마스터 믹스를 피펫팅합니다. 잠시 소용돌이치고 4 ° C 냉장고에 30 분 동안 어둠 속에서 두십시오.
- transcription factor staining buffer set를 사용하여 Fixation/Permeabilization 농축액 1량에 Fixation/Permeabilization 희석제 3량을 추가하여 Fixation/Permeabilization buffer를 준비합니다. 각 샘플에는 100μL의 고정/투과 완충액이 필요합니다.
- 표면 염색된 세포를 500μL의 DPBS로 세척합니다. 500 × g 에서 5 분 동안 회전하고 상층액을 디캔팅합니다. 준비된 100 μL의 고정/투과 완충액을 각 튜브에 피펫팅합니다. 잠시 소용돌이치고 어둠 속에서 30-60분 동안 4°C에서 고정이 발생하도록 합니다.
- 전사 인자 염색 완충액 세트를 사용하여 1부피의 Permeabilization Buffer 10x 농축액에 9부피의 증류수를 첨가하여 1x 투과화 완충액을 준비합니다. 각 샘플은 세척을 위해 1,000μL의 투과화 완충액이 필요하고 세포 내 단백질을 표적으로 하는 항체로 염색하기 위해 100μL의 투과화 완충액이 필요합니다.
- 500 μL의 1x 투과화 완충액을 첨가하여 고정/투과화된 세포를 세척합니다. RT에서 5분 동안 500× g 으로 회전합니다.
- 1x Permeabilization buffer, anti-human FOXP3 eFluor 450 1:50, anti-human HELIOS PE 1:50 및 anti-human CTLA-4 PerCP-e710 1:50을 사용하여 세포 내 염색 항체 마스터 믹스를 준비합니다. 각 샘플에는 100μL의 항체 마스터 믹스가 필요합니다.
참고: 이 패널은 CAR 리포터 유전자가 GFP이거나 CAR 리포터 단백질(예: EGFRt)이 FITC 접합 항체로 염색된 경우에 작동합니다. - 6.2.8 단계에서 상등액을 디캔팅합니다. 세포 내 염색 항체 마스터 믹스 100μL를 추가하고 잠시 와류를 일으킨 다음 어둠 속에서 30분 동안 RT에서 배양합니다.
- 500 μL의 1x 투과화 완충액을 첨가하여 염색된 고정/투과성 세포를 세척합니다. 500 × g 에서 5 분 동안 회전합니다. 상등액을 디캔팅하고 세포 펠릿을 300μL의 DPBS에 재현탁시킨 후 얼음 위에 보관합니다.
- 그림 5와 같이 유세포 분석으로 분석합니다. 예상 결과는 대부분의 CAR Tregs가 FOXP3+HELIOS+ 셀이 될 것이라는 것입니다. CD4+ Tconv 세포를 FOXP3 및 HELIOS 염색에 대한 음성 대조군으로 사용합니다.
7. 인간적인 CAR Treg 억제
- Responder T cell (Tresp) 세포 미량 염료 염색 및 하룻밤 활성화
- 확장된 CAR Treg 세포, 새로 분리된 CD4+ Tconv 세포 및 새로 분리된 CD8+ T 세포를 별도의 15mL 코니컬 튜브에 수집하고 아직 제거하지 않은 경우 anti-CD3/CD28 bead를 디비드합니다.
- 5.1단계에서 설명한 대로 조사된 CAR 항원 발현 표적 세포를 준비합니다.
- 활성화되지 않은 T 세포 및 방사선 조사된 표적 세포 농도를 측정합니다.
- 5 × 106 CD4+ Tconv 세포를 5 × 106 CD8+ T 세포(1:1 비율)와 결합합니다. 이들은 분석에서 CAR Tregs에 의해 억제되는 반응 T 세포(Tresp) 입니다. RT에서 5분 동안 500× g 의 Tresp 세포를 스핀합니다. 상등액을 조심스럽게 흡인하고 Tresp 세포를 DPBS 1mL에 재현탁합니다.
- DMSO에서 재구성된 5mM CellTrace Violet(CTV) 염료 1mL를 DPBS 1mL의 7Tresp 세포 10개에 첨가하여 최종 농도를 5μM CTV로 만듭니다. 37°C의 수조에 20분 동안 넣습니다. 10분에서 부드럽게 소용돌이치며 침전된 CTV를 재분배합니다.
- 예열된 RPMI10 완전 배지 9mL로 세척합니다. 500 × g 에서 5 분 동안 회전합니다. 예열된 RPMI10 완전 배지 5mL에 재현탁합니다.
- CTV 표지 Tresp 세포 농도를 측정합니다. 최소 증식 제어로 96웰 라운드 바닥 플레이트의 3-6웰에 있는 200μL의 RPMI10 배지에 5 × 104 CTV 표지 된 비활성화 Tresp 세포를 추가합니다.
- RPM10 배지에서 IL-2가 없는 1:10 비드 대 Tresp 세포 비율 로 anti-CD3/CD28 beads로 CTV 표지 Tresp 세포를 활성화합니다. 조직 배양 인큐베이터에서 24웰 플레이트의 웰당 1mL의 RPMI10 배지에 10개의6 CTV 표지 Tresp 세포를 하룻밤 동안 분주합니다.
- 동시에 106 CAR+ Tregs를 얻습니다. 이 금액은 96웰 라운드 바텀 플레이트 웰당 5 × 104 타겟 셀에서 5 × 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 105 CAR Tregs의 4개 CAR Treg 활성화 조건: 방사선 조사된 CAR 항원 음성 타겟 세포(음성 대조군, no activation) 및 방사선 조사된 CAR 항원 양성 표적 세포(실험, CAR 활성화)를 조사했습니다.
- 3 × 105 CAR Tregs를 2개의 별도 15 mL 원뿔형 튜브에 3 × 105 조사된 CAR 항원 음성 세포(1:1 비율) 및 3 ×× 105 CAR 항원 양성 표적 세포(1:1 비율)와 결합하고 500 × g에서 RT에서 5분 동안 회전합니다. 상등액을 조심스럽게 흡인합니다.
- 7.1.10단계에서 각 튜브의 펠릿을 예열된 RPMI10 배지 600μL에 재현탁합니다. 그 결과 1:1 Treg: Tresp 3회 각각에 대해 200μL가 생성됩니다. 다음과 같이 96웰 둥근 바닥 플레이트에서 연속 희석을 수행합니다.
- 준비된 600μL의 Treg + 타겟 세포 현탁액에서 200μL의 세포 현탁액을 3개의 1:1 비율 웰 각각에 피펫으로 주입합니다.
- 예열된 RPMI10 완전 배지 100μL를 빈 1:2, 1:4 및 1:8 비율 웰 각각에 추가합니다.
- 각 삼중주에 대해 1:1 웰에서 관련 1:2 비율 웰로 세포 현탁액 100μL를 피펫팅합니다.
- 각 트리플리케이트에 대해 1:2 웰에서 관련 1:4 비율 웰로 세포 현탁액의 100μL를 피펫팅합니다.
- 각 트리플리케이트에 대해 1:4 웰에서 관련 1:8 비율 웰로 세포 현탁액의 100μL를 피펫팅합니다.
- 1:8 비율 웰에서 남은 100μL의 세포 현탁액을 폐기물 용기에 피펫팅합니다.
참고: 각 웰에는 5 ×10 4 (1:1), 2.5 × 104 (1:2), 1.25 × 104 (1:4) 또는 0.625 × 104 (1:8) CAR Tregs와 동일한 수의 방사선 조사된 표적 세포가 있는 100μL의 세포 현탁액이 포함되어야 합니다.
- CAR Treg 및 Tresp 세포 공동 배양
- 활성화 후 16-18시간 후, 24웰 플레이트에서 활성화된 Tresp 세포를 원뿔형 튜브로 수집하고 자석을 통해 anti-CD3/CD28 비드를 제거합니다.
- 디비드된 CTV 표지 Tresp 세포 수를 측정합니다.
- 세척하고 2 × 106 Tresp 세포를 500 × g 에서 5 분 동안 탈수합니다. 상층액을 조심스럽게 흡인합니다. 4mL의 RPMI10 완전 배지에 세포를 재현탁합니다.
- 최대 증식 제어를 위해 CAR Tregs를 사용하여 각 웰에 100μL의 T 세포 현탁액(5개 × 10개의4T 세포)을 추가하고, 100μL의 RPMI10 배지만 있는 3-6개의 웰에 추가합니다. 플레이트를 37°C, 5% CO2 조직 배양 인큐베이터에 72시간 동안 놓습니다.
참고: 96웰 둥근 바닥 플레이트에는 이제 활성화되지 않은 Tresp 세포만 있는 3-6개의 웰(최소 증식 제어), 활성화된 Tresp 세포만 있는 3-6개의 웰(최대 증식 제어) 및 CAR Tregs의 수가 감소하는 동안 활성화된 Tresp 세포가 있습니다.
- 유세포 분석 판독
- 각 96웰 원형 바닥 플레이트의 내용물을 재현탁하고 라벨이 부착된 FACS 튜브로 옮깁니다. 또는 플레이트 판독 모드가 있는 유세포 분석기를 사용할 수 있는 경우 96-well V-bottom 플레이트로 옮깁니다. 500 × g 에서 5 분 동안 회전합니다.
- 그 동안 DPBS, anti-human CD4 PE/Cy7 1:200 및 anti-human CD8 PerCP 1:200이 포함된 항체 마스터 믹스를 준비합니다. 각 샘플에는 100μL의 항체 마스터 믹스가 필요합니다.
- 세포 펠릿을 부드럽게 와류로 만듭니다. 각 FACS 튜브에 100μL의 항체 마스터 믹스를 피펫으로 주입합니다. 잠시 소용돌이치고 어둠 속에서 30분 동안 4°C에서 배양합니다.
- 500μL의 DPBS로 세척합니다. 96웰 V-바닥을 사용하는 경우 100μL의 DPBS로 2x 세척합니다. 500 × g 에서 5 분 동안 회전합니다. 상층액을 디캔팅하고 세포 펠릿을 200μL의 DPBS에 재현탁시킨 다음 어두운 곳에서 얼음 위에 튜브를 보관합니다.
- 그림 6과 같이 유세포 분석으로 분석합니다. 예상되는 결과는 균일하고 높은 CTV 형광 피크를 나타내기 위해 비활성화 Tresp 세포 단독으로(최소 증식), 각 세포 분열(최대 증식)에 해당하는 CTV 강도의 여러 피크를 표시하는 활성화된 Tresp 세포단독으로, CTV 피크의 수와 높이의 감소를 나타내는 활성화된 CAR Tregs가 있는 상태에서 활성화된 CD4+ 및 CD8+ T 세포, 따라서 확산됩니다.
- Treg 세포 매개 억제를 다음과 같이 계산합니다.
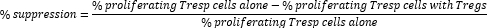
참고: FlowJo 소프트웨어를 사용하는 경우 세포 증식 모델링을 사용하여 각 샘플에 대한 분할 지수(DI)를 계산하고 위 공식에서 증식 세포의 백분율 대신 DI를 사용하여 억제 백분율을 계산할 수도 있습니다.
결과
여기에 설명된 프로토콜은 자가면역 질환, 이식편대숙주질환, 장기 이식 거부 반응 및 알레르기에 대한 살아있는 치료제를 만드는 것을 목표로 인간 조절 T 세포(Tregs)에서 새로운 키메라 항원 수용체(CAR) 구조를 평가하기 위한 간소화되고 표준화된 파이프라인을 제공합니다. 그림 1은 생체 외 확장 후 Treg 계통 전사 인자 FOXP3 및 HELIOS의 높은 ?...
토론
이 프로토콜은 인간 키메라 항원 수용체 조절 T 세포(CAR Tregs)를 생성하고 평가하기 위한 간소화되고 포괄적인 방법론을 제공합니다. 혈액암 치료에 대한 CAR 기술의 성공은 T 세포의 면역 억제 하위 집합인 Tregs에 적용되도록 영감을 주었습니다. 기존 T 세포와 달리 Tregs는 면역 반응을 억제하여 자가면역 질환, 장기 이식 거부 반응, 이식편대숙주병, 알레르기와 같은 원치 ?...
공개
LMRF는 발명자이며 조작된 면역 세포에 대한 특허로 로열티를 받았으며 Guidepoint Global 및 McKesson에 컨설팅을 제공하고 있습니다. 나머지 저자는 경쟁 이해관계가 없음을 선언합니다.
감사의 말
LMRF는 HIRN(Human Islet Research Network) Emerging Leader in Type 1 Diabetes Grant U24DK104162-07, ACS(American Cancer Society) Institutional Research Grant IRG-19-137-20, South Carolina Clinical and Translational Research(SCTR) 파일럿 프로젝트 Discovery Grant 1TL1TR001451-01, DRC(Diabetes Research Connection) Grant IPF 22-1224 및 Swim Across America Grant 23-1579의 지원을 받습니다. RWC는 세포, 생화학 및 분자 과학 교육 보조금 T32GM132055 and Hollings Cancer Center Lowvelo Graduate Fellowship의 지원을 받습니다. 이 연구는 사우스캐롤라이나 의과대학 Hollings Cancer Center의 유세포 분석 및 세포 분류 공유 리소스(P30 CA138313)의 일부 지원을 받았습니다. CAR 돌연변이 플라스미드를 선물해 주신 UCSF(University of California, San Francisco)의 Qizhi Tang 박사에게 특별한 감사를 드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
참고문헌
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유