需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人嵌合抗原受体调节性 T 细胞的产生
摘要
该方案提供了一个简化的工作流程来生成和测试人嵌合抗原受体调节性 T 细胞 (CAR Tregs)。
摘要
嵌合抗原受体 (CAR) T 细胞疗法重塑了癌症治疗的面貌,使以前无法治愈的血液系统癌症的缓解率创下纪录。这些成功激发了人们对使 CAR 平台适应主要负责调节和抑制免疫反应的 CD4+ T 细胞的一个小而关键的亚群的兴趣,即调节性 T 细胞 (Tregs)。将 Tregs 的免疫抑制活性重定向到任何细胞外靶标的能力对于创建自身免疫性疾病、器官移植排斥反应和移植物抗宿主病的细胞疗法具有巨大意义。在这里,我们详细描述了从人外周血中分离 真正的 Treg 的方法,利用慢病毒或 CRISPR/Cas9 辅助敲入使用腺相关病毒介导的同源定向修复 (HDR) 模板递送对人 Treg 进行基因修饰,以及稳定人 CAR Treg 的 离体 扩增。最后,我们描述了人类 CAR Treg 表型稳定性和 体外 抑制功能的评估,这为人类 CAR Treg 在临床前和临床应用中的行为提供了见解。
引言
嵌合抗原受体 (CAR) T 细胞疗法彻底改变了血液系统恶性肿瘤的治疗,在以前无法治疗的癌症中实现了非常高的缓解率 1,2。使用 CAR T 细胞治疗胶质母细胞瘤 3,4,5 的早期结果令人鼓舞,凸显了 CAR 技术的多功能性和针对多种恶性肿瘤的未来潜力。随着该领域探索 CAR 的进一步应用,调节性 T 细胞 (Treg) 已成为一种很有前途的细胞类型。Treg 在维持免疫稳态和通过多种机制调节免疫应答方面起着至关重要的作用,包括隔离 IL-2、分泌免疫抑制性细胞因子和调节抗原呈递细胞 6,7。
借助 CAR 技术,Tregs 可用于治疗器官移植排斥反应、自身免疫性疾病以及过敏和哮喘等炎症性疾病 6,8,9。CAR Tregs 可以通过减少免疫抑制药物的使用来显着改善患者的预后和生活质量,免疫抑制药物会抑制整个免疫系统并与有害副作用相关10,11。临床前模型在将 CAR 技术转化为 Tregs 方面显示出有希望的结果,在 1 型糖尿病、多发性硬化症、移植物抗宿主病和炎症性肠病等疾病中取得了成功应用 9,12,13,14,15。在临床上,目前正在探索 CAR Tregs 以防止实体器官移植排斥反应16。
本文介绍了生成人嵌合抗原受体调节性 T 细胞 (CAR Tregs) 的详细方法。该方案涉及从人外周血中分离 Treg,并使用慢病毒转导和使用 CRISPR/Cas9 基因编辑和腺相关病毒 (AAV) 载体的精确基因敲入等技术对其进行基因修饰。我们还描述了对这些工程化 Treg 的表型稳定性和抑制功能的评估,这是验证其治疗潜力的关键步骤 17,18,19。这种方法简化了 CAR Treg 疗法的设计和早期测试,这些疗法有可能扩大 CAR T 细胞疗法的变革性影响以调节免疫系统。通过分享我们的方法,我们希望激发蓬勃发展的 CAR Treg 治疗领域的进一步研究和创新 9,20。
研究方案
1. 人 Treg 分离
- Leukopak 加工
- 将 leukopak 的内容物转移到 50 mL 锥形管中。用移液管轻轻混合,加入等体积的 Dulbecco 磷酸盐缓冲盐水 (DPBS) + 2% 胎牛血清 (FBS)。
- 在室温 (RT) 下以 300 × g 离心 10 分钟。小心吸出上清液。在 2 mL DPBS + 2% FBS 中重构细胞沉淀。用移液管以 4:1 的比例向细胞悬液中加入 8 mL 氯化铵溶液,轻轻倒置混合,并在冰上裂解剩余的红细胞 15 分钟。
- 在 RT 下以 300 × g 离心 10 分钟。小心吸出上清液。加入 30 mL DPBS + 2% FBS 洗涤细胞。关闭制动器,在 RT 下以 150 × g 旋转洗涤的细胞 10 分钟。小心吸出上清液。将细胞沉淀重悬于 30 mL DPBS + 2% FBS 中。
- 用台盼蓝以 1:1 的比例计数现在分离的外周血单核细胞 (PBMC)。
- 由于细胞浓度高,最初用 DPBS 以 1:100 的比例稀释 10 μL 细胞;然后,将 10 μL 的 1:100 稀释细胞与 10 μL 台盼蓝溶液混合,进行最终的 1:1 稀释。使用自动细胞计数仪时,通过将报告的浓度乘以 100 来校正细胞计数以反映 200 倍稀释度,因为大多数计数仪都假设稀释度为 2 倍。预计从 1/10 白细胞包中产生 1-2.5 ×10 9 PBMC。
- CD4 + T 细胞分离(阴性选择)
- 在 RT 下以 500 × g 离心 10个 8-10 9 个 PBMC 5 分钟,然后以 5 × 107 个细胞/mL 的浓度重悬于细胞分离缓冲液 (DPBS + 1 mM EDTA + 2% FBS) 中。
注:为了获得足够的人类 Treg 进行基因修饰,我们建议从 1 × 10个 9 PBMC 开始。 - 根据制造商对 CD4 + T 细胞富集试剂盒的说明进行磁性分离。
- 通过台盼蓝(10 μL 细胞 + 10 μL 台盼蓝)计数来确定分离的 CD4 + T 细胞的量。
- 在 RT 下以 500 × g 离心 10个 8-10 9 个 PBMC 5 分钟,然后以 5 × 107 个细胞/mL 的浓度重悬于细胞分离缓冲液 (DPBS + 1 mM EDTA + 2% FBS) 中。
- CD8+ T 细胞分离(阴性选择)
- 在 RT 下以 500 × g 离心 5 ×10 7 个 PBMC 5 分钟。以 5 × 107 个细胞/mL 的浓度重悬于细胞分离缓冲液 (DPBS + 1 mM EDTA + 2% FBS) 中。
注:我们建议从 5 × 107 PBMC 开始,以获得 2-5 × 106 CD8+ T 细胞。 - 根据制造商对 CD8 + T 细胞富集试剂盒的说明进行磁性分离。
- 通过台盼蓝计数(10 μL 细胞 + 10 μL 台盼蓝)确定分离的 CD8 + T 细胞的数量。
- 在 RT 下以 500 × g 离心 5 ×10 7 个 PBMC 5 分钟。以 5 × 107 个细胞/mL 的浓度重悬于细胞分离缓冲液 (DPBS + 1 mM EDTA + 2% FBS) 中。
- Treg 荧光辅助细胞分选 (FACS)
- 如步骤 1.2 中所述分离 CD4 + T 细胞,并在第二天将它们储存在含有 2% FBS 的 DPBS 中过夜,在 4 °C 下(细胞数量和活力损失最小)用于 FACS。通过台盼蓝(10 μL 细胞 + 10 μL 台盼蓝)计数,确定步骤 1.2 中 CD4 + T 细胞的数量。
- 以 500 × g 离心 CD4 + 细胞 5 分钟。在 200 μL DPBS 中重构细胞。
- 每 1 × 10个 6 个细胞中,加入 1 μL 抗人 CD4 FITC、1 μL 抗人 CD25 APC 和 1 μL 抗人 CD127 PE。轻轻涡旋并置于 4 °C 黑暗冰箱中 30 分钟。
- 用 10 mL 含 2% FBS 的 DPBS 洗涤细胞。以 500 × g 离心 5 分钟。在含 2% FBS 的 DPBS 中以 1.5 ×10 7 个细胞/mL 的速度轻轻重悬染色细胞。这是推荐通过荧光激活细胞分选 (FACS) 进行分选的细胞浓度。
- 将染色的细胞悬液穿过 40 μm 过滤帽进入 FACS 管中,然后将管保持在冰上。
- 准备 15 mL 收集管,其中包含 3 mL RPMI10 培养基,并置于冰上。
注:该培养基由 RPMI1640 基础培养基、10% FBS、1x 青霉素-链霉素、1x L-丙氨酰-L-谷氨酰胺、1x 非必需氨基酸、1x 丙酮酸钠和 1x HEPES 组成。 - 使用 FACS 对 CD4 + CD25高CD127 调节性 T 细胞 (Treg) 和 CD4 + CD25低CD127 + 常规 T 细胞 (Tconv) 进行排序,如图 1A 所示。
- 确定细胞产量和活力;然后进行下游分析或 T 细胞活化。
2. T 细胞活化
- 用台盼蓝(10 μL 细胞 + 10 μL 台盼蓝)计数分离的 T 细胞。
- 每获得 1 × 10个 T 细胞洗涤 25 μL 抗 CD3/CD28 珠子(106 个珠子),保持珠子与 T 细胞的 1:1 比例。通过添加 DPBS 洗涤抗 CD3/CD28 微珠,在磁力架上孵育 3 分钟,并去除现已稀释的抗 CD3/CD28 微珠缓冲液,该缓冲液可能对细胞有毒。
- 从磁力架上取下试管,将洗涤后的珠子重悬于 RPMI10 培养基中,以获得 1 ×10 6 个珠子/1 mL RPMI10。
- 在 RPMI10 培养基中用抗 CD3/CD28 微珠重悬 T 细胞,浓度为 1 ×10 6 个 T 细胞/mL。然后,向 Treg 细胞中添加 1,000 IU/mL 的 IL-2,向 CD4+ Tconv 细胞中添加 100 IU/mL 的 IL-2,向 CD8+ T 细胞中添加 300 IU/mL 的 IL-2。
- 以 1 ×10 个 6 个细胞的 24 孔板培养 T 细胞,其中含有不同量的抗 CD3/CD28 珠子和 IL-2。将 24 孔板置于 37 °C、5% CO2 组织培养箱中。
- 在 IL-2 存在下,活化的 T 细胞扩增 9-12 天,直至用于实验或用抗 CD3/CD28 微珠重新激活以进行进一步扩增。每 2-3 天更换一次培养基,每次加入新鲜培养基时添加 IL-2。在扩增过程中,通过计数细胞或在分裂前目视检查,将 Treg 的细胞密度保持在 5 × 105 至 10 ×6 个细胞/mL。
3. 人 Treg 慢病毒转导
- 激活后 48 小时重悬并计数 Tregs。在 RT 下以 500 × 离心 5 分钟。用 1,000 IU/mL 的 IL-2 以 1.25 ×10 6 个细胞/mL 的速度重悬 RPMI10 中的 Tregs。
- 将离心机预热至 32 °C。
- 在冰上解冻含有慢病毒的 CAR 构建体。
注:我们储存了一次性慢病毒等分试样,其中包含足够的慢病毒,可在 -80 °C 下以 1 的 MOI 转导 2.5 × 105 个细胞。 - 在微量离心管中,将每个慢病毒等分试样加入 2.5 × 105 个 Tregs 的 200 μL 中,每个试管指示一个反应。在 32 °C 下以 1,000 × g 接种 1 小时。
- 将每个 200 μL 反应物移至 24 孔板中。确保介质覆盖整个孔。将 24 孔板与转导的 Treg 在组织培养箱中孵育过夜(16-18 小时)。用 RPMI10 培养基将每个孔加满至 2 mL,最终 IL-2 浓度为 1,000 IU/mL。
- 活化后 9-12 天继续扩增转导的 Treg,方法是分裂细胞并根据需要补充新鲜的预热 RPMI10 和 IL-2(每 2-3 天)。理想的细胞浓度为 5 × 105-1 × 106 个细胞/mL。
- 使用流式细胞术评估基因修饰效率,如图 2 所示。
注:我们的慢病毒 CAR 构建体在 CAR 基因的 N 端包含一个 Myc 标签和一个通过 2A 肽与 CAR 基因连接的 GFP 报告基因,允许在没有抗体染色 (GFP) 的情况下定量转导效率并确认 CAR 表面表达 (Myc-tag)。我们在转导后 5 天评估基因修饰效率。转导效率可在 30% 到 70% 之间变化,具体取决于供体和所使用的 CAR 构建体。如果需要,可以对 CAR+ 细胞进行排序。 - 确保修饰的 Tregs 完成其激活周期(9-12 天)并在没有 IL-2 的情况下休息 24 小时,然后再用于任何实验。
4. CRISPR/Cas9 介导的人 Treg 基因敲入
- 重悬 Tregs 并在激活后 48 小时转移到 15 mL 锥形管中。将细胞悬液在磁铁中孵育 3 分钟。
- 在磁力架中,通过移液管将培养基中的细胞转移到新管中。抗 CD3/CD28 微珠将保持附着在管壁上。去除珠子后,让去珠的 Treg 在 RPMI10 中静置 2 小时,以从去珠的直接压力中恢复,提高未来的转导效率和电穿孔恢复率。
- 用台盼蓝数去珠的 Tregs。
- 将不含 FBS 的减血清培养基预热至 37 °C。
- 用 2.5 mL 不含 抗生素(青霉素-链霉素)的 RPMI10 培养基和每孔 1,000 IU/mL IL-2 制备一个 6 孔板。在组织培养箱中将板预热至 37 °C。
- 在冰上解冻含有腺相关病毒 (AAV) 的 CAR 同源定向修复 (HDR) 模板。
注:我们储存了一次性等分试样,其中包含足够的 AAV,可在 -80 °C 下以 20,000 的 MOI 感染 4 × 106 个细胞。 - 以 500 × g 离心 Tregs 5 分钟。倾析上清液后,以 4 × 107 个细胞/mL 的浓度重悬于预热的减血清培养基中。
- 将细胞分装在 100 μL 低蛋白结合的 1.5 mL 离心管中。向每个样品中加入 MOI 为 20,000 的 CAR AAV 并重悬。将反应管在组织培养箱中孵育 1 小时。
- 在 1 小时孵育期间,通过将 8.3 μL Cas9 蛋白(1 mg/mL 原液)缓慢加入到 2.5 μL 靶向 TRAC 基因位点(100 μM 原液)的 sgRNA 中,制备和组装 CRISPR/Cas9 核糖核蛋白 (RNP) 复合物,Cas9 与 sgRNA 的摩尔比为 1:1,每个样品的总 RNP 体积为 10.8 μL。轻轻上下吹打以混合。将 RNP 混合物在组织培养箱中于 37°C 孵育 15 分钟。
注意:RNP 复合物可以在之后保持在 RT 中,直到准备好使用。 - 用 3 mL 高渗透压电穿孔缓冲液填充新的电穿孔管(E 管)。将装满的 E 管插入电穿孔系统的移液器站,直到听到咔嗒声。在电穿孔系统中将电穿孔条件设置为 2,200 V、20 ms、1 个脉冲 。
- 与 AAV 孵育 1 小时后,在 RT 下用 AAV 以 300 × g 离心细胞 5 分钟。小心吸出上清液,并将细胞沉淀重悬于每个样品由 100 μL 电穿孔系统提供的细胞重悬缓冲液中。
注意:快速工作,避免将细胞留在缓冲液中超过 15 分钟。避免产生气泡。 - 每个样品添加 10.8 μL RNP 复合物。用移液器充分混合,不要产生气泡。
- 将移液器推至第二个止动点以打开夹具,插入 100 μL 电穿孔吸头。将移液器的顶部头放入电穿孔吸头中,直到夹具与活塞的安装杆牢固啮合。逐渐松开按钮,同时保持对移液器的向下压力,以确保吸头紧贴,没有任何间隙。
- 将移液器按至第一个停止点,然后将电穿孔尖端浸入细胞-RNP 混合物中。轻轻地将样品拉入移液器中,没有任何气泡。
注意:电穿孔过程中,吸头内不能出现气泡。 - 将装有样品的电穿孔吸头的移液器垂直插入 E 管,直到听到咔嗒声。避免产生气泡。
- 确认已输入人类 Treg 的最佳设置(2,200 V、20 ms、1 个脉冲),然后按 触摸屏上的开始 对细胞进行电穿孔。
- 电穿孔完成后,等待触摸屏显示 Complete 。轻轻移开移液器,立即将样品转移到准备好的 6 孔板中,该板含有 2.5 mL 预热、不含抗生素的 RPMI10 培养基,每孔含有 1,000 IU/mL IL-2。对剩余的样品重复此作。以线性运动(从左到右,从上到下)轻轻摇动板,以确保细胞在每个孔中均匀分布,然后将其放入组织培养箱中。
注:如果使用相同的细胞和 RNP 复合物,则重复使用电穿孔针头的次数最高可达 3 倍。在计数细胞或以任何方式干扰它们之前,请等待 30 分钟的恢复期,例如如果需要,添加 HDR 增强剂。 - 第二天,16-18 小时后,用含抗生素的培养基更换培养基,用台盼蓝计数电穿孔的 Tregs,并以 106 个细胞/mL 的浓度用 1,000 IU/mL IL-2 培养。如步骤 2.6 所述,通过分裂细胞并补充新鲜的 RPMI10 和 IL-2 来继续扩增电穿孔的 Treg。
- 将样品放在冰上,以便通过流式细胞术进行分析。
- 设置单色补偿对照并应用于实验文件。
- 首先读取未染色的样品以调整 FSC 和 SSC 增益,使淋巴细胞群位于"所有事件"点图的中间。
- 设置淋巴细胞进入非碎片/单细胞进入活细胞进入 CD4 + 细胞的门控策略,如图 3C 所示。
- 使用流式细胞术评估基因修饰效率。
注意:除了 TRAC 基因座同源臂外,我们的 AAV CAR 构建体还包含一个截短的表皮生长因子受体 (EGFRt) 报告基因,该基因通过 2A 肽与 CAR 基因相连,如图 3 所示。基因敲入效率由 CD3 的表面染色决定,CD3 的缺失表明 TCR 表面表达缺失,因此,CRISPR/Cas9 和 EGFRt 成功靶向 TRAC 基因座,其表达表明 CAR 转基因的成功整合。CAR 敲入调节性 T 细胞是 CD3-EGFRt+ 细胞。我们在电穿孔后 5 天评估基因修饰效率。 - 确保修饰的 Treg 完成其激活周期(9-12 天)并在不存在 IL-2 的情况下休息 24 小时,然后再用于任何实验。
5. 人 CAR Treg 激活
- 共培养设置(第 0 天)
- 将表达 CAR 抗原的靶细胞系收集到锥形管中。
注:我们使用 K562 细胞(一种缺乏 HLA、CD80 和 CD86 表达的人髓系白血病细胞系)作为 CAR Treg 激活的靶细胞。亲本 K562 细胞用作阴性对照,表达 CAR 抗原的 K562 用于激活 CAR Tregs17,21。 - 在 Cesium-137 或 X 射线辐照器中用 4,000 rad 照射目标细胞系。如果无法接触辐照器,则进行丝裂霉素 C 处理以阻止细胞增殖,同时保持靶细胞中的表面抗原表达22。
- 如果尚未这样做,则通过重悬与抗 CD3/CD28 珠子结合的 Treg 并将其转移到 15 mL 锥形管中来去除 Treg。将细胞悬液在磁铁中孵育 3-5 分钟。当仍在磁力架中时,通过移液管将培养基中的细胞转移到新管中;抗 CD3/CD28 微珠将保持附着在管壁上。
- 用台盼蓝测定照射的靶细胞和去珠的 CAR Treg 浓度。
- 以 500 × g 离心辐照的靶细胞和 CAR Tregs 5 分钟。用预热的 RPMI10 以 106 个细胞/mL 的浓度重悬于单独的试管中。将 IL-2 添加到 CAR Tregs 中,浓度为 2,000 IU/mL。
注:一旦 CAR Treg 与靶细胞结合,该量的 IL-2 将被稀释 2 倍,最终 IL-2 浓度为 1,000 IU/mL。 - 将 1 ×10 5 个 CAR 调节性细胞 (100 μL) 与 1 ×10 5 (100 μL) CAR 抗原阴性、辐照靶细胞(活化阴性对照)、1 × 10个 5 (100 μL) CAR 抗原阳性、辐照靶细胞(实验)或 2.5 μL 抗 CD3/CD28 珠(活化阳性对照)和 97.5 μL RPMI10 培养基共培养在 96 孔圆底板中。将板置于 37 °C、5% CO2 组织培养箱中 48 小时。
注:每孔的最终体积为 200 μL。确保每个条件都有 3 次重复。
- 将表达 CAR 抗原的靶细胞系收集到锥形管中。
- 流式细胞术读数
- 除非使用读板器,否则从 96 孔圆底板中重悬每个孔的内容物,并将它们转移到 FACS 管中。以 500 x g 离心 5 分钟。倒出上清液并轻轻涡旋细胞沉淀。
- 制备流式细胞术抗体预混液:100 μL/样品,含有 DPBS、抗人 CD4 PE/Cy7 1:200、抗人 CD71 PE 1:100 和 Ghost Viability Dye BV510 1:2000。
注:如果 CAR 报告基因是 GFP,则此面板效果很好。例如,如果报告基因编码需要抗体染色的表面蛋白,例如 EGFRt,则可以使用 FITC 偶联抗体。 - 将 100 μL 抗体预混液移液到每个样品中,轻轻混合,并在 4 °C 冰箱中孵育 30 分钟。
- 用 500 μL DPBS 以 500 × g 旋转 5 分钟洗涤。将细胞沉淀重悬于 200 μL DPBS 中。
- 将样品放在冰上,以便通过流式细胞术进行分析。
- 设置单色补偿控制并应用于实验流程文件。
- 读取未染色的样品以调整 SSC 和 FSC 增益,使淋巴细胞群位于"所有事件"点图的中间。
- 设置淋巴细胞进入非碎片/单细胞进入活细胞进入 CD4 + 细胞的门控策略,如图 3C 所示(使用不同的荧光团)。
- 以大约 1,500 个事件/秒的事件速率读取样本,以评估 Treg 激活。
注意:预期结果是在 CAR 抗原存在下 CAR Tregs 中 CD71 表面表达上调,如图 4 所示。如果在 CAR 抗原存在下未观察到上调,则可能存在强直信号。
6. 人 CAR Treg 稳定性
- 共培养设置和扩展(第 0-9 天)
- 设置共培养物以激活 CAR Tregs,如步骤 5.1 中所述。
- 48 小时后,将共培养物从每个 96 孔圆底板孔转移到含有预热的 2 mL RPMI10 和 1,000 IU/mL IL-2 的 24 孔板孔中,以允许细胞扩增。
- 加入新鲜预热的 RPMI10 和 1,000 IU/mL IL-2 并根据需要分成额外的 24 孔板。
- 流式细胞术读数
- 重悬并将每个重复的内容物转移到 15 mL 或 50 mL 锥形管中。测定细胞浓度。
- 将 5 × 105 和 1 × 106 个细胞转移到 FACS 管中,进行每个重复。以 500 × g 离心 5 分钟。
- 制备用于表面染色的流式细胞术抗体预混液:100 μL/样品,含有 DPBS、抗人 CD4 PE/Cy7 1:200、抗人 CD25 APC 1:200 和 Ghost Viability Dye BV510 1:2000。如果需要,包括 CAR 报告蛋白的 FITC 偶联抗体。
- 倒出步骤 6.2.2 中的上清液,并轻轻涡旋细胞沉淀。将 100 μL 表面染色抗体预混液移液到每个 FACS 管中。短暂涡旋并置于 4 °C 冰箱中避光 30 分钟。
- 使用转录因子染色缓冲液组,通过将 3 体积的固定/透化稀释剂添加到 1 体积的固定/透化浓缩液中来制备固定/透化缓冲液。每个样品需要 100 μL 固定/透化缓冲液。
- 用 500 μL DPBS 洗涤表面染色的细胞。以 500 × g 离心 5 分钟,倒出上清液。将 100 μL 准备好的固定/透化缓冲液移液到每个试管中。短暂涡旋,并在 4 °C 下在黑暗中固定 30-60 分钟。
- 使用转录因子染色缓冲液组,通过将 9 体积的蒸馏水添加到 1 体积的 10x 透化缓冲液中来制备 1x 透化缓冲液。每个样品需要 1,000 μL 透化缓冲液进行洗涤,需要 100 μL 透化缓冲液用于使用靶向细胞内蛋白的抗体进行染色。
- 通过添加 500 μL 的 1x 透化缓冲液来洗涤固定/透化细胞。在 RT 下以 500 × g 旋转 5 分钟。
- 用 1x 透化缓冲液、抗人 FOXP3 eFluor 450 1:50、抗人 HELIOS PE 1:50 和抗人 CTLA-4 PerCP-e710 1:50 制备细胞内染色抗体预混液。每个样品需要 100 μL 抗体预混液。
注:如果 CAR 报告基因是 GFP 或 CAR 报告基因(例如 EGFRt)用 FITC 偶联抗体染色,则此面板有效。 - 倒出步骤 6.2.8 中的上清液。加入 100 μL 细胞内染色抗体预混液,短暂涡旋,并在室温下避光孵育 30 分钟。
- 通过添加 500 μL 的 1x 透化缓冲液洗涤染色的固定/透化细胞。以 500 × g 离心 5 分钟。倒出上清液,将细胞沉淀重悬于 300 μL DPBS 中,并将其储存在冰上。
- 通过流式细胞术分析,如图 5 所示。预期的结果是大多数 CAR Treg 将是 FOXP3+HELIOS+ 细胞。使用 CD4 + Tconv 细胞作为 FOXP3 和 HELIOS 染色的阴性对照。
7. 人 CAR Treg 抑制
- 应答 T 细胞 (Tresp) 细胞痕量染料染色和过夜活化
- 将扩增的 CAR Treg 细胞、 新鲜分离的 CD4 + Tconv 细胞和 新鲜分离的 CD8 + T 细胞收集到单独的 15 mL 锥形管中,如果尚未完成,则对抗 CD3/CD28 珠子进行去珠。
- 如步骤 5.1 中所述,准备辐照的 CAR 抗原表达靶细胞。
- 测定未活化的 T 细胞和辐照靶细胞浓度。
- 将 5 × 10个 6 CD4+ Tconv 细胞与 5 × 个10 个 6 CD8+ T 细胞(比例为 1:1)混合。这些是检测中被 CAR Treg 抑制的反应 性 T 细胞 (Tresp)。 在 RT 下以 500 × g 离心 Tresp 细胞 5 分钟。小心吸出上清液并将 Tresp 细胞重悬于 1 mL DPBS 中。
- 将 1 mL 在 DMSO 中重构的 5 mM CellTrace Violet (CTV) 染料添加到 1 mL DPBS 中的 107 个 Tresp 细胞中,最终浓度为 5 μM CTV。置于 37 °C 的水浴中 20 分钟。10 分钟时,轻轻涡旋以重新分配沉淀的 CTV。
- 用 9 mL 预热的 RPMI10 完全培养基洗涤。以 500 × g 离心 5 分钟。重悬于 5 mL 预热的 RPMI10 完全培养基中。
- 确定 CTV 标记的 Tresp 细胞浓度。在 96 孔圆底板的 3-6 个孔中,在 200 μL RPMI10 培养基中加入 5 ×10 个 CTV 标记 的未活化 Tresp 细胞,作为最小增殖对照。
- 在 RPM10 培养基中 ,以 1:10 的磁珠与不含 IL-2 的磁珠与 Tresp 细胞比例 ,用抗 CD3/CD28 磁珠激活 CTV 标记的 Tresp 细胞。在组织培养箱中,将 10个 6 个 CTV 标记的 Tresp 细胞分配到 24 孔板的每孔 1 mL RPMI10 培养基中过夜。
- 同时,获得 10 个6 个 CAR+ Treg。该量包括四个 CAR Treg:Tresp 比率的一式三份,1:1、1:2、1:4、1:8,每 96 孔圆底板孔 5 × 104 个 靶细胞,如 5 × 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 105 CAR Treg,在两种 CAR Treg 激活条件下:照射的 CAR 抗原阴性靶细胞(阴性对照、 无激活)和辐照的 CAR 抗原阳性靶细胞(实验,CAR 激活)。
- 将 3 × 105 个 CAR Treg 与 3 × 105 个辐照的 CAR 抗原阴性细胞(1:1 比例)和 3 × 105 个 CAR Treg 与 3 × 105 个辐照的 CAR 抗原阳性靶细胞(1:1 比例)混合在两个单独的 15 mL 锥形管中,并在室温下以 500 × g 旋转 5 分钟。小心吸出上清液。
- 将步骤 7.1.10 中每个试管中的沉淀重悬于 600 μL 预热的 RPMI10 培养基中。因此,每个 1:1 Treg:Tresp 一式三份的加样量为 200 μL。在 96 孔圆底板上进行连续稀释,如下所示:
- 从制备的 600 μL 调节性 T + 靶细胞悬液中,将 200 μL 细胞悬液移液到 3 个 1:1 比例的孔中。
- 将 100 μL 预热的 RPMI10 完全培养基加入每个空的 1:2、1:4 和 1:8 比例孔中。
- 对于每个一式三份,将 100 μL 细胞悬液从 1:1 孔中移液到相关的 1:2 比例孔中。
- 对于每个一式三份,从 1:2 孔中移取 100 μL 细胞悬液到相关的 1:4 比例孔中。
- 对于每个一式三份,从 1:4 孔中移取 100 μL 细胞悬液到相关的 1:8 比例孔中。
- 将剩余的 100 μL 细胞悬液从 1:8 比例的孔中移液到废液容器中。
注:每个孔应含有 100 μL 细胞悬液,其中含有 5 × 104 (1:1)、2.5 × 104 (1:2)、1.25 × 104 (1:4) 或 0.625 × 104 (1:8) CAR Treg 和相同数量的辐照靶细胞。
- CAR Treg 和 Tresp 细胞共孵育
- 激活后 16-18 小时后,将活化的 Tresp 细胞从 24 孔板收集到锥形管中,并通过磁铁去除抗 CD3/CD28 珠子。
- 确定 去珠 CTV 标记的 Tresp 细胞计数。
- 以 500 × g 洗涤并旋转 2 ×10 个 Tresp 细胞 5 分钟。小心吸出上清液。将细胞重悬于 4 mL RPMI10 完全培养基中。
- 向每个孔中加入 100 μL T 细胞悬液(5 ×10 个 4 T 细胞),并单独向 3-6 个孔中加入 100 μL RPMI10 培养基,以实现最大的增殖控制。将板置于 37 °C、5% CO2 组织培养箱中 72 小时。
注:96 孔圆底板现在有 3-6 个孔,仅含未活化的 Tresp 细胞(最低增殖控制),3-6 个孔,仅含活化的 Tresp 细胞(最大增殖控制)和活化的 Tresp 细胞,其中 CAR Treg 数量减少。
- 流式细胞术读数
- 重悬并将每个 96 孔圆底板的内容物转移到标记的 FACS 管中。或者,如果有具有板读取模式的流式细胞仪,则转移到 96 孔 V 形底板。以 500 × g 离心 5 分钟。
- 同时,用 DPBS、抗人 CD4 PE/Cy7 1:200 和抗人 CD8 PerCP 1:200 制备抗体预混液。每个样品需要 100 μL 抗体预混液。
- 轻轻涡旋细胞沉淀。将 100 μL 抗体预混液移液到每个 FACS 管中。短暂涡旋并在 4 °C 下避光孵育 30 分钟。
- 用 500 μL DPBS 洗涤。如果使用 96 孔 V 形底,则用 100 μL DPBS 洗涤 2 次。以 500 × g 离心 5 分钟。倒出上清液,将细胞沉淀重悬于 200 μL DPBS 中,并将试管避光储存在冰上。
- 通过流式细胞术分析,如图 6 所示。预期结果是单独的未活化的 Tresp 细胞(最小增殖)显示均匀的高 CTV 荧光峰,单独的活化 Tresp 细胞显示多个 CTV 强度峰,一个对应于每个细胞分裂(最大增殖),以及活化的 CD4 + 和 CD8+ T 细胞在活化的 CAR Treg 存在下显示 CTV 峰的数量和高度减少, 因此,在增殖中。
- 计算 Treg 细胞介导的抑制如下:
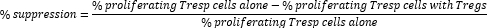
注:如果使用 FlowJo 软件,也可以使用细胞增殖建模来计算每个样品的分裂指数 (DI),并使用 DI 而不是上述公式中增殖细胞的百分比来计算抑制百分比。
结果
此处描述的方案提供了一个简化和标准化的管道,用于评估人类调节性 T 细胞 (Treg) 中的新嵌合抗原受体 (CAR) 构建,旨在为自身免疫性疾病、移植物抗宿主病、器官移植排斥反应和过敏创造活体疗法。 图 1 描述了我们如何使用 FACS 从外周血中获得高纯度的人 Tregs(图 1A),通过离 体 扩增后高水平的 Treg 谱系转录?...
讨论
该方案为生成和评估人嵌合抗原受体调节性 T 细胞 (CAR Tregs) 提供了一种简化而全面的方法。CAR 技术在治疗血液系统癌症方面的成功激发了其应用于 T 细胞的免疫抑制亚群 Tregs。与传统 T 细胞不同,Treg 会抑制免疫反应,为不必要的免疫引起的疾病提供潜在的治疗方法,例如自身免疫性疾病、器官移植排斥反应、移植物抗宿主病和过敏9。利用 CAR Tregs ?...
披露声明
LMRF 是一位发明家,从工程免疫细胞的专利中获得专利费,并为 Guidepoint Global 和 McKesson 提供咨询。其余作者声明没有利益冲突。
致谢
LMRF 由人类胰岛研究网络 (HIRN) 1 型糖尿病新兴领导者资助 U24DK104162-07、美国癌症协会 (ACS) 机构研究资助 IRG-19-137-20、南卡罗来纳州临床和转化研究 (SCTR) 试点项目发现资助 1TL1TR001451-01、糖尿病研究联系 (DRC) 资助 IPF 22-1224 和横跨美国游泳资助 23-1579。RWC 得到了细胞、生化和分子科学培训补助金 T32GM132055 和 Hollings 癌症中心 Lowvelo 研究生奖学金的支持。这项研究部分得到了南卡罗来纳医科大学 Hollings 癌症中心流式细胞术和细胞分选共享资源 (P30 CA138313) 的支持。特别感谢加州大学旧金山分校 (UCSF) 的 Qizhi Tang 博士慷慨赠送 CAR 突变质粒。
材料
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
参考文献
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。