É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de células T reguladoras do receptor de antígeno quimérico humano
Neste Artigo
Resumo
Este protocolo fornece um fluxo de trabalho simplificado para gerar e testar células T reguladoras do receptor de antígeno quimérico humano (CAR Tregs).
Resumo
A terapia com células T do receptor de antígeno quimérico (CAR) reformulou a face do tratamento do câncer, levando a taxas recordes de remissão em cânceres hematológicos anteriormente incuráveis. Esses sucessos estimularam o interesse em adaptar a plataforma CAR a um subconjunto pequeno, mas fundamental, de células T CD4 + responsáveis principalmente por regular e inibir a resposta imune, as células T reguladoras (Tregs). A capacidade de redirecionar a atividade imunossupressora de Tregs para qualquer alvo extracelular tem enormes implicações para a criação de terapias celulares para doenças autoimunes, rejeição de transplante de órgãos e doença do enxerto contra o hospedeiro. Aqui, descrevemos em detalhes metodologias para isolamento genuíno de Treg do sangue periférico humano, modificação genética de Tregs humanos utilizando lentivírus ou knock-in auxiliado por CRISPR / Cas9 usando entrega de modelo de reparo dirigido homólogo mediado por vírus adeno-associado (HDR) e expansão ex vivo de Tregs CAR humanos estáveis. Por fim, descrevemos a avaliação da estabilidade fenotípica do CAR Treg humano e da função supressora in vitro , que fornece informações sobre como o CAR Tregs humano se comportará em aplicações pré-clínicas e clínicas.
Introdução
As terapias com células T do receptor de antígeno quimérico (CAR) revolucionaram o tratamento de neoplasias hematológicas, alcançando taxas de remissão notavelmente altas em cânceres anteriormente intratáveis 1,2. Os primeiros resultados encorajadores usando células T CAR para tratar o glioblastoma 3,4,5 destacam a versatilidade da tecnologia CAR e o potencial futuro para atingir uma ampla gama de malignidades. À medida que o campo explora outras aplicações de CARs, as células T reguladoras (Tregs) surgiram como um tipo de célula promissor. As Tregs desempenham um papel crucial na manutenção da homeostase imunológica e na regulação das respostas imunes por meio de vários mecanismos, incluindo o sequestro de IL-2, a secreção de citocinas imunossupressoras e a modulação de células apresentadoras de antígenos 6,7.
Com a tecnologia CAR, as Tregs podem ser aproveitadas para o tratamento de rejeição de transplante de órgãos, doenças autoimunes e distúrbios inflamatórios como alergias e asma 6,8,9. As CAR Tregs podem levar a melhorias significativas nos resultados e na qualidade de vida dos pacientes, reduzindo o uso de drogas imunossupressoras, que inibem o sistema imunológico como um todo e estão associadas a efeitos colaterais nocivos10,11. Modelos pré-clínicos mostraram resultados promissores na tradução da tecnologia CAR para Tregs, com aplicações bem-sucedidas em doenças como diabetes tipo 1, esclerose múltipla, doença do enxerto contra o hospedeiro e doença inflamatória intestinal 9,12,13,14,15. Na clínica, os CAR Tregs estão sendo explorados para prevenir a rejeição de transplante de órgãos sólidos16.
Este artigo apresenta uma metodologia detalhada para a geração de células T reguladoras do receptor de antígeno quimérico humano (CAR Tregs). Este protocolo envolve isolar Tregs do sangue periférico humano e modificá-los geneticamente usando técnicas como transdução lentiviral e knock-in preciso de genes usando edição de genes CRISPR / Cas9 e vetores de vírus adeno-associados (AAV). Também descrevemos a avaliação da estabilidade fenotípica e da função supressora dessas Tregs projetadas, que são etapas cruciais para validar seu potencial terapêutico 17,18,19. Essa abordagem agiliza o projeto e os testes iniciais das terapias CAR Treg, que têm o potencial de estender o impacto transformador da terapia com células T CAR para regular o sistema imunológico. Ao compartilhar nossa metodologia, esperamos inspirar mais pesquisas e inovações no crescente espaço de terapia CAR Treg 9,20.
Protocolo
1. Isolamento de Treg humano
- Processamento de Leukopak
- Transfira o conteúdo do leucopak para um tubo cônico de 50 mL. Adicione um volume igual de solução salina tamponada com fosfato (DPBS) de Dulbecco + 2% de soro fetal bovino (FBS) misturando suavemente com uma pipeta.
- Gire a 300 × g por 10 min em temperatura ambiente (RT). Aspire cuidadosamente o sobrenadante. Reconstitua o pellet celular em 2 mL de DPBS + 2% FBS. Adicione 8 mL de solução de cloreto de amônio por pipeta à suspensão celular na proporção de 4:1, misture por inversão suave e permita a lise dos glóbulos vermelhos restantes no gelo por 15 min.
- Centrifugar a 300 × g durante 10 min a RT. Aspirar cuidadosamente o sobrenadante. Adicione 30 mL de DPBS + 2% de FBS para lavar as células. Com o travão desligado, centrifugar as células lavadas a 150 × g durante 10 min a RT. Aspirar cuidadosamente o sobrenadante. Ressuspenda o pellet celular em 30 mL de DPBS + 2% FBS.
- Conte as células mononucleares do sangue periférico (PBMCs) agora isoladas com azul de tripano na proporção de 1:1.
- Devido à alta concentração celular, diluir inicialmente 10 μL de células 1:100 com DPBS; em seguida, misture 10 μL das células diluídas a 1:100 com 10 μL de solução de azul de tripano para a diluição final de 1:1. Ao usar um contador de células automatizado, corrija a contagem de células para refletir a diluição de 200 vezes, multiplicando a concentração relatada por 100, pois a maioria dos contadores assume uma diluição de 2 vezes. Antecipe o rendimento de 1-2,5 × 109 PBMC de um leucopak 1/10.
- Isolamento de células T CD4+ (seleção negativa)
- Gire para baixo 108-10 9 PBMCs a 500 × g por 5 min em RT e ressuspenda no tampão de separação de células (DPBS + 1 mM EDTA + 2% FBS) a 5 × 107 células / mL.
NOTA: Para obter Tregs humanos suficientes para modificação genética, recomendamos começar com 1 × 109 PBMCs. - Realize a separação magnética de acordo com as instruções do fabricante para o kit de enriquecimento de células T CD4+ .
- Determinar a quantidade de células T CD4+ isoladas contando com azul de tripano (10 μL de células + 10 μL de azul de tripano).
- Gire para baixo 108-10 9 PBMCs a 500 × g por 5 min em RT e ressuspenda no tampão de separação de células (DPBS + 1 mM EDTA + 2% FBS) a 5 × 107 células / mL.
- Isolamento de células T CD8+ (seleção negativa)
- Gire 5 × 107 PBMCs a 500 × g por 5 min em RT. Ressuspenda no tampão de separação de células (DPBS + 1 mM EDTA + 2% FBS) a 5 × 107 células / mL.
NOTA: Recomendamos começar com 5 × 107 PBMC para obter 2-5 × 106 células T CD8+ . - Realize a separação magnética de acordo com as instruções do fabricante para o kit de enriquecimento de células T CD8+ .
- Determine o número de células T CD8+ isoladas contando com azul de tripano (10 μL de células + 10 μL de azul de tripano).
- Gire 5 × 107 PBMCs a 500 × g por 5 min em RT. Ressuspenda no tampão de separação de células (DPBS + 1 mM EDTA + 2% FBS) a 5 × 107 células / mL.
- Classificação de células assistida por fluorescência Treg (FACS)
- Isole as células T CD4+ conforme descrito na etapa 1.2 e armazene-as durante a noite em DPBS com 2% de FBS a 4 ° C (perda mínima no número de células e viabilidade) para FACS no dia seguinte. Determine o número de células T CD4 + da etapa 1.2 contando com azul de tripano (10 μL de células + 10 μL de azul de tripano).
- Gire as células CD4 + a 500 × g por 5 min. Reconstituir células em 200 μL de DPBS.
- Por 1 × 106 células, adicione 1 μL de FITC CD4 anti-humano, 1 μL de APC CD25 anti-humano e 1 μL de PE CD127 anti-humano. Agite suavemente e coloque na geladeira escura a 4 ° C por 30 min.
- Lave as células com 10 mL de DPBS com 2% de FBS. Centrifugar a 500 × g durante 5 min. Ressuspenda suavemente as células coradas a 1,5 × 107 células/mL em PPBS com 2% de FBS. Esta é a concentração celular recomendada para classificar por meio de classificação de células ativadas por fluorescência (FACS).
- Passe a suspensão de células coradas através de uma tampa de filtro de 40 μm em tubos FACS e, em seguida, mantenha os tubos no gelo.
- Prepare tubos de coleta de 15 mL contendo 3 mL de meio RPMI10 e coloque no gelo.
NOTA: Este meio consiste em RPMI1640 meio basal, 10% FBS, 1x penicilina-estreptomicina, 1x L-alanil-L-glutamina, 1x aminoácidos não essenciais, 1x piruvato de sódio e 1x HEPES. - Classifique as células T reguladoras CD4 + CD25 altas CD127 (Tregs) e as células T convencionais CD4 + CD25baixasCD127 + (Tconv) usando FACS, conforme mostrado na Figura 1A.
- Determinar o rendimento e a viabilidade celular; em seguida, prossiga com a análise a jusante ou ativação de células T.
2. Ativação de células T
- Conte as células T isoladas com azul de tripano (10 μL de células + 10 μL de azul de tripano).
- Lave 25 μL de grânulos anti-CD3 / CD28 (106 grânulos) para cada 1 × 106 células T obtidas, mantendo uma proporção de 1: 1 de grânulos para células T. Lave os grânulos anti-CD3 / CD28 adicionando DPBS, incubando em um ímã por 3 min e removendo o tampão anti-CD3 / CD28 agora diluído, que pode ser tóxico para as células.
- Remova o tubo do ímã e ressuspenda os grânulos lavados no meio RPMI10 para ter 1 × 106 grânulos / 1 mL de RPMI10.
- Ressuspenda as células T com esferas anti-CD3 / CD28 em meio RPMI10 a uma concentração de 1 × 106 células T / mL. Em seguida, adicione 1.000 UI/mL de IL-2 às células Treg, 100 UI/mL de IL-2 às células Tconv CD4+ e 300 UI/mL de IL-2 às células T CD8+ .
- Cultura de células T a 1 × 106 células por poço de uma placa de 24 poços com diferentes quantidades de grânulos anti-CD3/CD28 e IL-2. Coloque a placa de 24 poços em uma incubadora de cultura de tecidos a 37 °C e CO2 a 5%.
- Expanda as células T ativadas por 9-12 dias na presença de IL-2 até serem usadas para experimentos ou reativação com esferas anti-CD3 / CD28 para expansão adicional. Substitua o meio a cada 2-3 dias e adicione IL-2 toda vez que um meio novo for adicionado. Manter a densidade celular das Tregs em 5 × 105 a 1 × 106 células por ml durante a expansão, contando as células ou por inspecção visual antes da divisão.
3. Transdução de Treg lentiviral humano
- Ressuspenda e conte Tregs 48 h após a ativação. Gire a 500 ×g por 5 min em RT. Ressuspenda Tregs em RPMI10 a 1,25 × 106 células / mL com 1.000 UI / mL de IL-2.
- Pré-aqueça a centrífuga a 32 °C.
- Descongele a construção CAR contendo lentivírus no gelo.
NOTA: Armazenamos alíquotas de lentivírus de uso único com lentivírus suficiente para transduzir 2,5 × 105 células a um MOI de 1 a -80 °C. - Adicionar cada alíquota de lentivírus a 2,5 × 105 Tregs em 200 μL num tubo de microcentrífuga, indicando cada tubo uma reacção. Espinar a 1.000 × g durante 1 h a 32 °C.
- Mova cada reação de 200 μL para uma placa de 24 poços. Certifique-se de que a mídia cubra todo o poço. Incubar a placa de 24 poços com as Tregs transduzidas em uma incubadora de cultura de tecidos durante a noite (16-18 h). Complete cada poço até 2 mL com meio RPMI10 com a concentração final de IL-2 sendo 1.000 UI / mL.
- Continue expandindo as Tregs transduzidas 9-12 dias após a ativação, dividindo as células e suplementando com RPMI10 e IL-2 pré-aquecidos frescos conforme necessário (a cada 2-3 dias). A concentração ideal de células é de 5 × 105-1 × 106 células/mL.
- Avalie a eficiência da modificação gênica usando citometria de fluxo, conforme mostrado na Figura 2.
NOTA: Nossas construções lentivirais CAR contêm uma marca Myc no terminal N do gene CAR e um gene repórter GFP ligado ao gene CAR por um peptídeo 2A, permitindo a quantificação da eficiência da transdução sem coloração de anticorpos (GFP) e confirmação da expressão da superfície CAR (Myc-tag). Avaliamos a eficiência da modificação gênica 5 dias após a transdução. As eficiências de transdução podem variar entre 30% e 70%, dependendo do doador e da construção do CAR utilizada. As células CAR+ podem ser classificadas, se desejado. - Certifique-se de que as Tregs modificadas completem seu ciclo de ativação (9-12 dias) e descansem 24 h na ausência de IL-2 antes de serem usadas em qualquer experimento.
4. Knock-in de gene mediado por CRISPR/Cas9 em Tregs humanas
- Ressuspenda as Tregs e transfira para um tubo cônico de 15 mL 48 h após a ativação. Incube a suspensão da célula em um ímã por 3 min.
- Enquanto estiver no ímã, transfira as células do meio via pipeta para um novo tubo. As esferas anti-CD3/CD28 permanecerão presas à parede do tubo. Deixe as Tregs desembaraçadas descansarem em RPMI10 por 2 h após a remoção do grânulo para se recuperar do estresse imediato do desbeading, aumentando a eficiência futura da transdução e a recuperação da eletroporação.
- Conte as Tregs descontadas com azul de tripano.
- Pré-aqueça o meio sérico reduzido sem FBS a 37 °C.
- Prepare uma placa de 6 poços com 2,5 mL de meio RPMI10 sem antibióticos (penicilina-estreptomicina) e com 1.000 UI / mL de IL-2 por poço. Pré-aqueça a placa a 37 °C em uma incubadora de cultura de tecidos.
- Descongele o modelo de reparo dirigido por homologia (HDR) contendo vírus adeno-associado (AAV) no gelo.
NOTA: Armazenamos alíquotas de uso único com AAV suficiente para infectar 4 × 106 células a um MOI de 20.000 a -80 ° C. - Gire Tregs a 500 × g por 5 min. Após a decantação do sobrenadante, ressuspenda as células em meio de soro reduzido pré-aquecido a 4 × 107 células / mL.
- Alíquotas de células em 100 μL em tubos de centrífuga de 1,5 mL de baixa ligação a proteínas. Adicione CAR AAV em um MOI de 20.000 a cada amostra e ressuspenda. Incubar os tubos de reação na incubadora de cultura de tecidos por 1 h.
- Durante a incubação de 1 h, prepare e monte os complexos de ribonucleoproteína (RNP) CRISPR/Cas9 adicionando lentamente 8,3 μL de proteína Cas9 (estoque de 1 mg/mL) a 2,5 μL de sgRNA direcionado ao locus do gene TRAC (estoque de 100 μM) para uma proporção molar de Cas9 para sgRNA de 1:1 e um volume RNP total de 10,8 μL por amostra. Pipete suavemente para cima e para baixo para misturar. Incubar a mistura RNP por 15 min a 37°C na incubadora de cultura de tecidos.
NOTA: Os complexos RNP podem permanecer em RT depois até que estejam prontos para uso. - Encha um novo tubo de eletroporação (tubo E) com 3 mL de tampão de eletroporação de alta osmolaridade. Insira o tubo E cheio na estação de pipeta do sistema de eletroporação até ouvir um clique. Defina as condições de eletroporação para 2.200 V, 20 ms, 1 pulso no sistema de eletroporação.
- Quando a incubação de 1 h com AAV estiver completa, girar as células com AAV a 300 × g por 5 min em RT. Aspirar cuidadosamente o sobrenadante e ressuspender o pellet celular em 100 μL do tampão de ressuspensão celular fornecido pelo sistema de eletroporação por amostra.
NOTA: Trabalhe rapidamente e evite deixar as células no buffer por mais de 15 min. Evite criar bolhas. - Adicione 10,8 μL de complexo RNP por amostra. Misture bem com uma pipeta sem criar bolhas.
- Insira uma ponta de eletroporação de 100 μL empurrando a pipeta até sua segunda parada para abrir o clamp. Posicione a cabeça superior da pipeta na ponta de eletroporação até que o clamp encaixe firmemente na haste de montagem do pistão. Solte gradualmente o botão enquanto mantém a pressão para baixo na pipeta para garantir que a ponta se encaixe perfeitamente sem folgas.
- Pressione a pipeta até a primeira parada e mergulhe a ponta de eletroporação na mistura célula-RNP. Puxe suavemente a amostra para dentro da pipeta sem bolhas.
NOTA: Nenhuma bolha pode estar presente dentro da ponta durante a eletroporação. - Insira a pipeta com a ponta de eletroporação montada contendo a amostra verticalmente no tubo E até ouvir um clique. Evite criar bolhas.
- Confirme se as configurações ideais para Tregs humanas foram inseridas (2,200 V, 20 ms, 1 pulso) e pressione start na tela sensível ao toque para eletroporar as células.
- Aguarde até que a tela sensível ao toque exiba Concluído após a conclusão da eletroporação. Remova suavemente a pipeta e transfira imediatamente a amostra para a placa preparada de 6 poços contendo 2,5 mL de meio RPMI10 pré-aquecido e livre de antibióticos com 1.000 UI/mL de IL-2 por poço. Repita com as amostras restantes. Balance suavemente a placa em movimentos lineares (da esquerda para a direita, de cima para baixo) para garantir uma distribuição uniforme das células em cada poço e coloque-a na incubadora de cultura de tecidos.
NOTA: A reutilização de uma ponta de eletroporação é aceitável até 3x se as mesmas células e complexo RNP estiverem em uso. Aguarde um período de recuperação de 30 minutos antes de contar as células ou perturbá-las de qualquer forma, como adicionar um intensificador HDR, se desejar. - No dia seguinte, 16-18 h depois, substitua o meio por meio contendo antibióticos, conte as Tregs eletroporadas com azul de tripano e cultive a 106 células/mL com 1.000 UI/mL de IL-2. Continue expandindo Tregs eletroporadas dividindo as células e suplementando RPMI10 e IL-2 frescos, conforme descrito na etapa 2.6.
- Manter as amostras no gelo para análise por citometria de fluxo.
- Configure controles de compensação de cor única e aplique ao arquivo de experimento.
- Leia a amostra não corada primeiro para ajustar os ganhos do FSC e do SSC para que a população de linfócitos fique no meio do gráfico de pontos 'Todos os eventos'.
- Estabeleça a estratégia de gating de linfócitos em células não debris / únicas em células viáveis em células CD4 + , conforme exibido na Figura 3C.
- Avalie a eficiência da modificação gênica usando citometria de fluxo.
NOTA: Nossas construções AAV CAR contêm, além dos braços de homologia do locus TRAC, um gene repórter do receptor do fator de crescimento epidérmico truncado (EGFRt) ligado ao gene CAR por um peptídeo 2A, conforme mostrado na Figura 3. A eficiência do knock-in do gene é determinada pela coloração da superfície para CD3, cuja perda indica perda da expressão da superfície do TCR e, portanto, direcionamento bem-sucedido do locus TRAC com CRISPR / Cas9 e EGFRt, cuja expressão indica integração bem-sucedida do transgene CAR. As Tregs knock-in CAR são células CD3-EGFRt+. Avaliamos a eficiência da modificação gênica 5 dias após a eletroporação. - Certifique-se de que as Tregs modificadas completem seu ciclo de ativação (9-12 dias) e descansem 24 horas na ausência de IL-2 antes de serem usadas em qualquer experimento.
5. Ativação humana do CAR Treg
- Configuração de co-cultura (Dia 0)
- Colete a linha de células-alvo que expressam o antígeno CAR em um tubo cônico.
NOTA: Usamos células K562, uma linha celular de leucemia mielóide humana que não possui expressão de HLA, CD80 e CD86 como células-alvo para a ativação de CAR Treg. As células K562 parentais são usadas como controle negativo e as K562 que expressam o antígeno CAR são usadas para ativar as TregsCAR 17,21. - Irradie linhagens de células-alvo com 4.000 rad em um irradiador de césio-137 ou raios-X. Em caso de falta de acesso a um irradiador, realizar o tratamento com mitomicina C para interromper a proliferação celular, mantendo a expressão do antígeno de superfície nas células-alvo22.
- Se ainda não o fez, retire as Tregs ressuspendendo as Tregs ligadas aos grânulos anti-CD3 / CD28 e transferindo-as para um tubo cônico de 15 mL. Incube a suspensão da célula em um ímã por 3-5 min. Ainda no ímã, transfira as células do meio via pipeta para um novo tubo; os grânulos anti-CD3/CD28 permanecerão presos à parede do tubo.
- Determinar as concentrações de células-alvo irradiadas e CAR Treg desbeadizadas com azul de tripano.
- Spin irradiou células-alvo e CAR Tregs a 500 × g por 5 min. Ressuspenda com RPMI10 pré-aquecido a 106 células / mL em seus tubos separados. Adicione IL-2 às Tregs CAR para uma concentração de 2.000 UI / mL.
NOTA: Esta quantidade de IL-2 será diluída 2 vezes assim que as Tregs CAR forem combinadas com as células-alvo para uma concentração final de IL-2 de 1.000 UI / mL. - Co-cultura 1 × 105 CAR Tregs (100 μL) com 1 ×10 5 (100 μL) células-alvo irradiadas negativas para antígeno CAR (controle negativo para ativação), 1 ×10 5 (100 μL) células-alvo irradiadas positivas para antígeno CAR (experimento) ou 2,5 μL de esferas anti-CD3/CD28 (controle positivo para ativação) e 97,5 μL de meio RPMI10 em uma placa inferior redonda de 96 poços. Colocar a placa numa incubadora de cultura de tecidos a 37 °C, CO5% 2 durante 48 h.
NOTA: O volume final por alvéolo é de 200 μL. Certifique-se de que cada condição tenha três réplicas.
- Colete a linha de células-alvo que expressam o antígeno CAR em um tubo cônico.
- Leitura por citometria de fluxo
- A menos que esteja usando um leitor de placas, ressuspenda o conteúdo de cada poço da placa de fundo redondo de 96 poços e transfira-os para um tubo FACS. Gire a 500 x g por 5 min. Transvasar o sobrenadante e agitar suavemente o sedimento celular.
- Prepare a mistura principal de anticorpos de citometria de fluxo: 100 μL/amostra contendo DPBS, anti-CD4 PE/Cy7 humano 1:200, anti-humano CD71 PE 1:100 e Ghost Viability Dye BV510 1:2000.
NOTA: Este painel funciona bem se o gene repórter CAR for GFP. Se um gene repórter codifica uma proteína de superfície que requer coloração de anticorpos, como EGFRt, um anticorpo conjugado com FITC pode ser usado, por exemplo. - Pipetar 100 μL da mistura principal de anticorpos em cada amostra, misturar suavemente e incubar durante 30 min no frigorífico a 4 °C.
- Lave com 500 μL de DPBS centrifugando a 500 × g por 5 min. Ressuspenda o pellet celular em 200 μL de DPBS.
- Manter as amostras no gelo para análise por citometria de fluxo.
- Configure controles de compensação de cor única e aplique ao arquivo de fluxo do experimento.
- Leia amostras não coradas para ajustar os ganhos de SSC e FSC para que a população de linfócitos esteja no meio do gráfico de pontos 'Todos os eventos'.
- Estabeleça a estratégia de gating de linfócitos em células não detritos / únicas em células viáveis em células CD4 + , conforme exibido na Figura 3C (Diferentes fluoróforos usados).
- Leia amostras a uma taxa de eventos de aproximadamente 1.500 eventos / s para avaliar a ativação do Treg.
NOTA: O resultado esperado é a regulação positiva da expressão da superfície de CD71 em CAR Tregs na presença do antígeno CAR, conforme mostrado na Figura 4. Se a regulação positiva não for observada na presença do antígeno CAR, a sinalização tônica pode estar presente.
6. Estabilidade humana de Treg do CARRO
- Configuração e expansão da co-cultura (dias 0-9)
- Configure co-culturas para ativar CAR Tregs conforme descrito na etapa 5.1.
- Após 48 h, transfira a co-cultura de cada placa de fundo redondo de 96 poços para um poço de placa de 24 poços contendo 2 mL pré-aquecidos de RPMI10 com 1.000 UI / mL de IL-2 para permitir a expansão celular.
- Adicione RPMI10 fresco pré-aquecido com 1.000 UI / mL de IL-2 e divida em placas adicionais de 24 poços, conforme necessário.
- Leitura por citometria de fluxo
- Ressuspender e transferir o conteúdo de cada réplica para um tubo cónico de 15 ml ou 50 ml. Determine as concentrações celulares.
- Transferir entre 5 × 105 e 1 × 106 células para um tubo FACS para cada replicação. Centrifugar a 500 × g durante 5 min.
- Prepare a mistura principal de anticorpos de citometria de fluxo para coloração de superfície: 100 μL / amostra contendo DPBS, anti-CD4 PE / Cy7 1:200, anti-CD25 humano APC 1:200 e Ghost Viability Dye BV510 1:2000. Inclua anticorpo conjugado com FITC para proteína repórter CAR, se necessário.
- Transvasar o sobrenadante do passo 6.2.2 e vórtice suavemente o sedimento celular. Pipetar 100 μL da mistura principal de anticorpos de coloração superficial para cada tubo FACS. Vortex breve e coloque em uma geladeira a 4 ° C por 30 min no escuro.
- Usando um conjunto de tampão de coloração de fator de transcrição, prepare o tampão de fixação/permeabilização adicionando 3 volumes de diluente de fixação/permeabilização a 1 volume de concentrado de fixação/permeabilização. Cada amostra requer 100 μL de tampão de fixação/permeabilização.
- Lave as células coradas com a superfície com 500 μL de DPBS. Centrifugar a 500 × g durante 5 min e decantar o sobrenadante. Pipetar 100 μL de tampão de fixação/permeabilização preparado para cada tubo. Agitar brevemente e permitir que a fixação ocorra a 4 °C durante 30-60 min no escuro.
- Usando um conjunto de tampão de coloração de fator de transcrição, prepare 1x tampão de permeabilização adicionando 9 volumes de água destilada a 1 volume de concentrado de tampão de permeabilização 10x. Cada amostra requer 1.000 μL de tampão de permeabilização para lavagem e 100 μL de tampão de permeabilização para coloração com anticorpos direcionados a proteínas intracelulares.
- Lave as células fixas/permeabilizadas adicionando 500 μL de tampão de permeabilização 1x. Gire a 500 × g por 5 min em RT.
- Prepare a mistura mestre de anticorpos de coloração intracelular com 1x tampão de permeabilização, anti-humano FOXP3 eFluor 450 1:50, anti-humano HELIOS PE 1:50 e anti-humano CTLA-4 PerCP-e710 1:50. Cada amostra exigirá 100 μL de mistura principal de anticorpos.
NOTA: Este painel funciona se o gene repórter CAR for GFP ou se a proteína repórter CAR (por exemplo, EGFRt) for corada com um anticorpo conjugado com FITC. - Transvasar o sobrenadante do passo 6.2.8. Adicione 100 μL da mistura principal de anticorpos de coloração intracelular, faça um vórtice breve e incube em RT por 30 min no escuro.
- Lave as células fixas/permeabilizadas coradas adicionando 500 μL de 1x tampão de permeabilização. Gire a 500 × g por 5 min. Transvase o sobrenadante, ressuspenda o sedimento celular em 300 μL de DPBS e armazene-o no gelo.
- Analise por citometria de fluxo conforme mostrado na Figura 5. O resultado esperado é que a maioria das Tregs CAR serão células FOXP3+HELIOS+ . Use células Tconv CD4+ como controle negativo para a coloração FOXP3 e HELIOS.
7. Supressão humana de CAR Treg
- Coloração de traço de corante de célula T Respondedora (Tresp) e ativação noturna
- Colete as células CAR Treg expandidas, as células Tconv CD4+ recém-isoladas e as células T CD8+ recém-isoladas em tubos cônicos separados de 15 mL e retire as esferas anti-CD3/CD28, se ainda não o fizeram.
- Preparar as células-alvo irradiadas que expressam o antigénio CAR, conforme descrito no passo 5.1.
- Determine as concentrações de células T não ativadas e células-alvo irradiadas.
- Combine 5 × 106 células Tconv CD4+ com 5 × 106 células T CD8+ (proporção de 1:1). Estas são as células T respondedoras (Tresp) a serem inibidas por CAR Tregs no ensaio. Gire as células Tresp a 500 × g por 5 min em RT. Aspire cuidadosamente o sobrenadante e ressuspenda as células Tresp em 1 mL de DPBS.
- Adicione 1 mL de corante CellTrace Violet (CTV) de 5 mM reconstituído em DMSO às 107 células Tresp em 1 mL de DPBS para uma concentração final de 5 μM de CTV. Colocar em banho-maria a 37 °C durante 20 min. Aos 10 min, vórtice suave para redistribuir o CTV sedimentado.
- Lave com 9 mL de meio completo RPMI10 pré-aquecido. Gire a 500 × g por 5 min. Ressuspenda em 5 mL de meio completo RPMI10 pré-aquecido.
- Determine a concentração de células Tresp marcadas com CTV. Adicione 5 × 104 células Tresp não ativadas marcadas com CTV em 200 μL de meio RPMI10 em 3-6 poços de uma placa de fundo redondo de 96 poços como controles mínimos de proliferação.
- Ative as células Tresp marcadas com CTV com esferas anti-CD3 / CD28 em uma proporção de 1:10 de esferas para células Tresp sem IL-2 em meio RPM10. Dispense 106 células Tresp marcadas com CTV em 1 mL de meio RPMI10 por poço de uma placa de 24 poços na incubadora de cultura de tecidos durante a noite.
- Em paralelo, obtenha 106 CAR+ Tregs. Esta quantidade cobre triplicados de quatro razões CAR Treg:Tresp, 1:1, 1:2, 1:4, 1:8, a 5 × 104 células-alvo por poço de placa de fundo redondo de 96 poços, como 5 × 104 × 3 + 2,5 × 104 × 3 + 1,25 × 104 × 3 + 0,625 × 104 × 3 = 2,81 × 105 Tregs CAR, em duas condições de ativação de CAR Treg: células-alvo negativas para o antígeno CAR irradiado (controle negativo, sem ativação) e células-alvo positivas para antígeno CAR irradiadas (experimento, ativação de CAR).
- Combinar 3 × 105 Tregs CAR com 3 × 105 células CAR negativas irradiadas (proporção 1:1) e 3 Tregs CAR × 105 CAR Tregs com 3 × 105 células-alvo positivas para o antigénio CAR irradiadas (proporção 1:1), em dois tubos cónicos separados de 15 ml e centrifugar a 500 × g durante 5 min a RT. Aspirar cuidadosamente o sobrenadante.
- Ressuspenda o pellet em cada tubo da etapa 7.1.10 em 600 μL de meio RPMI10 pré-aquecido. Isso resulta em 200 μL para cada um dos triplicados 1:1 Treg:Tresp. Efectuar a diluição em série numa placa de fundo redondo de 96 poços do seguinte modo:
- A partir dos 600 μL preparados de Treg + suspensão de células-alvo, pipetar 200 μL de suspensão de células em cada um dos 3 poços de proporção 1:1.
- Adicione 100 μL de meio completo RPMI10 pré-aquecido em cada um dos poços vazios de proporção 1:2, 1:4 e 1:8.
- Para cada um dos triplicados, pipetar 100 μL da suspensão celular dos alvéolos 1:1 para os alvéolos associados na proporção 1:2.
- Para cada um dos triplicados, pipetar 100 μL da suspensão celular, dos alvéolos 1:2, para os alvéolos associados na proporção 1:4.
- Para cada um dos triplicados, pipetar 100 μL da suspensão celular, dos alvéolos 1:4, para os alvéolos associados na proporção 1:8.
- Pipetar os restantes 100 μL da suspensão celular dos alvéolos na proporção de 1:8 para um recipiente de resíduos.
NOTA: Cada alvéolo deve conter 100 μL da suspensão celular com 5 × 104 (1:1), 2,5 × 104 (1:2), 1,25 × 104 (1:4) ou 0,625 × 104 (1:8) CAR Tregs e um número igual de células-alvo irradiadas.
- Co-incubação de células CAR Treg e Tresp
- Após 16-18 h após a ativação, colete as células Tresp ativadas da placa de 24 poços em um tubo cônico e remova os grânulos anti-CD3 / CD28 via ímã.
- Determine as contagens de células Tresp marcadas com CTV descontadas .
- Lave e centrifugue 2 × 106 células Tresp a 500 × g durante 5 min. Aspire cuidadosamente o sobrenadante. Ressuspenda as células em 4 mL de meio completo RPMI10.
- Adicione 100 μL da suspensão de células T (5 × 104 células T) a cada poço com CAR Tregs, bem como a 3-6 poços com 100 μL de meio RPMI10 sozinho para controles máximos de proliferação. Colocar a placa numa incubadora de cultura de tecidos a 37 °C, CO5% 2 durante 72 h.
NOTA: A placa de fundo redondo de 96 poços agora tem 3-6 poços com células Tresp não ativadas sozinhas (controle mínimo de proliferação), 3-6 poços com células Tresp ativadas sozinhas (controle máximo de proliferação) e células Tresp ativadas na presença de números decrescentes de CAR Tregs.
- Leitura por citometria de fluxo
- Ressuspenda e transfira o conteúdo de cada placa inferior redonda de 96 poços para um tubo FACS rotulado. Em alternativa, transferir para uma placa de fundo em V de 96 poços se estiver disponível um citómetro de fluxo com modo de leitura de placas. Gire a 500 × g por 5 min.
- Enquanto isso, prepare a mistura principal de anticorpos com DPBS, anti-CD4 PE / Cy7 1:200 e anti-CD8 PerCP 1:200 humano. Cada amostra exigirá 100 μL de mistura principal de anticorpos.
- Agite suavemente o pellet celular. Pipetar 100 μL de mistura principal de anticorpos em cada tubo FACS. Agitar brevemente e incubar a 4 °C durante 30 min no escuro.
- Lavar com 500 μL de DPBS. Lave 2x com 100 μL de DPBS se estiver usando um fundo em V de 96 poços. Gire a 500 × g por 5 min. Transvase o sobrenadante, ressuspenda o pellet celular em 200 μL de DPBS e armazene os tubos em gelo no escuro.
- Analise por citometria de fluxo, conforme mostrado na Figura 6. O resultado esperado é que as células Tresp não ativadas isoladamente (proliferação mínima) apresentem um pico de fluorescência CTV alto e uniforme, as células Tresp ativadas sozinhas exibindo vários picos de intensidade de CTV, um correspondendo a cada divisão celular (proliferação máxima), e as células T CD4+ e CD8+ ativadas na presença de CAR Tregs ativadas exibindo uma redução no número e na altura dos picos de CTV, portanto, em proliferação.
- Calcule a supressão mediada por células Treg da seguinte forma:
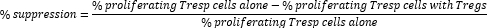
NOTA: Se estiver usando o software FlowJo, também é possível usar a modelagem de proliferação celular para calcular o índice de divisão (DI) para cada amostra e calcular a supressão percentual usando DI em vez da porcentagem de células em proliferação na fórmula acima.
Resultados
O protocolo descrito aqui fornece um pipeline simplificado e padronizado para avaliar novas construções de receptores de antígeno quimérico (CAR) em células T reguladoras humanas (Tregs), com o objetivo de criar terapêuticas vivas para doenças autoimunes, doença do enxerto contra o hospedeiro, rejeição de transplante de órgãos e alergia. A Figura 1 mostra como obtemos Tregs humanos altamente puros do sangue periférico usando FACS (
Discussão
Este protocolo fornece uma metodologia simplificada e abrangente para gerar e avaliar células T reguladoras do receptor de antígeno quimérico humano (CAR Tregs). O sucesso da tecnologia CAR no tratamento de cânceres hematológicos inspirou sua aplicação ao subconjunto imunossupressor de células T, Tregs. Ao contrário das células T convencionais, as Tregs inibem as respostas imunes, oferecendo tratamentos potenciais para condições resultantes de imunidade indesejada, como doen?...
Divulgações
A LMRF é uma inventora e recebeu royalties de patentes de células imunológicas modificadas e presta consultoria para a Guidepoint Global e a McKesson. Os demais autores declaram não haver interesses conflitantes.
Agradecimentos
O LMRF é financiado pela concessão U24DK104162-07 de Líder Emergente em Diabetes Tipo 1 da Human Islet Research Network (HIRN), Bolsa de Pesquisa Institucional da American Cancer Society (ACS) IRG-19-137-20, Pesquisa Clínica e Translacional da Carolina do Sul (SCTR) Concessão de Descoberta de Projeto Piloto 1TL1TR001451-01, Diabetes Research Connection (DRC) Concessão IPF 22-1224 e Swim Across America Concessão 23-1579. O RWC é apoiado pela bolsa de treinamento em Ciências Celulares, Bioquímicas e Moleculares T32GM132055 e pela Hollings Cancer Center Lowvelo Graduate Fellowship. Este estudo foi apoiado em parte pelo Recurso Compartilhado de Citometria de Fluxo e Classificação de Células, Hollings Cancer Center, Medical University of South Carolina (P30 CA138313). Agradecimentos especiais ao Dr. Qizhi Tang da Universidade da Califórnia, San Francisco (UCSF) por gentilmente presentear os plasmídeos mutantes CAR.
Materiais
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
Referências
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados