Method Article
غاليريا ميلونيلا كنموذج لفحص مضادات الميكروبات
In This Article
Summary
تقدم هذه الدراسة إطارا موحدا لتحسين نماذج عدوى G. mellonella لاستخدامها في التقييم قبل السريري لمضادات الميكروبات. يمكن أن يؤدي تطبيق نموذج G. mellonella كجزء من خط أنابيب تطوير مضادات الميكروبات قبل السريرية إلى تقليل عدد المركبات غير الفعالة التي تتقدم إلى التجارب السريرية.
Abstract
لمكافحة القضية العالمية المتزايدة لمقاومة المضادات الحيوية ، من الضروري تسريع تطوير المضادات الحيوية الجديدة. ينتج عن التطور الحالي لمضادات الميكروبات قبل السريرية عددا كبيرا من الخيوط التي يثبت أنها غير مناسبة سواء قبل التجارب السريرية أو أثناءها. لزيادة كفاءة التطوير قبل السريري ، يجب تطوير نماذج ذات صلة وموحدة ويمكن الوصول إليها وفعالة من حيث التكلفة. تستخدم يرقات Galleria mellonella (عثة الشمع الكبرى) على نطاق واسع كنموذج للعدوى لتقييم الفوعة الميكروبية ، وإجراء اختبار سمية الدواء ، والعمل كوسيلة أولية لتقييم الفعالية في الجسم الحي للمركبات الجديدة المضادة للميكروبات. تتمتع نماذج العدوى هذه بأهمية بيولوجية أكبر من العديد من الشاشات المختبرية ذات الإنتاجية المماثلة وتقلل الاعتماد على نماذج الثدييات عند استخدامها كشاشة مسبقة لاختبار مضادات الميكروبات. يصف هذا البروتوكول منهجية موحدة لتحسين نماذج عدوى G. mellonella ، والتي يمكن تطبيقها على الأنواع البكتيرية والعلاجات المضادة للميكروبات المفضلة. وباستخدام العامل الممرض ذي الأولوية لدى منظمة الصحة العالمية Pseudomonas aeruginosa كنموذج، نحدد الخطوات التي يمكن اتخاذها لوضع نموذج قابل للتكرار للعدوى والاختبارات العلاجية. يتضمن ذلك توصيات بشأن الإعداد التجريبي وإعداد العينات وبروتوكولات العدوى والعلاج. إن دمج هذا النموذج في خطوط أنابيب تطوير مضادات الميكروبات قبل السريرية من شأنه أن يقلل من الاعتماد على نماذج الثدييات ، ويقلل من عدد المركبات غير الفعالة التي تصل إلى التجارب السريرية ، ويزيد في النهاية من كفاءة تطوير مضادات الميكروبات قبل السريرية.
Introduction
تستخدم يرقات Galleria mellonella (عثة الشمع الكبرى) على نطاق واسع عبر العلوم البيولوجية كنماذج عدوى للأنواع الميكروبية ، ولاختبار سمية مركبات الأدوية الجديدة1،2. لديها القدرة على تحقيق فائدة كبيرة في خط أنابيب اختبار مضادات الميكروبات قبل السريرية ، لأنها عالية الإنتاجية ، وتكرار الخصائص الأساسية في الجسم الحي للعدوى البشرية ، وتقليل الاعتماد على نماذج الثدييات ، بما يتماشى مع مبادئ التخفيض والصقل والاستبدال التي تحكم الاستخدام الأخلاقي لأنواع الثدييات في البحث.
يتطلب تطوير مضادات حيوية جديدة اختبارات مكثفة قبل السريرية في نماذج المختبر وفي الجسم الحي قبل التحقق السريري3. فقط عدد قليل من العوامل الجديدة التي لديها حزم بيانات واعدة قبل السريرية تترجم إلى العيادة ، وأحد المساهمين في معدل الاستنزاف المرتفع هذا هو فشل الشاشات قبل السريرية في التقاط تعقيدات بيئات العدوى4. لا تساهم هذه المشكلات في انخفاض معدل ترجمة العوامل المضادة للميكروبات إلى العيادة فحسب ، بل تساهم أيضا في زيادة استخدام الفقاريات التجريبية أثناء الفحص قبل السريري في المرحلة المتأخرة. لتحسين التقييم قبل السريري لمضادات الميكروبات الجديدة وتقليل استخدام نماذج الفئران باهظة الثمن والمستهلكة للوقت والمعقدة والإشكالية أخلاقيا في الجسم الحي ، هناك حاجة إلى أدوات أفضل لفحص الأدوية في المراحل المبكرة تقلل من عدد المركبات غير الواعدة التي تتقدم إلى الاختبار في أنظمة الفقاريات.
G. mellonella لديها دورة حياة قصيرة من 8 أسابيع ، وتتألف من أربع مراحل الحياة: البيض ، واليرقات ، والشرانق ، والبالغين ، والتي يتم استخدام شكل اليرقات في هذا البروتوكول1. من السهل الحفاظ على G. mellonella طوال التجربة دون الحاجة إلى معدات متخصصة أو منشأة مخصصة للأبحاث الحيوانية. لا يوجد شرط للحصول على موافقة أخلاقية لاستخدامها ، ويمكن للباحثين تربية الكائن الحي داخليا لتحسين الجودة التجريبية2،5،6،7. يشبه الجهاز المناعي G. mellonella إلى حد كبير جهاز المناعة الفطري للثدييات ، مع القدرة على الاستجابة للمنبهات "الذاتية" و "غير الذاتية"8. الخلايا الدموية هي المسؤولة عن التعرف على الأنماط الجزيئية المرتبطة بمسببات الأمراض والبلعمة اللاحقة ، وتلعب دورا مشابها وظيفيا لدور العدلات في البشر9. يقوم G. mellonella بتشفير ثلاثة أنواع من المستقبلات الشبيهة بالحصيلة التي تم تحديدها من خلال تماثل التسلسل للبشر ، وتنتج بروتينات شبيهة بالمكملات ، والتي تتعرف على المواد غير الذاتية وتشكل مجمعات ميلانية موضعية بعد تنشيط وبلمرة الفينولوكسيديز إلى الميلانين10. يمكن أن يكون هذا بمثابة قراءة مرئية لصحة اليرقات أثناء تجارب العدوى ، حيث يتم تعتيم البشرة عن طريق الميلانين. ومع ذلك ، تجدر الإشارة إلى أن محور الميلانة في الحشرات ، والذي يتضمن الفينولوكسيديز ، يختلف اختلافا كبيرا عن محور التيروزيناز والميلانين في الثدييات11,12. بالإضافة إلى ذلك ، تنتج G. mellonella 18 ببتيدا مضادا للميكروبات ، بما في ذلك الليزوزيم ومتماثلات الدفاع13. هذا التشابه، فضلا عن إجراءات صيانة اليرقات المباشرة والطبيعة الإنتاجية العالية للنموذج، جعلت من G. mellonella كائنا مستخدما على نطاق واسع في تقييم الأدوية الجديدة. في تطوير المضادات الحيوية قبل السريرية ، زادت فائدة G. mellonella مقارنة بالنماذج في المختبر ، حيث يمكنها نمذجة تفاعلات الأدوية المضيفة والممرضة بشكل أكثر دقة في بيئة معقدة ذات مناعة نشطة.
في الوقت الحاضر ، لا يوجد مورد موحد من الدرجة البحثية ل G. mellonella في أوروبا. يجب على الباحثين بدلا من ذلك شراء يرقات G. mellonella من متاجر الطعم أو الحفاظ على مستعمرتهم الخاصة. في حين تم وصف طرق الحفاظ على مستعمرة G. mellonella الداخلية ويمكن أن تزيد من الاتساق التجريبي5،6،7 ، فمن المحتمل أن يكون هذا الخيار جذابا فقط لأولئك الذين يستخدمون اليرقات بشكل متكرر. على هذا النحو ، يركز هذا البروتوكول على الإعداد التجريبي بعد شراء اليرقات من مورد الطعم الحي. في حين أن هذه الطريقة يسهل الوصول إليها ، إلا أنها تزيد من التعقيد التجريبي ويمكن أن تدخل تباينا إضافيا في المقايسات بسبب التناقضات في صحة اليرقات عند النقطة التي يتم استلامها فيها من الموردين. لكي يقبل الأكاديميون والصناعة والمنظمون اختبار G. mellonella ويعتمدونه كجزء من خط أنابيب تطوير مضادات الميكروبات قبل السريرية ، من الضروري وجود نظام موحد لتحسين وتقييم فعالية مضادات الميكروبات.
تعمل هذه الدراسة على تحسين التصميم التجريبي لنموذج عدوى G. mellonella لتطوير المضادات الحيوية. في حين تم وصف نماذج عدوى G. mellonella 14,15 ، فإن المنهجية الحالية توثق خطوات إضافية للتخفيف من التعقيد الإضافي الناجم عن عدم اتساق العرض وتوفر إطارا لتقييم مضادات الميكروبات الجديدة. وكحالة اختبار، أصيبت بكتيريا G. mellonella بمسببات الأمراض ذات الأولوية الأولى لمنظمة الصحة العالمية Pseudomonas aeruginosa، وتم تحسين العلاج بعامل أمينوغليكوزيد (توبراميسين). يوفر هذا الإطار ، الموضح في الشكل 1 ، أساسا لدراسات فحص مضادات الميكروبات قبل السريرية المستقبلية باستخدام عوامل جديدة.
Protocol
في هذه الدراسة ، تم اختيار يرقات Galleria mellonella (عثة الشمع الكبرى) كنموذج لاختبار الحساسية للمضادات الحيوية وتجارب السمية الحادة. لا يلزم الحصول على موافقة أخلاقية للاستخدام التجريبي ل Galleria mellonella. يتم سرد تفاصيل الكواشف والمعدات المستخدمة في جدول المواد.
1. التصميم التجريبي
- تحديد أحجام مجموعات يرقات Galleria mellonella المناسبة بناء على التغير النسبي في بقاء اليرقات الذي تهدف الدراسة إلى التقاطه. يفصل الجدول 1 أحجام المجموعات المطلوبة للكشف عن التغيرات المئوية المحددة في البقاء على قيد الحياة باستخدام نموذج عدوى سلالة Pseudomonas aeruginosa PAO1.
ملاحظة: عند استخدام ممرض جديد ، حدد أولا التباين بين المقايسة في البقاء النسبي لليرقات المصابة ولكن غير المعالجة ، لأن هذا سيؤثر على تحديد حجم العينة.- قم بتضمين مجموعتين من عناصر التحكم في PBS: واحدة يتم حقنها قبل بقية العدوى للتأكد من أن المحقنة حادة وصالحة للاستخدام ، والأخرى يتم حقنها أثناء أو بعد الالتهابات البكتيرية لضمان التعقيم المناسب بين مجموعات العدوى. في حالة التحسين باستخدام ممرض جديد ، قم بتضمين عنصر تحكم معالج حراريا للتأكد من أن الموت ليس نتيجة استجابة مناعية للجزيئات الغريبة.
ملاحظة: يمكن استخدام محاقن الأنسولين للحقن ، مما يقلل من مخاطر التقشير والتلوث. ومع ذلك ، قد تستخدم التجارب بشكل روتيني المئات من G. mellonella ، مما يجعل استخدام محاقن الأنسولين مكلفا ومهدرا. - بالنسبة للدراسات التي تعمل على تحسين العلاج المضاد للبكتيريا ، قم بتضمين ضابطين إضافيين: مجموعة مصابة بالبكتيريا ثم يتم حقنها بعلاج "صوري" للمركبة ، ومجموعة يتم حقنها مرتين مع السيارة ، مرة واحدة في وقت الإصابة بالحالات الأخرى ومرة واحدة في وقت العلاج.
ملاحظة: الأول هو عنصر تحكم غير معالج ، بينما يتحكم الأخير في أي صدمة ناجمة عن الحقن. مثل هذه الصدمة أكثر احتمالا عند استخدام الإبر الحادة.
- قم بتضمين مجموعتين من عناصر التحكم في PBS: واحدة يتم حقنها قبل بقية العدوى للتأكد من أن المحقنة حادة وصالحة للاستخدام ، والأخرى يتم حقنها أثناء أو بعد الالتهابات البكتيرية لضمان التعقيم المناسب بين مجموعات العدوى. في حالة التحسين باستخدام ممرض جديد ، قم بتضمين عنصر تحكم معالج حراريا للتأكد من أن الموت ليس نتيجة استجابة مناعية للجزيئات الغريبة.
- اطلب G. mellonella من مورد الطعم الحي ، أو احتفظ بمستعمرة من G. mellonella كما هو موضح سابقا5،6،7. بالنسبة للمورد المدرج في جدول المواد ، اطلب 1.8 ضعف العدد المخطط لليرقات ، حيث سيتم استبعاد ما يقرب من 33٪ بناء على الحجم ، وقد يموت 10٪ أخرى بعد تعقيم البشرة.
- تحديد تباين وزن G. mellonella قبل الاستخدام التجريبي ، والتأكد من أن نطاق الوزن لا يتجاوز انحرافا معياريا واحدا للمتوسط.
ملاحظة: بالنسبة للموردين غير المدرجين في جدول المواد، رتب للمورد لتوفير مخزون جديد.
- تحديد تباين وزن G. mellonella قبل الاستخدام التجريبي ، والتأكد من أن نطاق الوزن لا يتجاوز انحرافا معياريا واحدا للمتوسط.
- عند الاستلام، قم بتخزين G. mellonella في درجة حرارة الغرفة للحد من فرصة الشرنقة، والتي تحدث بعد الحضانة عند 37 درجة مئوية.
ملاحظة: ليست كل اليرقات من الموردين التجاريين تشكل شرانق ، والتي كانت تستخدم سابقا كمؤشر لصحة اليرقات16. - استخدام اليرقات في غضون 1 أسبوع من الاستلام ، وفي هذه الحالة لا تتطلب التغذية.
ملاحظة: على الرغم من أن مرحلة حياة اليرقات ستختلف بين الدفعات ، إلا أن معظم اليرقات يتم تسليمها خلال الطور الأخير قبل التشرنق. في هذه المرحلة ، تنخفض التغذية بشكل طبيعي مقارنة بالمراحل السابقة17.
2. تعقيم واختيار يرقات G. mellonella
- وزن يرقات Galleria mellonella والتخلص من أي يرقات تقع خارج نطاق 224 مجم ± 49.2 مجم ، وهو متوسط وزن اليرقات زائد أو ناقص انحراف معياري واحد. سيؤدي ذلك إلى استبعاد حوالي 33٪ من اليرقات.
ملاحظة: قد يختلف اختلاف الوزن بين الموردين. بالنسبة للموردين غير المدرجين في هذا البروتوكول ، احسب نطاق الوزن المناسب. - قم بتنفيذ الخطوات التالية في ظل ظروف معقمة.
- رش 70٪ من الإيثانول في طبق بتري ، مما يضمن ما يكفي لتغطية قاع الطبق.
- تعقيم سطح G. mellonella على دفعات من 10-20 يرقات.
- ضع كل دفعة على حدة في الطبق ورش اليرقات مرتين بنسبة 70٪ إيثانول.
- استخدم الملقط للف اليرقات ، مما يضمن التغطية الكاملة.
- أخرج اليرقات من الإيثانول وضعها في طبق بتري معقم. اترك الطبق مكشوفا للسماح لليرقات بالجفاف.
تنبيه: ترك G. mellonella في الإيثانول لمدة تزيد عن 15 ثانية سيؤدي إلى ارتفاع معدل الوفيات.
- بمجرد أن يستعيد ما يقرب من 90٪ من اليرقات نشاطها بعد 2 ساعة ، افصل اليرقات المستعادة إلى مجموعات ذات حجم يسمح بالكشف الكافي عن تغيرات البقاء على قيد الحياة وفقا لحسابات الطاقة المفصلة في الجدول 1.
- استخدم G. mellonella في غضون 6 ساعات من التعقيم.
3. تحسين كثافة اللقاح البكتيري
- قم بإعداد مخزون عدوى بكتيرية من CFU / mL معروف قبل الإصابة. تختلف طرق توليد المخزونات حسب الكائن الحي. هنا ، نمت Pseudomonas aeruginosa إلى مرحلة منتصف السجل في مرق المغذيات ، ونقلت ، وجمدت بكثافة 6 × 107 CFU / مل.
- قم بإذابة مخزون العدوى عن طريق الطرد المركزي عند 10,000 × جم في درجة حرارة الغرفة لمدة 5 دقائق ، وأعد تعليقه في برنامج تلفزيوني. تمييع المخزون البكتيري بشكل متسلسل عشرة أضعاف لتوليد مجموعة من جرعات اللقاح من 101-10 7 CFU لكل يرقة ، مع الأخذ في الاعتبار أن كل يرقة يتم حقنها ب 10 ميكرولتر من اللقاح.
ملاحظة: سيختلف نطاق جرعة اللقاح المحدد اعتمادا على الفوعة البكتيرية ، ولكن يجب أن يكون النطاق المقترح هنا مناسبا لمعظم الأنواع المسببة للأمراض. يمكن أن يساعد تحديد معدل النمو في المختبر في اختيار نطاق الجرعة المناسب ، حيث يرتبط معدل النمو الخاص بالسلالة في الاستزراع السائل بنفوق اليرقات. - قبل بدء العدوى ، قم بتعداد اللقاح بتخفيف تسلسلي لمايلز وميسرا لتحديد كثافة اللقاح بدقة18.
- تحضير ثلاثة أنابيب ميكروفوج سعة 1 مل تحتوي إما على dH2O معقم أو 70٪ إيثانول أو PBS معقم. سيتم استخدامها باستمرار لتعقيم المحقنة المستخدمة لحقن اليرقات.
- افحص حقنة هاميلتون معقمة سعة 100 ميكرولتر ، وتأكد من أن طرف الإبرة حاد ولم يطور خطافا ، مما يتسبب في صدمة كبيرة لموقع الإصابة.
تنبيه: سيبدأ طرف إبرة حقنة هاملتون في الالتواء بعد حوالي 300 إصابة. إذا كان طرف الإبرة مشوها ، فيجب استبداله. - اغسل المحقنة بالتتابع باستخدام dH2O والإيثانول و PBS قبل الإصابة بالعدوى ، وقم بسحب السعة القصوى للمحقنة والتخلص منها.
- دوامة لقاح العدوى المعاد تعليقه ووضع 100 ميكرولتر كحد أقصى في حقنة هاملتون ، وهو ما يكفي لحقن 10 ميكرولتر لكل يرقة.
- حقن كل يرقة مع 10 ميكرولتر من اللقاح في الساق اليمنى الخلفية. تأكد من أن الإبرة تخترق حوالي 2 مم في الجسم.
ملاحظة: يمكن استخدام طرق مختلفة للعدوى. وتشمل هذه وضع اليرقة فوق طرف ماصة لفضح prolegs ، وتأمين المحقنة بشكل ثابت ووضع G. mellonella باليد ، أو حقن اليد الحرة. - بين كل مجموعة من العدوى ، قم بتعقيم المحقنة كما هو مفصل في الخطوة 2.5 لمنع التلوث من متعايشات الجلد المتبقية.
- احتضان اليرقات المصابة عند درجة حرارة كافية لنمو الميكروبات ، بين 20 درجة مئوية و 42 درجة مئوية ، وهو نطاق مناسب لبقاء G. mellonella 5.
- مراقبة البقاء على قيد الحياة G. mellonella على فترات منتظمة من الوقت الذي عادة ما يتم فيه ملاحظة الوفيات لأول مرة لقياس وقت الوفاة بدقة. يجب تقييم ذلك في شاشة أولية. إزالة أي يرقات ميتة وتسجيل وقت وفاتها.
- حدد جرعة العدوى المثلى لدراسة اختبار علاجي بناء على الجرعة التي تنتج معدل وفيات بنسبة 50٪ بحلول 18 ساعة وأكثر من 80٪ بحلول 72 ساعة. وهذا يسمح بتطوير شاشة سريعة ليوم واحد مع ضمان الفوعة الكافية ونافذة علاجية مناسبة.
4. اختبار سمية العوامل الجديدة المضادة للميكروبات في اليرقات غير المصابة
- تقييم سمية مضادات الميكروبات الجديدة والمركبات المختارة في غاليريا ميلونيلا قبل استخدامها مع اليرقات المصابة تجريبيا. إعداد مجموعة واسعة من الجرعات تتجاوز النطاق العلاجي المتوقع لمضادات الميكروبات، مسترشدة ببيانات السمية في المختبر (مثل خط الخلايا)، إن وجدت.
- النظر في أنه سيتم حقن اليرقات مع 10 ميكرولتر من العلاجية. قم بإعداد ضوابط السيارة فقط بتركيزات مطابقة لتلك التي يتم فيها تقديم العلاج.
- حقن G. mellonella صحية ومعقمة في أحجام المجموعات المناسبة مع تركيزات المركبات المختلفة المضادة للميكروبات و PBS ، كما هو مفصل في الخطوات 3.2-3.10. في هذه الدراسة ، كان مضاد الميكروبات المستخدم هو توبراميسين.
ملاحظة: بالنسبة للعامل الذي يتطلب DMSO كمذيب ، قم بالحقن بإبرة قياس 26 ثانية ، بدلا من إبرة قياس 22 القياسية ، لأن الصدمة من الإبر الكبيرة تزيد من معدل الوفيات عند استخدام DMSO. - حدد الجرعة الآمنة على أنها الجرعة التي لا تسفر عن فرق كبير في معدل الوفيات مقارنة باليرقات المحقونة ب PBS فقط.
5. تحسين علاج العدوى البكتيرية G. mellonella بعامل مضاد للميكروبات
- تحضير مجموعة من جرعات العامل المضاد للميكروبات ، مع الأخذ في الاعتبار أن اليرقات المصابة تعامل بجرعة 10 ميكرولتر. استخدم مجموعة من الجرعات بأقل قدر من السمية ، كما تم تقييمها في الخطوة 4.
- اتبع الخطوتين 1 و 2 من هذا البروتوكول لإعداد وإصابة Galleria mellonella في المجموعات المناسبة بجرعة العدوى المحسنة مسبقا.
- في 2 ساعة بعد الإصابة ، عالج اليرقات بالعامل المضاد للميكروبات المحضر أو محلول التحكم في السيارة. اتبع الخطوات 3.2-3.8 ، الحقن في الساق المعاكسة من تلك التي تم حقنها أثناء العدوى. تعقيم الإبرة بين المجموعات.
ملاحظة: تم اختيار العلاج في 2 ساعة لهذا التحسين للحصول على بيانات قوية للجرعة والاستجابة ، والتي تم من خلالها تحديد التحسين اللاحق لتوقيت العلاج19. - يجب مراقبة البقاء على قيد الحياة على قيد الحياة من G. mellonella على فترات 30 دقيقة أو أكثر من الوقت الذي يتم فيه عادة ملاحظة الوفيات لأول مرة. إزالة أي يرقات ميتة وتسجيل وقت وفاتها.
- احسب التغير في نسب البقاء على قيد الحياة بين مجموعات العلاج. استخدم تحليل كابلان ماير للبقاء على قيد الحياة لتحديد ما إذا كان العلاج يؤدي إلى تغيير كبير في وفيات اليرقات. قم بتضمين التصحيح اللاحق المناسب للتعدد الزوجي في التحليلات متعددة المجموعات.
6. تحسين توقيت العلاج من G. mellonella المصابة
- اتبع الخطوتين 1 و 2 لتحضير Galleria mellonella في المجموعات المناسبة بجرعة العدوى المحسنة مسبقا.
- تحضير العامل المضاد للميكروبات بالجرعة المحسنة مسبقا في الخطوة 4.
- في أي من ساعتين أو 4 ساعات أو 6 ساعات أو 9 ساعات أو 12 ساعة بعد الإصابة ، عالج اليرقات المصابة باتباع الخطوات 3.2-3.8 لمقارنة كيفية تأثير توقيت العلاج على الوفيات.
- يجب مراقبة البقاء على قيد الحياة على قيد الحياة من G. mellonella على فترات 30 دقيقة أو أكثر من الوقت الذي يتم فيه عادة ملاحظة الوفيات لأول مرة. إزالة أي يرقات ميتة وتسجيل وقت وفاتها. التوقيت الأمثل هو الذي يحافظ على البقاء على قيد الحياة الملاحظ بعد التحسين الأولي لجرعة العلاج.
ملاحظة: عند اختبار فعالية مضادات الميكروبات في G. mellonella ، قم بتحسين كل من جرعة العلاج والتوقيت بشكل منفصل ، باستخدام الأول لإبلاغ جرعة العلاج في الأخير.
النتائج
تقييم تباين الدفعة في وزن G. mellonella
يأتي المصدر المحتمل للتباين غير المرغوب فيه في تجارب العدوى من الاختلافات في الحجم بين الوحدات التجريبية الفردية (أي اليرقات) وعبر الدفعات. يمكن التخفيف من آثار هذا الاختلاف إما عن طريق تعديل جرعات العلاج أو العدوى على أساس الوزن ، أو عن طريق اختيار تلك اليرقات فقط ضمن نطاق وزن محدد لاستخدامها في التجارب. التعديل الأخير أكثر واقعية ولا يخضع للخطأ البشري الذي قد ينشأ أثناء تحضير الجرعة. ومن المزايا الإضافية لوزن اليرقات أنها تمكن من تحويل جرعات العلاج من تلك التي تعطى لليرقات إلى مكافئاتها البشرية ملغم / كغم. ولتحديد التباين داخل الدفعات وفيما بينها، تم وزن ثلاث دفعات من 50 يرقة، مرتبة في أوقات مختلفة. كان متوسط الوزن في كل مجموعة 225.5 مجم و 230.54 مجم و 215.86 مجم ، مع انحرافات معيارية تبلغ 49.1 مجم و 53.7 مجم و 44.3 مجم على التوالي (الشكل 2 أ). بين الدفعات ، لم يكن هناك فرق كبير في الوزن. عبر الدفعات ، تراوح الوزن من 107.5 مجم إلى 341.0 مجم ، بمتوسط 224.0 مجم ± 49.2 مجم.
للحصول على نتائج قابلة للتكرار ، تم وزن اليرقات قبل التجربة واختيارها إذا كان وزنها 224 مجم ± 49.2 مجم ، مما قلل نطاق الوزن من 233.5 مجم إلى 98.4 مجم ، وأزل 33٪ من اليرقات. يتماشى هذا مع العمل السابق الذي حدد تباينا كبيرا في بقاء اليرقات المصابة ب MRSA بنطاقات وزن أكبر من 100 مجم14,20. قارنا أيضا وزن G. mellonella في نقطة التسليم مع ذلك في أسبوع واحد بعد الولادة ، لأن أي تغيير كبير في الوزن يمكن أن يؤثر على النتائج التجريبية عندما لا يتم استخدام اليرقات فور وصولها. كان متوسط وزن G. mellonella 230.54 مجم ± 53.7 مجم. بعد أسبوع واحد من الولادة ، كان متوسط الوزن 221.8 مجم ± 45.7 مجم انحراف معياري (الشكل 2 ب). لم يكن هناك فرق كبير بين الوزن عند الوصول والوزن بعد أسبوع واحد ، والذي نستنتج منه أنه يمكن استخدام اليرقات لأغراض تجريبية في أي وقت خلال الأسبوع الأول من الولادة. من المهم ملاحظة أن هذه النتائج تمثل فقط G. mellonella المشتراة من مورد واحد ، وقد يختلف الوزن بشكل كبير بين الموردين أو عند طلب اليرقات في أوقات مختلفة.
تحسين كثافة لقاح P. aeruginosa PAO1
تم تقييم ضراوة خمس عزلات من P. aeruginosa عند أربع كثافات لقاح ، بما في ذلك ثلاث سلالات مختبرية شائعة الاستخدام ، PAO1 و PA14 و PAK ، وعزلتين سريريتين من عدوى الجهاز التنفسي المزمنة ، LESB58 ، و IST27-M. تم استخدام هذه كجزء من لوحة سلالة ذات صلة بالتليف الكيسي طورها Mahenthiralingam et al.21 وتمثل التطور العالمي للأنواع. أظهرت بيانات النمو الأولية في مرق المغذيات معدل نمو أقل للعزلات من العدوى المزمنة (الشكل 3). بالنظر إلى ذلك ، أصيبت G. mellonella في مجموعات من 10 يرقات بجرعات 101 أو 102 أو 10 3 أو 10 4 CFU / يرقة في 10 ميكرولتر من PBS ل PAO1 و PA14 و PAK ، وجرعات 102 أو 103 أو 10 4 أو 105 CFU / يرقة ل LESB58 و IST27-M. كما تم حقن مجموعتين من 10 يرقات ب PBS فقط ، مجموعة واحدة قبل العدوى ومجموعة واحدة بعدها. حقن PBS قبل مكافحة العدوى ل PBS الملوثة أو تلوث الإبر بالأنواع الميكروبية من بشرة الغاليريا ، بينما حقن PBS بعد مكافحة العدوى لأي تلوث للإبر بالبكتيريا المستخدمة في عملية العدوى. كانت الجرعات المثلى ل PAO1 و PA14 و PAK 10 CFU / يرقة ، حيث أدت الكثافات الأكبر إلى وفاة بنسبة 50٪ >بنسبة 18 ساعة (الشكل 4). كانت 10 CFU هي أقل جرعة يمكن تحضيرها بشكل موثوق ومتكرر للعدوى. كانت هناك حاجة إلى جرعات أعلى من LESB58 و IST27-M لتحقيق حركية البقاء المطلوبة ، مما يعكس النمو البطيء والقدرة الاستيعابية المنخفضة لهذه العزلات في ظل الظروف المختبرية (الشكل 4). كانت الجرعة المثلى لكليهما 104 CFU / يرقات. LESB58 و IST27-M هي عزلات سريرية من الأفراد المصابين بالتهابات مزمنة ، وقد أظهر LESB58 سابقا ضراوة أقل في نماذج القوارض من PAO122.
اختبار سمية التوبراميسين والكوليستين في غاليريا ميلونيلا
قبل تقييم فعالية المركبات الجديدة المضادة للميكروبات ، يجب تقييم سميتها عن طريق حقن مجموعة واسعة من الجرعات ذات الصلة سريريا. هذا يسمح بإزالة المركبات ذات السمية العالية من الاختبار في وقت مبكر من خط الأنابيب قبل السريري. تم تقييم توبراميسين وكوليستين ضد يرقات G. mellonella غير المصابة ، حيث يتم إعطاؤهما عادة لعلاج عدوى P. aeruginosa في الأشخاص المصابين بالتليف الكيسي (pwCF) 23. يتراوح الاستخدام السريري للتوبرامايسين من 3 ملغم / كغم يوميا للأفراد المصابين بأمراض خطيرة دون التليف الكيسي إلى 11 ملغم / كغم كل 24 ساعة لأولئك الذين يعانون من التليف الكيسي24،25. واستخدمت هذه القيم كدليل للجرعات في غاليريا ميلونيلا مع اختيار 1 مغ/كغ، 2.5 مغ/كغ، 5 مغ/كغ، 10 مغ/كغ، 25 مغ/كغ، 50 مغ/كغ، 100 مغ/كغ، 250 مغ/كغ توبراميسين لاختبار السمية. لم يلاحظ أي وفاة في أي تركيز. وبالنظر إلى عدم وجود سمية للتوبراميسين بتركيزات عالية، تم تقييم سمية الكوليستين لأنها ارتبطت سابقا بالسمية الكلوية أو العصبية في 29.8٪ من معامل كثافة الفولين متعدد الأشخاص، بجرعة تحميل قدرها 2.9 (±1.5) مغ/كغ والجرعة اليومية الإجمالية 4.1 (±1.1) مغ/كغ26. هذا جعله مرشحا قيما لاختبار السمية ، على الرغم من أن التأثيرات الخاصة بالأعضاء في البشر تشير إلى أن السمية قد لا تترجم إلى G. mellonella. في الواقع ، عندما تم إعطاء جرعات من 1 مغ / كغ ، 2.5 ملغم / كغم ، 5 مغ / كغ ، 10 مغ / كغ ، 25 ملغم / كغم ، 50 ملغم / كغم ، 100 ملغم / كغم ، و 250 ملغم / كغم من الكولستين ، لم يلاحظ أي موت لليرقات على مدى 72 ساعة. على هذا النحو ، تم إعطاء الكوليستين أخيرا بأعلى قابلية للذوبان في H2O ، عند 2000 مجم / كجم. وقد لوحظ موت جميع اليرقات في غضون 12 ساعة، مما يؤكد أنه يمكن تقييم سمية الدواء في G. mellonella ولكن ينبغي توخي الحذر عند محاولة التنبؤ بالسمية البشرية.
تحسين جرعة العلاج من توبراميسين ضد عدوى P. aeruginosa PAO1
تم إعطاء مجموعة من جرعات التوبراميسين ذات الصلة سريريا إلى اليرقات المصابة ب P. aeruginosa لتحسين جرعة العلاج. بالنسبة لمضادات الميكروبات الجديدة ، يمكن اختيار الجرعة في البداية بناء على الاستخدام السريري للمضادات الحيوية الموجودة المماثلة أو على البيانات قبل السريرية للعامل الجديد ، مثل الحد الأدنى من تركيزات مثبطات المرق. لتقييم فعالية التوبراميسين ضد P. aeruginosa PAO1 ، أصيبت يرقات G. mellonella ب 10 CFU من P. aeruginosa PAO1 ، كما تم تحسينه سابقا ، وحقنت ب 1 مجم / كجم ، 2.5 مجم / كجم ، أو 5 مجم / كجم توبراميسين بعد ساعتين من الإصابة. تم اختيار هذه الجرعات بناء على عمل G. mellonella السابق مع توبراميسين وتتماشى مع الجرعات السريرية الحالية من توبراميسين في الأفراد غير المصابين بالتليف الكيسي24،27،28.
كانت عتبة النجاح الأولي زيادة بنسبة 50٪ في بقاء G. mellonella مقارنة بالضوابط غير المعالجة. كان للعلاج PAO1 ب 1 ملغ/كغ من توبراميسين تأثير ضئيل على وفيات G. mellonella ، مع وفاة 90٪ في 28 ساعة بعد العدوى (الشكل 5). أدى العلاج ب 2.5 مغ/كغ من توبراميسين إلى تأخير معدل الوفيات ولكنه أسفر عن معدل وفيات بنسبة 80٪ بشكل عام باستخدام 5 ملغم/كغ من التوبراميسين، مما أدى إلى بقاء 90٪ على قيد الحياة على النحو الأمثل. كانت الجرعة الفعالة ل PA14 5 مغ / كغ ، ولكن بالنسبة ل PAK كانت 2.5 ملغم / كغم. كانت الجرعة الفعالة ل IST27-M أعلى عند 10 مغ / كغ ، في حين لم يكن تركيز توبراميسين المختبر كافيا لإنقاذ اليرقات من عدوى LESB58. ارتبط هذا الاتجاه بقيم الحد الأدنى للتركيز المثبط (MIC) للتوبراميسين في مرق مولر هينتون المعدل بالكاتيون ، حيث كان 1 ميكروغرام / مل كافيا لتثبيط 90٪ من النمو في جميع السلالات باستثناء LESB58 ، الذي كان لديه ميكروفون 8 ميكروغرام / مل. على هذا النحو ، يمكن استخدام اختبار MIC الأولي للإشارة إلى المقاومة النسبية بين السلالات ، على الرغم من أنه لا ينبغي استخدامه لتحديد نطاقات الجرعة في G. mellonella ، والتي يجب تحسينها بشكل منفصل.
تحسين توقيت علاج توبراميسين ضد عدوى المتصورة الزنجارية PAO1
لا يحدث التطبيق السريري للمضادات الحيوية عادة في غضون ساعات من الإصابة ولكن بعد أيام أو أسابيع. لا يمكن اختبار مضادات الميكروبات الجديدة بهذه الطريقة في G. mellonella ، حيث لوحظ ارتفاع معدل الوفيات في غضون 24 ساعة من الإصابة ب P. aeruginosa PAO1. لزيادة أهمية نموذج العدوى ، يجب إعطاء مضادات الميكروبات الجديدة في وقت متأخر قدر الإمكان أثناء العدوى. لتحسين مواعيد العلاج ، تم إعطاء 5 ملغم / كغم من توبراميسين ليرقات G. mellonella المصابة ب PAO1 في 2 ساعة و 4 ساعات و 6 ساعات و 9 ساعات و 12 ساعة بعد الإصابة. تم تعريف النجاح التجريبي على أنه العلاج بالمضادات الحيوية الذي أدى إلى زيادة بنسبة >50٪ في البقاء على قيد الحياة مقارنة بالعدوى ب PAO1. العلاج في 9 ساعات و 12 ساعة تأخر الوفيات ، على الرغم من أنه لم يكن قادرا على حل العدوى (الشكل 6). أسفر العلاج في 2 ساعة و 4 ساعات و 6 ساعات عن بقاء أكثر من 50٪.
تحسين حجم مجموعة G. mellonella
تم حساب حجم المجموعة التجريبية بناء على التباين الملاحظ في بقاء G. mellonella على قيد الحياة بعد الإصابة ب 10 CFU / يرقات P. aeruginosa PAO1. يمكن أن يختلف حجم المجموعة بناء على النسبة المئوية المتوقعة للتغيير بين المجموعة الضابطة غير المعالجة والمجموعة العلاجية في أي دراسة (الجدول 1). اتبعت الحسابات ما وصفه Charan et al.29. المعادلة المستخدمة موصوفة أدناه.
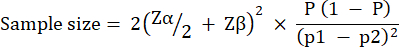
أين:
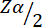 = 1.96 عند خطأ من النوع 1 بنسبة 5٪.
= 1.96 عند خطأ من النوع 1 بنسبة 5٪.
Zβ = 0.842 هي القيمة التي توفر قوة إحصائية بنسبة 80٪.
p1 = نسبة الأحداث في مجموعة الاختبار ، محسوبة على أنها p2 + النسبة المئوية المتوقعة للتغيير
p2 = نسبة الأحداث في المجموعة الضابطة (العدوى غير المعالجة) ، محسوبة على أساس تباين البقاء على قيد الحياة P. aeruginosa PAO1 عند 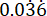 .
.
P = الانتشار المجمع ، يعرف بأنه (p1 + p2) / 2.
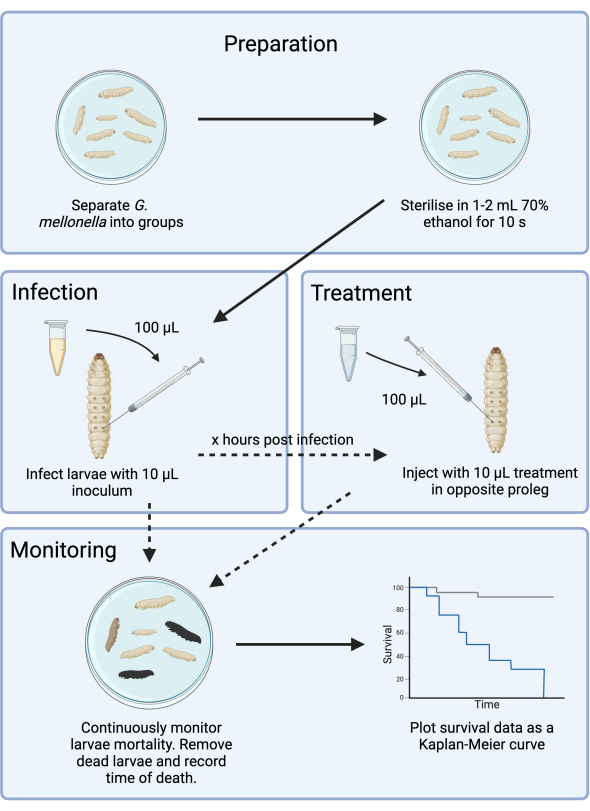
الشكل 1: رسم تخطيطي لدراسة عدوى G. mellonella . يتضمن البروتوكول العام تحضير يرقات G. mellonella قبل الإصابة ، والعدوى بلقاح 10 ميكرولتر ، والعلاج الاختياري في عدد من الساعات بعد الإصابة ، والمراقبة المستمرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
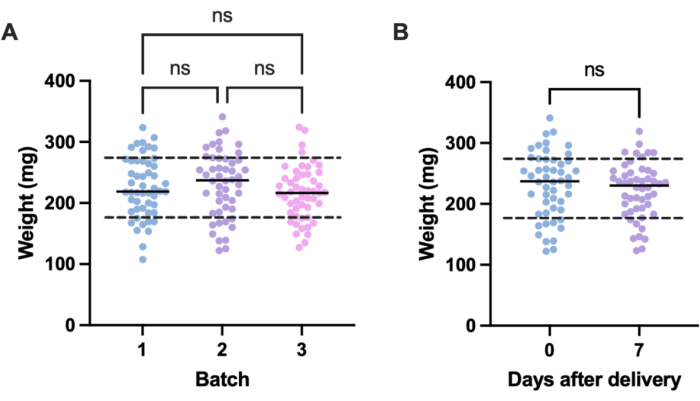
الشكل 2: التباين المعتمد على الدفعات والوقت في وزن يرقات Galleria mellonella . (أ) وزن ثلاث دفعات من 50 يرقة Galleria mellonella تزن فور الولادة. تم طلب كل دفعة في أوقات مختلفة. لم يكن هناك فرق كبير في الوزن عبر الدفعات كما تم حسابه بواسطة ANOVA أحادي الاتجاه (P > 0.05). (ب) وزن 50 يرقة وزنها عند الاستلام مقارنة بالدفعة نفسها التي وزنت بعد أسبوع واحد. لم يكن هناك فرق كبير في الوزن كما تم حسابه بواسطة اختبار t للطالب (P > 0.05). NS: ليس مهما. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
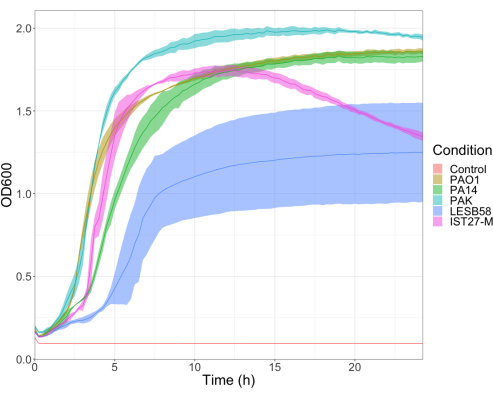
الشكل 3: منحنيات نمو سلالات P. aeruginosa PAO1 و PA14 و PAK و LESB58 و IST27-M. نمت كل سلالة في LB من OD600 الأولي من 0.08-0.13 ، وتم قياس OD600 لاحقا كل 15 دقيقة خلال 24 ساعة من النمو الثابت عند 37 درجة مئوية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
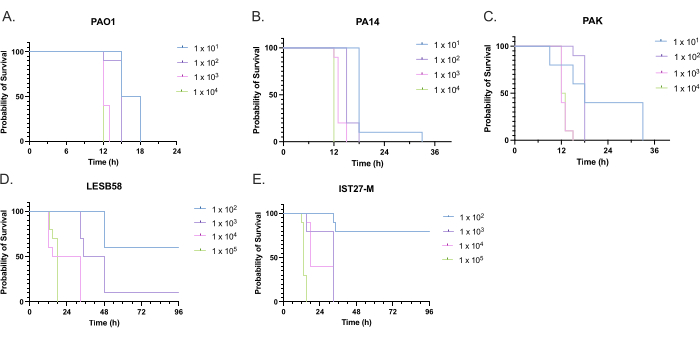
الشكل 4: تحسين كثافة اللقاح لسلالات Pseudomonas aeruginosa لإصابة يرقات Galleria mellonella. بقاء يرقات Galleria mellonella بعد الحقن بكثافات مختلفة من وحدات تكوين المستعمرات (CFU) لكل يرقة. كانت كثافات اللقاح المختبرة 10 أو 10² أو 10³ أو 104 CFU لكل يرقة ل (A) PAO1 أو (B) PA14 أو (C) PAK و 10² أو 10³ أو 10 4 أو 105 CFU لكل يرقة ل (D) LESB58 و (E) IST27-M. تم استخدام عشرة يرقات لكل مجموعة ، تم حقن كل منها ب 10 ميكرولتر من اللقاح في الساق الخلفية اليمنى. تمت مراقبة البقاء على قيد الحياة كل 30 دقيقة بدءا من 16 ساعة بعد الإصابة ، وتم تسجيل وقت الوفاة. أظهرت جميع السلالات ضراوة تعتمد على الجرعة على النحو المحدد في اختبار رتبة اللوغاريتم (Mantel-Cox) للأهمية. P < 0.05 لجميع مقارنات الجرعة داخل السلالة باستثناء PAK 101مقابل باك 102 ، باك 103ضد. باك 104 ، LESB58 104مقابل. LESB58 105 ، و IST27-M 103مقابل. IST27-M 104 ، والتي لم تكن كبيرة. هذا الرقم يمثل ثلاث نسخ بيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
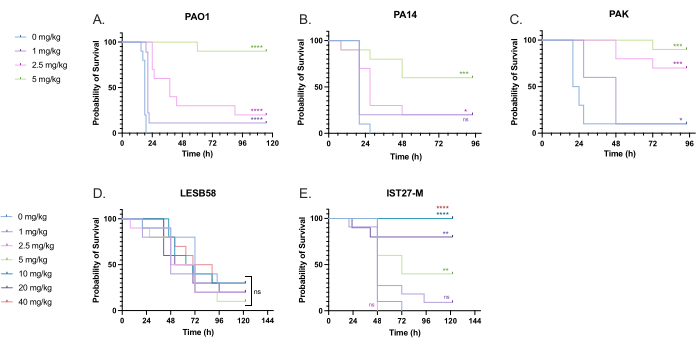
الشكل 5: بقاء يرقات Galleria mellonella بعد الحقن بسلالات لوحة P. aeruginosa ومعالجتها بكبريتات توبراميسين بعد 2 ساعة من الإصابة. أصيبت يرقات 10 G. mellonella لكل مجموعة تجريبية إما ب 10 CFU من (A) PAO1 أو (B) PA14 أو (C) PAK أو 103 CFU من (D) LESB58 أو (E) IST27-M لكل يرقات في 10 ميكرولتر من PBS. تم إعطاء العدوى إلى الساق اليسرى الخلفية. بعد ساعتين من الإصابة، تم حقن PAO1 وPA14 وPAK ب 10 ميكرولتر من PBS كعنصر تحكم بدون علاج، 1 مغ/كغ، 2.5 ملغ/كغ أو 5 ملغ/كغ توبراميسين، مع LESB58 وIST27-M عولجوا إما ب 10 ميكرولتر PBS أو 1 مغ/كغ أو 2.5 مغ/كغ أو 5 مغ/كغ أو 10 مغ/كغ أو 20 ملغ/كغ أو 40 ملغ/كغ توبراميسين، كما هو موضح في الشكل. تم تخفيف توبراميسين في الماء المقطر وإعطائه في الساق اليمنى الخلفية. تم مراقبة البقاء على قيد الحياة بشكل مستمر ، وتم تسجيل وقت الوفاة. اختبار رتبة اللوغاريتم (Mantel-Cox) للأهمية مقابل تحكم PBS لكل سلالة. ns: غير مهم ، * P < 0.05 ، ** P < 0.005 ، ** P < 0.0005 **** P < 0.0001. هذا الرقم يمثل ثلاث نسخ بيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
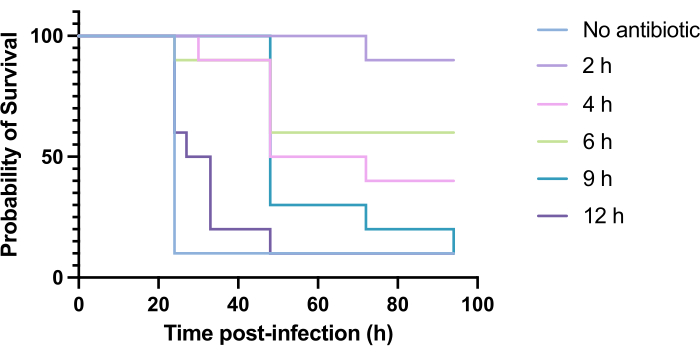
الشكل 6: بقاء يرقات Galleria mellonella على قيد الحياة بعد الإصابة بالزائفة الزنجارية PAO1 والعلاج اللاحق بالتوبراميسين في نقاط زمنية مختلفة بعد الإصابة. أصيبت 10 G. يرقات mellonella لكل مجموعة تجريبية ب 10 CFU من PAO1 في 10 ميكرولتر من PBS ، تم حقنها في الساق اليمنى الخلفية. وحقنت اليرقات بعد ذلك في 2 ساعة أو 4 ساعات أو 6 ساعات أو 9 ساعات أو 12 ساعة بعد الإصابة ب 5 مغ/كغ من كبريتات توبراميسين في 10 ميكرولتر من الماء المقطر في الجزء الخلفي الأيسر. تم مراقبة البقاء على قيد الحياة بشكل مستمر ، وتم تسجيل وقت الوفاة. اختبار رتبة اللوغاريتم (Mantel-Cox) للأهمية مقابل السيطرة غير المعالجة. P < 0.0005 ، **** P < 0.0001. هذا الرقم يمثل ثلاث نسخ بيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| التغير المتوقع في البقاء على قيد الحياة (٪) | حجم المجموعة |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
الجدول 1: حجم المجموعة لتجارب البقاء على قيد الحياة G. mellonella التي تصاب فيها يرقات G. mellonella ب 10 CFU / يرقات مع P. aeruginosa PAO1 ثم تدار عاملا.
Discussion
يتزايد عبء مقاومة مضادات الميكروبات باستمرار. في عام 2019 ، ارتبط ما يقدر بنحو 4.95 مليون حالة وفاة بمقاومة مضادات الميكروبات في جميع أنحاءالعالم 30. وبحلول عام 2050، يقدر أن يصل معدل الوفيات الناجمة عن مقاومة مضادات الميكروبات إلى 10 ملايين31. وللتصدي لهذا الخطر، يجب تطوير مضادات الميكروبات الجديدة واختبارها بكفاءة وفعالية من حيث التكلفة، مما يستلزم استخدام نماذج ما قبل السريرية تتنبأ بدقة بفعالية مضادات الميكروبات. يعد معدل الاستنزاف المرتفع الذي لوحظ أثناء الترجمة إلى التجارب السريرية عاملا مقيدا رئيسيا. وصفت إحدى الدراسات 13 مضادا حيويا مرشحا فشلوا في التجارب السريرية ، مع فشل 11 في التقدم إلى المرحلة الثانية32.
توفر الدراسة الحالية إطارا لتحسين دراسات فحص مضادات الميكروبات قبل السريرية G. mellonella وطريقة لتقييم فعالية مضادات الميكروبات. تتمتع يرقات G. mellonella بفائدة كبيرة في تقييم سمية الدواء ، وتحديد MIC ، واختبار الفوعة ، مع المساهمة في الحد من الثدييات المستخدمة في التطور قبل السريري. تتمتع يرقات Galleria mellonella بإنتاجية عالية نسبيا ، وهي ذات صلة بيولوجية ، وتترجم جيدا إلى نماذج ثدييات أكثر تعقيدا. وفي الوقت نفسه ، في حين أن الفئران المختبرية من النوع البري تكلف ما بين 8 جنيهات إسترلينية و 30 جنيها إسترلينيا لكل منها مع ~ 7 جنيهات إسترلينية صيانة أسبوعية لكل فأر ، تكلف G. mellonella ~ 2 جنيه إسترليني لكل 50 يرقة. لذلك ، فإن اختبار 10 مركبات في نموذج G. mellonella سيكلف ~ 60 جنيها إسترلينيا ، مقارنة بما يزيد عن 4000 جنيه إسترليني لنفس الدراسة على الفئران. علاوة على ذلك ، قارنت الدراسات السابقة سمية وفعالية المركبات الجديدة وحددت علاقة بين السمية الحادة في G. mellonella والفئران8،19،33. لذلك ، يوصى بتنفيذ شاشة G. mellonella لتحديد أولويات المركبات المراد اختبارها بشكل أكبر في نماذج الماوس.
على الرغم من الفائدة الواضحة للنموذج ، هناك العديد من الاعتبارات لضمان التطبيق الناجح. يؤدي عدم وجود يرقات معقمة من الدرجة البحثية إلى تعقيد تحضيرها للاستخدام التجريبي ، حيث يلزم تعقيم الإيثانول ، أو يطلب من الباحثين الحفاظ على مستعمرة G. mellonella الخاصة بهم ، والتي من شأنها أن تخفف من مخاطر التلوث وتحسن الجودة التجريبية الشاملة 5,6. يمكن أن يؤدي التعقيم غير السليم إلى وفيات كبيرة ، ومن الصعب تعقيم الكائن الحي بالكامل ، حيث يؤدي وقت التعرض الطويل للإيثانول إلى الوفاة. تشمل الطرق البديلة للتعقيم مسح ساق كل يرقة بنسبة 70٪ من الإيثانول قبل الإصابة ، مما يقلل من معدل الوفيات أثناء التعقيم ، ولكنه طريقة أكثر كثافة في العمل. يمكن أيضا استخدام مطهرات أخرى ، على الرغم من عدم تقييم أي بدائل في هذه الدراسة ، حيث أدى تعقيم الإيثانول إلى وفاة بنسبة < 10٪ ، بمجرد تحسينها. علاوة على ذلك ، غالبا ما يكون من غير الواضح ما إذا كان الموردون يعالجون G. mellonella بالمضادات الحيوية ، حيث قد يحصل الموردون على يرقاتهم من موردين آخرين بدلا من الحفاظ على المستعمرات بأنفسهم.
تختلف بيولوجيا G. mellonella اختلافا كبيرا عن الثدييات ، مما يفرض قيودا على فائدتها. يفتقر جهاز المناعة لديهم إلى أي مناعة تكيفية، على الرغم من وجود الجوانب الرئيسية القابلة للذوبان والخلوية للمناعة الفطرية. الخلايا الدموية هي دفاع مناعي فطري رئيسي ل G. mellonella وتظهر خصائص تشبه البلعمة. تم وصف مجموعات فرعية مختلفة من هذه الخلايا ، بما في ذلك الخلايا المحببة والخلايا البلازمية ، من بين أمور أخرى34. لا تستطيع G. mellonella أيضا تلخيص مواقع العدوى ذات الصلة ، مثل تلك الخاصة بالتهابات الجهاز التنفسي أو المثانة. ومع ذلك ، في خط الأنابيب قبل السريري ، سيكون G. mellonella بمثابة فحص مسبق لنماذج الفئران ، مما يضمن أن المركبات الواعدة فقط هي التي ستتقدم إلى نظام الثدييات المعقد الذي يشبه إلى حد كبير بيئات العدوى البشرية. أخيرا ، سيستفيد النموذج من المزيد من التوصيف الجينومي ل G. mellonella لتحديد مدى ملاءمته لتقييم التغيرات في المؤشرات الحيوية ذات الصلة سريريا. على وجه الخصوص ، هذا يستلزم تحسين فهمنا لمناعة G. mellonella.
بشكل عام ، يعد نموذج عدوى Galleria mellonella أداة قيمة للتقييم قبل السريري للمركبات الجديدة المضادة للميكروبات قبل تقييمها في نماذج الثدييات. في حين أن استخدامها معقد بسبب الافتقار إلى توحيد العرض ، فإن تطبيقها عالي الإنتاجية وبسيط ويمكن تطبيقه على نطاق واسع عبر مشهد تطوير مضادات الميكروبات. في المستقبل ، يمكن أن يؤدي دمج هذا النموذج ضمن خط أنابيب موحد قبل السريري إلى تسريع تطوير مركبات جديدة مضادة للميكروبات لزيادة نسبة المرشحين الذين يتقدمون من التقييم قبل السريري إلى التجارب السريرية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تلقى TB و AK و JF و DN دعما للمنح لمركز البحوث الاستراتيجية (SRC) "إطار ما قبل السريري القائم على الأدلة لتطوير علاجات مضادة للميكروبات في التليف الكيسي" (PIPE-CF; رقم المشروع SRC 022) من صندوق التليف الكيسي في المملكة المتحدة ومؤسسة التليف الكيسي الأمريكية. يقر LD و JF بالتمويل من أبحاث الكلى الشمالية الغربية (المشروع رقم 49/19).
Materials
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
References
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved