Method Article
抗菌スクリーニングモデルとしてのGalleria mellonella
要約
この研究は、前臨床抗菌評価で使用するために G.mellonella 感染モデルを最適化するための標準化されたフレームワークを示しています。 G. mellonella モデルを前臨床抗菌薬開発パイプラインの一部として適用することで、臨床試験に進む効果のない化合物の数を減らすことができるかもしれません。
要約
世界的に高まる抗生物質耐性の問題に立ち向かうためには、新規抗菌薬の開発を加速させることが不可欠です。現在の前臨床抗菌薬開発では、臨床試験前または臨床試験中に不適切であることが証明されたリードが相当数得られています。前臨床開発の効率を高めるためには、関連性があり、標準化され、アクセスしやすく、費用対効果の高いモデルを開発する必要があります。 Galleria mellonella (オオガロガ)の幼虫は、微生物の病原性を評価するための感染モデルとして広く使用されており、薬物毒性試験を実施し、新規抗菌化合物の 生体内 有効性を評価する予備的な手段として機能します。これらの感染モデルは、同等のスループットを持つ多くのin vitroスクリーニングよりも生物学的関連性が高く、抗菌試験のプレスクリーニングとして使用すると、哺乳類モデルへの依存度が低下します。このプロトコルは、 G. mellonella 感染モデルの最適化のための標準化された方法論を説明しています。これは、細菌種や選択した抗菌治療薬に適用できます。WHOの優先病原体である 緑膿菌 を例に、再現性のある感染モデルと治療的検査を開発するために実行できる手順を概説します。これには、実験のセットアップ、サンプル調製、感染および治療プロトコルに関する推奨事項が含まれます。このモデルを前臨床抗菌薬開発パイプラインに統合することで、哺乳類モデルへの依存度が減少し、臨床試験に到達する効果のない化合物の数が減り、最終的には前臨床抗菌薬開発の効率が向上します。
概要
Galleria mellonella(オオオカゲ)の幼虫は、微生物種の感染モデルとして、また新規薬物化合物の毒性試験として、生物科学全体で広く使用されています1,2。これらは、ハイスループットであり、ヒト感染の不可欠なin vivo特性を再現し、研究における哺乳類種の倫理的使用を規定する削減、改良、および置換の原則に沿って哺乳類モデルへの依存を減らすため、前臨床抗菌試験パイプラインでかなりの有用性を持つ可能性があります。
新しい抗菌薬の開発には、臨床検証に先立って、 in vitro および in vivo モデルで広範な前臨床試験を行う必要があります3。有望な前臨床データパッケージを持つ新規薬剤はごくわずかで、この高い離脱率の1つは、感染環境の複雑さを捉えるための前臨床スクリーニングの失敗です4。これらの問題は、臨床への抗菌薬の翻訳率が低いだけでなく、後期前臨床スクリーニングにおける実験脊椎動物の使用の増加にも寄与しています。新規抗菌薬の前臨床評価を改善し、高価で時間がかかり、複雑で倫理的に問題のあるマウス のin vivo モデルの使用を減らすためには、脊椎動物系での試験に進む見込みのない化合物の数を減らす、より優れた初期段階の薬物スクリーニングツールが必要です。
G. mellonellaは、卵、幼虫、蛹、成虫の4つの生活段階からなる8週間の短いライフサイクルを有し、そのうちの幼虫の形態は、このプロトコル1で利用されています。G. mellonellaは、専門の機器や専用の動物研究施設を必要とせずに、実験全体を通して簡単にメンテナンスできます。それらの使用について倫理的承認を求める必要はなく、研究者は実験品質を改善するために生物を社内で繁殖させることができます2,5,6,7。G. mellonellaの免疫系は、哺乳類の自然免疫系と非常によく似ており、「自己」および「非自己」の刺激に応答する能力を持っています8。血球は、病原体に関連する分子パターン認識とその後の食作用に関与しており、ヒトの好中球と機能的に類似した役割を果たしています9。G. mellonellaは、配列によってヒトとの相同性によって同定された3種類のToll様受容体をコードし、非自己物質を認識し、フェノロキシダーゼのメラニン10への活性化および重合に続いて局在するメラニン化複合体を形成する補体様タンパク質を産生します。これは、感染実験中にキューティクルがメラニン化によって暗くなるため、幼虫の健康状態を視覚的に読み取るのに役立ちます。ただし、フェノールオキシダーゼを含む昆虫のメラニン化軸は、哺乳類のチロシナーゼ-メラニン軸とは大きく異なることに留意すべきである11,12。さらに、G. mellonellaは、リゾチームやディフェンシンホモログ13を含む18の誘導性抗菌ペプチドを産生する。この類似性に加えて、モデルの単純な幼虫の維持手順と高スループットの性質により、G. mellonella は新薬の評価に広く利用される生物となっています。前臨床抗生物質の開発において、G. mellonellaは、能動免疫を持つ複雑な環境での宿主-病原-薬物相互作用をより正確にモデル化できるため、in vitroモデルと比較して有用性が向上しています。
現在、ヨーロッパにはG.mellonellaの標準化された研究グレードのサプライヤーはありません。研究者は代わりに、餌屋からG.mellonellaの幼虫を購入するか、独自のコロニーを維持する必要があります。G. mellonellaのコロニーを社内で維持する方法が説明されており、実験の一貫性を高めることができます5,6,7、この選択肢は、幼虫を頻繁に使用する人々にとってのみ魅力的である可能性があります。そのため、このプロトコルは、生き餌の供給者から幼虫を購入した後の実験設定に焦点を当てています。この方法は、よりアクセスしやすい一方で、実験の複雑さを増し、サプライヤーから幼虫を受け取る時点での幼虫の健康状態に一貫性がないため、アッセイに追加のばらつきをもたらす可能性があります。学術界、産業界、規制当局がG.メロネラ試験を前臨床抗菌薬開発パイプラインの一部として受け入れ、採用するためには、抗菌薬の有効性の最適化と評価のための標準化されたシステムが必要です。
この研究は、抗生物質開発のためのG.mellonella感染モデルの実験デザインを最適化します。G. mellonella感染モデルが記載されているが14,15、本方法論は、供給の不一致によってもたらされる追加の複雑さを軽減するための追加のステップを文書化し、新規抗菌薬の評価のためのフレームワークを提供する。テストケースとして、G. mellonellaをWHO優先1の病原体である緑膿菌に感染させ、アミノグリコシド剤(トブラマイシン)による治療を最適化しました。図1に示すこのフレームワークは、新規薬剤を用いた将来の前臨床抗菌スクリーニング研究の基盤となります。
プロトコル
この研究では、 Galleria mellonella (オオオカゲ)の幼虫を抗生物質感受性試験および急性毒性試験のモデルとして選択しました。 Galleria mellonellaの実験的使用に倫理的承認は必要ありません。.使用した試薬や機器の詳細は 、資料表に記載されています。
1. 実験計画法
- 研究が捕捉することを目指している幼虫の生存率の比例的な変化に基づいて、適切な Galleria mellonella 幼虫グループサイズを決定します。 表1 は、 緑膿菌PAO1 感染モデルを用いて生存率の特定の割合の変化を検出するために必要なグループサイズを詳述している。
注:新規病原体を使用する場合は、まず、感染したが未治療の幼虫の比例生存率のアッセイ間変動性を決定します。- PBSコントロールには、シリンジが鋭利で使用に適していることを確認するために残りの感染前に注射するグループと、細菌感染中または感染後に注射して感染グループ間の適切な滅菌を確保するための2つのグループを含めます。新しい病原体で最適化する場合は、異物に対する免疫反応による死亡ではないことを確認するために、加熱処理されたコントロールを含めます。
注:インスリン注射器は注射に使用できるため、鈍化や汚染のリスクが軽減されます。しかし、実験では日常的に数百種類の G.メロネラ菌が使用されるため、インスリン注射器の使用は高価で無駄になります。 - 抗菌治療を最適化する研究では、細菌に感染したグループとビヒクルの「偽」治療を注射するグループ、ビヒクルを2回注射するグループ(感染時に1回は他の条件に、1回は治療時に)の2つのコントロールを追加します。
注:前者は未治療のコントロールであり、後者は注射によって引き起こされたトラウマを制御します。このような外傷は、鈍い針を使用するとより可能性が高くなります。
- PBSコントロールには、シリンジが鋭利で使用に適していることを確認するために残りの感染前に注射するグループと、細菌感染中または感染後に注射して感染グループ間の適切な滅菌を確保するための2つのグループを含めます。新しい病原体で最適化する場合は、異物に対する免疫反応による死亡ではないことを確認するために、加熱処理されたコントロールを含めます。
- G.メロネラを生き餌の供給業者に注文するか、前述の5,6,7のようにG.メロネラのコロニーを維持します。材料表に記載されているサプライヤーは、サイズに基づいて約33%が除外され、さらに10%がキューティクル滅菌後に死亡する可能性があるため、予定された幼虫の数の1.8倍を注文してください。
- 実験に使用する前に G.mellonella の重量変動性を判断し、重量範囲が平均の1標準偏差を超えないようにしてください。
注意: 材料表に記載されていないサプライヤーの場合は、サプライヤーに新しい在庫を提供するように手配してください。
- 実験に使用する前に G.mellonella の重量変動性を判断し、重量範囲が平均の1標準偏差を超えないようにしてください。
- 受領後、 G. mellonella を室温で保存して、37°Cでのインキュベーション後に発生する繭化の可能性を制限してください。
注:商業供給業者からのすべての幼虫が繭を形成するわけではなく、これは以前に幼虫の健康の指標として使用されてきました16。 - 幼虫は受領後1週間以内に使用してください、その場合、彼らは給餌を必要としません。
注:幼虫のライフステージはバッチによって異なりますが、ほとんどの幼虫は蛹になる前の最後の幼虫に出産されます。この段階では、摂食は前の段階と比較して自然に減少します17。
2. G. mellonella 幼虫の滅菌と選抜
- Galleria mellonellaの幼虫の体重を量り、幼虫の平均重量である224 mg±49.2 mgの範囲外にあるものは捨てます。これにより、幼虫の約33%が除外されます。
注:重量のばらつきはサプライヤーによって異なる場合があります。このプロトコルに記載されていない供給業者については、適切な重量範囲を計算してください。 - アセプティック条件下で次の手順を実行します。
- 70%エタノールをシャーレにスプレーし、ディッシュの底を覆うのに十分な量を確保します。
- G. mellonellaの表面を10〜20匹の幼虫のバッチで滅菌します。
- 各バッチを個別に皿に入れ、幼虫に70%エタノールを2回スプレーします。
- ピンセットを使用して幼虫を転がし、完全にカバーします。
- エタノールから幼虫を取り出し、滅菌済みのペトリ皿に入れます。幼虫を乾かすために、皿を蓋をせずにおいてください。
注意: G.mellonella をエタノールに15秒以上放置すると、死亡率が高くなります。
- 幼虫の約90%が2時間後に活動を再開したら、回収した幼虫を 、表1に詳述されている検出力の計算に従って生存変化を十分に検出できるサイズのグループに分けます。
- G. mellonellaは滅菌後6時間以内に使用してください。
3. 細菌の接種密度の最適化
- 感染前に既知のCFU/mLの細菌感染ストックを調製します。ストックの生成方法は生物によって異なります。ここでは、 緑膿菌を 栄養ブロス中で中対数期まで増殖させ、分注し、6 x 107 CFU/mLの密度で凍結しました。
- 感染ストックを10,000 x g 、室温で5分間遠心分離してペレット化し、PBSに再懸濁します。各幼虫に10μLの接種材料が注射されることを考慮して、幼虫あたり101-10 7 CFUの範囲の接種量を生成するために、細菌ストックを10倍に連続希釈します。
注:特定の接種範囲は細菌の病原性によって異なりますが、ここで提案されている範囲はほとんどの病原性種に適しているはずです。 In vitro の成長率の決定は、液体培養における菌株特異的な成長率が幼虫の死亡率と相関しているため、適切な用量範囲の選択に役立つ可能性があります。 - 感染を開始する前に、MilesおよびMisra段階希釈で接種物を列挙し、接種物密度18を正確に決定します。
- 滅菌dH2O、70%エタノール、または滅菌PBSのいずれかを含む3本の1 mLマイクロチューブを調製します。これらは、幼虫を注入するために使用される注射器を滅菌するために継続的に使用されます。
- 滅菌済みの100μLハミルトンシリンジを検査し、針先が鋭利で、感染部位に重大な外傷を引き起こすフックが発生していないことを確認します。
注意: ハミルトンシリンジの針先は、約300回の感染後に反り始めます。針先がゆがんでいる場合は、交換する必要があります。 - 感染する前に、シリンジをdH2O、エタノール、およびPBSで順次洗浄し、シリンジの最大容量を引き出して廃棄します。
- 再懸濁した感染接種物をボルテックスし、ハミルトンシリンジに最大100μLを吸い上げ、幼虫あたり10μLを注入するのに十分です。
- 各幼虫に10μLの接種物を右後部前脚に注入します。針が体内に約2mm貫通していることを確認します。
注:さまざまな感染方法を使用できます。これらには、幼虫をピペットの先端にかざして前脚を露出させる、シリンジを静的に固定して G.mellonella を手で位置決めする、またはフリーハンドで注射することが含まれます。 - 感染の各セットの間に、ステップ2.5で詳述されているようにシリンジを滅菌して、残留皮膚の共生による汚染を防ぎます。.
- 感染した幼虫を、微生物の増殖に十分な温度、20°Cから42°C(G. mellonellaの生存に適した範囲)でインキュベートします5。
- G. mellonellaの生存を、通常最初に死亡が観察される時点から定期的にモニタリングし、死亡時間を正確に測定します。これは、第一画面で評価する必要があります。死んだ幼虫をすべて取り除き、死亡時刻を記録します。
- 18時間までに50%の死亡率、72時間までに80%を超える死亡率をもたらす用量に基づいて、治療試験研究に最適な感染用量を選択します。これにより、十分な病原性と適切な治療ウィンドウを確保しながら、迅速な1日スクリーニングの開発が可能になります。
4. 新規抗菌薬の非感染幼虫に対する毒性試験
- 実験的に感染した幼虫に使用する前に、 Galleria mellonella の新規抗菌薬と選択したビヒクルの毒性を評価します。in vitro (細胞株など)の毒性データ(利用可能な場合)に基づいて、抗菌薬の予想される治療範囲を超える広範囲の用量を準備します。.
- 幼虫に10μLの治療薬が注射されることを考えてください。ビヒクルのみのコントロールを、治療薬が送達される濃度と一致する濃度で調製します。
- ステップ3.2-3.10で詳述されているように、さまざまな抗菌剤およびPBSビヒクル濃度で、適切なグループサイズで健康で無菌の G.mellonella を注入します。本研究では、使用した抗菌薬はトブラマイシンでした。
注:溶媒としてDMSOを必要とする薬剤の場合、DMSOを使用すると大きな針による外傷が死亡率を増加させるため、標準の22ゲージ針ではなく、26秒ゲージの針で注入してください。 - 安全な用量を、PBSのみを注射した幼虫と比較して死亡率に大きな差がない用量と定義します。
5. 抗菌剤によるG.メロネラ菌感染症の治療の最適化
- 感染した幼虫が10μLの用量で治療されることを考慮して、抗菌剤の用量の範囲を準備します。ステップ4で評価したように、毒性を最小限に抑えたさまざまな用量を使用してください。.
- このプロトコルのステップ1と2に従って、以前に最適化された感染用量で適切なグループで Galleria mellonella を準備して感染させます。.
- 感染後2時間で、調製した抗菌剤またはビヒクル制御溶液で幼虫を治療します。.手順3.2〜3.8に従い、感染時に注射した前脚とは反対の前脚に注射します。グループ間で針を滅菌します。
注:この最適化のために2時間での治療は、強力な用量反応データを取得するために選択され、そこからその後の治療タイミングの最適化が決定された19。 - G. mellonellaの生存を、通常最初に死亡率が観察される時点から30分間隔またはそれ以上の頻度で監視します。死んだ幼虫をすべて取り除き、死亡時刻を記録します。
- 治療群間の生存率の変化を計算します。Kaplan-Meier生存分析を使用して、治療が幼虫の死亡率の有意な変化につながるかどうかを判断します。マルチグループ解析のペアワイズ多重度に対する適切な事後補正を含めます。
6. 感染したG. mellonellaの治療タイミングの最適化
- 手順1と2に従って、以前に最適化された感染用量で適切なグループで Galleria mellonella を準備します。.
- ステップ4で以前に最適化した用量で抗菌剤を調製します。
- 感染後2時間、4時間、6時間、9時間、または12時間後に、感染した幼虫をステップ3.2〜3.8に従って治療し、治療のタイミングが死亡率にどのように影響するかを比較します。
- G. mellonellaの生存を、通常最初に死亡率が観察される時点から30分間隔またはそれ以上の頻度で監視します。死んだ幼虫をすべて取り除き、死亡時刻を記録します。最適なタイミングは、治療用量の初期最適化後に観察された生存を維持するタイミングです。
注: G. mellonellaの抗菌効果をテストする場合は、治療用量とタイミングの両方を別々に最適化し、前者を使用して後者の治療用量を通知します。.
結果
G. mellonella 重量のバッチ変動の評価
感染実験における望ましくないばらつきの潜在的な原因は、個々の実験ユニット(すなわち、幼虫)間およびバッチ間のサイズの違いから来ています。この変動の影響は、体重に基づいて治療用量または感染用量を調整するか、実験で使用するために定義された体重範囲内の幼虫のみを選択することによって軽減できます。後者の調整はより実用的であり、用量調製中に発生する可能性のある人為的ミスの影響を受けません。.幼虫の体重を量ることのさらなる利点は、幼虫に投与されたものからそれらのmg / kgの人間の同等物への治療用量の変換を可能にすることです。バッチ内およびバッチ間のばらつきを定量化するために、異なる時期に注文された50匹の幼虫の3つのバッチを秤量しました。各群の平均重量は225.5mg、230.54mg、215.86mgで、標準偏差はそれぞれ49.1mg、53.7mg、44.3mgでした(図2A)。バッチ間では、重量に大きな差はありませんでした。バッチ全体で、重量は107.5 mgから341.0 mgの範囲であり、平均は224.0 mg±49.2 mgでした。
再現性のある結果を得るために、実験前に幼虫の体重を測定し、体重が224 mg±49.2 mgの場合を選択し、重量の範囲を233.5 mgから98.4 mgに減らし、幼虫を33%取り除きました。これは、体重帯が100 mg14,20を超えるMRSAに感染した幼虫の生存率に有意な変動を同定した以前の研究と一致しています。また、幼虫が到着直後に使用しない場合、体重の大幅な変化が実験結果に影響を与える可能性があるため、分娩時のG.メロネラの体重と送達後1週間の体重を比較しました。G. mellonellaの平均重量は230.54 mg±53.7 mgでした。分娩後1週間の平均重量は221.8mg±標準偏差は45.7mgでした(図2B)。到着時の体重と1週間後の体重との間に有意差はなく、このことから、幼虫は分娩から最初の1週間以内の任意の時点で実験目的に使用できると結論付けています。これらの結果は、1つの供給者から購入したG.mellonellaのみを表しており、供給者間または幼虫が異なる時期に注文された場合、重量は大幅に異なる可能性があることに注意することが重要です。
緑膿菌PAO1の接種密度の最適化
4つの接種密度で 緑膿菌 分離株5株(PAO1、PA14、PAKの3つの一般的な実験室株、および慢性呼吸器感染症からの2つの臨床分離株LESB58、およびIST27-M)の病原性を評価した。これらは、Mahenthiralingamらによって開発されたCF関連ひずみパネルの一部として使用されました。21 であり、種の世界的な系統発生を代表しています。栄養ブロスの予備的な成長データは、慢性感染からの分離株の成長率が低いことを示しました(図3)。このことから、 G. mellonella は、PAO1、PA14、PAKについてはPBS10μlに101、102、103、または104 CFU/幼虫を投与し、LESB58およびIST27-Mについては102、103、104、または105 CFU/幼虫を投与した10匹の幼虫のグループで感染しました。10匹の幼虫の2つのグループにもPBSのみを注射され、1つのグループは感染前、もう1つのグループは感染後に注射されました。感染前のPBS注射は、汚染されたPBSまたはガレリアキューティクルからの微生物種による針の汚染を制御しますが、感染管理後のPBS注射は、感染プロセスで使用される細菌による針の汚染を管理します。PAO1、PA14、およびPAKの最適用量は10CFU/幼虫であり、密度が高いほど18時間までに50>死亡しました(図4)。10 CFUは、感染に対して確実かつ再現性よく準備できる最低用量でした。望ましい生存速度を達成するためには、高用量のLESB58およびIST27-Mが必要であり、 これは、in vitro 条件下でこれらの分離株の増殖が遅く、運搬能力が低いことを反映しています(図4)。両方の最適用量は104 CFU /幼虫でした。LESB58およびIST27-Mは、慢性感染症を有する個人からの臨床的分離株であり、LESB58は以前にげっ歯類モデルでPAO122よりも低い病原性を示しました。
Galleria mellonellaにおけるトブラマイシンとコリスチンの毒性試験
新規抗菌化合物の有効性を評価する前に、臨床的に関連性のある幅広い用量を注射することにより、その毒性を評価する必要があります。これにより、毒性の高い化合物を前臨床パイプラインの早い段階で試験から除外することができます。トブラマイシンとコリスチンは、嚢胞性線維症(pwCF)の人々の緑膿菌感染症の治療のために一般的に投与されるため、感染していないG.mellonellaの幼虫に対して評価されました23。トブラマイシンの臨床使用は、嚢胞性線維症のない重症者のための毎日3mg / kgから、嚢胞性線維症の人々のための24時間ごとに11mg / kgまでの範囲です24,25。これらの値は、1 mg / kg、2.5 mg / kg、5 mg / kg、10 mg / kg、25 mg / kg、50 mg / kg、100 mg / kg、250 mg / kgトブラマイシンを毒性試験に選択して、Galleria mellonellaでの投与のガイドとして使用しました。.どの濃度でも死亡は観察されませんでした。高濃度でのトブラマイシンの毒性の欠如を考慮すると、コリスチン毒性は、以前にpwCFの29.8%で腎毒性または神経毒性と関連していたため、負荷用量は2.9(±1.5)mg / kg、全1日量は4.1(±1.1)mg / kgであったため、評価されました26。そのため、毒性試験の有力候補となりましたが、ヒトにおける臓器特異的な影響から、毒性がG.メロネラ菌には反映されない可能性があることが示唆されました。実際、1 mg/kg、2.5 mg/kg、5 mg/kg、10 mg/kg、25 mg/kg、50 mg/kg、100 mg/kg、250 mg/kg のコリスチンを投与した場合、72 時間にわたって幼虫の死亡は観察されませんでした。そのため、コリスチンは最終的にH2Oへの最高溶解度である2000 mg / kgで投与されました。すべての幼虫の死亡が12時間以内に観察され、G. mellonellaの薬物毒性を評価できることが確認されましたが、ヒトの毒性を予測しようとするときは注意が必要です。
緑膿菌PAO1感染に対するトブラマイシンの投与量の最適化
臨床的に関連性のあるさまざまなトブラマイシン用量が、P. aeruginosaに感染した幼虫に投与され、治療投与量を最適化しました。.新規抗菌薬の場合、投与量は、類似の既存の抗生物質の臨床使用に基づいて、またはブロスの最小阻害濃度などの新規薬剤の前臨床データに基づいて最初に選択できます。緑膿菌PAO1に対するトブラマイシンの有効性を評価するために、G.mellonellaの幼虫は、以前に最適化されたように、緑膿菌PAO1の10 CFUに感染し、感染後2時間で1 mg / kg、2.5 mg / kg、または5 mg / kgのトブラマイシンを注射しました。.これらの用量は、トブラマイシンと以前のG.mellonellaの研究に基づいて選択され、嚢胞性線維症のない個人におけるトブラマイシンの現在の臨床用量と一致しています24,27,28。
初期成功の閾値は、未治療の対照群と比較して、 G. mellonella の生存率が50%増加したことであった。1 mg / kgのトブラマイシンによるPAO1治療は、 G.メロネラ 菌の死亡率にほとんど影響を与えず、感染後28時間で90%が死亡しました(図5)。2.5 mg/kgのトブラマイシンによる治療は死亡率を遅らせましたが、5 mg/kgのトブラマイシンによる全体的な死亡率は80%で、最適な90%の生存率が得られました。.PA14の実効用量は5 mg / kgでしたが、PAKの実効用量は2.5 mg / kgでした。IST27-Mの実効用量は10 mg / kgと高く、LESB58感染から幼虫を救うのに十分なトブラマイシン濃度は試験されませんでした。この傾向は、陽イオン調整ミューラーヒントンブロス中のトブラマイシンの最小阻害濃度(MIC)値と相関しており、MICが8μg/mLであったLESB58を除くすべての菌株で1μg/mLで増殖の90%を阻害するのに十分でした。そのため、初期のMICテストは、菌株間の相対的な耐性を示すために使用できますが、 G. mellonellaの用量範囲を決定するために使用すべきではなく、個別に最適化する必要があります。
緑膿菌PAO1感染に対するトブラマイシン治療タイミングの最適化
抗生物質の臨床適用は、通常、感染から数時間以内には行われず、感染から数日または数週間後に行われます。緑膿菌PAO1に感染してから24時間以内に高い死亡率が観察されるため、この方法で新規抗菌薬を試験することはG.mellonellaでは達成できません。感染モデルの関連性を高めるために、新規抗菌薬は感染中にできるだけ遅く投与する必要があります。治療タイミングを最適化するために、感染後2時間、4時間、6時間、9時間、および12時間に、PAO1感染G.メロネラの幼虫に5 mg / kgのトブラマイシンを投与しました。.実験的成功は、PAO1 の感染と比較して生存率が >50% 増加する抗生物質治療として定義されました。9時間後および12時間後の治療では、感染を解消することはできなかったが、死亡率が遅れた(図6)。2時間、4時間、6時間での治療では、50%以上の生存率が得られました。
G. mellonellaグループサイズの最適化
実験群のサイズは、緑膿菌PAO1の10 CFU /幼虫に感染した後のG.mellonellaの生存率に観察された変動に基づいて計算されました。グループのサイズは、どの研究でも未治療のコントロール群と治療群の間の予想される変化率によって異なる場合があります(表1)。計算は、Charan et al.29によって記述されているものに従いました。使用される式について、以下で説明します。
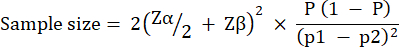
どこ:
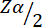 = 1.96、タイプ1誤差5%。
= 1.96、タイプ1誤差5%。
Zβ = 0.842 は、80% の統計的検出力を提供する値です。
p1 = テストグループ内のイベントの割合 (p2 + 期待される変化率として計算)
p2 = 緑 膿菌 PAO1 の 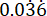 での生存変動に基づいて計算された、対照 (未治療の感染) 群のイベントの割合。
での生存変動に基づいて計算された、対照 (未治療の感染) 群のイベントの割合。
P = プールされた有病率で、(p1 + p2)/2 と定義されます。
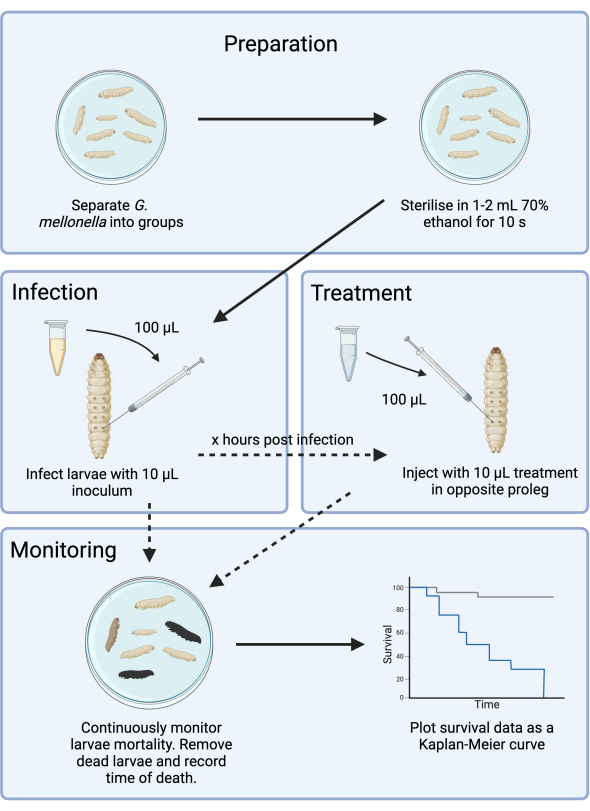
図1: G. mellonella 感染研究の概略図。 一般的なプロトコルには、感染前の G.メロネラ 幼虫の調製、10μLの接種物による感染、感染後数時間での任意の治療、および継続的なモニタリングが含まれます。 この図の拡大版を表示するには、ここをクリックしてください。
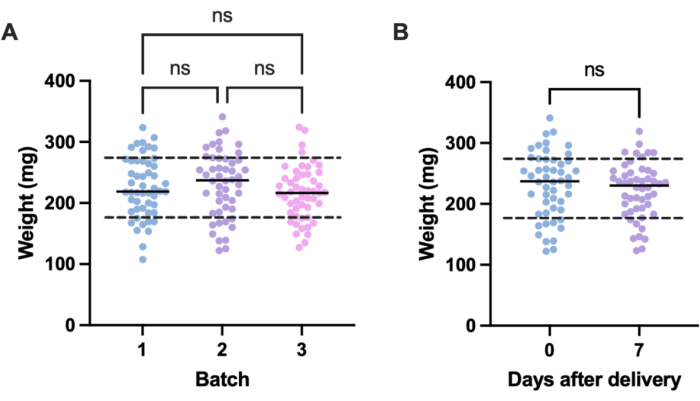
図2: Galleria mellonella の幼虫の体重のバッチおよび時間依存の変動。 (A)50匹の ガレリアメロネラ の幼虫の3バッチの重量は、配達後すぐに計量しました。各バッチは異なる時間に注文されました。一元配置分散分析(P > 0.05)で計算したバッチ間の重量に有意差はありませんでした。(B)受領時に計量された50匹の幼虫の重量と、1週間後に計量された同じバッチの重量。スチューデントの t検定 (P > 0.05)で計算された体重に有意差はありませんでした。ns: 重要ではありません。 この図の拡大版を表示するには、ここをクリックしてください。
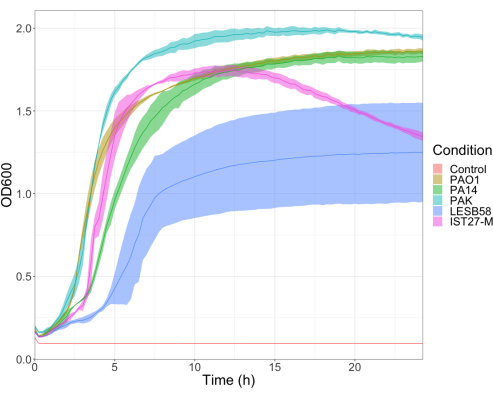
図3:緑膿菌株PAO1、PA14、PAK、LESB58、およびIST27-M株の成長曲線。各株は、0.08-0.13の初期OD600からLBで成長し、OD600は、その後、37°Cで24時間の静的成長中に15分ごとに測定されました。 この図の拡大版を表示するには、ここをクリックしてください。
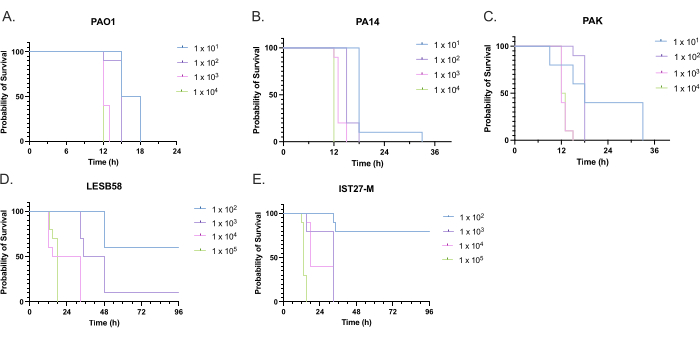
図4:Galleria mellonella幼虫の感染に対するPseudomonas aeruginosa株の接種密度の最適化。 幼虫ごとに異なる密度のコロニー形成単位(CFU)を使用した注射後のGalleria mellonella幼虫の生存。試験した接種密度は、(A)PAO1、(B)PA14、または(C)PAKで幼虫あたり10、10²、10³、または104 CFUで、(D)LESB58および(E)IST27-Mで幼虫あたり10²、10³、104、または105 CFUでした。グループごとに10匹の幼虫を使用し、それぞれに10μLの接種物を右後脚に注射しました。生存率は、感染後16時間から30分ごとに監視され、死亡時刻が記録されました。すべての株は、有意性についてLog-rank(Mantel-Cox)テストによって決定された用量依存的な病原性を示しました。<PAK 101vs.PAK 102、PAK 103対PAK 104、LESB58 104対LESB58 105、および IST27-M 103対IST27-M 104 は重要ではありませんでした。この図は、3つの生物学的複製を表しています。この図の拡大版を表示するには、ここをクリックしてください。
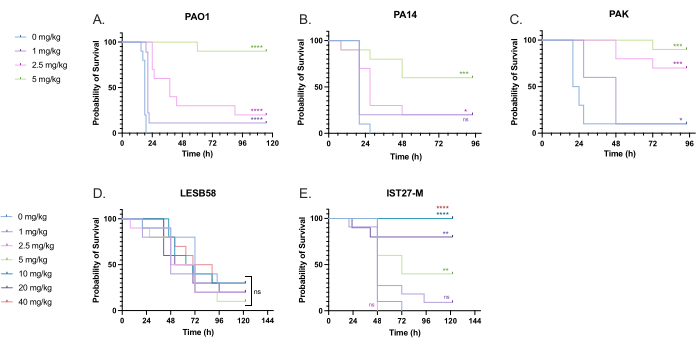
図5:緑膿菌パネル株の注射と感染後2時間後のトブラマイシン硫酸塩による治療後のGalleria mellonella幼虫の生存率。 実験群あたり10匹のG.mellonellaの幼虫は、10μLのPBS中に、幼虫あたり10CFUの(A)PAO1、(B)PA14、または(C)PAKのいずれか、または(D)LESB58または(E)IST27-Mの10CFUのいずれかに感染しました。感染は左後脚に投与されました。感染後2時間後に、PAO1、PA14、およびPAKに、無治療コントロールとして10μLのPBS、1 mg / kg、2.5 mg / kg、または5 mg / kgのトブラマイシンを注射し、LESB58およびIST27-Mを10 μL PBS、1 mg / kg、2.5 mg / kg、5 mg / kg、10 mg / kg、20 mg / kg、または40 mg / kgトブラマイシンで処理しました。 図に示すように。トブラマイシンを蒸留水で希釈し、右後脚に投与した。生存率は継続的に監視され、死亡時刻が記録されました。有意性に対するログランク(Mantel-Cox)検定 vs.各株のPBS制御。ns: 有意ではない、*P < 0.05、**P < 0.005、***P < 0.0005 ****P < 0.0001。この図は、3つの生物学的複製を表しています。この図の拡大版を表示するには、ここをクリックしてください。
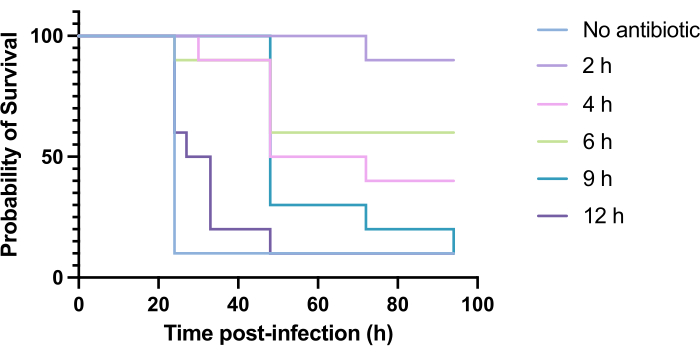
図6:緑膿菌PAO1に感染した後のGalleria mellonella幼虫の生存率と、感染後のさまざまな時点でのトブラマイシンによる治療。 実験群あたり10匹のG.mellonellaの幼虫を、10μLのPBS中に10CFUのPAO1に感染させ、右後脚に注射しました。その後、感染後2時間、4時間、6時間、9時間、または12時間後に、左後脚の10μLの蒸留水に5 mg / kgの硫酸トブラマイシンを注入しました。生存率は継続的に監視され、死亡時刻が記録されました。有意性に対するログランク(Mantel-Cox)検定 vs.未処理のコントロール。P < 0.0005、****P < 0.0001。この図は、3つの生物学的複製を表しています。この図の拡大版を表示するには、ここをクリックしてください。
| 予想される生存率の変化(%) | グループサイズ |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
表1:G. mellonellaの幼虫を10 CFU/幼虫にP. aeruginosa PAO1に感染させ、その後薬剤を投与するG. mellonella生存実験のグループサイズ。
ディスカッション
薬剤耐性(AMR)の負担は増加の一途をたどっています。2019年には、世界中で推定495万人がAMRに関連して死亡しました30。2050年までに、AMRによる死亡率は1,000万人に達すると推定されています31。このリスクに対処するには、新規抗菌薬を効率的かつ費用対効果の高い方法で開発および試験する必要があり、抗菌薬の有効性を正確に予測する前臨床モデルを使用する必要があります。臨床試験への転換中に観察される高い離脱率は、主要な制限要因です。1件の研究では、臨床試験で失敗した13の抗菌薬候補が報告されており、11の抗菌薬候補は第II相32に進行しませんでした。
本研究は、G. mellonellaの前臨床抗菌薬スクリーニング研究の最適化のためのフレームワークと、抗菌薬の有効性を評価するための方法を提供します。G. mellonellaの幼虫は、薬物毒性の評価、MIC測定、および病原性試験において大きな有用性を持ち、前臨床開発に使用される哺乳動物の減少に貢献しています。Galleria mellonellaの幼虫は比較的高いスループットを持ち、生物学的に関連性があり、より複雑な哺乳類モデルにうまく変換されます。一方、野生型の実験用マウスは1匹あたり8ポンドから30ポンドの費用がかかり、マウス1匹あたり週7ポンドのメンテナンスが必要ですが、G. mellonellaは50匹の幼虫に対して~2ポンドの費用がかかります。したがって、G. mellonellaモデルで10種類の化合物をテストするには、~60ポンドの費用がかかりますが、マウスでの同じ研究では4000ポンド以上かかります。さらに、以前の研究では、新規化合物の毒性と有効性を比較し、G.メロネラとマウスの急性毒性との相関関係を特定しました8,19,33。したがって、マウスモデルでさらに試験する化合物に優先順位を付けるために、G. mellonellaスクリーニングを実装することをお勧めします。
このモデルの明らかな有用性にもかかわらず、アプリケーションを成功させるためには、いくつかの考慮事項があります。エタノール滅菌が必要であったり、研究者が自分自身のG.メロネラコロニーを維持する必要があるため、研究グレードの無菌幼虫がいないため、実験使用の準備が複雑になります。これにより、汚染のリスクが軽減され、全体的な実験品質が向上します5,6。不適切な滅菌はかなりの死亡率をもたらす可能性があり、エタノールへの曝露時間が長くなると死に至るため、生物を完全に滅菌することは困難です。滅菌の代替方法には、感染前に各幼虫の前脚を70%エタノールで拭くことが含まれ、これにより滅菌中の死亡率は減少しますが、より労働集約的な方法です。他の消毒剤も使用できますが、この研究では代替薬は評価されていませんでしたが、エタノール滅菌を最適化すると<10%の死亡率が得られました。さらに、供給者が自身のコロニーを維持するのではなく、他の供給者から幼虫を調達する可能性があるため、供給者がG. mellonellaを抗生物質で治療しているかどうかは不明であることが多い。
G. mellonella の生物学は哺乳類とはかなり異なり、その有用性には制限があります。彼らの免疫系には適応免疫がありませんが、自然免疫の主要な可溶性および細胞性の側面は存在します。血球は 、G. mellonella の主要な自然免疫防御であり、食細胞様の特性を示します。 これらの細胞の種々のサブセットが、とりわけ顆粒球および形質細胞を含む記載されている34。 G. mellonella は、呼吸器感染症や膀胱感染症などの関連する感染部位を再現することもできません。しかし、前臨床パイプラインでは、 G. mellonella はマウスモデルの事前スクリーニングとして機能し、最も有望な化合物のみが、ヒトの感染環境により近い複雑な哺乳類系に進むことを保証します。最後に、このモデルは、G. mellonellaのさらなるゲノム特性評価から、臨床的に重要なバイオマーカーの変化を評価するための適合性を判断するための利点を得るでしょう。特に、 G. mellonella の免疫についての理解を深める必要があります。
全体として、 Galleria mellonella 感染モデルは、哺乳類モデルで新規抗菌化合物を評価する前に、その前臨床評価のための貴重なツールです。供給の標準化が進んでいないため、その使用は複雑ですが、その用途はハイスループットでシンプルで、抗菌薬開発のランドスケープ全体に広く適用できます。将来的には、このモデルを標準化された前臨床パイプラインに統合することで、新しい抗菌化合物の開発を加速し、前臨床試験から臨床試験に進む候補の割合を増やすことができるかもしれません。
開示事項
著者は何も開示していません。
謝辞
TB、AK、JF、DNは、戦略研究センター(SRC)の「嚢胞性線維症における抗菌治療薬の開発のためのエビデンスに基づく前臨床フレームワーク」(PIPE-CF;課題番号SRC 022)を英国嚢胞性線維症トラストおよび米国嚢胞性線維症財団から発行しました。LDとJFは、Kidney Research North West(プロジェクトNo.49/19)からの資金提供を認めています。
資料
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
参考文献
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved