Method Article
Galleria mellonella comme modèle de dépistage antimicrobien
Dans cet article
Résumé
Cette étude présente un cadre normalisé pour l’optimisation des modèles d’infection à G. mellonella en vue de leur utilisation dans l’évaluation préclinique des antimicrobiens. L’application d’un modèle de G. mellonella dans le cadre d’un pipeline de développement préclinique d’antimicrobiens pourrait réduire le nombre de composés inefficaces progressant vers les essais cliniques.
Résumé
Pour lutter contre le problème mondial croissant de la résistance aux antibiotiques, il est essentiel d’accélérer le développement de nouveaux antibiotiques. Le développement préclinique actuel des antimicrobiens produit un nombre important de pistes qui s’avèrent inappropriées avant ou pendant les essais cliniques. Pour augmenter l’efficacité du développement préclinique, des modèles pertinents, standardisés, accessibles et rentables doivent être développés. Les larves de Galleria mellonella (grande teigne de la cire) sont largement utilisées comme modèle d’infection pour évaluer la virulence microbienne, effectuer des tests de toxicité des médicaments et servir de moyen préliminaire d’évaluation de l’efficacité in vivo de nouveaux composés antimicrobiens. Ces modèles d’infection ont une plus grande pertinence biologique que de nombreux dépistages in vitro de débit comparable et réduisent la dépendance aux modèles de mammifères lorsqu’ils sont utilisés comme prédépistage pour les tests antimicrobiens. Ce protocole décrit une méthodologie normalisée pour l’optimisation des modèles d’infection à G. mellonella , qui peut être appliquée aux espèces bactériennes et aux traitements antimicrobiens de votre choix. En utilisant l’agent pathogène prioritaire de l’OMS Pseudomonas aeruginosa comme exemple, nous décrivons les étapes qui peuvent être entreprises pour développer un modèle reproductible d’infections et de tests thérapeutiques. Cela comprend des recommandations sur le montage expérimental, la préparation des échantillons et les protocoles d’infection et de traitement. L’intégration de ce modèle dans les pipelines de développement préclinique d’antimicrobiens réduirait la dépendance à l’égard des modèles de mammifères, réduirait le nombre de composés inefficaces atteignant les essais cliniques et, en fin de compte, augmenterait l’efficacité du développement préclinique d’antimicrobiens.
Introduction
Les larves de Galleria mellonella (la grande teigne de la cire) sont largement utilisées dans les sciences biologiques comme modèles d’infection pour les espèces microbiennes et pour les tests de toxicité de nouveaux composés médicamenteux 1,2. Ils ont le potentiel d’être considérablement utiles dans un pipeline d’essais antimicrobiens précliniques, car ils sont à haut débit, reproduisent les caractéristiques intégrales in vivo de l’infection humaine et réduisent la dépendance à l’égard des modèles de mammifères, conformément aux principes de réduction, de raffinement et de remplacement qui régissent l’utilisation éthique des espèces de mammifères dans la recherche.
Le développement de nouveaux antibiotiques nécessite des tests précliniques approfondis sur des modèles in vitro et in vivo avant la validation clinique3. Seuls quelques nouveaux agents avec des ensembles de données précliniques prometteurs se traduisent en clinique, et l’un des facteurs contribuant à ce taux d’attrition élevé est l’incapacité des dépistages précliniques à saisir les complexités des environnements infectieux4. Ces problèmes contribuent non seulement à un faible taux de traduction des agents antimicrobiens en clinique, mais aussi à une utilisation accrue d’animaux vertébrés de laboratoire lors du dépistage préclinique à un stade avancé. Afin d’améliorer l’évaluation préclinique des nouveaux antimicrobiens et de réduire l’utilisation de modèles murins in vivo coûteux, longs, complexes et problématiques sur le plan éthique, de meilleurs outils de dépistage de médicaments à un stade précoce sont nécessaires pour réduire le nombre de composés peu prometteurs qui progressent jusqu’aux tests dans les systèmes vertébrés.
G. mellonella a un court cycle de vie de 8 semaines, composé de quatre stades de vie : œuf, larves, pupes et adultes, dont la forme larvaire est utilisée dans ce protocole1. G. mellonella est facile à entretenir tout au long d’une expérience sans avoir besoin d’équipement spécialisé ou d’une installation de recherche animale dédiée. Il n’est pas nécessaire d’obtenir une approbation éthique pour leur utilisation, et les chercheurs peuvent sélectionner l’organisme en interne pour améliorer la qualité expérimentale 2,5,6,7. Le système immunitaire de G. mellonella ressemble beaucoup à celui du système immunitaire inné des mammifères, avec la capacité de répondre aux stimuli du « soi » et du « non-soi »8. Les hémocytes sont responsables de la reconnaissance des formes moléculaires associées aux agents pathogènes et de la phagocytose qui en résulte, jouant un rôle fonctionnellement analogue à celui des neutrophiles chez l’homme9. G. mellonella code pour trois types de récepteurs de type Toll qui ont été identifiés par homologie de séquence avec l’homme, et produit des protéines de type complément, qui reconnaissent le non-soi matériel et forment des complexes de mélanisation localisés après l’activation et la polymérisation de la phénoloxydase en mélanine10. Cela peut servir de lecture visuelle de la santé des larves pendant les expériences d’infection, car la cuticule est assombrie par la mélanisation. Il convient toutefois de noter que l’axe de mélanisation chez les insectes, qui implique la phénoloxydase, diffère considérablement de l’axe tyrosinase-mélanine chez les mammifères11,12. De plus, G. mellonella produit 18 peptides antimicrobiens inductibles, y compris des homologues du lysozyme et de la défensine13. Cette similitude, ainsi que les procédures simples d’entretien des larves et la nature à haut débit du modèle, ont fait de G. mellonella un organisme largement utilisé dans l’évaluation de nouveaux médicaments. Dans le développement préclinique d’antibiotiques, G. mellonella a une utilité accrue par rapport aux modèles in vitro, car ils peuvent modéliser avec plus de précision les interactions hôte-pathogène-médicament dans un environnement complexe avec une immunité active.
À l’heure actuelle, il n’existe pas de fournisseur normalisé de G. mellonella en Europe. Les chercheurs doivent plutôt acheter des larves de G. mellonella dans des magasins d’appâts ou maintenir leur propre colonie. Bien que des méthodes pour maintenir une colonie interne de G. mellonella aient été décrites et puissent augmenter la cohérence expérimentale 5,6,7, cette option n’est susceptible d’être attrayante que pour ceux qui utilisent fréquemment les larves. En tant que tel, ce protocole se concentre sur le dispositif expérimental suite à l’achat de larves auprès d’un fournisseur d’appâts vivants. Bien qu’elle soit plus accessible, cette méthode augmente la complexité expérimentale et peut introduire une variabilité supplémentaire dans les essais en raison des incohérences dans la santé des larves au moment où elles sont reçues des fournisseurs. Pour que les universitaires, l’industrie et les organismes de réglementation acceptent et adoptent le test de G. mellonella dans le cadre d’un pipeline de développement préclinique d’antimicrobiens, un système normalisé d’optimisation et d’évaluation de l’efficacité antimicrobienne est nécessaire.
Cette étude optimise la conception expérimentale d’un modèle d’infection à G. mellonella pour le développement d’antibiotiques. Bien que des modèles d’infection à G. mellonella aient été décrits14,15, la méthodologie actuelle documente les étapes supplémentaires visant à atténuer la complexité supplémentaire introduite par l’incohérence de l’approvisionnement et fournit un cadre pour l’évaluation des nouveaux antimicrobiens. À titre de test, G. mellonella a été infecté par l’agent pathogène prioritaire de l’OMS, Pseudomonas aeruginosa, et le traitement par un agent aminoglycoside (tobramycine) a été optimisé. Ce cadre, illustré à la figure 1, fournit une base pour les futures études précliniques de dépistage des antimicrobiens avec de nouveaux agents.
Protocole
Dans cette étude, les larves de Galleria mellonella (teigne de la cire) ont été sélectionnées comme modèle pour les tests de sensibilité aux antibiotiques et les essais de toxicité aiguë. Aucune approbation éthique n’est requise pour l’utilisation expérimentale de Galleria mellonella. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Conception expérimentale
- Déterminer la taille appropriée des groupes de larves de Galleria mellonella en fonction du changement proportionnel de la survie larvaire que l’étude vise à capturer. Le tableau 1 détaille la taille des groupes nécessaires pour détecter des changements spécifiques en pourcentage dans la survie à l’aide d’un modèle d’infection par la souche PAO1 de Pseudomonas aeruginosa .
REMARQUE : Lors de l’utilisation d’un nouvel agent pathogène, il faut d’abord déterminer la variabilité inter-essai de la survie proportionnelle des larves infectées mais non traitées, car cela influencera la détermination de la taille de l’échantillon.- Incluez deux groupes de témoins PBS : l’un injecté avant le reste des infections pour s’assurer que la seringue est tranchante et apte à l’emploi, et l’autre injecté pendant ou après les infections bactériennes pour assurer une bonne stérilisation entre les groupes d’infection. En cas d’optimisation avec un nouvel agent pathogène, inclure un témoin traité thermiquement pour s’assurer que la mort n’est pas le résultat d’une réponse immunitaire à des particules étrangères.
REMARQUE : Les seringues à insuline peuvent être utilisées pour les injections, réduisant ainsi les risques d’émoussement et de contamination. Cependant, les expériences peuvent utiliser régulièrement des centaines de G. mellonella, ce qui rend l’utilisation de seringues à insuline coûteuse et coûteuse. - Pour les études optimisant le traitement antibactérien, incluez deux témoins supplémentaires : un groupe infecté par des bactéries puis injecté avec un traitement « simulé » de véhicule, et un groupe injecté deux fois avec le véhicule, une fois au moment de l’infection pour les autres affections et une fois au moment du traitement.
REMARQUE : Le premier est un contrôle non traité, tandis que le second contrôle tout traumatisme causé par les injections. Un tel traumatisme est plus probable lorsque des aiguilles émoussées sont utilisées.
- Incluez deux groupes de témoins PBS : l’un injecté avant le reste des infections pour s’assurer que la seringue est tranchante et apte à l’emploi, et l’autre injecté pendant ou après les infections bactériennes pour assurer une bonne stérilisation entre les groupes d’infection. En cas d’optimisation avec un nouvel agent pathogène, inclure un témoin traité thermiquement pour s’assurer que la mort n’est pas le résultat d’une réponse immunitaire à des particules étrangères.
- Commandez G. mellonella auprès d’un fournisseur d’appâts vivants ou maintenez une colonie de G. mellonella comme décrit précédemment 5,6,7. Pour le fournisseur indiqué dans le tableau des matériaux, commandez 1,8 fois le nombre prévu de larves, car environ 33 % seront exclues en fonction de leur taille, et 10 % supplémentaires pourraient mourir après la stérilisation des cuticules.
- Déterminer la variabilité du poids de G. mellonella avant l’utilisation expérimentale et s’assurer que la plage de poids ne dépasse pas un écart-type de la moyenne.
REMARQUE : Pour les fournisseurs qui ne figurent pas dans la table des matériaux, demandez au fournisseur de fournir un nouveau stock.
- Déterminer la variabilité du poids de G. mellonella avant l’utilisation expérimentale et s’assurer que la plage de poids ne dépasse pas un écart-type de la moyenne.
- À la réception, conserver G. mellonella à température ambiante pour limiter le risque de cocooning, qui se produit après l’incubation à 37 °C.
REMARQUE : Les larves provenant de fournisseurs commerciaux ne forment pas toutes des cocons, qui ont déjà été utilisés comme indicateur de la santé des larves16. - Utilisez les larves dans la semaine suivant leur réception, auquel cas elles n’ont pas besoin d’être nourries.
REMARQUE : Bien que le stade de vie larvaire varie d’un lot à l’autre, la plupart des larves sont mises bas au cours du dernier stade avant de se nymphoser. À ce stade, l’alimentation diminue naturellement par rapport aux stades précédents17.
2. Stérilisation et sélection des larves de G. mellonella
- Peser les larves de Galleria mellonella et jeter celles qui se situent à l’extérieur de la plage de 224 mg ± 49,2 mg, ce qui correspond au poids moyen des larves plus ou moins un écart-type. Cela entraînera l’exclusion d’environ 33 % des larves.
REMARQUE : La variation de poids peut différer d’un fournisseur à l’autre. Pour les fournisseurs qui ne figurent pas dans le présent protocole, calculer une fourchette de poids appropriée. - Effectuez les étapes suivantes dans des conditions aseptiques.
- Vaporisez de l’éthanol à 70 % dans une boîte de Pétri, en veillant à ce qu’il y en ait suffisamment pour couvrir le fond de la boîte.
- Stérilisez la surface de G. mellonella en lots de 10 à 20 larves.
- Placez chaque lot individuellement dans le plat et vaporisez les larves deux fois avec de l’éthanol à 70%.
- Utilisez une pince à épiler pour rouler les larves, en assurant une couverture complète.
- Retirez les larves de l’éthanol et placez-les dans une boîte de Pétri stérile. Laissez le plat à découvert pour permettre aux larves de sécher.
ATTENTION : Laisser G. mellonella dans l’éthanol pendant plus de 15 s entraînera une mortalité élevée.
- Une fois qu’environ 90 % des larves ont retrouvé de l’activité après 2 h, séparez les larves récupérées en groupes d’une taille qui permettra de détecter suffisamment les changements de survie selon les calculs de puissance détaillés dans le tableau 1.
- Utilisez G. mellonella dans les 6 heures suivant la stérilisation.
3. Optimiser la densité de l’inoculum bactérien
- Préparez un stock d’infection bactérienne d’une UFC/ml connue avant l’infection. Les méthodes de création de stocks varient selon l’organisme. Ici, Pseudomonas aeruginosa a été cultivé jusqu’à la phase mi-logarithmique dans un bouillon nutritif, aliquoteté et congelé à une densité de 6 x 107 UFC/mL.
- Granuler le stock infectieux en le centrifugant à 10 000 x g à température ambiante pendant 5 min, et le remettre en suspension dans du PBS. Diluer en série le stock bactérien dix fois pour générer une gamme de doses d’inoculum de 10 1-107 UFC par larve, en considérant que chaque larve reçoit 10 μL d’inoculum.
REMARQUE : La gamme de doses spécifiques à l’inoculum variera en fonction de la virulence bactérienne, mais la gamme proposée ici devrait convenir à la plupart des espèces pathogènes. La détermination du taux de croissance in vitro peut aider à choisir une gamme de doses appropriée, car le taux de croissance spécifique à la souche en culture liquide est corrélé à la mortalité larvaire. - Avant de commencer les infections, dénombrez l’inoculum avec une dilution en série de Miles et Misra pour déterminer avec précision la densité de l’inoculum18.
- Préparez trois tubes microfuges de 1 mL contenant soit du dH2O stérile, de l’éthanol à 70 % ou du PBS stérile. Ceux-ci seront utilisés en permanence pour stériliser la seringue utilisée pour injecter les larves.
- Inspectez une seringue Hamilton stérile de 100 μL, en vous assurant que la pointe de l’aiguille est tranchante et qu’elle n’a pas développé de crochet, ce qui causerait un traumatisme important au site de l’infection.
ATTENTION : L’extrémité de l’aiguille d’une seringue Hamilton commencera à se déformer après environ 300 infections. Si la pointe de l’aiguille est déformée, elle doit être remplacée. - Lavez la seringue séquentiellement avec du dH2O, de l’éthanol et du PBS avant les infections, en prélevant et en jetant la capacité maximale de la seringue.
- Injectez l’inoculum d’infection remis en suspension et aspirez un maximum de 100 μL dans la seringue Hamilton, ce qui est suffisant pour injecter 10 μL par larve.
- Injecter à chaque larve 10 μL d’inoculum dans la patte arrière droite. Assurez-vous que l’aiguille pénètre environ 2 mm dans le corps.
REMARQUE : Diverses méthodes d’infection peuvent être utilisées. Il s’agit notamment de tenir la larve au-dessus de la pointe d’une pipette pour exposer les pattes, de fixer la seringue de manière statique et de positionner le G. mellonella à la main, ou de l’injecter à main levée. - Entre chaque série d’infections, stérilisez la seringue comme indiqué à l’étape 2.5 pour éviter la contamination par des commensaux cutanés résiduels.
- Incuber les larves infectées à une température suffisante pour la croissance microbienne, entre 20 °C et 42 °C, ce qui est une plage appropriée pour la survie de G. mellonella 5.
- Surveiller la survie de G. mellonella à intervalles réguliers à partir du moment où la mortalité est habituellement observée pour la première fois afin de mesurer avec précision le moment de la mort. Cela doit être évalué lors d’un premier dépistage. Retirez toutes les larves mortes et notez l’heure de leur mort.
- Choisir la dose d’infection optimale pour une étude d’essai thérapeutique en fonction de la dose qui entraîne une mortalité de 50 % à 18 heures et de plus de 80 % à 72 heures. Cela permet de développer un dépistage rapide en une journée tout en assurant une virulence suffisante et une fenêtre thérapeutique adaptée.
4. Essais de toxicité de nouveaux agents antimicrobiens chez des larves non infectées
- Évaluer la toxicité des nouveaux antimicrobiens et des vecteurs choisis chez Galleria mellonella avant de les utiliser avec des larves infectées expérimentalement. Préparer une large gamme de doses dépassant la plage thérapeutique prévue de l’antimicrobien, en s’appuyant sur des données de toxicité in vitro (p. ex., lignées cellulaires), le cas échéant.
- Considérez que les larves se verront injecter 10 μL de produit thérapeutique. Préparez des contrôles pour véhicule seulement à des concentrations correspondant à celles dans lesquelles le traitement est administré.
- Injecter des G. mellonella sains et stériles dans des groupes de tailles appropriées avec les différentes concentrations de véhicules antimicrobiens et PBS, comme indiqué aux étapes 3.2 à 3.10. Dans la présente étude, l’antimicrobien utilisé était la tobramycine.
REMARQUE : Pour un agent nécessitant du DMSO comme solvant, injecter avec une aiguille de calibre 26s, plutôt qu’avec l’aiguille standard de calibre 22, car le traumatisme causé par des aiguilles plus grosses augmente la mortalité lors de l’utilisation de DMSO. - Définir une dose sûre comme une dose qui n’entraîne pas de différence significative en termes de mortalité par rapport aux larves injectées uniquement avec du PBS.
5. Optimiser le traitement de l’infection bactérienne à G. mellonella avec un agent antimicrobien
- Préparez une gamme de doses de l’agent antimicrobien, en tenant compte du fait que les larves infectées sont traitées avec une dose de 10 μL. Utiliser une gamme de doses avec une toxicité minimale, comme évalué à l’étape 4.
- Suivez les étapes 1 et 2 de ce protocole pour préparer et infecter Galleria mellonella dans les groupes appropriés à la dose d’infection précédemment optimisée.
- 2 h après l’infection, traiter les larves avec l’agent antimicrobien préparé ou la solution de contrôle du véhicule. Suivez les étapes 3.2 à 3.8, en injectant dans la patte opposée à celle injectée lors de l’infection. Stérilisez l’aiguille entre les groupes.
REMARQUE : Un traitement à 2 h a été choisi pour cette optimisation afin d’obtenir de solides données dose-réponse, à partir desquelles l’optimisation ultérieure du moment du traitement a été déterminée19. - Surveiller la survie de G. mellonella à des intervalles de 30 minutes ou plus fréquemment à partir du moment où la mortalité est habituellement observée pour la première fois. Retirez toutes les larves mortes et notez l’heure de leur mort.
- Calculer la variation des taux de survie entre les groupes de traitement. Utilisez l’analyse de survie de Kaplan-Meier pour déterminer si le traitement entraîne une modification significative de la mortalité larvaire. Inclure une correction post-hoc appropriée pour la multiplicité par paires dans les analyses multigroupes.
6. Optimiser le moment du traitement des G. mellonella infectés
- Suivez les étapes 1 et 2 pour préparer Galleria mellonella en groupes appropriés à la dose d’infection précédemment optimisée.
- Préparez l’agent antimicrobien à la dose précédemment optimisée à l’étape 4.
- À 2 h, 4 h, 6 h, 9 h ou 12 h après l’infection, traitez les larves infectées en suivant les étapes 3.2 à 3.8 pour comparer l’impact du moment du traitement sur la mortalité.
- Surveiller la survie de G. mellonella à des intervalles de 30 minutes ou plus fréquemment à partir du moment où la mortalité est habituellement observée pour la première fois. Retirez toutes les larves mortes et notez l’heure de leur mort. Le moment optimal est celui qui maintient la survie observée suite à l’optimisation initiale de la dose de traitement.
REMARQUE : Lors de l’évaluation de l’efficacité antimicrobienne chez G. mellonella, optimisez séparément la dose et le moment du traitement, en utilisant la première pour déterminer la dose de traitement chez le second.
Résultats
Évaluation de la variation du poids de G. mellonella dans les lots
Une source potentielle de variation indésirable dans les expériences d’infection provient des différences de taille entre les unités expérimentales individuelles (c.-à-d. les larves) et entre les lots. Les effets de cette variation peuvent être atténués soit en ajustant les doses de traitement ou d’infection en fonction du poids, soit en sélectionnant uniquement les larves dans une fourchette de poids définie pour les utiliser dans les expériences. Ce dernier ajustement est plus pragmatique et n’est pas sujet à l’erreur humaine qui pourrait survenir lors de la préparation de la dose. Un autre avantage de la pesée des larves est qu’elle permet de convertir les doses de traitement administrées aux larves en mg/kg équivalents humains. Pour quantifier les variations au sein des lots et entre ceux-ci, trois lots de 50 larves, commandés à des moments différents, ont été pesés. Le poids moyen dans chaque groupe était de 225,5 mg, 230,54 mg et 215,86 mg, avec des écarts-types de 49,1 mg, 53,7 mg et 44,3 mg, respectivement (figure 2A). Entre les lots, il n’y avait pas de différence significative de poids. D’un lot à l’autre, le poids variait de 107,5 mg à 341,0 mg, avec une moyenne de 224,0 mg ± 49,2 mg.
Pour obtenir des résultats reproductibles, les larves ont été pesées avant l’expérimentation et sélectionnées si leur poids était de 224 mg ± 49,2 mg, réduisant la plage de poids de 233,5 mg à 98,4 mg et éliminant 33 % des larves. Cela correspond à des travaux antérieurs qui ont identifié une variation significative de la survie des larves infectées par le SARM avec des bandes de poids supérieures à 100 mg14,20. Nous avons également comparé le poids de G. mellonella au moment de l’accouchement à celui d’une semaine après l’accouchement, car tout changement de poids significatif pourrait influencer les résultats expérimentaux lorsque les larves ne sont pas utilisées immédiatement à leur arrivée. Le poids moyen de G. mellonella était de 230,54 mg ± 53,7 mg. Une semaine après l’accouchement, le poids moyen était de 221,8 mg ± un écart-type de 45,7 mg (figure 2B). Il n’y avait pas de différence significative entre le poids à l’arrivée et le poids après une semaine, ce qui nous permet de conclure que les larves peuvent être utilisées à des fins expérimentales à tout moment au cours de la première semaine suivant l’accouchement. Il est important de noter que ces résultats ne sont représentatifs que de G. mellonella acheté auprès d’un seul fournisseur, et que le poids peut différer considérablement d’un fournisseur à l’autre ou lorsque les larves sont commandées à des moments différents.
Optimisation de la densité de l’inoculum de P. aeruginosa PAO1
La virulence de cinq isolats de P. aeruginosa à quatre densités d’inoculum a été évaluée, y compris trois souches de laboratoire couramment utilisées, PAO1, PA14 et PAK, et deux isolats cliniques d’infection respiratoire chronique, LESB58 et IST27-M. Ceux-ci ont été utilisés dans le cadre d’un panel de souches pertinentes pour les FC élaboré par Mahenthiralingam et al.21 et sont représentatifs de la phylogénie mondiale de l’espèce. Les données préliminaires sur la croissance dans les bouillons nutritifs ont montré un taux de croissance plus faible pour les isolats d’infection chronique (figure 3). Compte tenu de cela, G. mellonella a été infecté par groupes de 10 larves avec des doses de 101, 102, 103 ou 104 UFC/larve dans 10 μl de PBS pour PAO1, PA14 et PAK, et des doses de 102, 103, 104 ou 105 UFC/larve pour LESB58 et IST27-M. Deux groupes de 10 larves ont également reçu une injection de PBS uniquement, un groupe avant et un groupe après les infections. Les injections de PBS avant le contrôle des infections pour le PBS contaminé ou la contamination des aiguilles par des espèces microbiennes de la cuticule Galleria, tandis que les injections de PBS après le contrôle de l’infection pour toute contamination des aiguilles par des bactéries utilisées dans le processus d’infection. Les doses optimales pour PAO1, PA14 et PAK étaient de 10 UFC/larve, car des densités plus élevées entraînaient > mort de 50 % en 18 heures (figure 4). 10 UFC était la dose la plus faible qui pouvait être préparée de manière fiable et reproductible pour l’infection. Des doses plus élevées de LESB58 et d’IST27-M ont été nécessaires pour obtenir la cinétique de survie souhaitée, ce qui reflète la croissance plus lente et la capacité de charge plus faible de ces isolats dans des conditions in vitro (figure 4). La dose optimale pour les deux était de 104 UFC/larve. LESB58 et IST27-M sont des isolats cliniques provenant d’individus atteints d’infections chroniques, et LESB58 a déjà démontré une virulence plus faible chez des modèles de rongeurs que PAO122.
Essais de toxicité de la tobramycine et de la colistine chez Galleria mellonella
Avant d’évaluer l’efficacité de nouveaux composés antimicrobiens, leur toxicité doit être évaluée en injectant une large gamme de doses cliniquement pertinentes. Cela permet aux composés à haute toxicité d’être retirés des tests dès le début du pipeline préclinique. La tobramycine et la colistine ont été évaluées contre des larves non infectées de G. mellonella, car elles sont couramment administrées pour le traitement de l’infection à P. aeruginosa chez les personnes atteintes de fibrose kystique23. L’utilisation clinique de la tobramycine varie de 3 mg/kg par jour pour les personnes gravement malades sans mucoviscidose à 11 mg/kg toutes les 24 h pour les personnes atteintes de mucoviscidose24,25. Ces valeurs ont été utilisées comme guide pour la posologie de la tobramycine dans Galleria mellonella, avec 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg de tobramycine sélectionnée pour les essais de toxicité. Aucun décès n’a été observé à aucune concentration. Compte tenu de l’absence de toxicité de la tobramycine à des concentrations élevées, la toxicité de la colistine a été évaluée, car elle a déjà été associée à une néphrotoxicité ou à une neurotoxicité chez 29,8 % des fibrofibrose pondérée, avec une dose de charge de 2,9 (±1,5) mg/kg et une dose quotidienne globale de 4,1 (±1,1) mg/kg26. Cela en a fait un candidat précieux pour les essais de toxicité, bien que les effets spécifiques à certains organes chez l’homme suggèrent que la toxicité pourrait ne pas se traduire par G. mellonella. En effet, lorsque des doses de 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg et 250 mg/kg de colistine ont été administrées, aucune mort de larves n’a été observée sur 72 h. Ainsi, la colistine a finalement été administrée à sa solubilité la plus élevée en H2O, à 2000 mg/kg. La mort de toutes les larves a été observée dans les 12 heures, ce qui confirme que la toxicité des médicaments peut être évaluée chez G. mellonella, mais qu’il faut faire preuve de prudence lorsqu’on tente de prédire la toxicité pour l’homme.
Optimisation de la posologie de la tobramycine contre l’infection à P. aeruginosa PAO1
Une gamme de doses de tobramycine cliniquement pertinentes a été administrée aux larves infectées par P. aeruginosa afin d’optimiser la posologie du traitement. Pour les nouveaux antimicrobiens, la posologie peut être initialement choisie en fonction de l’utilisation clinique d’antibiotiques existants similaires ou de données précliniques pour le nouvel agent, telles que les concentrations minimales inhibitrices du bouillon. Pour évaluer l’efficacité de la tobramycine contre P. aeruginosa PAO1, les larves de G. mellonella ont été infectées avec 10 UFC de P. aeruginosa PAO1, tel qu’optimisé précédemment, et injectées avec 1 mg/kg, 2,5 mg/kg ou 5 mg/kg de tobramycine 2 h après l’infection. Ces doses ont été choisies en fonction des travaux antérieurs de G. mellonella avec la tobramycine et sont conformes aux doses cliniques actuelles de tobramycine chez les personnes sans fibrose kystique 24,27,28.
Le seuil de succès initial était une augmentation de 50 % de la survie de G. mellonella par rapport aux témoins non traités. Le traitement par PAO1 avec 1 mg/kg de tobramycine a eu peu d’impact sur la mortalité de G. mellonella , avec 90 % de décès 28 heures après l’infection (Figure 5). Le traitement avec 2,5 mg/kg de tobramycine a retardé la mortalité, mais a entraîné une mortalité globale de 80 % avec 5 mg/kg de tobramycine, ce qui a entraîné une survie optimale de 90 %. La dose efficace pour le PA14 était de 5 mg/kg, mais pour le PAK était de 2,5 mg/kg. La dose efficace pour IST27-M était plus élevée à 10 mg/kg, tandis qu’aucune concentration de tobramycine testée n’était suffisante pour sauver les larves de l’infection à LESB58. Cette tendance était corrélée avec les valeurs de concentration minimale inhibitrice (CMI) de tobramycine dans le bouillon Mueller Hinton ajusté aux cations, où 1 μg/mL était suffisant pour inhiber 90 % de la croissance dans toutes les souches, à l’exception de LESB58, qui avait une CMI de 8 μg/mL. Par conséquent, les tests initiaux de CMI peuvent être utilisés pour indiquer la résistance relative entre les souches, mais ils ne doivent pas être utilisés pour déterminer les plages de doses chez G. mellonella, qui doivent être optimisées séparément.
Optimisation du calendrier de traitement à la tobramycine contre l’infection à P. aeruginosa PAO1
L’application clinique d’antibiotiques n’a généralement pas lieu dans les heures qui suivent l’infection, mais dans les jours ou les semaines qui suivent. Il est impossible de tester de nouveaux antimicrobiens de cette manière chez G. mellonella, car une mortalité élevée est observée dans les 24 heures suivant l’infection par P. aeruginosa PAO1. Pour accroître la pertinence du modèle d’infection, les nouveaux antimicrobiens doivent être administrés le plus tard possible au cours de l’infection. Afin d’optimiser les délais de traitement, 5 mg/kg de tobramycine ont été administrés à des larves de G. mellonella infectées par PAO1 2 h, 4 h, 6 h, 9 h et 12 h après l’infection. Le succès expérimental a été défini comme l’augmentation de >50 % de la survie par le traitement antibiotique par rapport à l’infection par PAO1. Le traitement à 9 h et à 12 h a retardé la mortalité, bien qu’il n’ait pas permis de résoudre l’infection (figure 6). Le traitement à 2 h, 4 h et 6 h a permis d’obtenir un taux de survie de plus de 50 %.
Optimisation de la taille du groupe de G. mellonella
La taille du groupe expérimental a été calculée sur la base de la variation observée dans la survie de G. mellonella après une infection par 10 UFC / larves de P. aeruginosa PAO1. La taille du groupe peut varier en fonction du pourcentage de variation attendu entre le groupe témoin non traité et le groupe de traitement dans n’importe quelle étude (tableau 1). Les calculs ont suivi ceux décrits par Charan et al.29. L’équation utilisée est décrite ci-dessous.
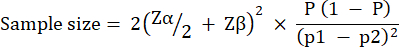
Où:
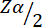 = 1,96 à une erreur de type 1 de 5 %.
= 1,96 à une erreur de type 1 de 5 %.
Zβ = 0,842 est la valeur qui fournit une puissance statistique de 80 %.
p1 = Proportion d’événements dans le groupe test, calculée comme suit : p2 + la variation attendue en pourcentage
p2 = La proportion d’événements dans le groupe témoin (infection non traitée), calculée sur la base de la variabilité de la survie de P. aeruginosa PAO1 à 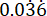 .
.
P = Prévalence combinée, définie comme (p1 + p2)/2.
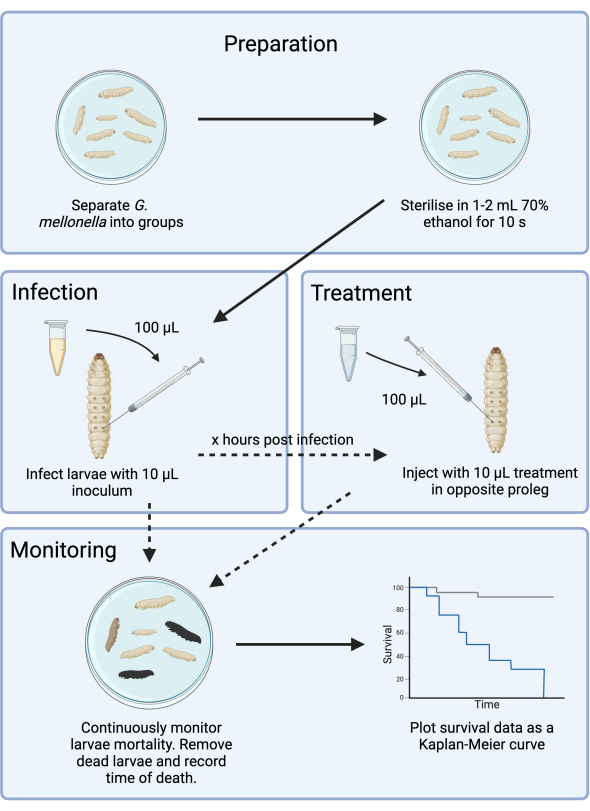
Figure 1 : Schéma d’une étude sur l’infection à G. mellonella. Le protocole général comprend la préparation des larves de G. mellonella avant l’infection, l’infection avec un inoculum de 10 μL, le traitement facultatif un certain nombre d’heures après l’infection et une surveillance continue. Veuillez cliquer ici pour voir une version agrandie de cette figure.
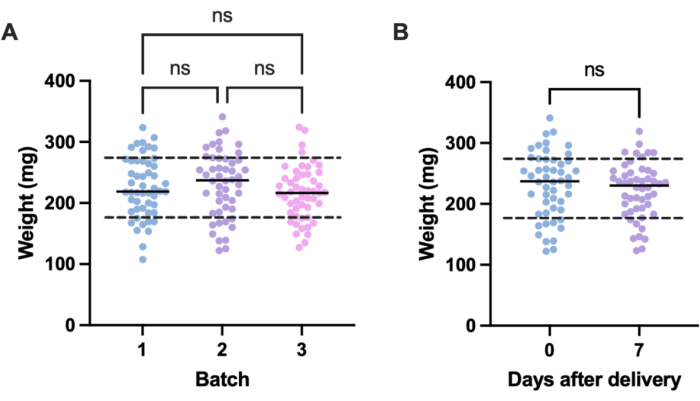
Figure 2 : Variation du poids des larves de Galleria mellonella en fonction du lot et du temps. (A) Poids de trois lots de 50 larves de Galleria mellonella pesées immédiatement après la livraison. Chaque lot a été commandé à des moments différents. Il n’y avait pas de différence significative de poids entre les lots, calculée par une ANOVA à un facteur (P > 0,05). (B) Poids de 50 larves pesées à la réception par rapport au même lot pesé une semaine plus tard. Il n’y avait pas de différence significative dans le poids calculé par le test t de Student (P > 0,05). ns : Pas significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
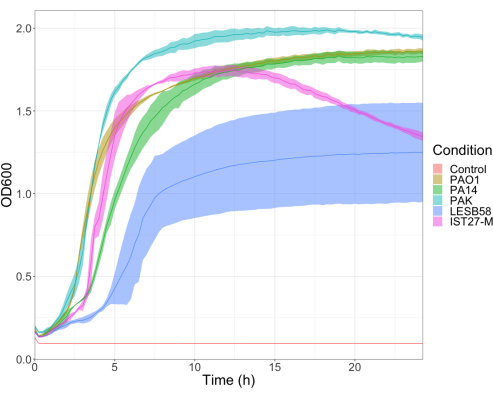
Figure 3 : Courbes de croissance des souches PAO1, PA14, PAK, LESB58 et IST27-M de P. aeruginosa. Chaque souche a été cultivée en LB à partir d’une DO600 initiale de 0,08 à 0,13, et la DO600 a ensuite été mesurée toutes les 15 minutes pendant 24 h de croissance statique à 37 °C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
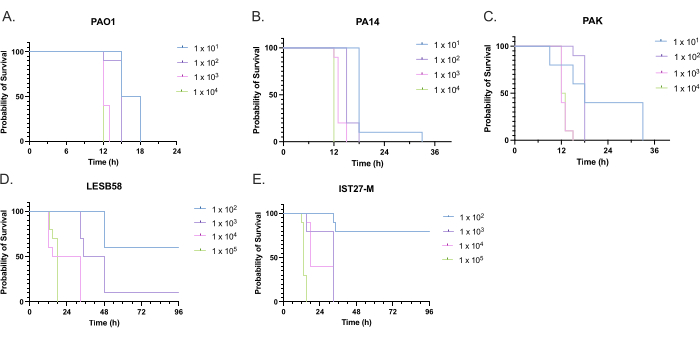
Figure 4 : Optimisation de la densité de l’inoculum des souches de Pseudomonas aeruginosa pour l’infection des larves de Galleria mellonella. Survie des larves de Galleria mellonella après l’injection avec différentes densités d’unités formant colonies (UFC) par larve. Les densités d’inoculum testées étaient de 10, 10², 10³ ou 10,4 UFC par larve pour (A) PAO1, (B) PA14 ou (C) PAK, et de 10², 10³, 104 ou 10,5 UFC par larve pour (D) LESB58 et (E) IST27-M. Dix larves ont été utilisées par groupe, chacune injectant 10 μL d’inoculum dans la patte arrière droite. La survie a été surveillée toutes les 30 minutes à partir de 16 heures après l’infection, et l’heure du décès a été enregistrée. Toutes les souches ont montré une virulence dose-dépendante déterminée par le test Log-rank (Mantel-Cox) pour la signification. P < 0,05 pour toutes les comparaisons de doses à l’intérieur de la souche, à l’exception de PAK 101vs. PAK 102, PAK 103c. PAK 104, LESB58 104c. LESB58 105, et IST27-M 103c. IST27-M 104, qui n’étaient pas significatifs. Cette figure est représentative de trois réplicats biologiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
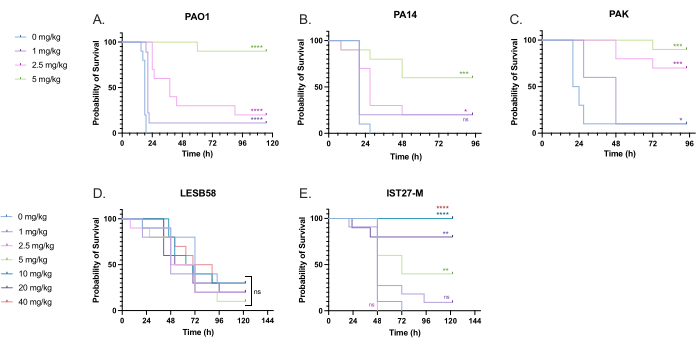
Figure 5 : Survie des larves de Galleria mellonella après injection avec des souches de panel de P. aeruginosa et traitement au sulfate de tobramycine 2 h après l’infection. 10 larves de G. mellonella par groupe expérimental ont été infectées soit par 10 UFC de (A) PAO1, (B) PA14 ou (C) PAK, soit par 103 UFC de (D) LESB58 ou (E) IST27-M par larve dans 10 μL de PBS. Des infections ont été administrées à la patte arrière gauche. 2 h après l’infection, on a injecté 10 μL de PBS comme témoin sans traitement, 1 mg/kg, 2,5 mg/kg ou 5 mg/kg de tobramycine, tandis que LESB58 et IST27-M ont été traités avec 10 μL de PBS, 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg ou 40 mg/kg de tobramycine, comme indiqué sur la figure. La tobramycine a été diluée dans de l’eau distillée et administrée dans la patte arrière droite. La survie a été surveillée en permanence et l’heure du décès a été enregistrée. Test de log-rank (Mantel-Cox) pour la signification vs. le contrôle PBS pour chaque souche. ns : Non significatif, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Cette figure est représentative de trois réplicats biologiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
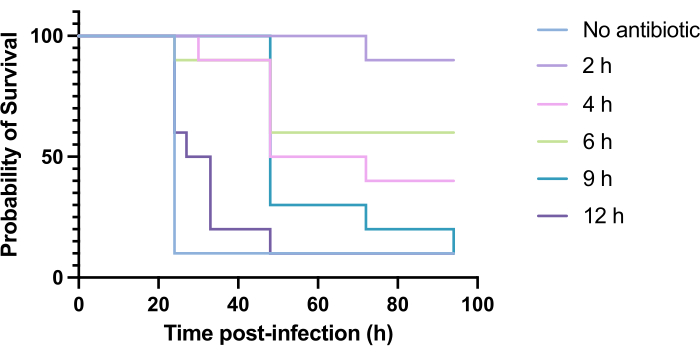
Figure 6 : Survie des larves de Galleria mellonella après l’infection par Pseudomonas aeruginosa PAO1 et le traitement ultérieur par la tobramycine à divers moments après l’infection. 10 larves de G. mellonella par groupe expérimental ont été infectées par 10 UFC de PAO1 dans 10 μL de PBS, injectés dans la patte arrière droite. Par la suite, à 2 h, 4 h, 6 h, 9 h ou 12 h après l’infection, les larves ont reçu 5 mg/kg de sulfate de tobramycine dans 10 μL d’eau distillée dans la patte arrière gauche. La survie a été surveillée en permanence et l’heure du décès a été enregistrée. Test de log-rank (Mantel-Cox) pour la signification vs. contrôle non traité. P < 0,0005, ****P < 0,0001. Cette figure est représentative de trois réplicats biologiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variation attendue de la survie (%) | Taille du groupe |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tableau 1 : Taille du groupe pour les expériences de survie de G. mellonella au cours desquelles les larves de G. mellonella sont infectées par 10 UFC/larves avec P. aeruginosa PAO1 et reçoivent par la suite un agent.
Discussion
Le fardeau de la résistance aux antimicrobiens (RAM) ne cesse d’augmenter. En 2019, on estimait à 4,95 millions le nombre de décès associés à la résistance aux antimicrobiensdans le monde. D’ici 2050, la mortalité causée par la résistance aux antimicrobiens est estimée à 10 millions31. Pour faire face à ce risque, de nouveaux antimicrobiens doivent être mis au point et testés de manière efficace et rentable, ce qui nécessite l’utilisation de modèles précliniques qui prédisent avec précision l’efficacité des antimicrobiens. Le taux d’attrition élevé observé lors de la traduction vers les essais cliniques est un facteur limitatif majeur. Une étude a décrit 13 candidats antibiotiques qui ont échoué dans les essais cliniques, dont 11 n’ont pas réussi à passer à la phase II32.
La présente étude fournit un cadre pour l’optimisation des études précliniques de dépistage antimicrobien de G. mellonella et une méthode d’évaluation de l’efficacité antimicrobienne. Les larves de G. mellonella ont une utilité considérable dans l’évaluation de la toxicité des médicaments, la détermination de la CMI et les tests de virulence, tout en contribuant à la réduction du nombre de mammifères utilisés dans le développement préclinique. Les larves de Galleria mellonella ont un débit relativement élevé, sont pertinentes sur le plan biologique et se traduisent bien dans des modèles de mammifères plus complexes. Pendant ce temps, alors que les souris de laboratoire de type sauvage coûtent entre 8 et 30 £ chacune avec ~7 £ d’entretien hebdomadaire par souris, G. mellonella coûte ~2 £ pour 50 larves. Tester 10 composés dans un modèle de G. mellonella coûterait donc ~60 £, contre plus de 4000 £ pour la même étude chez la souris. De plus, des études antérieures ont comparé la toxicité et l’efficacité de nouveaux composés et ont identifié une corrélation entre la toxicité aiguë chez G. mellonella et chez la souris 8,19,33. Par conséquent, il est recommandé de mettre en œuvre un criblage de G. mellonella pour hiérarchiser les composés à tester davantage sur des modèles murins.
Malgré l’utilité évidente du modèle, il y a plusieurs considérations pour assurer une application réussie. L’absence de larves stériles de qualité recherche complique leur préparation pour une utilisation expérimentale, car la stérilisation à l’éthanol est nécessaire, ou les chercheurs sont tenus de maintenir leur propre colonie de G. mellonella, ce qui atténuerait le risque de contamination et améliorerait la qualité globale des expériences 5,6. Une stérilisation inappropriée peut entraîner une mortalité considérable, et il est difficile de stériliser entièrement l’organisme, car un temps d’exposition plus long à l’éthanol entraîne la mort. D’autres méthodes de stérilisation comprennent l’écouvillonnage de la patte de chaque larve avec de l’éthanol à 70 % avant l’infection, ce qui réduirait la mortalité pendant la stérilisation, mais il s’agit d’une méthode plus exigeante en main-d’œuvre. D’autres antiseptiques pourraient également être utilisés, bien qu’aucune alternative n’ait été évaluée dans cette étude, car la stérilisation à l’éthanol a entraîné <10% de mortalité, une fois optimisée. De plus, il est souvent difficile de savoir si les fournisseurs traitent leur G. mellonella avec des antibiotiques, car les fournisseurs peuvent s’approvisionner en larves auprès d’autres fournisseurs plutôt que d’entretenir eux-mêmes des colonies.
La biologie de G. mellonella diffère considérablement de celle des mammifères, ce qui impose des limites à leur utilité. Leur système immunitaire n’a aucune immunité adaptative, bien que des aspects solubles et cellulaires clés de l’immunité innée soient présents. Les hémocytes sont l’une des principales défenses immunitaires innées de G. mellonella et présentent des propriétés semblables à celles des phagocytes. Différents sous-ensembles de ces cellules ont été décrits, notamment des granulocytes et des plasmatocytes, entre autres34. G. mellonella ne peut pas non plus récapituler les sites d’infection pertinents, tels que ceux des infections respiratoires ou vésicales. Cependant, dans un pipeline préclinique, G. mellonella servirait de pré-criblage aux modèles murins, garantissant que seuls les composés les plus prometteurs progresseraient jusqu’au système complexe des mammifères qui ressemble le plus aux environnements d’infection humaine. Enfin, le modèle bénéficierait d’une caractérisation génomique plus poussée de G. mellonella afin de déterminer sa pertinence pour évaluer les changements dans les biomarqueurs cliniquement pertinents. En particulier, cela nécessite d’améliorer notre compréhension de l’immunité à G. mellonella.
Dans l’ensemble, le modèle d’infection à Galleria mellonella est un outil précieux pour l’évaluation préclinique de nouveaux composés antimicrobiens avant leur évaluation dans des modèles de mammifères. Bien que leur utilisation soit compliquée par un manque de normalisation de l’approvisionnement, leur application est à haut débit, simple et peut être appliquée à grande échelle dans le paysage du développement des antimicrobiens. À l’avenir, l’intégration de ce modèle au sein d’un pipeline préclinique standardisé pourrait accélérer le développement de nouveaux composés antimicrobiens afin d’augmenter la proportion de candidats passant de l’évaluation préclinique aux essais cliniques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
TB, AK, JF et DN ont reçu une subvention pour le Centre de recherche stratégique (CRS) « Un cadre préclinique fondé sur des données probantes pour le développement de traitements antimicrobiens dans la fibrose kystique » (PIPE-CF ; N° de projet SRC 022) du UK Cystic Fibrosis Trust et de la US Cystic Fibrosis Foundation. LD et JF reconnaissent le financement de Kidney Research North West (projet no 49/19).
matériels
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Références
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon