Method Article
Galleria mellonella como modelo de cribado antimicrobiano
En este artículo
Resumen
Este estudio presenta un marco estandarizado para optimizar los modelos de infección por G. mellonella para su uso en la evaluación preclínica de antimicrobianos. La aplicación de un modelo de G. mellonella como parte de una línea de desarrollo preclínico de antimicrobianos podría disminuir el número de compuestos ineficaces que avanzan a los ensayos clínicos.
Resumen
Para combatir el creciente problema mundial de la resistencia a los antibióticos, es esencial acelerar el desarrollo de nuevos antibióticos. El desarrollo preclínico actual de antimicrobianos produce un número significativo de pistas que resultan inadecuadas antes o durante los ensayos clínicos. Para aumentar la eficiencia del desarrollo preclínico, se deben desarrollar modelos relevantes, estandarizados, accesibles y rentables. Las larvas de Galleria mellonella (polilla de la cera) se utilizan ampliamente como modelo de infección para evaluar la virulencia microbiana, realizar pruebas de toxicidad de fármacos y servir como medio preliminar para evaluar la eficacia in vivo de nuevos compuestos antimicrobianos. Estos modelos de infección tienen mayor relevancia biológica que muchos cribados in vitro de rendimiento comparable y disminuyen la dependencia de los modelos de mamíferos cuando se utilizan como precribado para las pruebas de antimicrobianos. Este protocolo describe una metodología estandarizada para la optimización de modelos de infección por G. mellonella , que se puede aplicar a las especies bacterianas y a las terapias antimicrobianas de elección. Utilizando como ejemplo el patógeno prioritario de la OMS, Pseudomonas aeruginosa , describimos los pasos que se pueden llevar a cabo para desarrollar un modelo reproducible de infección y pruebas terapéuticas. Esto incluye recomendaciones sobre la configuración experimental, la preparación de muestras y los protocolos de infección y tratamiento. La integración de este modelo en los proyectos de desarrollo preclínico de antimicrobianos disminuiría la dependencia de los modelos de mamíferos, reduciría el número de compuestos ineficaces que llegan a los ensayos clínicos y, en última instancia, aumentaría la eficiencia del desarrollo preclínico de antimicrobianos.
Introducción
Las larvas de Galleria mellonella (la polilla de la cera) se utilizan ampliamente en las ciencias biológicas como modelos de infección para especies microbianas y para pruebas de toxicidad de nuevos compuestos farmacológicos 1,2. Tienen el potencial de una utilidad considerable en una línea de pruebas preclínicas de antimicrobianos, ya que son de alto rendimiento, replican las características integrales in vivo de la infección humana y reducen la dependencia de los modelos de mamíferos, en línea con los principios de reducción, refinamiento y reemplazo que rigen el uso ético de las especies de mamíferos en la investigación.
El desarrollo de nuevos antibióticos requiere extensas pruebas preclínicas in vitro e in vivo antes de la validación clínica3. Solo unos pocos agentes novedosos con paquetes de datos preclínicos prometedores se traducen en la clínica, y uno de los factores que contribuyen a esta alta tasa de deserción es el fracaso de los cribados preclínicos para capturar las complejidades de los entornos de infección4. Estos problemas contribuyen no solo a una baja tasa de traslación de los agentes antimicrobianos a la clínica, sino también a un mayor uso de animales vertebrados de experimentación durante el cribado preclínico en las últimas etapas. Para mejorar la evaluación preclínica de los nuevos antimicrobianos y reducir el uso de modelos murinos in vivo costosos, lentos, complejos y éticamente problemáticos, se necesitan mejores herramientas de detección de fármacos en fase inicial que reduzcan el número de compuestos poco prometedores que avanzan hacia las pruebas en sistemas de vertebrados.
G. mellonella tiene un ciclo de vida corto de 8 semanas, compuesto por cuatro etapas de vida: huevo, larvas, pupas y adultos, de los cuales la forma larvaria se utiliza en este protocolo1. G. mellonella es fácil de mantener a lo largo de un experimento sin necesidad de un equipo especializado o de un centro de investigación con animales dedicado. No existe ningún requisito para buscar aprobación ética para su uso, y los investigadores pueden criar el organismo internamente para mejorar la calidad experimental 2,5,6,7. El sistema inmunitario de G. mellonella se asemeja mucho al del sistema inmunitario innato de los mamíferos, con la capacidad de responder a estímulos "propios" y "no propios"8. Los hemocitos son responsables del reconocimiento de patrones moleculares asociados a patógenos y de la posterior fagocitosis, desempeñando un papel funcionalmente análogo al de los neutrófilos en los seres humanos9. G. mellonella codifica tres tipos de receptores tipo Toll que han sido identificados por homología de secuencia con los humanos, y producen proteínas similares al complemento, que reconocen material no propio y forman complejos de melanización localizados después de la activación y polimerización de la fenoloxidasa en melanina10. Esto puede servir como una lectura visual de la salud de las larvas durante los experimentos de infección, ya que la cutícula se oscurece por la melanización. Cabe señalar, sin embargo, que el eje de melanización en los insectos, que involucra la fenoloxidasa, difiere sustancialmente del eje tirosinasa-melanina en los mamíferos11,12. Además, G. mellonella produce 18 péptidos antimicrobianos inducibles, incluidos los homólogos de lisozima y defensina13. Esta similitud, así como los sencillos procedimientos de mantenimiento de las larvas y la naturaleza de alto rendimiento del modelo, han hecho de G. mellonella un organismo ampliamente utilizado en la evaluación de nuevos fármacos. En el desarrollo preclínico de antibióticos, G. mellonella ha aumentado su utilidad en comparación con los modelos in vitro, ya que pueden modelar con mayor precisión las interacciones huésped-patógeno-fármaco en un entorno complejo con inmunidad activa.
En la actualidad, no existe ningún proveedor estandarizado de G. mellonella para la investigación en Europa. En su lugar, los investigadores deben comprar larvas de G. mellonella en tiendas de cebo o mantener su propia colonia. Si bien se han descrito métodos para mantener una colonia interna de G. mellonella que pueden aumentar la consistencia experimental 5,6,7, es probable que esta opción sea atractiva solo para aquellos que usan las larvas con frecuencia. Como tal, este protocolo se centra en la configuración experimental después de la compra de larvas a un proveedor de cebo vivo. Si bien es más accesible, este método aumenta la complejidad experimental y puede introducir variabilidad adicional en los ensayos debido a inconsistencias en la salud de las larvas en el momento en que se reciben de los proveedores. Para que los académicos, la industria y los reguladores acepten y adopten las pruebas de G. mellonella como parte de un proceso de desarrollo preclínico de antimicrobianos, es necesario un sistema estandarizado para la optimización y evaluación de la eficacia de los antimicrobianos.
Este estudio optimiza el diseño experimental de un modelo de infección por G. mellonella para el desarrollo de antibióticos. Si bien se han descrito modelos de infección por G. mellonella 14,15, la presente metodología documenta pasos adicionales para mitigar la complejidad adicional introducida por la inconsistencia del suministro y proporciona un marco para la evaluación de nuevos antimicrobianos. Como caso de prueba, G. mellonella se infectó con el patógeno de prioridad uno de la OMS, Pseudomonas aeruginosa, y se optimizó el tratamiento con un agente aminoglucósido (tobramicina). Este marco, ilustrado en la Figura 1, proporciona una base para futuros estudios preclínicos de cribado de antimicrobianos con nuevos agentes.
Protocolo
En este estudio, se seleccionaron larvas de Galleria mellonella (polilla de la cera) como modelo para las pruebas de susceptibilidad a los antibióticos y los ensayos de toxicidad aguda. No se requiere aprobación ética para el uso experimental de Galleria mellonella. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Diseño experimental
- Determinar el tamaño adecuado de los grupos de larvas de Galleria mellonella en función del cambio proporcional en la supervivencia larvaria que el estudio pretende capturar. En la Tabla 1 se detallan los tamaños de grupo necesarios para detectar cambios porcentuales específicos en la supervivencia utilizando un modelo de infección por la cepa PAO1 de Pseudomonas aeruginosa .
NOTA: Cuando se utilice un patógeno nuevo, primero determine la variabilidad entre ensayos en la supervivencia proporcional de las larvas infectadas pero no tratadas, ya que esto influirá en la determinación del tamaño de la muestra.- Incluya dos grupos de controles de PBS: uno inyectado antes que el resto de las infecciones para garantizar que la jeringa esté afilada y sea apta para su uso, y otro inyectado durante o después de las infecciones bacterianas para garantizar una esterilización adecuada entre los grupos de infección. Si se optimiza con un nuevo patógeno, incluya un control tratado térmicamente para garantizar que la muerte no sea el resultado de una respuesta inmunitaria a partículas extrañas.
NOTA: Las jeringas de insulina podrían usarse para inyecciones, lo que reduce los riesgos de embotamiento y contaminación. Sin embargo, los experimentos pueden utilizar rutinariamente cientos de G. mellonella, lo que hace que el uso de jeringas de insulina sea costoso y derrochador. - Para los estudios que optimizan el tratamiento antibacteriano, incluya dos controles adicionales: un grupo infectado con bacterias y luego inyectado con un tratamiento "simulado" del vehículo, y un grupo inyectado dos veces con el vehículo, una vez en el momento de la infección para las otras afecciones y una vez en el momento del tratamiento.
NOTA: El primero es un control no tratado, mientras que el segundo controla cualquier trauma causado por las inyecciones. Este tipo de traumatismo es más probable cuando se utilizan agujas romas.
- Incluya dos grupos de controles de PBS: uno inyectado antes que el resto de las infecciones para garantizar que la jeringa esté afilada y sea apta para su uso, y otro inyectado durante o después de las infecciones bacterianas para garantizar una esterilización adecuada entre los grupos de infección. Si se optimiza con un nuevo patógeno, incluya un control tratado térmicamente para garantizar que la muerte no sea el resultado de una respuesta inmunitaria a partículas extrañas.
- Ordene G. mellonella de un proveedor de cebo vivo, o mantenga una colonia de G. mellonella como se describió anteriormente 5,6,7. Para el proveedor que figura en la Tabla de Materiales, pida 1,8 veces el número previsto de larvas, ya que aproximadamente el 33% se excluirá en función del tamaño, y otro 10% puede morir después de la esterilización de la cutícula.
- Determinar la variabilidad del peso de G. mellonella antes del uso experimental y asegurarse de que el rango de peso no exceda una desviación estándar de la media.
NOTA: Para los proveedores que no figuran en la Tabla de Materiales, haga arreglos para que el proveedor proporcione nuevas existencias.
- Determinar la variabilidad del peso de G. mellonella antes del uso experimental y asegurarse de que el rango de peso no exceda una desviación estándar de la media.
- Una vez recibida, almacene G. mellonella a temperatura ambiente para limitar la posibilidad de capullo, que se produce después de la incubación a 37 °C.
NOTA: No todas las larvas de los proveedores comerciales forman capullos, que se han utilizado previamente como indicador de la salud de las larvas16. - Use las larvas dentro de 1 semana después de la recepción, en cuyo caso no requieren alimentación.
NOTA: Aunque la etapa de vida larvaria variará entre lotes, la mayoría de las larvas nacen durante el último estadio antes de la pupa. En esta etapa, la alimentación disminuye naturalmente en comparación con las etapas anteriores17.
2. Esterilización y selección de larvas de G. mellonella
- Pesar las larvas de Galleria mellonella y desechar las que estén fuera del rango de 224 mg ± 49,2 mg, que es el peso promedio de las larvas más o menos una desviación estándar. Esto resultará en la exclusión de aproximadamente el 33% de las larvas.
NOTA: La variación de peso puede diferir entre los proveedores. Para los proveedores que no figuran en este protocolo, calcule un rango de peso adecuado. - Realice los siguientes pasos en condiciones asépticas.
- Rocíe etanol al 70% en una placa de Petri, asegurándose de que haya suficiente para cubrir el fondo de la placa.
- Esterilizar la superficie de G. mellonella en lotes de 10 a 20 larvas.
- Coloque cada lote individualmente en el plato y rocíe las larvas dos veces con etanol al 70%.
- Use pinzas para enrollar las larvas, asegurando una cobertura total.
- Retire las larvas del etanol y colóquelas en una placa de Petri estéril. Deje el plato sin tapar para permitir que las larvas se sequen.
PRECAUCIÓN: Dejar G . mellonella en etanol durante más de 15 s provocará una alta mortalidad.
- Una vez que aproximadamente el 90% de las larvas hayan recuperado la actividad después de 2 h, separar las larvas recuperadas en grupos de un tamaño que permita una detección suficiente de los cambios en la supervivencia de acuerdo con los cálculos de potencia detallados en la Tabla 1.
- Use G. mellonella dentro de las 6 h posteriores a la esterilización.
3. Optimización de la densidad del inóculo bacteriano
- Prepare una reserva de infección bacteriana de una UFC/ml conocida antes de la infección. Los métodos para generar existencias variarán según el organismo. Aquí, Pseudomonas aeruginosa se cultivó hasta la fase media del registro en caldo de nutrientes, alícuota y se congeló a una densidad de 6 x 107 UFC/mL.
- Granular el caldo infeccioso centrifugando a 10.000 x g a temperatura ambiente durante 5 min, y resuspender en PBS. Diluir en serie el stock bacteriano diez veces para generar un rango de dosis de inóculo de 101-10 7 UFC por larva, considerando que a cada larva se le inyectan 10 μL de inóculo.
NOTA: El rango específico de dosis de inóculo variará dependiendo de la virulencia bacteriana, pero el rango propuesto aquí debería ser adecuado para la mayoría de las especies patógenas. La determinación de la tasa de crecimiento in vitro puede ayudar a informar la selección de un rango de dosis apropiado, ya que la tasa de crecimiento específica de la cepa en el cultivo líquido se correlaciona con la mortalidad larvaria. - Antes de comenzar las infecciones, enumere el inóculo con una dilución seriada de Miles y Misra para determinar con precisión la densidad del inóculo18.
- Prepare tres tubos de microfuga de 1 mL que contengan dH2O estéril, etanol al 70% o PBS estéril. Estos se utilizarán continuamente para esterilizar la jeringa utilizada para inyectar las larvas.
- Inspeccione una jeringa Hamilton estéril de 100 μL, asegurándose de que la punta de la aguja esté afilada y no haya desarrollado un gancho, lo que causará un traumatismo significativo en el sitio de la infección.
PRECAUCIÓN: La punta de la aguja de una jeringa Hamilton comenzará a deformarse después de aproximadamente 300 infecciones. Si la punta de la aguja está deformada, debe ser reemplazada. - Lave la jeringa secuencialmente condH2O, etanol y PBS antes de las infecciones, extrayendo y desechando la capacidad máxima de la jeringa.
- Agite el inóculo de infección resuspendido y extraiga un máximo de 100 μL en la jeringa Hamilton, suficiente para inyectar 10 μL por larva.
- Inyectar a cada larva 10 μL de inóculo en la pata trasera derecha. Asegúrese de que la aguja penetre aproximadamente 2 mm en el cuerpo.
NOTA: Se pueden utilizar varios métodos de infección. Estos incluyen sostener la larva sobre la punta de una pipeta para exponer las patas, asegurar la jeringa estáticamente y colocar la G. mellonella con la mano, o inyectar a mano alzada. - Entre cada serie de infecciones, esterilice la jeringa como se detalla en el paso 2.5 para evitar la contaminación de los comensales cutáneos residuales.
- Incubar las larvas infectadas a una temperatura suficiente para el crecimiento microbiano, entre 20 °C y 42 °C, que es un rango apropiado para la supervivencia de G. mellonella 5.
- Monitorear la supervivencia de G. mellonella a intervalos regulares desde el momento en que generalmente se observa la mortalidad por primera vez para medir con precisión el momento de la muerte. Esto debe ser evaluado en una pantalla inicial. Retire las larvas muertas y registre su hora de muerte.
- Seleccionar la dosis óptima de infección para un estudio de pruebas terapéuticas en función de la dosis que produzca una mortalidad del 50% a las 18 h y de más del 80% a las 72 h. Esto permite el desarrollo de un cribado rápido de un solo día, al tiempo que garantiza una virulencia suficiente y una ventana terapéutica adecuada.
4. Ensayos de toxicidad de nuevos agentes antimicrobianos en larvas no infectadas
- Evaluar la toxicidad de los nuevos antimicrobianos y vehículos seleccionados en Galleria mellonella antes de su uso con larvas infectadas experimentalmente. Preparar una amplia gama de dosis que excedan el rango terapéutico esperado del antimicrobiano, guiado por datos de toxicidad in vitro (por ejemplo, línea celular), si están disponibles.
- Considere que a las larvas se les inyectará 10 μL del terapéutico. Prepare controles solo para vehículos a concentraciones que coincidan con aquellas en las que se administra el tratamiento.
- Inyecte G. mellonella sana y estéril en grupos apropiados con las diferentes concentraciones de antimicrobianos y PBS del vehículo, como se detalla en los pasos 3.2-3.10. En el presente estudio, el antimicrobiano utilizado fue la tobramicina.
NOTA: Para el agente que requiere DMSO como solvente, inyecte con una aguja de calibre 26s, en lugar de la aguja estándar de calibre 22, ya que el traumatismo de las agujas más grandes aumenta la mortalidad cuando se usa DMSO. - Defina una dosis segura como aquella que no produce diferencias significativas en la mortalidad en comparación con las larvas inyectadas solo con PBS.
5. Optimización del tratamiento de la infección bacteriana por G. mellonella con un agente antimicrobiano
- Preparar un rango de dosis del agente antimicrobiano, considerando que las larvas infectadas se tratan con una dosis de 10 μL. Utilice un intervalo de dosis con una toxicidad mínima, como se evaluó en el paso 4.
- Siga los pasos 1 y 2 de este protocolo para preparar e infectar Galleria mellonella en grupos apropiados con la dosis de infección previamente optimizada.
- A las 2 h después de la infección, trate las larvas con el agente antimicrobiano preparado o la solución de control del vehículo. Siga los pasos 3.2-3.8, inyectando en la pierna opuesta a la inyectada durante la infección. Esterilizar la aguja entre grupos.
NOTA: Para esta optimización se seleccionó el tratamiento a las 2 h con el fin de obtener datos sólidos de dosis-respuesta, a partir de los cuales se determinó la optimización posterior del tiempo de tratamiento19. - Monitorear la supervivencia de G. mellonella a intervalos de 30 minutos o con mayor frecuencia desde el momento en que generalmente se observa la mortalidad por primera vez. Retire las larvas muertas y registre su hora de muerte.
- Calcular el cambio en las proporciones de supervivencia entre los grupos de tratamiento. Utilice el análisis de supervivencia de Kaplan-Meier para determinar si el tratamiento conduce a una mortalidad larvaria significativamente alterada. Incluir una corrección post-hoc apropiada para la multiplicidad por pares en análisis multigrupo.
6. Optimización del tiempo de tratamiento de G. mellonella infectada
- Siga los pasos 1 y 2 para preparar Galleria mellonella en grupos apropiados con la dosis de infección previamente optimizada.
- Prepare el agente antimicrobiano a la dosis previamente optimizada en el paso 4.
- A las 2 h, 4 h, 6 h, 9 h o 12 h después de la infección, trate las larvas infectadas siguiendo los pasos 3.2-3.8 para comparar cómo el momento del tratamiento afecta la mortalidad.
- Monitorear la supervivencia de G. mellonella a intervalos de 30 minutos o con mayor frecuencia desde el momento en que generalmente se observa la mortalidad por primera vez. Retire las larvas muertas y registre su hora de muerte. El momento óptimo es el que mantiene la supervivencia observada tras la optimización inicial de la dosis de tratamiento.
NOTA: Al probar la eficacia antimicrobiana en G. mellonella, optimice tanto la dosis de tratamiento como el momento por separado, utilizando la primera para informar la dosis de tratamiento en la segunda.
Resultados
Evaluación de la variación de los lotes en el peso de G. mellonella
Una fuente potencial de variación no deseada en los experimentos de infección proviene de las diferencias de tamaño entre las unidades experimentales individuales (es decir, larvas) y entre lotes. Los efectos de esta variación pueden mitigarse ajustando el tratamiento o las dosis de infección en función del peso, o seleccionando sólo las larvas dentro de un rango de peso definido para su uso en experimentos. Este último ajuste es más pragmático y no está sujeto a errores humanos que puedan surgir durante la preparación de la dosis. Una ventaja adicional del pesaje de las larvas es que permite la conversión de las dosis de tratamiento de las administradas a las larvas a sus equivalentes humanos, en mg/kg. Para cuantificar la variación dentro de los lotes y entre ellos, se pesaron tres lotes de 50 larvas, ordenadas en diferentes momentos. El peso medio en cada grupo fue de 225,5 mg, 230,54 mg y 215,86 mg, con desviaciones estándar de 49,1 mg, 53,7 mg y 44,3 mg, respectivamente (Figura 2A). Entre lotes, no hubo diferencia significativa en el peso. En todos los lotes, el peso osciló entre 107,5 mg y 341,0 mg, con una media de 224,0 mg ± 49,2 mg.
Para obtener resultados reproducibles, las larvas se pesaron antes de la experimentación y se seleccionaron si su peso era de 224 mg ± 49,2 mg, reduciendo el rango de peso de 233,5 mg a 98,4 mg, y eliminando el 33% de las larvas. Esto está en línea con trabajos previos que identificaron una variación significativa en la supervivencia de larvas infectadas con SARM con bandas de peso mayores de 100 mg14,20. También comparamos el peso de G. mellonella en el punto de parto con el de una semana después del parto, ya que cualquier cambio significativo de peso podría influir en los resultados experimentales cuando las larvas no se utilizan inmediatamente después de su llegada. El peso medio de G. mellonella fue de 230,54 mg ± 53,7 mg. Una semana después del parto, el peso medio fue de 221,8 mg ± 45,7 mg de desviación estándar (Figura 2B). No hubo diferencias significativas entre el peso a la llegada y el peso después de una semana, por lo que se concluye que las larvas pueden ser utilizadas con fines experimentales en cualquier momento dentro de la primera semana desde el parto. Es importante tener en cuenta que estos resultados son representativos solo de G. mellonella comprada a un proveedor, y el peso puede diferir significativamente entre proveedores o cuando las larvas se ordenan en diferentes momentos.
Optimización de la densidad de inóculo de P. aeruginosa PAO1
Se evaluó la virulencia de cinco aislados de P. aeruginosa a cuatro densidades de inóculo, incluyendo tres cepas de laboratorio de uso común, PAO1, PA14 y PAK, y dos aislados clínicos de infección respiratoria crónica, LESB58 e IST27-M. Estos se utilizaron como parte de un panel de deformaciones relevantes para la FQ desarrollado por Mahenthiralingam et al.21 y son representativos de la filogenia global de la especie. Los datos preliminares de crecimiento en el caldo de nutrientes mostraron una menor tasa de crecimiento para los aislados de infección crónica (Figura 3). Teniendo en cuenta esto, G. mellonella se infectó en grupos de 10 larvas con dosis de 101, 102, 103 o 104 UFC/larva en 10μl de PBS para PAO1, PA14 y PAK, y dosis de 102, 103, 104 o 105 UFC/larva para LESB58 e IST27-M. Dos grupos de 10 larvas también fueron inyectados con PBS solamente, un grupo antes y otro después de las infecciones. Las inyecciones de PBS antes de las infecciones controlan el PBS contaminado o la contaminación de las agujas con especies microbianas de la cutícula de Galleria, mientras que las inyecciones de PBS después de la infección controlan cualquier contaminación de las agujas con bacterias utilizadas en el proceso de infección. Las dosis óptimas para PAO1, PA14 y PAK fueron de 10 UFC/larva, ya que las densidades mayores resultaron en > muerte del 50% a las 18 h (Figura 4). 10 UFC fue la dosis más baja que se podía preparar de manera confiable y reproducible para la infección. Se requirieron dosis más altas de LESB58 e IST27-M para lograr la cinética de supervivencia deseada, lo que refleja el crecimiento más lento y la menor capacidad de carga de estos aislados en condiciones in vitro (Figura 4). La dosis óptima para ambos fue de 104 UFC/larva. LESB58 e IST27-M son aislados clínicos de individuos con infecciones crónicas, y LESB58 ha demostrado previamente una virulencia más baja en modelos de roedores que PAO122.
Ensayos de toxicidad de tobramicina y colistina en Galleria mellonella
Antes de evaluar la eficacia de los nuevos compuestos antimicrobianos, debe evaluarse su toxicidad inyectando una amplia gama de dosis clínicamente relevantes. Esto permite que los compuestos con alta toxicidad se eliminen de las pruebas en una fase temprana de la fase preclínica. La tobramicina y la colistina fueron evaluadas contra larvas de G. mellonella no infectadas, ya que se administran comúnmente para el tratamiento de la infección por P. aeruginosa en personas con fibrosis quística (fCF)23. El uso clínico de tobramicina oscila entre 3 mg/kg diarios para los enfermos graves sin fibrosis quística y 11 mg/kg cada 24 h para los pacientes con fibrosis quística24,25. Estos valores se utilizaron como guía para la dosificación en Galleria mellonella, con 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg de tobramicina seleccionados para las pruebas de toxicidad. No se observó ninguna muerte en ninguna concentración. Teniendo en cuenta la ausencia de toxicidad de la tobramicina a altas concentraciones, se evaluó la toxicidad de la colistina, ya que previamente se había asociado con nefrotoxicidad o neurotoxicidad en el 29,8% de los pwCF, con una dosis de carga de 2,9 (±1,5) mg/kg y una dosis diaria global de 4,1 (±1,1) mg/kg26. Esto lo convirtió en un candidato valioso para las pruebas de toxicidad, aunque los efectos específicos de órganos en humanos sugirieron que la toxicidad podría no traducirse a G. mellonella. De hecho, cuando se administraron dosis de 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg y 250 mg/kg de colistina, no se observó la muerte de las larvas durante 72 h. Como tal, la colistina se administró finalmente en su máxima solubilidad enH2O, a 2000 mg/kg. Se observó la muerte de todas las larvas dentro de las 12 h, lo que confirma que la toxicidad del fármaco puede evaluarse en G. mellonella, pero que se debe tener precaución al tratar de predecir la toxicidad en humanos.
Optimización de la dosis de tratamiento de tobramicina contra la infección por P. aeruginosa PAO1
Se administró una variedad de dosis de tobramicina clínicamente relevantes a las larvas infectadas con P. aeruginosa para optimizar la dosis de tratamiento. En el caso de los nuevos antimicrobianos, la dosis puede seleccionarse inicialmente en función del uso clínico de antibióticos similares existentes o de los datos preclínicos del nuevo agente, como las concentraciones mínimas inhibitorias del caldo. Para evaluar la eficacia de la tobramicina frente a P. aeruginosa PAO1, las larvas de G. mellonella se infectaron con 10 UFC de P. aeruginosa PAO1, según se había optimizado previamente, y se les inyectó 1 mg/kg, 2,5 mg/kg o 5 mg/kg de tobramicina a las 2 h después de la infección. Estas dosis fueron elegidas con base en trabajos previos de G. mellonella con tobramicina y están en línea con las dosis clínicas actuales de tobramicina en individuos sin fibrosis quística 24,27,28.
El umbral para el éxito inicial fue un aumento del 50% en la supervivencia de G. mellonella en comparación con los controles no tratados. El tratamiento con PAO1 con 1 mg/kg de tobramicina tuvo poco impacto en la mortalidad por G. mellonella , con un 90% de muerte a las 28 h post-infección (Figura 5). El tratamiento con 2,5 mg/kg de tobramicina retrasó la mortalidad, pero produjo una mortalidad general del 80% con 5 mg/kg de tobramicina, lo que resultó en una supervivencia óptima del 90%. La dosis efectiva para la PA14 fue de 5 mg/kg, pero para la PAK fue de 2,5 mg/kg. La dosis efectiva para IST27-M fue mayor a 10 mg/kg, mientras que ninguna concentración de tobramicina analizada fue suficiente para rescatar a las larvas de la infección por LESB58. Esta tendencia se correlacionó con los valores de concentración inhibitoria mínima (CMI) para la tobramicina en el caldo Mueller Hinton ajustado por cationes, en el que 1 μg/mL fue suficiente para inhibir el 90% del crecimiento en todas las cepas excepto en LESB58, que tuvo una CMI de 8 μg/mL. Como tal, las pruebas iniciales de CMI se pueden usar para indicar la resistencia relativa entre cepas, aunque no deben usarse para determinar rangos de dosis en G. mellonella, que deben optimizarse por separado.
Optimización del tiempo de tratamiento con tobramicina frente a la infección por P. aeruginosa PAO1
La aplicación clínica de antibióticos no suele ocurrir a las pocas horas de la infección, sino días o semanas después. Probar nuevos antimicrobianos de esta manera es inalcanzable en G. mellonella, ya que se observa una alta mortalidad dentro de las 24 horas posteriores a la infección por P. aeruginosa PAO1. Para aumentar la relevancia del modelo de infección, los nuevos antimicrobianos deben administrarse lo más tarde posible durante la infección. Para optimizar los tiempos de tratamiento, se administraron 5 mg/kg de tobramicina a las larvas de G. mellonella infectadas con PAO1 a las 2 h, 4 h, 6 h, 9 h y 12 h post-infección. El éxito experimental se definió como el tratamiento antibiótico que produjo un aumento del >50% en la supervivencia en comparación con la infección por PAO1. El tratamiento a las 9 h y a las 12 h retrasó la mortalidad, aunque no logró resolver la infección (Figura 6). El tratamiento a las 2 h, 4 h y 6 h produjo una supervivencia superior al 50%.
Optimización del tamaño del grupo de G. mellonella
El tamaño del grupo experimental se calculó con base en la variación observada en la supervivencia de G. mellonella después de la infección con 10 UFC/larvas de P. aeruginosa PAO1. El tamaño del grupo puede diferir en función del cambio porcentual esperado entre el grupo de control y el grupo de tratamiento no tratados en cualquier estudio (Tabla 1). Los cálculos siguieron lo descrito por Charan et al.29. La ecuación utilizada se describe a continuación.
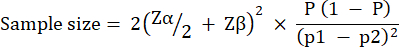
Dónde:
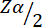 = 1,96 con un error de tipo 1 del 5%.
= 1,96 con un error de tipo 1 del 5%.
Zβ = 0,842 es el valor que proporciona el 80% de potencia estadística.
p1 = La proporción de eventos en el grupo de prueba, calculada como p2 + el cambio porcentual esperado
p2 = proporción de eventos en el grupo de control (infección no tratada), calculada sobre la base de la variabilidad de la supervivencia de P. aeruginosa PAO1 a 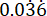 .
.
P = Prevalencia agrupada, definida como (p1 + p2)/2.
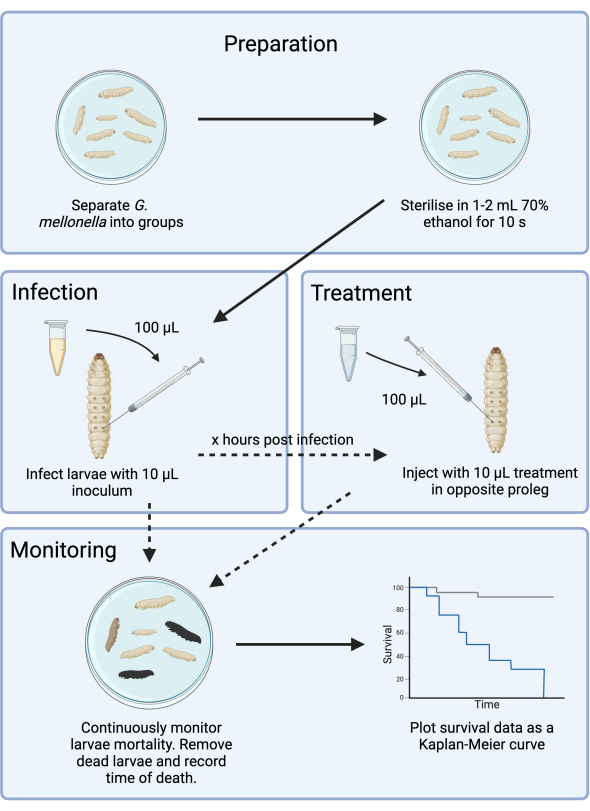
Figura 1: Esquema de un estudio de infección por G. mellonella . El protocolo general incluye la preparación de las larvas de G. mellonella antes de la infección, la infección con 10 μL de inóculo, el tratamiento opcional a las pocas horas después de la infección y el seguimiento continuo. Haga clic aquí para ver una versión más grande de esta figura.
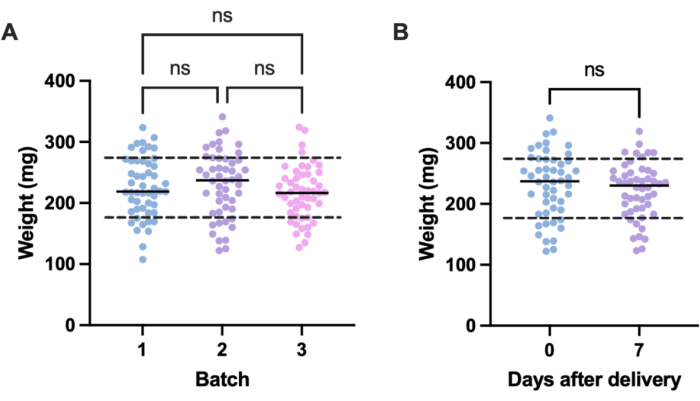
Figura 2: Variación dependiente del lote y del tiempo en el peso de las larvas de Galleria mellonella. (A) Peso de tres lotes de 50 larvas de Galleria mellonella pesadas inmediatamente después de la entrega. Cada lote se pidió en diferentes momentos. No hubo diferencias significativas en el peso entre lotes, calculado por un ANOVA de un factor (P > 0,05). (B) Peso de 50 larvas pesadas en el momento de la recepción en comparación con el mismo lote pesado una semana después. No hubo diferencia significativa en el peso calculado por la prueba t de Student (P > 0,05). ns: No significativo. Haga clic aquí para ver una versión más grande de esta figura.
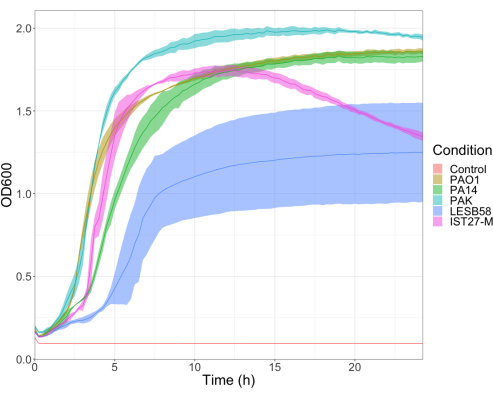
Figura 3: Curvas de crecimiento de las cepas de P. aeruginosa PAO1, PA14, PAK, LESB58 e IST27-M. Cada cepa se cultivó en LB a partir de un ODinicial 600 de 0,08-0,13, y posteriormente se midió el DO600 cada 15 min durante 24 h de crecimiento estático a 37 °C. Haga clic aquí para ver una versión más grande de esta figura.
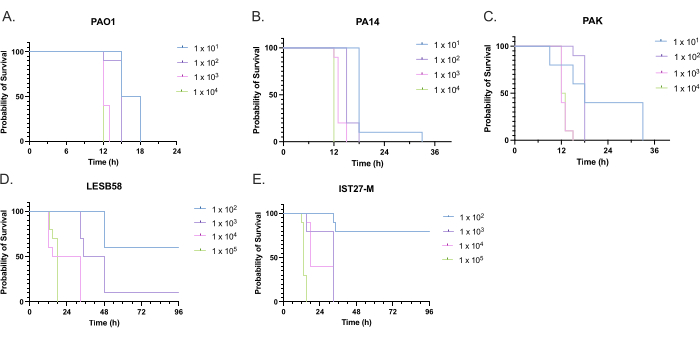
Figura 4: Optimización de la densidad de inóculo de cepas de Pseudomonas aeruginosa para la infección de larvas de Galleria mellonella . Supervivencia de larvas de Galleria mellonella después de la inyección con diferentes densidades de unidades formadoras de colonias (UFC) por larva. Las densidades de inóculo probadas fueron de 10, 10², 10³ o 104 UFC por larva para (A) PAO1, (B) PA14 o (C) PAK, y 10², 10³, 104 o 105 UFC por larva para (D) LESB58 y (E) IST27-M. Se utilizaron diez larvas por grupo, cada una inyectada con 10 μL de inóculo en la propata posterior derecha. La supervivencia se controló cada 30 min a partir de las 16 h post-infección y se registró el momento de la muerte. Todas las cepas mostraron virulencia dependiente de la dosis, determinada por la prueba de rango logarítmico (Mantel-Cox) para la significación. P < 0,05 para todas las comparaciones de dosis dentro de la cepa, excepto para PAK 101 vs. PAK 102, PAK 103 vs. PAK 104, LESB58 104 vs. LESB58 105, e IST27-M 103 vs. IST27-M 104, que no fueron significativos. Esta figura es representativa de tres réplicas biológicas. Haga clic aquí para ver una versión más grande de esta figura.
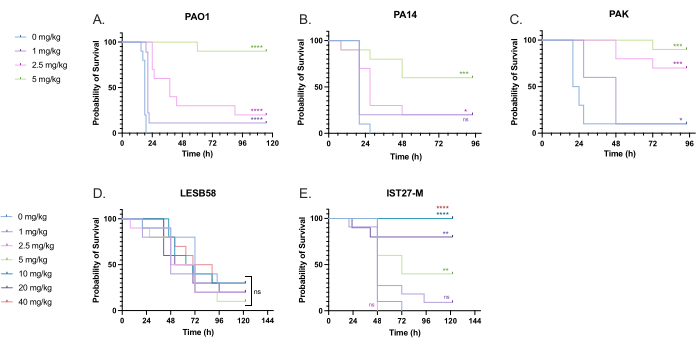
Figura 5: Supervivencia de las larvas de Galleria mellonella tras la inyección con cepas de panel de P. aeruginosa y el tratamiento con sulfato de tobramicina 2 h después de la infección. 10 larvas de G. mellonella por grupo experimental se infectaron con 10 UFC de (A) PAO1, (B) PA14 o (C) PAK o 103 UFC de (D) LESB58 o (E) IST27-M por larva en 10 μL de PBS. Las infecciones se administraron en la propata trasera izquierda. 2 h después de la infección, se inyectaron 10 μL de PBS como control sin tratamiento, 1 mg/kg, 2,5 mg/kg o 5 mg/kg de tobramicina, con LESB58 e IST27-M tratados con 10 μL de PBS, 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg o 40 mg/kg de tobramicina, como se indica en la figura. La tobramicina se diluyó en agua destilada y se administró en la pata trasera derecha. Se realizó un seguimiento continuo de la supervivencia y se registró el momento de la muerte. Prueba de rango logarítmico (Mantel-Cox) para significación vs. el control PBS para cada cepa. ns: No significativo, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Esta figura es representativa de tres réplicas biológicas. Haga clic aquí para ver una versión más grande de esta figura.
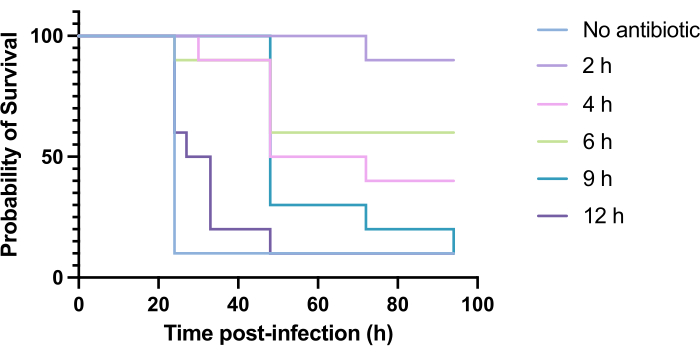
Figura 6: Supervivencia de las larvas de Galleria mellonella tras la infección por Pseudomonas aeruginosa PAO1 y el posterior tratamiento con tobramicina en varios momentos posteriores a la infección. 10 larvas de G. mellonella por grupo experimental se infectaron con 10 UFC de PAO1 en 10 μL de PBS, inyectadas en la propata trasera derecha. Posteriormente, las larvas se inyectaron a las 2 h, 4 h, 6 h, 9 h o 12 h después de la infección con 5 mg/kg de sulfato de tobramicina en 10 μL de agua destilada en la pata trasera izquierda. Se realizó un seguimiento continuo de la supervivencia y se registró el momento de la muerte. Prueba de rango logarítmico (Mantel-Cox) para significación vs. Control no tratado. P < 0,0005, ****P < 0,0001. Esta figura es representativa de tres réplicas biológicas. Haga clic aquí para ver una versión más grande de esta figura.
| Cambio esperado en la supervivencia (%) | Tamaño del grupo |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tabla 1: Tamaño del grupo para experimentos de supervivencia de G. mellonella en los que las larvas de G. mellonella se infectan con 10 UFC/larvas con P. aeruginosa PAO1 y posteriormente se les administra un agente.
Discusión
La carga de la resistencia a los antimicrobianos (RAM) aumenta continuamente. En 2019, se estima que 4,95 millones de muertes se asociaron con la resistencia a los antimicrobianos en todo el mundo30. Para 2050, se estima que la mortalidad causada por la resistencia a los antimicrobianos alcanzará los 10 millones31. Para hacer frente a este riesgo, los nuevos antimicrobianos deben desarrollarse y probarse de manera eficiente y rentable, lo que requiere el uso de modelos preclínicos que predigan con precisión la eficacia de los antimicrobianos. La alta tasa de deserción observada durante la traslación a ensayos clínicos es un factor limitante importante. Un estudio describió 13 candidatos a antibióticos que fracasaron en los ensayos clínicos, y 11 que no lograron avanzar a la fase II32.
El presente estudio proporciona un marco para la optimización de los estudios preclínicos de cribado antimicrobiano de G. mellonella y un método para la evaluación de la eficacia antimicrobiana. Las larvas de G. mellonella tienen una utilidad considerable en la evaluación de la toxicidad de los fármacos, la determinación de CMI y las pruebas de virulencia, al tiempo que contribuyen a la reducción de los mamíferos utilizados en el desarrollo preclínico. Las larvas de Galleria mellonella tienen un rendimiento relativamente alto, son biológicamente relevantes y se traducen bien en modelos de mamíferos más complejos. Mientras tanto, mientras que los ratones de laboratorio de tipo salvaje cuestan entre £ 8 y £ 30 cada uno con ~ £ 7 de mantenimiento semanal por ratón, G. mellonella cuesta ~ £ 2 por 50 larvas. Por lo tanto, probar 10 compuestos en un modelo de G. mellonella costaría ~ £ 60, en comparación con más de £ 4000 para el mismo estudio en ratones. Además, estudios previos han comparado la toxicidad y eficacia de nuevos compuestos e identificado una correlación entre la toxicidad aguda en G. mellonella y ratones 8,19,33. Por lo tanto, se recomienda implementar un cribado de G. mellonella para priorizar los compuestos que se van a probar más a fondo en modelos de ratón.
A pesar de la clara utilidad del modelo, hay varias consideraciones para garantizar una aplicación exitosa. La falta de larvas estériles de grado de investigación complica su preparación para el uso experimental, ya que se requiere la esterilización con etanol o se requiere que los investigadores mantengan su propia colonia de G. mellonella, lo que mitigaría el riesgo de contaminación y mejoraría la calidad experimental general 5,6. Una esterilización inadecuada puede producir una mortalidad considerable, y es un desafío esterilizar completamente el organismo, ya que un tiempo de exposición más prolongado al etanol conduce a la muerte. Los métodos alternativos de esterilización incluyen frotar la pata de cada larva con etanol al 70% antes de la infección, lo que disminuiría la mortalidad durante la esterilización, pero es un método más laborioso. También se podrían utilizar otros antisépticos, aunque no se evaluaron alternativas en este estudio, ya que la esterilización con etanol produjo una muerte del <10%, una vez optimizada. Además, a menudo no está claro si los proveedores tratan a su G. mellonella con antibióticos, ya que los proveedores pueden obtener sus larvas de otros proveedores en lugar de mantener las colonias ellos mismos.
La biología de G. mellonella difiere considerablemente de la de los mamíferos, lo que impone limitaciones a su utilidad. Su sistema inmunitario carece de inmunidad adaptativa, aunque están presentes aspectos solubles y celulares clave de la inmunidad innata. Los hemocitos son una de las principales defensas inmunitarias innatas de G. mellonella y muestran propiedades similares a las de los fagocitos. Se han descrito varios subconjuntos de estas células, incluyendo granulocitos y plasmatocitos, entre otros34. G. mellonella tampoco puede recapitular los sitios de infección relevantes, como los de las infecciones respiratorias o de la vejiga. Sin embargo, en un proceso preclínico, G. mellonella serviría como preselección para modelos murinos, asegurando que solo los compuestos más prometedores progresarían a través del complejo sistema de mamíferos que se asemeja más a los entornos de infección humanos. Por último, el modelo se beneficiaría de una mayor caracterización genómica de G. mellonella para determinar su idoneidad para evaluar cambios en biomarcadores clínicamente relevantes. En particular, esto requiere mejorar nuestra comprensión de la inmunidad de G. mellonella.
En general, el modelo de infección por Galleria mellonella es una herramienta valiosa para la evaluación preclínica de nuevos compuestos antimicrobianos antes de su evaluación en modelos de mamíferos. Si bien su uso es complicado por la falta de estandarización del suministro, su aplicación es de alto rendimiento, simple y se puede aplicar ampliamente en todo el panorama de desarrollo de antimicrobianos. En el futuro, la integración de este modelo dentro de una cartera preclínica estandarizada podría acelerar el desarrollo de nuevos compuestos antimicrobianos para aumentar la proporción de candidatos que pasan de la evaluación preclínica a los ensayos clínicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
TB, AK, JF y DN recibieron subvenciones para el Centro de Investigación Estratégica (SRC) "Un marco preclínico basado en la evidencia para el desarrollo de terapias antimicrobianas en la fibrosis quística" (PIPE-CF; Proyecto No. SRC 022) del UK Cystic Fibrosis Trust y la US Cystic Fibrosis Foundation. LD y JF reconocen la financiación de Kidney Research North West (Proyecto Nº 49/19).
Materiales
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Referencias
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados