Method Article
Galleria mellonella come modello di screening antimicrobico
In questo articolo
Riepilogo
Questo studio presenta un quadro standardizzato per l'ottimizzazione dei modelli di infezione da G. mellonella da utilizzare nella valutazione antimicrobica preclinica. L'applicazione di un modello di G. mellonella come parte di una pipeline di sviluppo antimicrobico preclinico potrebbe ridurre il numero di composti inefficaci che progrediscono verso gli studi clinici.
Abstract
Per combattere il crescente problema globale della resistenza agli antibiotici, è essenziale accelerare lo sviluppo di nuovi antibiotici. L'attuale sviluppo preclinico di antimicrobici produce un numero significativo di elettrocateteri che si rivelano inadatti prima o durante gli studi clinici. Per aumentare l'efficienza dello sviluppo preclinico, è necessario sviluppare modelli pertinenti, standardizzati, accessibili ed economici. Le larve di Galleria mellonella (falena della cera maggiore) sono ampiamente utilizzate come modello di infezione per valutare la virulenza microbica, condurre test di tossicità dei farmaci e fungere da mezzo preliminare per valutare l'efficacia in vivo di nuovi composti antimicrobici. Questi modelli di infezione hanno una rilevanza biologica maggiore rispetto a molti screening in vitro con produttività comparabile e riducono la dipendenza dai modelli di mammifero quando vengono utilizzati come pre-screening per i test antimicrobici. Questo protocollo descrive una metodologia standardizzata per l'ottimizzazione dei modelli di infezione da G. melnella , che può essere applicata a specie batteriche e terapie antimicrobiche di scelta. Utilizzando come esempio il patogeno prioritario dell'OMS Pseudomonas aeruginosa , delineiamo i passi che possono essere intrapresi per sviluppare un modello riproducibile di infezione e test terapeutici. Ciò include raccomandazioni sulla configurazione sperimentale, sulla preparazione dei campioni e sui protocolli di infezione e trattamento. L'integrazione di questo modello all'interno delle pipeline di sviluppo preclinico di antimicrobici ridurrebbe la dipendenza dai modelli di mammifero, ridurrebbe il numero di composti inefficaci che raggiungono gli studi clinici e, in ultima analisi, aumenterebbe l'efficienza dello sviluppo preclinico di antimicrobici.
Introduzione
Le larve di Galleria mellonella (la falena della cera maggiore) sono ampiamente utilizzate nelle scienze biologiche come modelli di infezione per specie microbiche e per test di tossicità di nuovi composti farmacologici 1,2. Hanno il potenziale per una notevole utilità in una pipeline di test antimicrobici preclinici, in quanto sono ad alta produttività, replicano le caratteristiche integrali in vivo dell'infezione umana e riducono la dipendenza dai modelli di mammiferi, in linea con i principi di riduzione, perfezionamento e sostituzione che regolano l'uso etico delle specie di mammiferi nella ricerca.
Lo sviluppo di nuovi antibiotici richiede test preclinici approfonditi in vitro e in vivo prima della convalida clinica3. Solo pochi nuovi agenti con promettenti pacchetti di dati preclinici si traducono nella clinica, e uno dei fattori che contribuiscono a questo alto tasso di abbandono è l'incapacità degli screening preclinici di catturare le complessità degli ambienti di infezione4. Questi problemi contribuiscono non solo a un basso tasso di traduzione degli agenti antimicrobici alla clinica, ma anche a un maggiore uso di animali vertebrati da esperimento durante lo screening preclinico in fase avanzata. Per migliorare la valutazione preclinica di nuovi antimicrobici e ridurre l'uso di modelli murini in vivo costosi, dispendiosi in termini di tempo, complessi ed eticamente problematici, sono necessari migliori strumenti di screening farmacologico in fase iniziale che riducano il numero di composti poco promettenti che progrediscono verso i test nei sistemi di vertebrati.
G. mellonella ha un breve ciclo di vita di 8 settimane, composto da quattro fasi di vita: uovo, larve, pupe e adulti, di cui la forma larvale è utilizzata in questo protocollo1. G. mellonella sono facili da mantenere durante un esperimento senza la necessità di attrezzature specializzate o di una struttura di ricerca animale dedicata. Non è necessario richiedere l'approvazione etica per il loro uso e i ricercatori possono allevare l'organismo internamente per migliorare la qualità sperimentale 2,5,6,7. Il sistema immunitario di G. mellonella assomiglia molto a quello del sistema immunitario innato dei mammiferi, con la capacità di rispondere a stimoli "self" e "non-self"8. Gli emociti sono responsabili del riconoscimento dei pattern molecolari associati ai patogeni e della successiva fagocitosi, svolgendo un ruolo funzionalmente analogo a quello dei neutrofili nell'uomo9. G. mellonella codifica per tre tipi di recettori toll-like che sono stati identificati dall'omologia di sequenza con l'uomo e producono proteine simili al complemento, che riconoscono il materiale non-self e formano complessi di melanizzazione localizzati in seguito all'attivazione e alla polimerizzazione della fenoliossidasi in melanina10. Questo può servire come lettura visiva della salute delle larve durante gli esperimenti di infezione, poiché la cuticola è scurita dalla melanizzazione. Va notato, tuttavia, che l'asse di melanizzazione negli insetti, che coinvolge la fenolossidasi, differisce sostanzialmente dall'asse tirosinasi-melanina nei mammiferi11,12. Inoltre, G. mellonella produce 18 peptidi antimicrobici inducibili, tra cui gli omologhi del lisozima e della defensina13. Questa somiglianza, così come le semplici procedure di mantenimento larvale e l'elevata produttività del modello, hanno reso G. mellonella un organismo ampiamente utilizzato nella valutazione di nuovi farmaci. Nello sviluppo preclinico di antibiotici, G. mellonella ha una maggiore utilità rispetto ai modelli in vitro, in quanto può modellare in modo più accurato le interazioni ospite-patogeno-farmaco in un ambiente complesso con immunità attiva.
Al momento, non esiste un fornitore standardizzato di G. mellonella in Europa. I ricercatori devono invece acquistare larve di G. mellonella dai negozi di esche o mantenere la propria colonia. Sebbene siano stati descritti metodi per mantenere una colonia interna di G. mellonella e possano aumentare la consistenza sperimentale 5,6,7, è probabile che questa opzione sia attraente solo per coloro che usano frequentemente le larve. Pertanto, questo protocollo si concentra sulla configurazione sperimentale a seguito dell'acquisto di larve da un fornitore di esche vive. Sebbene più accessibile, questo metodo aumenta la complessità sperimentale e può introdurre ulteriore variabilità nei saggi a causa di incongruenze nella salute delle larve nel momento in cui vengono ricevute dai fornitori. Affinché il mondo accademico, l'industria e le autorità di regolamentazione accettino e adottino il test di G. mellonella come parte di una pipeline di sviluppo antimicrobico preclinico, è necessario un sistema standardizzato per l'ottimizzazione e la valutazione dell'efficacia antimicrobica.
Questo studio ottimizza il disegno sperimentale di un modello di infezione da G. mellonella per lo sviluppo di antibiotici. Mentre i modelli di infezione da G. mellonella sono stati descritti14,15, la presente metodologia documenta ulteriori passaggi per mitigare l'ulteriore complessità introdotta dall'incoerenza dell'offerta e fornisce un quadro per la valutazione di nuovi antimicrobici. Come caso di prova, G. mellonella è stata infettata con l'agente patogeno prioritario dell'OMS Pseudomonas aeruginosa e il trattamento con un agente aminoglicosidico (tobramicina) è stato ottimizzato. Questo quadro, illustrato nella Figura 1, fornisce una base per futuri studi di screening antimicrobico preclinico con nuovi agenti.
Protocollo
In questo studio, le larve di Galleria mellonella (falena della cera maggiore) sono state selezionate come modello per i test di sensibilità agli antibiotici e i test di tossicità acuta. Non è richiesta alcuna approvazione etica per l'uso sperimentale della Galleria mellonella. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Progettazione sperimentale
- Determinare le dimensioni appropriate del gruppo di larve di Galleria mellonella in base al cambiamento proporzionale nella sopravvivenza larvale che lo studio mira a catturare. La Tabella 1 descrive in dettaglio le dimensioni dei gruppi necessarie per rilevare specifiche variazioni percentuali nella sopravvivenza utilizzando un modello di infezione da Pseudomonas aeruginosa ceppo PAO1.
NOTA: Quando si utilizza un nuovo patogeno, determinare innanzitutto la variabilità tra i test nella sopravvivenza proporzionale delle larve infette ma non trattate, in quanto ciò influenzerà la determinazione della dimensione del campione.- Includi due gruppi di controlli PBS: uno iniettato prima del resto delle infezioni per garantire che la siringa sia affilata e adatta all'uso, e un altro iniettato durante o dopo le infezioni batteriche per garantire una corretta sterilizzazione tra i gruppi di infezione. Se si ottimizza con un nuovo agente patogeno, includere un controllo trattato termicamente per garantire che la morte non sia il risultato di una risposta immunitaria alle particelle estranee.
NOTA: Le siringhe da insulina possono essere utilizzate per le iniezioni, riducendo i rischi di ottundimento e contaminazione. Tuttavia, gli esperimenti possono utilizzare di routine centinaia di G. mellonella, rendendo l'uso di siringhe da insulina costoso e dispendioso. - Per gli studi che ottimizzano il trattamento antibatterico, includere due controlli aggiuntivi: un gruppo infettato da batteri e poi iniettato con un trattamento "fittizio" del veicolo, e un gruppo iniettato due volte con il veicolo, una volta al momento dell'infezione per le altre condizioni e una volta al momento del trattamento.
NOTA: Il primo è un controllo non trattato, mentre il secondo controlla eventuali traumi causati dalle iniezioni. Tale trauma è più probabile quando vengono utilizzati aghi smussati.
- Includi due gruppi di controlli PBS: uno iniettato prima del resto delle infezioni per garantire che la siringa sia affilata e adatta all'uso, e un altro iniettato durante o dopo le infezioni batteriche per garantire una corretta sterilizzazione tra i gruppi di infezione. Se si ottimizza con un nuovo agente patogeno, includere un controllo trattato termicamente per garantire che la morte non sia il risultato di una risposta immunitaria alle particelle estranee.
- Ordina G. mellonella da un fornitore di esche vive o mantieni una colonia di G. mellonella come descritto in precedenza 5,6,7. Per il fornitore elencato nella Tabella dei Materiali, ordinare 1,8 volte il numero previsto di larve, poiché circa il 33% sarà escluso in base alle dimensioni e un ulteriore 10% potrebbe morire dopo la sterilizzazione delle cuticole.
- Determinare la variabilità del peso di G. mellonella prima dell'uso sperimentale e assicurarsi che l'intervallo di peso non superi una deviazione standard della media.
NOTA: Per i fornitori non elencati nella Tabella dei materiali, fare in modo che il fornitore fornisca nuove scorte.
- Determinare la variabilità del peso di G. mellonella prima dell'uso sperimentale e assicurarsi che l'intervallo di peso non superi una deviazione standard della media.
- Al ricevimento, conservare G. mellonella a temperatura ambiente per limitare la possibilità di bozzolo, che si verifica dopo l'incubazione a 37 °C.
NOTA: Non tutte le larve provenienti da fornitori commerciali formano bozzoli, che sono stati precedentemente utilizzati come indicatore della salute delle larve16. - Utilizzare le larve entro 1 settimana dal ricevimento, nel qual caso non necessitano di alimentazione.
NOTA: Sebbene la fase di vita larvale vari tra i lotti, la maggior parte delle larve viene consegnata durante l'ultimo stadio prima dell'impupamento. In questa fase, l'alimentazione diminuisce naturalmente rispetto alle fasi precedenti17.
2. Sterilizzazione e selezione delle larve di G. mellonella
- Pesare le larve di Galleria mellonella e scartare quelle che non rientrano nell'intervallo di 224 mg ± 49,2 mg, che è il peso medio delle larve più o meno una deviazione standard. Ciò comporterà l'esclusione di circa il 33% delle larve.
NOTA: La variazione di peso può variare da un fornitore all'altro. Per i fornitori non elencati in questo protocollo, calcolare un intervallo di peso appropriato. - Eseguire i seguenti passaggi in condizioni asettiche.
- Spruzzare il 70% di etanolo in una capsula di Petri, assicurandosi che ne copra abbastanza da coprire il fondo della capsula.
- Sterilizzare la superficie di G. mellonella in lotti di 10-20 larve.
- Metti ogni lotto singolarmente nel piatto e spruzza le larve due volte con etanolo al 70%.
- Usa le pinzette per arrotolare le larve, garantendo una copertura completa.
- Togliete le larve dall'etanolo e mettetele in una capsula di Petri sterile. Lasciare il piatto scoperto per permettere alle larve di asciugarsi.
ATTENZIONE: Lasciare G. mellonella nell'etanolo per più di 15 s comporterà un'elevata mortalità.
- Una volta che circa il 90% delle larve ha riacquistato attività dopo 2 ore, separare le larve recuperate in gruppi di dimensioni tali da consentire un rilevamento sufficiente dei cambiamenti di sopravvivenza secondo i calcoli di potenza dettagliati nella Tabella 1.
- Utilizzare G. mellonella entro 6 ore dalla sterilizzazione.
3. Ottimizzazione della densità dell'inoculo batterico
- Preparare una scorta di infezione batterica di una CFU/mL nota prima dell'infezione. I metodi per generare gli stock variano a seconda dell'organismo. Qui, Pseudomonas aeruginosa è stato coltivato fino alla fase di metà log in brodo di nutrienti, aliquotato e congelato a una densità di 6 x 107 CFU/mL.
- Pellettare il brodo di infezione centrifugando a 10.000 x g a temperatura ambiente per 5 minuti e risospendere in PBS. Diluire in serie il ceppo batterico di dieci volte per generare un intervallo di dosi di inoculo di 10 1-107 CFU per larva, considerando che ogni larva viene iniettata con 10 μL di inoculo.
NOTA: L'intervallo di dose specifico dell'inoculo differirà a seconda della virulenza batterica, ma l'intervallo proposto qui dovrebbe essere adatto alla maggior parte delle specie patogene. La determinazione del tasso di crescita in vitro può aiutare a selezionare un intervallo di dosi appropriato, poiché il tasso di crescita specifico del ceppo in coltura liquida è correlato alla mortalità larvale. - Prima di iniziare le infezioni, enumerare l'inoculo con una diluizione seriale di Miles e Misra per determinare con precisione la densità dell'inoculo18.
- Preparare tre provette per microfugi da 1 mL contenenti dH2O sterile, etanolo al 70% o PBS sterile. Questi verranno utilizzati continuamente per sterilizzare la siringa utilizzata per iniettare le larve.
- Ispezionare una siringa Hamilton sterile da 100 μl, assicurandosi che la punta dell'ago sia affilata e non abbia sviluppato un uncino, che causerà un trauma significativo al sito di infezione.
ATTENZIONE: La punta di un ago per siringa di Hamilton inizierà a deformarsi dopo circa 300 infezioni. Se la punta dell'ago è deformata, deve essere sostituita. - Lavare la siringa in sequenza con dH2O, etanolo e PBS prima dell'infezione, prelevando e scartando la capacità massima della siringa.
- Agitare l'inoculo dell'infezione risospesa e aspirare un massimo di 100 μl nella siringa di Hamilton, sufficiente per iniettare 10 μl per larva.
- Iniettare ogni larva con 10 μL di inoculo nella zampa posteriore destra. Assicurarsi che l'ago penetri per circa 2 mm nel corpo.
NOTA: Possono essere utilizzati vari metodi di infezione. Questi includono tenere la larva sopra la punta di una pipetta per esporre le prozampe, fissare la siringa staticamente e posizionare la G. mellonella a mano o iniettare a mano libera. - Tra una serie di infezioni e l'altra, sterilizzare la siringa come descritto al punto 2.5 per prevenire la contaminazione da commensali cutanei residui.
- Incubare le larve infette a una temperatura sufficiente per la crescita microbica, compresa tra 20 °C e 42 °C, che è un intervallo appropriato per la sopravvivenza di G. mellonella 5.
- Monitorare la sopravvivenza di G. mellonella a intervalli regolari dal momento in cui la mortalità viene solitamente osservata per la prima volta per misurare con precisione il momento della morte. Questo deve essere valutato in una prima fase. Rimuovi tutte le larve morte e registra il loro momento di morte.
- Selezionare la dose di infezione ottimale per uno studio di test terapeutico in base alla dose che produce una mortalità del 50% entro 18 ore e oltre l'80% entro 72 ore. Ciò consente lo sviluppo di uno screening rapido di un solo giorno, garantendo al contempo una virulenza sufficiente e una finestra terapeutica appropriata.
4. Test di tossicità di nuovi agenti antimicrobici in larve non infette
- Valutare la tossicità di nuovi antimicrobici e veicoli scelti in Galleria mellonella prima del loro uso con larve infettate sperimentalmente. Preparare un'ampia gamma di dosi che superino l'intervallo terapeutico previsto dell'antimicrobico, sulla base di dati di tossicità in vitro (ad es. linea cellulare), se disponibili.
- Si consideri che alle larve verranno iniettati 10 μL di terapeutico. Preparare controlli solo veicolo a concentrazioni corrispondenti a quelle in cui viene somministrato il terapeutico.
- Iniettare G. mellonella sana e sterile in gruppi di dimensioni appropriate con le diverse concentrazioni di antimicrobico e veicolo PBS, come descritto nei passaggi 3.2-3.10. Nel presente studio, l'antimicrobico utilizzato era la tobramicina.
NOTA: Per gli agenti che richiedono DMSO come solvente, iniettare con un ago calibro 26s, piuttosto che con l'ago standard calibro 22, poiché il trauma causato da aghi più grandi aumenta la mortalità quando si utilizza il DMSO. - Definire una dose sicura come quella che non produce differenze significative nella mortalità rispetto alle larve iniettate solo con PBS.
5. Ottimizzazione del trattamento dell'infezione batterica da G. mellonella con un agente antimicrobico
- Preparare una serie di dosi dell'agente antimicrobico, considerando che le larve infette vengono trattate con una dose di 10 μl. Utilizzare una gamma di dosi con tossicità minima, come valutato al punto 4.
- Seguire i passaggi 1 e 2 di questo protocollo per preparare e infettare la galleria-mellonella in gruppi appropriati alla dose di infezione precedentemente ottimizzata.
- A 2 ore dall'infezione, trattare le larve con l'agente antimicrobico preparato o la soluzione di controllo del veicolo. Seguire i passaggi 3.2-3.8, iniettando nella gamba anteriore opposta a quella iniettata durante l'infezione. Sterilizzare l'ago tra i gruppi.
NOTA: Il trattamento a 2 ore è stato selezionato per questa ottimizzazione per acquisire forti dati dose-risposta, da cui è stata determinata la successiva ottimizzazione dei tempi di trattamento19. - Monitorare la sopravvivenza di G. mellonella a intervalli di 30 minuti o più frequentemente dal momento in cui la mortalità viene solitamente osservata per la prima volta. Rimuovi tutte le larve morte e registra il loro momento di morte.
- Calcolare la variazione delle proporzioni di sopravvivenza tra i gruppi di trattamento. Utilizzare l'analisi di sopravvivenza di Kaplan-Meier per determinare se il trattamento porta a una mortalità larvale significativamente alterata. Includere un'appropriata correzione post-hoc per la molteplicità a coppie nelle analisi multi-gruppo.
6. Ottimizzazione dei tempi di trattamento di G. mellonella infetta
- Seguire i passaggi 1 e 2 per preparare la galleria-mellonella in gruppi appropriati alla dose di infezione precedentemente ottimizzata.
- Preparare l'agente antimicrobico alla dose precedentemente ottimizzata nella fase 4.
- A 2 ore, 4 ore, 6 ore, 9 ore o 12 ore dopo l'infezione, trattare le larve infette seguendo i passaggi 3.2-3.8 per confrontare in che modo la tempistica del trattamento influisce sulla mortalità.
- Monitorare la sopravvivenza di G. mellonella a intervalli di 30 minuti o più frequentemente dal momento in cui la mortalità viene solitamente osservata per la prima volta. Rimuovi tutte le larve morte e registra il loro momento di morte. La tempistica ottimale è quella che mantiene la sopravvivenza osservata dopo l'ottimizzazione iniziale della dose di trattamento.
NOTA: Quando si verifica l'efficacia antimicrobica in G. mellonella, ottimizzare separatamente la dose e la tempistica del trattamento, utilizzando la prima per informare la dose di trattamento nella seconda.
Risultati
Valutazione della variazione del peso del lotto di G. mellonella
Una potenziale fonte di variazioni indesiderate negli esperimenti di infezione deriva dalle differenze di dimensioni tra le singole unità sperimentali (ad esempio, le larve) e tra i lotti. Gli effetti di questa variazione possono essere mitigati aggiustando le dosi di trattamento o di infezione in base al peso, oppure selezionando solo quelle larve all'interno di un intervallo di peso definito per l'uso negli esperimenti. Quest'ultimo aggiustamento è più pragmatico e non è soggetto a errori umani che potrebbero verificarsi durante la preparazione della dose. Un ulteriore vantaggio della pesatura delle larve è che consente la conversione delle dosi di trattamento da quelle somministrate alle larve ai loro mg/kg equivalenti umani. Per quantificare la variazione all'interno e tra i lotti, sono stati pesati tre lotti di 50 larve, ordinati in momenti diversi. Il peso medio in ciascun gruppo era di 225,5 mg, 230,54 mg e 215,86 mg, con deviazioni standard rispettivamente di 49,1 mg, 53,7 mg e 44,3 mg (Figura 2A). Tra i lotti, non c'era alcuna differenza significativa di peso. Tra i lotti, il peso variava da 107,5 mg a 341,0 mg, con una media di 224,0 mg ± 49,2 mg.
Per ottenere risultati riproducibili, le larve sono state pesate prima della sperimentazione e selezionate se il loro peso era compreso tra 224 mg ± 49,2 mg, riducendo l'intervallo di peso da 233,5 mg a 98,4 mg e rimuovendo il 33% delle larve. Ciò è in linea con lavori precedenti che hanno identificato una variazione significativa nella sopravvivenza delle larve infettate da MRSA con bande di peso superiori a 100 mg14,20. Abbiamo anche confrontato il peso di G. mellonella al momento del parto con quello di una settimana dopo il parto, poiché qualsiasi cambiamento di peso significativo potrebbe influenzare i risultati sperimentali quando le larve non vengono utilizzate immediatamente dopo l'arrivo. Il peso medio di G. mellonella era di 230,54 mg ± 53,7 mg. Una settimana dopo il parto, il peso medio era di 221,8 mg ± 45,7 mg di deviazione standard (Figura 2B). Non c'era alcuna differenza significativa tra il peso all'arrivo e il peso dopo una settimana, da cui si deduce che le larve possono essere utilizzate a scopo sperimentale in qualsiasi momento entro la prima settimana dalla consegna. È importante notare che questi risultati sono rappresentativi solo di G. mellonella acquistata da un fornitore e il peso può differire in modo significativo tra i fornitori o quando le larve vengono ordinate in momenti diversi.
Ottimizzazione della densità dell'inoculo di P. aeruginosa PAO1
È stata valutata la virulenza di cinque isolati di P. aeruginosa a quattro densità di inoculo, inclusi tre ceppi di laboratorio comunemente usati, PAO1, PA14 e PAK, e due isolati clinici da infezione respiratoria cronica, LESB58 e IST27-M. Questi sono stati utilizzati come parte di un pannello di ceppi rilevanti per la FC sviluppato da Mahenthiralingam et al.21 e sono rappresentativi della filogenesi globale della specie. I dati preliminari di crescita nel brodo di nutrienti hanno mostrato un tasso di crescita inferiore per gli isolati da infezione cronica (Figura 3). Considerando ciò, G. mellonella è stata infettata in gruppi di 10 larve con dosi di 101, 102, 103 o 104 CFU/larva in 10 μl di PBS per PAO1, PA14 e PAK e dosi di 102,10 3, 104 o 105 CFU/larva per LESB58 e IST27-M. Due gruppi di 10 larve sono stati anche iniettati solo con PBS, un gruppo prima e un gruppo dopo le infezioni. Le iniezioni di PBS prima delle infezioni controllano la presenza di PBS contaminato o la contaminazione degli aghi con specie microbiche dalla cuticola della Galleria, mentre le iniezioni di PBS dopo il controllo dell'infezione per qualsiasi contaminazione degli aghi con batteri utilizzati nel processo di infezione. Le dosi ottimali per PAO1, PA14 e PAK erano di 10 UFC/larva, poiché densità maggiori hanno comportato > morte del 50% entro 18 ore (Figura 4). 10 CFU era la dose più bassa che poteva essere preparata in modo affidabile e riproducibile per l'infezione. Dosi più elevate di LESB58 e IST27-M sono state necessarie per ottenere la cinetica di sopravvivenza desiderata, riflettendo la crescita più lenta e la minore capacità di carico di questi isolati in condizioni in vitro (Figura 4). La dose ottimale per entrambi era di10,4 CFU/larve. LESB58 e IST27-M sono isolati clinici da individui con infezioni croniche e LESB58 ha precedentemente dimostrato una virulenza inferiore nei modelli di roditori rispetto a PAO122.
Test di tossicità di tobramicina e colistina in Galleria Mellonella
Prima di valutare l'efficacia di nuovi composti antimicrobici, la loro tossicità deve essere valutata iniettando un'ampia gamma di dosi clinicamente rilevanti. Ciò consente di rimuovere i composti con elevata tossicità dai test nelle prime fasi della pipeline preclinica. La tobramicina e la colistina sono state valutate contro larve di G. mellonella non infette, poiché sono comunemente somministrate per il trattamento dell'infezione da P. aeruginosa nelle persone con fibrosi cistica (pwCF)23. L'uso clinico della tobramicina varia da 3 mg/kg al giorno per i soggetti gravemente malati senza fibrosi cistica a 11 mg/kg ogni 24 ore per quelli con fibrosi cistica24,25. Questi valori sono stati utilizzati come guida per il dosaggio in Galleria mellonella, con 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg di tobramicina selezionati per i test di tossicità. Non è stato osservato alcun decesso in nessuna concentrazione. Considerando l'assenza di tossicità della tobramicina ad alte concentrazioni, è stata valutata la tossicità della colistina in quanto è stata precedentemente associata a nefrotossicità o neurotossicità nel 29,8% delle pwCF, con una dose di carico di 2,9 (±1,5) mg/kg e la dose giornaliera complessiva di 4,1 (±1,1) mg/kg26. Ciò lo ha reso un valido candidato per i test di tossicità, sebbene gli effetti organo-specifici nell'uomo suggeriscano che la tossicità potrebbe non tradursi in G. mellonella. Infatti, quando sono state somministrate dosi di 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg e 250 mg/kg di colistina, non è stata osservata alcuna morte di larve nell'arco di 72 ore. Pertanto, la colistina è stata infine somministrata alla sua massima solubilità in H2O, a 2000 mg/kg. La morte di tutte le larve è stata osservata entro 12 ore, confermando che la tossicità del farmaco può essere valutata in G. mellonella, ma che è necessario prestare attenzione quando si cerca di prevedere la tossicità per l'uomo.
Ottimizzazione del dosaggio del trattamento della tobramicina contro l'infezione da P. aeruginosa PAO1
Una serie di dosi di tobramicina clinicamente rilevanti sono state somministrate a larve infette da P. aeruginosa per ottimizzare il dosaggio del trattamento. Per i nuovi antimicrobici, il dosaggio può essere inizialmente selezionato in base all'uso clinico di antibiotici simili esistenti o in base ai dati preclinici per il nuovo agente, come le concentrazioni minime inibitorie del brodo. Per valutare l'efficacia della tobramicina contro P. aeruginosa PAO1, le larve di G. mellonella sono state infettate con 10 CFU di P. aeruginosa PAO1, come precedentemente ottimizzato, e iniettate con 1 mg/kg, 2,5 mg/kg o 5 mg/kg di tobramicina a 2 ore dopo l'infezione. Queste dosi sono state scelte sulla base di precedenti lavori di G. mellonella con tobramicina e sono in linea con le attuali dosi cliniche di tobramicina in individui senza fibrosi cistica 24,27,28.
La soglia per il successo iniziale è stata un aumento del 50% della sopravvivenza di G. mellonella rispetto ai controlli non trattati. Il trattamento con PAO1 con 1 mg/kg di tobramicina ha avuto un impatto minimo sulla mortalità di G. melnella , con il 90% di decessi a 28 ore dall'infezione (Figura 5). Il trattamento con 2,5 mg/kg di tobramicina ha ritardato la mortalità, ma ha prodotto una mortalità complessiva dell'80% con 5 mg/kg di tobramicina, con conseguente sopravvivenza ottimale del 90%. La dose efficace per PA14 era di 5 mg/kg, ma per PAK era di 2,5 mg/kg. La dose efficace per IST27-M è risultata più alta a 10 mg/kg, mentre nessuna concentrazione di tobramicina testata è risultata sufficiente per salvare le larve dall'infezione da LESB58. Questa tendenza è correlata ai valori di concentrazione inibitoria minima (MIC) per la tobramicina nel brodo di Mueller Hinton aggiustato per i cationi, in cui 1 μg/mL era sufficiente per inibire il 90% della crescita in tutti i ceppi ad eccezione di LESB58, che aveva una MIC di 8 μg/mL. Pertanto, il test MIC iniziale può essere utilizzato per indicare la resistenza relativa tra i ceppi, anche se non dovrebbe essere utilizzato per determinare gli intervalli di dose in G. mellonella, che dovrebbero essere ottimizzati separatamente.
Ottimizzazione dei tempi di trattamento con tobramicina contro l'infezione da P. aeruginosa PAO1
L'applicazione clinica degli antibiotici in genere non si verifica entro poche ore dall'infezione, ma giorni o settimane dopo. La sperimentazione di nuovi antimicrobici in questo modo è impossibile in G. mellonella, poiché si osserva un'elevata mortalità entro 24 ore dall'infezione da P. aeruginosa PAO1. Per aumentare la rilevanza del modello di infezione, i nuovi antimicrobici devono essere somministrati il più tardi possibile durante l'infezione. Per ottimizzare i tempi di trattamento, 5 mg/kg di tobramicina sono stati somministrati a larve di G. mellonella infettate da PAO1 a 2 ore, 4 ore, 6 ore, 9 ore e 12 ore dopo l'infezione. Il successo sperimentale è stato definito come il trattamento antibiotico che produce un aumento della sopravvivenza del >50% rispetto all'infezione da PAO1. Il trattamento a 9 e 12 ore ha ritardato la mortalità, sebbene non sia stato in grado di risolvere l'infezione (Figura 6). Il trattamento a 2 ore, 4 ore e 6 ore ha prodotto una sopravvivenza superiore al 50%.
Ottimizzazione delle dimensioni del gruppo di G. mellonella
La dimensione del gruppo sperimentale è stata calcolata in base alla variazione osservata nella sopravvivenza di G. mellonella dopo l'infezione con 10 UFC/larve di P. aeruginosa PAO1. La dimensione del gruppo può variare in base alla variazione percentuale attesa tra il gruppo di controllo non trattato e il gruppo di trattamento in qualsiasi studio (Tabella 1). I calcoli seguirono quello descritto da Charan et al.29. L'equazione utilizzata è descritta di seguito.
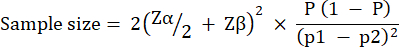
Dove:
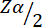 = 1,96 con errore di tipo 1 del 5%.
= 1,96 con errore di tipo 1 del 5%.
Zβ = 0,842 è il valore che fornisce l'80% della potenza statistica.
p1 = La proporzione di eventi nel gruppo di test, calcolata come p2 + la variazione percentuale prevista
p2 = La proporzione di eventi nel gruppo di controllo (infezione non trattata), calcolata in base alla variabilità di sopravvivenza di P. aeruginosa PAO1 a 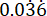 .
.
P = Prevalenza aggregata, definita come (p1 + p2)/2.
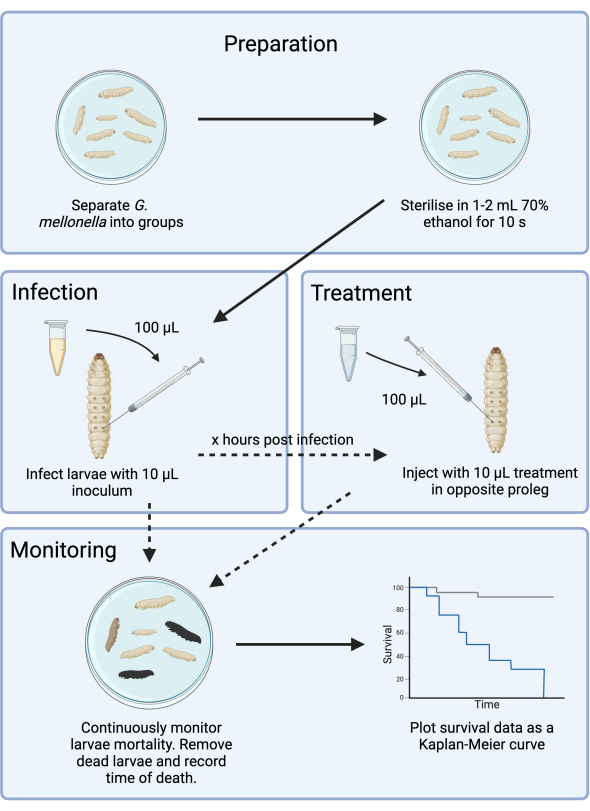
Figura 1: Schema di uno studio sull'infezione da G. mellonella . Il protocollo generale prevede la preparazione delle larve di G. mellonella prima dell'infezione, l'infezione con inoculo da 10 μL, il trattamento facoltativo a un certo numero di ore dopo l'infezione e il monitoraggio continuo. Clicca qui per visualizzare una versione più grande di questa figura.
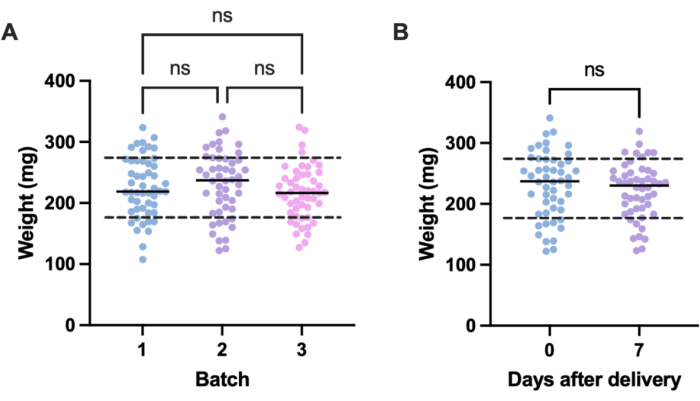
Figura 2: Variazione dipendente dal lotto e dal tempo nel peso delle larve di Galleria . (A) Peso di tre lotti di 50 larve di galleria , pesati immediatamente dopo la consegna. Ogni lotto è stato ordinato in momenti diversi. Non c'era alcuna differenza significativa di peso tra i lotti, come calcolato da un'ANOVA unidirezionale (P > 0,05). (B) Peso di 50 larve pesate al ricevimento rispetto allo stesso lotto pesato una settimana dopo. Non c'era alcuna differenza significativa di peso come calcolato da un test t di Student (P > 0,05). ns: Non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
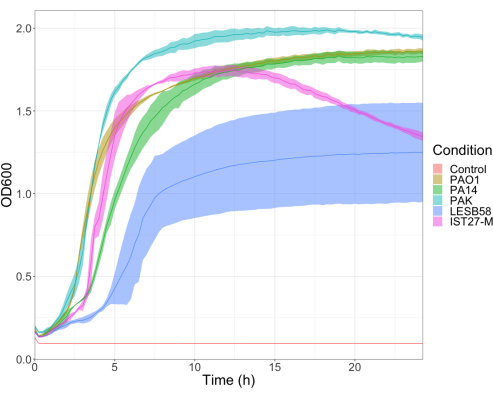
Figura 3: Curve di crescita dei ceppi di P. aeruginosa PAO1, PA14, PAK, LESB58 e IST27-M. Ogni ceppo è stato coltivato in LB da un OD600 iniziale di 0,08-0,13, e OD600 è stato successivamente misurato ogni 15 minuti durante una crescita statica di 24 ore a 37 °C. Clicca qui per visualizzare una versione più grande di questa figura.
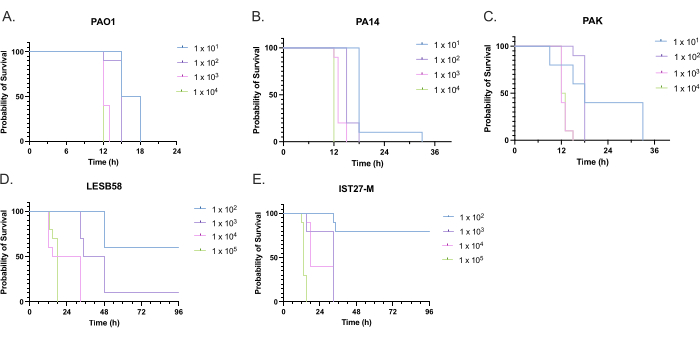
Figura 4: Ottimizzazione della densità dell'inoculo di ceppi di Pseudomonas aeruginosa per l'infezione delle larve di Galleria mellonella . Sopravvivenza delle larve di Galleria mellonella dopo iniezione con diverse densità di unità formanti colonie (CFU) per larva. Le densità di inoculo testate sono state 10, 10², 10³ o 104 CFU per larva per (A) PAO1, (B) PA14 o (C) PAK e 10², 10³, 104 o 105 CFU per larva per (D) LESB58 e (E) IST27-M. Sono state utilizzate dieci larve per gruppo, ciascuna iniettata con 10 μL di inoculo nella zampa posteriore destra. La sopravvivenza è stata monitorata ogni 30 minuti a partire da 16 ore dopo l'infezione ed è stato registrato il momento della morte. Tutti i ceppi hanno mostrato virulenza dose-dipendente, come determinato dal test Log-rank (Mantel-Cox) per la significatività. P < 0,05 per tutti i confronti di dose all'interno del ceppo ad eccezione di PAK 101 vs. PAK 102, PAK 103 contro PAK 104, LESB58 104 contro LESB58 105 e IST27-M 103 vs. IST27-M 104, che non erano significativi. Questa cifra è rappresentativa di tre repliche biologiche. Clicca qui per visualizzare una versione più grande di questa figura.
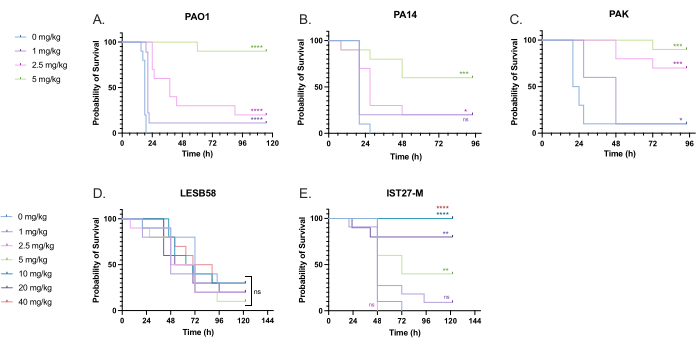
Figura 5: Sopravvivenza delle larve di Galleria-mellonella dopo iniezione con ceppi del pannello di P. aeruginosa e trattamento con tobramicina solfato 2 ore dopo l'infezione. 10 larve di G. mellonella per gruppo sperimentale sono state infettate con 10 CFU di (A) PAO1, (B) PA14 o (C) PAK o 103 CFU di (D) LESB58 o (E) IST27-M per larve in 10 μL di PBS. Le infezioni sono state somministrate alla zampa anteriore sinistra posteriore. 2 ore dopo l'infezione, PAO1, PA14 e PAK sono stati iniettati con 10 μL di PBS come controllo senza trattamento, 1 mg/kg, 2,5 mg/kg o 5 mg/kg di tobramicina, con LESB58 e IST27-M trattati con 10 μL di PBS, 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg o 40 mg/kg di tobramicina, come indicato in figura. La tobramicina è stata diluita in acqua distillata e somministrata nella zampa posteriore destra. La sopravvivenza è stata monitorata continuamente ed è stato registrato il momento della morte. Test log-rank (Mantel-Cox) per la significatività vs. il controllo PBS per ogni ceppo. ns: Non significativo, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Questa cifra è rappresentativa di tre repliche biologiche. Clicca qui per visualizzare una versione più grande di questa figura.
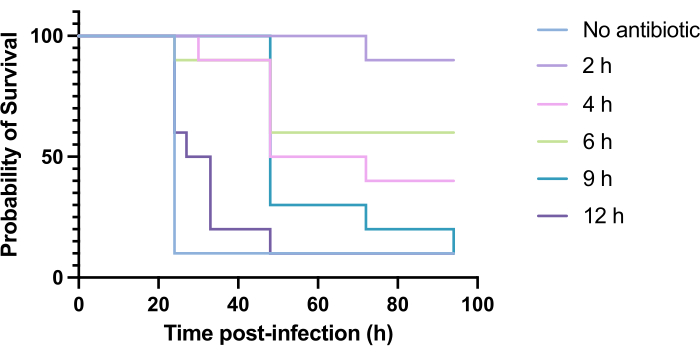
Figura 6: Sopravvivenza delle larve di Galleria mellonella dopo l'infezione da Pseudomonas aeruginosa PAO1 e successivo trattamento con tobramicina in vari momenti post-infezione. 10 larve di G. mellonella per gruppo sperimentale sono state infettate con 10 CFU di PAO1 in 10 μL di PBS, iniettato nella zampa posteriore destra. Le larve sono state successivamente iniettate a 2 ore, 4 ore, 6 ore, 9 ore o 12 ore dopo l'infezione con 5 mg/kg di tobramicina solfato in 10 μL di acqua distillata nella zampa anteriore sinistra posteriore. La sopravvivenza è stata monitorata continuamente ed è stato registrato il momento della morte. Test log-rank (Mantel-Cox) per la significatività vs. controllo non trattato. P < 0,0005, ****P < 0,0001. Questa cifra è rappresentativa di tre repliche biologiche. Clicca qui per visualizzare una versione più grande di questa figura.
| Variazione attesa della sopravvivenza (%) | Dimensione del gruppo |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tabella 1: Dimensione del gruppo per esperimenti di sopravvivenza di G. mellonella in cui le larve di G. mellonella vengono infettate con 10 CFU/larve con P. aeruginosa PAO1 e successivamente somministrate con un agente.
Discussione
L'onere della resistenza antimicrobica (AMR) è in continuo aumento. Nel 2019, si stima che 4,95 milioni di decessi siano stati associati alla resistenza antimicrobica in tutto il mondo30. Entro il 2050, si stima che la mortalità causata dalla resistenza antimicrobica raggiungerà i 10 milioni31. Per affrontare questo rischio, i nuovi antimicrobici devono essere sviluppati e testati in modo efficiente ed economico, il che richiede l'uso di modelli preclinici che prevedano con precisione l'efficacia antimicrobica. L'elevato tasso di abbandono osservato durante la traduzione verso gli studi clinici è un importante fattore limitante. Uno studio ha descritto 13 candidati antibiotici che hanno fallito negli studi clinici, con 11 che non sono riusciti a passare alla fase II32.
Il presente studio fornisce un quadro per l'ottimizzazione degli studi di screening antimicrobico preclinico di G. mellonella e un metodo per la valutazione dell'efficacia antimicrobica. Le larve di G. mellonella hanno una notevole utilità nella valutazione della tossicità dei farmaci, nella determinazione della MIC e nei test di virulenza, contribuendo al contempo alla riduzione dei mammiferi utilizzati nello sviluppo preclinico. Le larve di Galleria mellonella hanno una produttività relativamente elevata, sono biologicamente rilevanti e si traducono bene in modelli di mammiferi più complessi. Nel frattempo, mentre i topi da laboratorio wild-type costano tra £ 8 e £ 30 ciascuno con ~ £ 7 di manutenzione settimanale per topo, G. mellonella costa ~ £ 2 per 50 larve. Testare 10 composti in un modello di G. mellonella costerebbe, quindi, ~ £ 60, rispetto a più di £ 4000 per lo stesso studio sui topi. Inoltre, studi precedenti hanno confrontato la tossicità e l'efficacia di nuovi composti e identificato una correlazione tra la tossicità acuta in G. mellonella e nei topi 8,19,33. Pertanto, si raccomanda di implementare uno screening di G. mellonella per dare priorità ai composti da testare ulteriormente nei modelli murini.
Nonostante la chiara utilità del modello, ci sono diverse considerazioni per garantire un'applicazione di successo. La mancanza di larve sterili di livello di ricerca complica la loro preparazione per l'uso sperimentale, poiché è necessaria la sterilizzazione con etanolo o i ricercatori sono tenuti a mantenere la propria colonia di G. mellonella, il che mitigherebbe il rischio di contaminazione e migliorerebbe la qualità sperimentale complessiva 5,6. Una sterilizzazione impropria può produrre una notevole mortalità ed è difficile sterilizzare completamente l'organismo, poiché un tempo di esposizione più lungo all'etanolo porta alla morte. I metodi alternativi di sterilizzazione includono il tampone della zampa anteriore di ciascuna larva con etanolo al 70% prima dell'infezione, che ridurrebbe la mortalità durante la sterilizzazione, ma è un metodo più laborioso. Potrebbero essere utilizzati anche altri antisettici, anche se in questo studio non sono state valutate alternative, poiché la sterilizzazione con etanolo ha prodotto <10% di decessi, una volta ottimizzata. Inoltre, spesso non è chiaro se i fornitori trattano la loro G. mellonella con antibiotici, poiché i fornitori possono procurarsi le loro larve da altri fornitori piuttosto che mantenere le colonie da soli.
La biologia di G. mellonella differisce notevolmente da quella dei mammiferi, il che impone limitazioni alla loro utilità. Il loro sistema immunitario manca di qualsiasi immunità adattativa, sebbene siano presenti aspetti solubili e cellulari chiave dell'immunità innata. Gli emociti sono la principale difesa immunitaria innata di G. mellonella e mostrano proprietà simili a quelle dei fagociti. Sono stati descritti vari sottogruppi di queste cellule, tra cui granulociti e plasmatociti, tra gli altri34. G. mellonella inoltre non è in grado di ricapitolare i siti di infezione rilevanti, come quelli delle infezioni respiratorie o della vescica. Tuttavia, in una pipeline preclinica, G. mellonella servirebbe come pre-screening per i modelli murini, assicurando che solo i composti più promettenti progrediscano attraverso il complesso sistema dei mammiferi che assomiglia più da vicino agli ambienti di infezione umana. Infine, il modello trarrebbe beneficio da un'ulteriore caratterizzazione genomica di G. mellonella per determinare la sua idoneità a valutare i cambiamenti in biomarcatori clinicamente rilevanti. In particolare, ciò richiede di migliorare la nostra comprensione dell'immunità di G. melnella.
Nel complesso, il modello di infezione da mellonella Galleria è uno strumento prezioso per la valutazione preclinica di nuovi composti antimicrobici prima della loro valutazione in modelli di mammiferi. Sebbene il loro utilizzo sia complicato dalla mancanza di standardizzazione dell'approvvigionamento, la loro applicazione è ad alta produttività, semplice e può essere applicata ampiamente in tutto il panorama dello sviluppo antimicrobico. In futuro, l'integrazione di questo modello all'interno di una pipeline preclinica standardizzata potrebbe accelerare lo sviluppo di nuovi composti antimicrobici per aumentare la percentuale di candidati che passano dalla valutazione preclinica agli studi clinici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
TB, AK, JF e DN hanno ricevuto sovvenzioni per il Centro di ricerca strategica (SRC) "Un quadro preclinico basato sull'evidenza per lo sviluppo di terapie antimicrobiche nella fibrosi cistica" (PIPE-CF; Progetto n. SRC 022) del Cystic Fibrosis Trust del Regno Unito e della Cystic Fibrosis Foundation degli Stati Uniti. LD e JF riconoscono il finanziamento di Kidney Research North West (Progetto n. 49/19).
Materiali
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Riferimenti
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon