Method Article
항균 스크리닝 모델로서의 Galleria mellonella
요약
이 연구는 전임상 항균 평가에 사용하기 위해 G. mellonella 감염 모델을 최적화하기 위한 표준화된 프레임워크를 제시합니다. 전임상 항균 개발 파이프라인의 일부로 G. mellonella 모델을 적용하면 임상시험으로 진행되는 비효율적인 화합물의 수를 줄일 수 있습니다.
초록
전 세계적으로 증가하고 있는 항생제 내성 문제를 해결하기 위해서는 새로운 항생제의 개발을 가속화하는 것이 필수적입니다. 현재의 전임상 항균제 개발은 임상시험 전이나 임상시험 중에 부적합한 것으로 판명된 상당한 수의 리드를 산출합니다. 전임상 개발의 효율성을 높이려면 관련성 있고, 표준화되고, 접근 가능하고, 비용 효율적인 모델을 개발해야 합니다. Galleria mellonella (그레이터 왁스 나방) 유충은 미생물 독성을 평가하고, 약물 독성 테스트를 수행하고, 새로운 항균 화합물의 생체 내 효능을 평가하기 위한 예비 수단으로 사용되는 감염 모델로 널리 사용됩니다. 이러한 감염 모델은 처리량이 비슷한 많은 in vitro screen보다 생물학적 관련성이 더 크며 항균 검사를 위한 사전 screen으로 사용될 때 포유류 모델에 대한 의존도를 줄입니다. 이 프로토콜은 G. mellonella 감염 모델의 최적화를 위한 표준화된 방법론을 설명하며, 이는 박테리아 종 및 선택한 항균 치료제에 적용할 수 있습니다. WHO가 우선적으로 고려하는 병원체인 녹농균(Pseudomonas aeruginosa )을 예로 들며, 재현 가능한 감염 및 치료 검사 모델을 개발하기 위해 수행할 수 있는 단계를 간략하게 설명합니다. 여기에는 실험 설정, 검체 준비, 감염 및 치료 프로토콜에 대한 권장 사항이 포함됩니다. 이 모델을 전임상 항균 개발 파이프라인에 통합하면 포유류 모델에 대한 의존도를 줄이고, 임상 시험에 도달하는 비효율적인 화합물의 수를 줄이며, 궁극적으로 전임상 항균 개발의 효율성을 높일 수 있습니다.
서문
Galleria mellonella (Greater wax moth) 유충은 미생물 종의 감염 모델 및 새로운 약물 화합물 1,2의 독성 테스트로 생물 과학 전반에 걸쳐 광범위하게 사용됩니다. 이는 처리량이 높고, 인간 감염의 필수적인 생체 내 특성을 복제하며, 연구에서 포유류 종의 윤리적 사용을 규율하는 감소, 정제 및 교체 원칙에 따라 포유류 모델에 대한 의존도를 줄이기 때문에 전임상 항균 검사 파이프라인에서 상당한 유용성을 가질 수 있습니다.
새로운 항생제를 개발하기 위해서는 임상적 검증에 앞서 광범위한 시험관 내 및 생체 내 모델이 필요하다3. 유망한 전임상 데이터 패키지를 가진 소수의 새로운 약제만이 임상에 적용되며, 이러한 높은 감소율의 원인 중 하나는 감염 환경의 복잡성을 포착하기 위한 전임상 스크리닝의 실패입니다4. 이러한 문제는 항균제의 임상으로의 낮은 번역율에 기여할 뿐만 아니라 후기 단계의 전임상 스크리닝에서 실험용 척추동물의 사용을 증가시키는 데 기여합니다. 새로운 항균제의 전임상 평가를 개선하고 비용이 많이 들고 시간이 많이 걸리며 복잡하고 윤리적으로 문제가 있는 생체 내 쥐 모델의 사용을 줄이기 위해서는 척추동물 시스템에서 테스트로 진행되는 유망하지 않은 화합물의 수를 줄이는 더 나은 초기 단계 약물 스크리닝 도구가 필요합니다.
G. mellonella는 8주의 짧은 수명주기를 가지며 알, 유충, 번데기 및 성충의 4가지 생애 단계로 구성되며 그 중 유충 형태가 이 프로토콜에서 활용됩니다1. G. mellonella는 전문 장비나 전용 동물 연구 시설 없이도 실험 전반에 걸쳐 쉽게 유지 관리할 수 있습니다. 사용에 대한 윤리적 승인을 구할 필요는 없으며, 연구자들은 실험 품질 향상을 위해 사내에서 유기체를 사육할 수 있다 2,5,6,7. G. mellonella 면역체계는 포유류의 선천면역체계와 매우 유사하며, '자기' 및 '비자기' 자극에 반응하는 능력을 가지고 있다8. 혈구는 병원체 관련 분자 패턴 인식 및 후속 식세포작용(phagocytosis)을 담당하며, 인간의 호중구와 기능적으로 유사한 역할을 한다9. G. mellonella는 인간에 대한 염기서열 상동성으로 확인된 세 가지 유형의 톨 유사 수용체를 암호화하고, 페놀록시다아제의 활성화 및 멜라닌10으로의 중합 후 비자기 물질을 인식하고 국소적인 멜라닌화 복합체를 형성하는 보체 유사 단백질을 생성합니다. 이것은 감염 실험 중 큐티클이 멜라이닝화로 인해 어두워지기 때문에 유충의 건강을 시각적으로 판독하는 역할을 할 수 있습니다. 그러나, 페놀록시다아제를 포함하는 곤충에서의 멜라닌화 축은 포유류에서의 티로시나아제-멜라닌 축과 실질적으로 다르다는 것을 유의해야 한다11,12. 또한, G. mellonella는 라이소자임(lysozyme) 및 디펜신 상동체(defensin homologue)13를 포함한 18가지 유도성 항균 펩타이드를 생산합니다. 이러한 유사성뿐만 아니라 모델의 간단한 유충 유지 관리 절차 및 높은 처리량 특성으로 인해 G. mellonella는 신약 평가에서 널리 사용되는 유기체가 되었습니다. 전임상 항생제 개발에서 G. mellonella는 활성 면역이 있는 복잡한 환경에서 숙주-병원체-약물 상호 작용을 보다 정확하게 모델링할 수 있기 때문에 시험관 내 모델에 비해 유용성이 높아졌습니다.
현재 유럽에는 G. mellonella의 표준화된 연구 등급 공급업체가 없습니다. 연구자들은 대신 미끼 가게에서 G. mellonella 유충을 구입하거나 자신의 군체를 유지해야 합니다. 사내 G. mellonella 콜로니를 유지하는 방법이 설명되었고 실험적 일관성을 높일 수 있지만 5,6,7 이 옵션은 유충을 자주 사용하는 사람들에게만 매력적일 수 있습니다. 따라서 이 프로토콜은 살아있는 미끼 공급업체로부터 유충을 구매한 후 실험 설정에 중점을 둡니다. 이 방법은 접근성이 더 높지만 실험의 복잡성을 증가시키고 공급업체로부터 유충을 받는 시점에서 유충의 건강 상태의 불일치로 인해 분석에 추가적인 변동성을 도입할 수 있습니다. 학계, 산업 및 규제 기관이 전임상 항균제 개발 파이프라인의 일환으로 G. mellonella 검사를 수용하고 채택하기 위해서는 항균 효능의 최적화 및 평가를 위한 표준화된 시스템이 필요합니다.
이 연구는 항생제 개발을 위해 G. mellonella 감염 모델의 실험 설계를 최적화합니다. G. mellonella 감염 모델이 설명되었지만14,15, 본 방법론은 공급의 불일치로 인해 발생하는 추가적인 복잡성을 완화하기 위한 추가 단계를 문서화하고 새로운 항균제의 평가를 위한 프레임워크를 제공합니다. 테스트 사례로, G. mellonella는 WHO의 최우선 순위 1번 병원체인 Pseudomonas aeruginosa에 감염되었고, 아미노글리코시드 제제(토브라마이신)로 치료가 최적화되었습니다. 그림 1에서 볼 수 있는 이 프레임워크는 새로운 약제를 사용한 향후 전임상 항균제 스크리닝 연구를 위한 기반을 제공합니다.
프로토콜
이 연구에서는 Galleria mellonella (그레이터 왁스 나방) 유충을 항생제 감수성 테스트 및 급성 독성 시험을 위한 모델로 선택했습니다. Galleria mellonella의 실험적 사용에 대한 윤리적 승인은 필요하지 않습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 실험적 설계
- 연구가 포착하고자 하는 유충 생존의 비례 변화를 기반으로 적절한 Galleria mellonella 유충 그룹 크기를 결정합니다. 표 1 은 녹농균 균주 PAO1 감염 모델을 사용하여 생존율의 특정 백분율 변화를 감지하는 데 필요한 그룹 크기를 자세히 설명합니다.
참고: 새로운 병원체를 사용할 때는 먼저 감염되었지만 치료되지 않은 유충의 비례 생존율에서 분석 간 변동성을 측정해야 하며, 이는 샘플 크기 결정에 영향을 미칩니다.- PBS 대조군의 두 가지 그룹을 포함합니다: 하나는 주사기가 날카롭고 사용에 적합한지 확인하기 위해 나머지 감염 전에 주입하고, 다른 하나는 감염 그룹 간의 적절한 살균을 보장하기 위해 세균 감염 중 또는 감염 후에 주입합니다. 새로운 병원체로 최적화하는 경우 사망이 외부 입자에 대한 면역 반응의 결과가 아닌지 확인하기 위해 열처리된 대조군을 포함하십시오.
참고: 인슐린 주사기는 주사에 사용할 수 있어 무뎌짐 및 오염의 위험을 줄일 수 있습니다. 그러나 실험에서는 일상적으로 수백 개의 G. mellonella를 사용할 수 있으므로 인슐린 주사기를 사용하는 데 비용이 많이 들고 낭비가 됩니다. - 항균 치료를 최적화하기 위한 연구의 경우, 두 가지 추가 대조군을 포함시킨다: 박테리아에 감염된 후 차량 '가짜' 처리를 주입한 그룹과 다른 질환에 대해 감염 시 한 번, 치료 시간에 한 번, 총 두 번 차량을 주입한 그룹.
참고: 전자는 치료되지 않은 대조군이고 후자는 주사로 인한 외상을 통제합니다. 이러한 외상은 뭉툭한 바늘을 사용할 때 더 가능성이 높습니다.
- PBS 대조군의 두 가지 그룹을 포함합니다: 하나는 주사기가 날카롭고 사용에 적합한지 확인하기 위해 나머지 감염 전에 주입하고, 다른 하나는 감염 그룹 간의 적절한 살균을 보장하기 위해 세균 감염 중 또는 감염 후에 주입합니다. 새로운 병원체로 최적화하는 경우 사망이 외부 입자에 대한 면역 반응의 결과가 아닌지 확인하기 위해 열처리된 대조군을 포함하십시오.
- 살아있는 미끼 공급 업체로부터 G. mellonella를 주문하거나 이전에 설명한대로 G. mellonella의 식민지를 유지하십시오 5,6,7. 재료 표에 나열된 공급업체의 경우 계획된 유충 수의 1.8배를 주문하면 약 33%는 크기에 따라 제외되고 추가로 10%는 큐티클 멸균 후 죽을 수 있습니다.
- 실험적 사용 전에 G. mellonella 중량 변동성을 측정하고 중량 범위가 평균의 1 표준 편차를 초과하지 않는지 확인합니다.
알림: 재료 표에 나열되지 않은 공급업체의 경우 공급업체가 새 재고를 제공하도록 준비하십시오.
- 실험적 사용 전에 G. mellonella 중량 변동성을 측정하고 중량 범위가 평균의 1 표준 편차를 초과하지 않는지 확인합니다.
- 수령 시 G. mellonella 를 실온에 보관하여 37°C에서 배양 후 발생하는 누에고치 가능성을 제한하십시오.
참고: 상업 공급업체의 모든 유충이 고치를 형성하는 것은 아니며, 이전에는 유충 건강의 지표로 사용되었다16. - 유충은 수령 후 1주일 이내에 사용해야 하며, 이 경우 수유가 필요하지 않습니다.
알림: 유충 수명 단계는 배치마다 다르지만 대부분의 유충은 번데기 전 마지막 인스타 동안 분만됩니다. 이 단계에서는 이전 단계에 비해 자연적으로 수유량이 감소한다17.
2. G. mellonella 유충의 살균 및 선택
- Galleria mellonella 유충의 무게를 측정하고 유충의 평균 체중에 1 표준 편차를 더하거나 뺀 값인 224mg ± 49.2mg 범위를 벗어나는 것은 폐기합니다. 이로 인해 유충의 약 33%가 제외됩니다.
참고: 무게 차이는 공급업체마다 다를 수 있습니다. 이 프로토콜에 나열되지 않은 공급업체의 경우 적절한 중량 범위를 계산하십시오. - 무균 상태에서 다음 단계를 수행하십시오.
- 페트리 접시에 70% 에탄올을 뿌려 접시 바닥을 덮을 만큼 충분히 만듭니다.
- G. mellonella의 표면을 10-20 마리의 유충으로 살균합니다.
- 각 배치를 접시에 개별적으로 놓고 유충에 70% 에탄올을 두 번 뿌립니다.
- 핀셋을 사용하여 유충을 굴려 전체 범위를 보장합니다.
- 에탄올에서 유충을 제거하고 멸균 페트리 접시에 넣으십시오. 유충이 건조될 수 있도록 접시를 덮지 않은 상태로 두십시오.
주의: G. mellonella 를 에탄올에 15초 이상 방치하면 사망률이 높아집니다.
- 유충의 약 90%가 2시간 후에 활동을 회복하면 회수된 유충을 표 1에 자세히 설명된 전력 계산에 따라 생존 변화를 충분히 감지할 수 있는 크기의 그룹으로 분리합니다.
- 멸균 후 6시간 이내에 G. mellonella 를 사용하십시오.
3. 세균 접종 밀도 최적화
- 감염 전에 알려진 CFU/mL의 세균 감염 스톡을 준비합니다. 스톡을 생성하는 방법은 유기체에 따라 다릅니다. 여기에서, 녹농균(Pseudomonas aeruginosa )은 영양 액액에서 중간 로그 단계까지 성장시키고, 분주하고, 6 x 107 CFU/mL의 밀도로 냉동시켰다.
- 실온에서 10,000 x g 으로 5분 동안 원심분리하여 감염 스톡을 펠렛화하고 PBS에 재현탁시킵니다. 각 유충에 10μL의 접종물이 주입된다는 점을 고려하여 유충당 101-10 7 CFU의 접종 용량 범위를 생성하기 위해 박테리아 스톡을 10배 희석합니다.
참고: 특정 접종 용량 범위는 세균 독성에 따라 다르지만 여기에서 제안된 범위는 대부분의 병원성 종에 적합해야 합니다. 체외 성장률 측정은 액체 배양에서 균주 특이적 성장률이 유충 폐사율과 상관관계가 있기 때문에 적절한 투여 범위를 선택하는 데 도움이 될 수 있습니다. - 감염을 시작하기 전에, 접종 밀도를 정확하게 결정하기 위해 Miles and Misra 연속 희석법으로 접종물을 열거한다18.
- 멸균 dH2O, 70% 에탄올 또는 멸균 PBS를 포함하는 3개의 1mL 마이크로분리 튜브를 준비합니다. 이들은 유충을 주입하는 데 사용되는 주사기를 살균하는 데 지속적으로 사용됩니다.
- 멸균된 100μL Hamilton 주사기를 검사하여 바늘 끝이 날카롭고 감염 부위에 심각한 외상을 유발할 수 있는 고리가 발생하지 않았는지 확인합니다.
주의: Hamilton 주사기 바늘 끝은 약 300회 감염 후 뒤틀리기 시작합니다. 바늘 끝이 휘면 교체해야 합니다. - 감염 전에 dH2O, 에탄올 및 PBS로 주사기를 순차적으로 세척하고 주사기의 최대 용량을 끌어 올려 버립니다.
- 재현탁 감염 접종물을 소용돌이치게 하고 Hamilton 주사기에 최대 100μL를 주입하여 유충당 10μL를 주입합니다.
- 각 유충에 10μL의 접종물을 오른쪽 뒤쪽 앞다리에 주입합니다. 바늘이 몸에 약 2mm 관통하는지 확인하십시오.
참고: 다양한 감염 방법을 사용할 수 있습니다. 여기에는 피펫 팁 위에 유충을 올려 앞다리를 노출시키거나, 주사기를 정적으로 고정하고 G. mellonella 를 수동으로 배치하거나, 자유롭게 주입하는 것이 포함됩니다. - 각 감염 세트 사이에 2.5단계에 설명된 대로 주사기를 멸균하여 잔류 피부 공민으로 인한 오염을 방지합니다.
- 감염된 유충을 미생물 성장에 충분한 온도인 20°C에서 42°C 사이에서 배양시키는데, 이는 G. mellonella 생존에 적합한 범위이다5.
- 사망 시간을 정확하게 측정하기 위해 일반적으로 사망률이 처음 관찰된 시점부터 일정한 간격으로 G. mellonella 생존을 모니터링합니다. 이는 초기 화면에서 평가해야 합니다. 죽은 유충을 제거하고 사망 시간을 기록하십시오.
- 18시간까지 50%의 사망률, 72시간까지 80% 이상의 사망률을 보이는 용량을 기준으로 치료 테스트 연구를 위한 최적의 감염 용량을 선택하십시오. 이를 통해 충분한 독성과 적절한 치료 기간을 보장하면서 신속한 1일 스크리닝을 개발할 수 있습니다.
4. 감염되지 않은 유충에서 새로운 항균제의 독성 시험
- 실험적으로 감염된 유충과 함께 사용하기 전에 Galleria mellonella에서 새로운 항균제 및 선택한 차량의 독성을 평가합니다. 가능한 경우 시험관내 (예: 세포주) 독성 데이터에 따라 항균제의 예상 치료 범위를 초과하는 광범위한 용량을 준비합니다.
- 유충에 10μL의 치료제가 주입된다고 고려하십시오. 치료제가 전달되는 농도와 일치하는 농도로 차량 전용 대조군을 준비합니다.
- 3.2-3.10단계에 자세히 설명된 대로 다양한 항균 및 PBS 차량 농도를 가진 적절한 그룹 크기로 건강하고 멸균된 G. mellonella 를 주입합니다. 본 연구에서 사용된 항균제는 토브라마이신(tobramycin)이었다.
참고: DMSO를 용매로 필요로 하는 약제의 경우, DMSO를 사용할 때 큰 바늘로 인한 외상으로 인한 사망률이 증가하므로 표준 22 게이지 바늘 대신 26s 게이지 바늘로 주입하십시오. - 안전한 투여량은 PBS만 주입된 유충에 비해 폐사율에 유의한 차이가 없는 투여량으로 정의합니다.
5. 항균제를 사용한 G. mellonella 세균 감염 치료 최적화
- 감염된 유충은 10μL 용량으로 치료된다는 점을 고려하여 다양한 용량의 항균제를 준비합니다. 4단계에서 평가한 대로 독성을 최소화한 다양한 용량을 사용하십시오.
- 이 프로토콜의 1단계와 2단계에 따라 이전에 최적화된 감염 용량으로 적절한 그룹으로 Galleria mellonella 를 준비하고 감염시킵니다.
- 감염 후 2시간이 지나면 준비된 항균제 또는 차량 제어 용액으로 유충을 치료합니다. 3.2-3.8 단계에 따라 감염 시 주입한 것과 반대쪽 앞다리에 주입합니다. 그룹 사이의 바늘을 소독하십시오.
참고: 강력한 용량-반응 데이터를 획득하기 위해 이 최적화를 위해 2시간에서의 처리를 선택했으며, 이로부터 치료 타이밍의 후속 최적화가 결정되었습니다19. - G. mellonella 생존을 30분 간격으로 모니터링하거나 일반적으로 사망률이 처음 관찰되는 시간부터 더 자주 모니터링합니다. 죽은 유충을 제거하고 사망 시간을 기록하십시오.
- 처리군 간의 생존 비율 변화를 계산합니다. Kaplan-Meier 생존 분석을 사용하여 처리가 유충 사망률에 유의한 변화를 가져오는지 여부를 확인할 수 있습니다. 다중 그룹 분석에서 쌍별 다중성에 대한 적절한 사후 보정을 포함합니다.
6. 감염된 G. mellonella의 치료 시기 최적화
- 1단계와 2단계에 따라 이전에 최적화된 감염 용량으로 적절한 그룹으로 Galleria mellonella 를 준비합니다.
- 4단계에서 이전에 최적화된 용량으로 항균제를 준비합니다.
- 감염 후 2시간, 4시간, 6시간, 9시간 또는 12시간에 감염된 유충을 3.2-3.8단계에 따라 치료하여 치료 시기가 사망률에 어떤 영향을 미치는지 비교합니다.
- G. mellonella 생존을 30분 간격으로 모니터링하거나 일반적으로 사망률이 처음 관찰되는 시간부터 더 자주 모니터링합니다. 죽은 유충을 제거하고 사망 시간을 기록하십시오. 최적 타이밍은 치료 용량의 초기 최적화 후 관찰된 생존을 유지하는 타이밍입니다.
참고: G. mellonella에서 항균 효능을 테스트할 때 치료 용량과 시기를 별도로 최적화하고 전자를 사용하여 후자의 치료 용량을 알리십시오.
결과
G. mellonella 중량의 배치 변동 평가
감염 실험에서 원치 않는 변동의 잠재적 원인은 개별 실험 단위(즉, 유충) 간의 크기 차이와 배치 간의 크기 차이에서 비롯됩니다. 이러한 변화의 영향은 체중에 따라 치료 또는 감염 용량을 조정하거나 실험에 사용하기 위해 정의된 체중 범위 내의 유충만 선택함으로써 완화할 수 있습니다. 후자의 조정은 더 실용적이며 투여 준비 중에 발생할 수 있는 인적 오류의 영향을 받지 않습니다. 유충 계량의 또 다른 이점은 유충에 투여된 투여량에서 mg/kg에 해당하는 인간 등가물로 치료 용량을 전환할 수 있다는 것입니다. 배치 내 및 배치 간의 변동을 정량화하기 위해 서로 다른 시간에 주문된 50마리의 유충으로 구성된 3개 배치를 계량했습니다. 각 그룹의 평균 체중은 225.5mg, 230.54mg 및 215.86mg이었고 표준 편차는 각각 49.1mg, 53.7mg 및 44.3mg이었습니다(그림 2A). 배치 간에 무게에는 큰 차이가 없었습니다. 배치에 걸쳐 중량은 107.5mg에서 341.0mg 사이였으며 평균 224.0mg ± 49.2mg이었습니다.
재현 가능한 결과를 얻기 위해 실험 전에 유충의 무게를 측정하고 체중이 224mg ± 49.2mg인 경우 선택하여 체중 범위를 233.5mg에서 98.4mg으로 줄이고 유충의 33%를 제거했습니다. 이는 중량 밴드가 100mg14,20 이상인 MRSA에 감염된 유충의 생존에 상당한 변동이 있음을 확인한 이전 연구와 일치합니다. 우리는 또한 유충이 도착 즉시 사용되지 않을 경우 유망이 실험 결과에 영향을 미칠 수 있기 때문에 분만 시점의 G. mellonella 체중과 분만 후 1주일 후의 체중을 비교했습니다. 평균 G. mellonella 체중은 230.54mg ± 53.7mg이었다. 출산 후 1주일 후 평균 체중은 221.8mg ± 45.7mg 표준 편차였습니다(그림 2B). 도착 시 체중과 1주일 후 체중 사이에는 유의미한 차이가 없었으며, 이를 통해 유충은 분만 후 첫 주 이내 언제든지 실험 목적으로 사용할 수 있다는 결론을 내렸습니다. 이러한 결과는 한 공급업체에서 구매한 G. mellonella만을 대표하며, 공급업체마다 또는 유충을 다른 시기에 주문하는 경우 무게가 크게 다를 수 있다는 점에 유의하는 것이 중요합니다.
녹농균 PAO1의 접종 밀도 최적화
일반적으로 사용되는 3가지 실험실 균주인 PAO1, PA14 및 PAK와 만성 호흡기 감염, LESB58 및 IST27-M에 대한 2개의 임상 분리체를 포함하여 4가지 접종 밀도에서 5개의 녹농균 분리체의 독성을 평가했습니다. 이들은 Mahenthiralingam et al.에 의해 개발된 CF 관련 스트레인 패널의 일부로 사용되었다.21 종의 글로벌 계통 발생을 대표합니다. 영양 육수의 예비 성장 데이터는 만성 감염으로부터 격리된 개체에서 더 낮은 성장률을 보여주었습니다(그림 3). 이를 고려하면, G. mellonella 는 PAO1, PA14 및 PAK에 대해 PBS 10μl에 101, 102, 103 또는 104 CFU/유충의 용량과 LESB58 및 IST27-M에 대해 102, 103, 104 또는 105 CFU/유충의 용량으로 10마리의 유충 그룹으로 감염되었습니다. 10마리의 유충으로 구성된 두 그룹에도 PBS만 주입했는데, 한 그룹은 감염 전과 감염 후 한 그룹이었습니다. 감염 전 PBS 주사는 오염된 PBS 또는 갤러리아 큐티클의 미생물 종으로 바늘의 오염을 제어하는 반면, 감염 후 PBS 주사는 감염 과정에 사용된 박테리아에 의한 바늘의 오염을 제어합니다. PAO1, PA14 및 PAK에 대한 최적 투여량은 10CFU/유충이었으며, 밀도가 높을수록 18시간까지 50%> 폐사했습니다(그림 4). 10 CFU는 감염에 대해 신뢰할 수 있고 재현성 있게 준비할 수 있는 가장 낮은 용량이었습니다. 원하는 생존 역학을 달성하기 위해 더 많은 용량의 LESB58 및 IST27-M이 필요했으며, 이는 체외 조건에서 이러한 분리물의 느린 성장과 더 낮은 운반 능력을 반영합니다(그림 4). 둘 다에 대한 최적 투여량은 104 CFU/유충이었다. LESB58 및 IST27-M은 만성 감염이 있는 개인으로부터 임상적으로 분리된 것으로, LESB58은 이전에 PAO122보다 설치류 모델에서 더 낮은 독성을 입증했습니다.
Galleria mellonella의 tobramycin 및 colistin의 독성 테스트
새로운 항균 화합물의 효능을 평가하기 전에 임상적으로 관련된 광범위한 용량을 주입하여 독성을 평가해야 합니다. 이를 통해 독성이 높은 화합물을 전임상 파이프라인 초기에 테스트에서 제거할 수 있습니다. 토브라마이신과 콜리스틴은 낭포성 섬유증(pwCF) 환자의 녹농균 감염 치료를 위해 일반적으로 투여되는 감염되지 않은 G. mellonella 유충에 대해 평가되었습니다23. 토브라마이신의 임상적 사용은 낭포성 섬유증이 없는 중증 환자의 경우 매일 3mg/kg에서 낭포성 섬유증이 있는 환자의 경우 24시간마다 11mg/kg까지 다양합니다24,25. 이 값은 독성 시험을 위해 선택된 1 mg/kg, 2.5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg 토브라마이신으로 Galleria mellonella에서 투여하기 위한 지침으로 사용되었습니다. 어떤 농도에서도 사망이 관찰되지 않았습니다. 고농도에서 토브라마이신의 독성이 부족하다는 점을 고려하여, 콜리스틴 독성은 이전에 pwCF의 29.8%에서 신장 또는 신경 독성과 관련이 있었기 때문에 평가되었으며, 로딩 용량은 2.9(±1.5) mg/kg이고 전체 일일 투여량은 4.1(±1.1) mg/kg이었다 26. 이로 인해 독성 테스트를 위한 귀중한 후보가 되었지만, 인간에 대한 장기 특이적 영향은 독성이 G. mellonella로 변환되지 않을 수 있음을 시사했습니다. 실제로, 1 mg/kg, 2.5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg의 콜리스틴을 투여했을 때, 72시간 동안 유충의 죽음이 관찰되지 않았다. 따라서, 콜리스틴은 최종적으로H2O에서 2000mg/kg으로 가장 높은 용해도로 투여되었다. 모든 유충의 죽음은 12시간 이내에 관찰되었으며, 이는 G. mellonella에서 약물 독성을 평가할 수 있지만 인간 독성을 예측하려고 할 때 주의를 기울여야 함을 확인했습니다.
녹농균 PAO1 감염에 대한 토브라마이신의 치료 용량 최적화
치료 용량을 최적화하기 위해 녹농균에 감염된 유충에 임상적으로 유의미한 다양한 토브라마이신 용량을 투여했습니다. 새로운 항균제의 경우, 기존의 유사한 항생제의 임상적 사용 또는 국물 최소 억제 농도와 같은 새로운 약제에 대한 전임상 데이터를 기반으로 초기에 투여량을 선택할 수 있습니다. 녹농균 PAO1에 대한 토브라마이신 효능을 평가하기 위해, G. mellonella 유충을 이전에 최적화된 대로 녹농균 PAO1 10CFU에 감염시키고 감염 후 2시간에 1mg/kg, 2.5mg/kg 또는 5mg/kg 토브라마이신을 주입했습니다. 이러한 용량은 토브라마이신을 사용한 이전 G. mellonella 작업을 기반으로 선택되었으며 낭포성 섬유증이 없는 개인에서 토브라마이신의 현재 임상 용량과 일치합니다 24,27,28.
초기 성공의 역치는 치료하지 않은 대조군에 비해 G. mellonella 생존율이 50% 증가했다는 것입니다. 토브라마이신 1mg/kg을 사용한 PAO1 치료는 G. mellonella 사망률에 거의 영향을 미치지 않았으며, 감염 후 28시간 내에 90%가 사망했다(그림 5). 2.5mg/kg의 토브라마이신으로 처리하면 사망률이 지연되지만 5mg/kg의 토브라마이신으로 전체 사망률이 80%에 달해 최적의 90% 생존율을 보였다. PA14에 대한 유효 투여량은 5mg/kg이었으나, PAK에 대한 유효 투여량은 2.5mg/kg이었다. IST27-M에 대한 유효 투여량은 10mg/kg으로 더 높았지만, 테스트된 토브라마이신 농도는 LESB58 감염으로부터 유충을 구제하기에 충분하지 않았습니다. 이러한 경향은 양이온 조정 Mueller Hinton 브로스에서 토브라마이신의 최소 억제 농도(MIC) 값과 상관관계가 있었으며, MIC가 8μg/mL인 LESB58을 제외한 모든 균주에서 1μg/mL로 성장의 90%를 억제하기에 1μg/mL였습니다. 따라서 초기 MIC 검사는 균주 간의 상대적 저항을 나타내는 데 사용할 수 있지만, G. mellonella의 투여 범위를 결정하는 데 사용해서는 안 되며 별도로 최적화해야 합니다.
녹농균 PAO1 감염에 대한 토브라마이신 치료 시기 최적화
항생제의 임상적 적용은 일반적으로 감염 후 몇 시간 이내에 이루어지는 것이 아니라 감염 후 며칠 또는 몇 주 후에 발생합니다. 녹농균 PAO1 감염 후 24시간 이내에 높은 사망률이 관찰되기 때문에 G. mellonella에서는 이러한 방식으로 새로운 항생제를 테스트하는 것이 불가능합니다. 감염 모델의 관련성을 높이려면 새로운 항균제를 감염 중 가능한 한 늦게 투여해야 합니다. 치료 시기를 최적화하기 위해, 감염 후 2시간, 4시간, 6시간, 9시간, 12시간에 PAO1에 감염된 G. mellonella 유충에 5mg/kg의 토브라마이신을 투여했습니다. 실험적 성공은 항생제 치료가 PAO1 감염에 비해 생존율이 >50% 증가한 것으로 정의되었습니다. 9시간 및 12시간 치료는 감염을 해결하지는 못했지만 사망률을 지연시켰다(그림 6). 2시간, 4시간, 6시간에서 처리한 결과 생존율이 50% 이상이었습니다.
G. mellonella 그룹 크기 최적화
실험군 크기는 녹농균 PAO1의 10 CFU/유충 감염 후 G. mellonella 생존에서 관찰된 변동을 기반으로 계산되었습니다. 그룹 크기는 모든 연구에서 치료되지 않은 대조군과 치료군 간의 예상 백분율 변화에 따라 달라질 수 있습니다(표 1). 계산은 Charan et al.29에 의해 설명된 것을 따랐습니다. 사용된 방정식은 아래에 설명되어 있습니다.
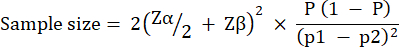
어디:
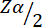 = 1.96, 유형 1 오류 5%에서.
= 1.96, 유형 1 오류 5%에서.
Zβ = 0.842는 80%의 통계적 검정력을 제공하는 값입니다.
p1 = p2로 계산된 테스트 그룹의 이벤트 비율 + 예상 백분율 변화
p2 = 에서 녹농 균 PAO1 생존 변동성 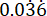 을 기반으로 계산된 대조군(치료되지 않은 감염) 그룹의 사건 비율.
을 기반으로 계산된 대조군(치료되지 않은 감염) 그룹의 사건 비율.
P = (p1 + p2)/2로 정의되는 통합 유병률.
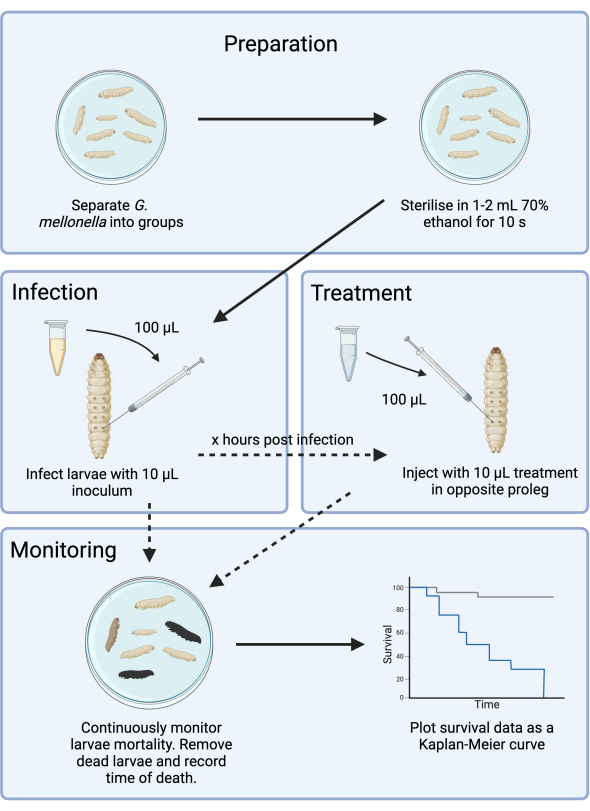
그림 1: G. mellonella 감염 연구의 개략도. 일반 프로토콜에는 감염 전 G. mellonella 유충 준비, 10μL 접종물 감염, 감염 후 몇 시간 후의 선택적 치료 및 지속적인 모니터링이 포함됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
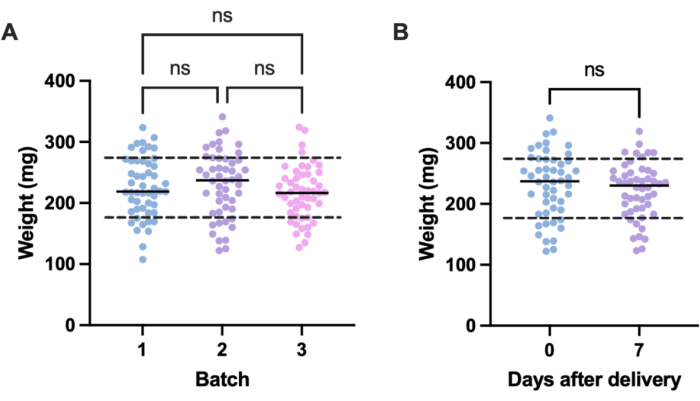
그림 2: Galleria mellonella 유충 무게의 배치 및 시간에 따른 변화. (A) 50 Galleria mellonella 유충 3개 배치의 무게는 배송 즉시 무게를 측정했습니다. 각 배치는 서로 다른 시간에 주문되었습니다. 일원 분산 분석(P > 0.05)으로 계산한 바와 같이 배치 간에 가중치에는 유의한 차이가 없었습니다. (B) 수령 시 무게를 측정한 50마리의 유충의 무게와 1주일 후에 무게를 측정한 동일한 배치의 무게. Student's t-test (P > 0.05)에서 계산한 체중에는 유의한 차이가 없었다. ns: 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
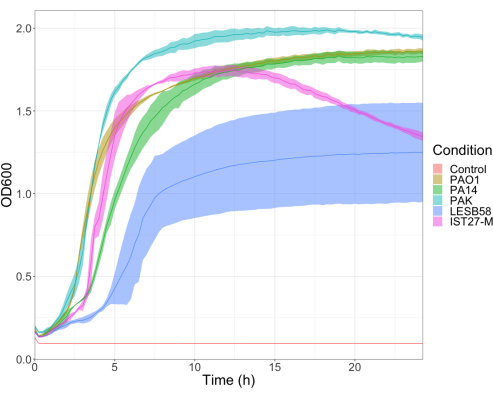
그림 3: 녹농균 균주 PAO1, PA14, PAK, LESB58 및 IST27-M의 성장 곡선. 각 균주는 0.08-0.13의 초기 OD600 에서 LB로 성장시켰고, OD600 은 37°C에서 24시간 정적 성장 동안 15분마다 측정했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
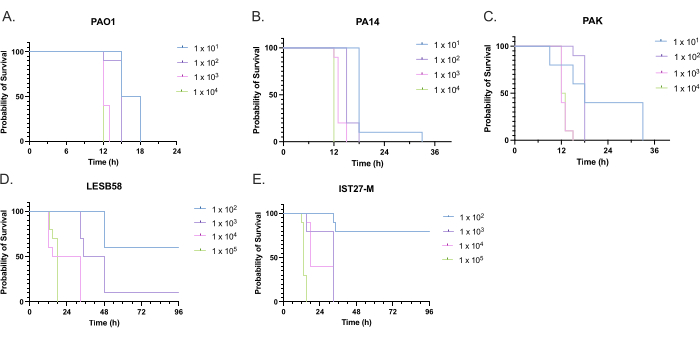
그림 4: Galleria mellonella 유충의 감염에 대한 녹농균(Pseudomonas aeruginosa) 균주의 접종 밀도 최적화. 유충당 다양한 밀도의 콜로니 형성 단위(CFU)를 주입한 후 Galleria mellonella 유충의 생존. 테스트된 접종 밀도는 (A) PAO1, (B) PA14 또는 (C) PAK의 경우 유충당 10, 10², 10³ 또는 104 CFU였으며 (D) LESB58 및 (E) IST27-M의 경우 유충당 10², 10³, 104 또는 105 CFU였습니다. 그룹당 10마리의 유충을 사용했으며, 각 유충은 오른쪽 뒤쪽 앞다리에 10μL의 접종물을 주입했습니다. 감염 후 16시간부터 30분마다 생존을 모니터링하고 사망 시간을 기록했습니다. 모든 균주는 유의성에 대한 Log-rank(Mantel-Cox) 테스트에 의해 결정된 용량 의존적 독성을 보여주었습니다. PAK 10 1 대 PAK 10을 제외한 모든 균주 내 투여량 비교에 대해 P <0.05 PAK 102, PAK 103대 PAK 104, LESB58 104대 LESB58 105 및 IST27-M 103대 IST27-M 104, 유의하지 않았습니다. 이 수치는 세 가지 생물학적 복제를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
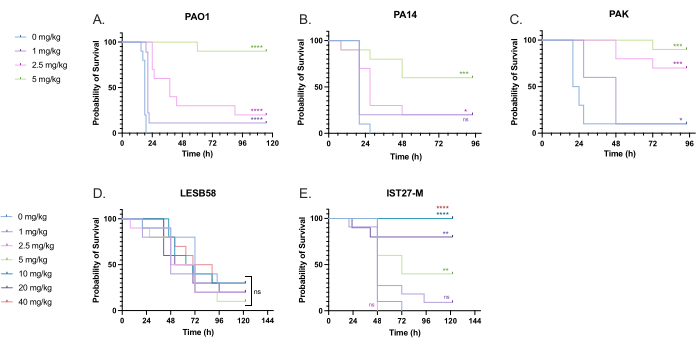
그림 5: 녹농균 패널 균주를 주입하고 감염 후 2시간 후에 토브라마이신 설페이트를 투여한 후 Galleria mellonella 유충의 생존. 실험 그룹당 10 G. mellonella 유충은 (A) PAO1, (B) PA14 또는 (C) PAK의 10 CFU 또는 10 μL의 PBS에서 유충당 (D) LESB58 또는 (E) IST27-M의 103 CFU에 감염되었습니다. 감염은 뒤쪽 왼쪽 앞다리에 투여되었습니다. 감염 2시간 후, PAO1, PA14 및 PAK에 무처리 대조군으로 10μL의 PBS, 1mg/kg, 2.5mg/kg 또는 5mg/kg 토브라마이신을 주입하고, LESB58 및 IST27-M을 10μL PBS, 1mg/kg, 2.5mg/kg, 5mg/kg, 10mg/kg, 20mg/kg 또는 40mg/kg 토브라마이신으로 처리하고, 그림과 같이. 토브라마이신을 증류수에 희석하여 후방 우측 앞다리에 투여하였다. 생존 여부를 지속적으로 모니터링하고 사망 시간을 기록했습니다. 로그 랭크(Mantel-Cox) 유의성 검정 대 각 변형에 대한 PBS 제어. ns: 중요하지 않음, *P < 0.05, **P < 0.005, ***P < 0.0005 ****P < 0.0001. 이 수치는 세 가지 생물학적 복제를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
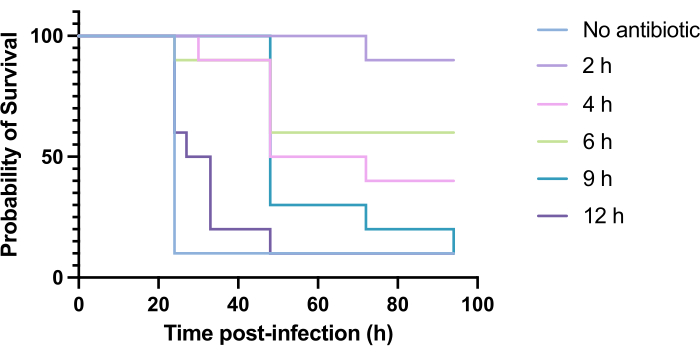
그림 6: 녹농균(Pseudomonas aeruginosa PAO1) 감염 후 다양한 시점에서 토브라마이신(tobramycin)으로 처리한 후 Galleria mellonella 유충의 생존. 실험군당 10 G. mellonella 유충을 10 μL의 PBS에 있는 10 CFU의 PAO1에 감염시켜 후방 우측 앞다리에 주입하였다. 유충은 감염 후 2 h, 4 h, 6 h, 9 h 또는 12 시간에 후방 좌측 proleg의 10 μL의 증류수에 5 mg/kg tobramycin sulfate를 주입했습니다. 생존 여부를 지속적으로 모니터링하고 사망 시간을 기록했습니다. 로그 랭크(Mantel-Cox) 유의성 검정 대 치료되지 않은 대조군. P < 0.0005, ****P < 0.0001. 이 수치는 세 가지 생물학적 복제를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 기대 생존 변동률(%) | 그룹 규모 |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
표 1: G. mellonella 유충이 녹농균 PAO1이 있는 10 CFU/유충에 감염된 후 약제를 투여한 G. mellonella 생존 실험의 그룹 크기.
토론
항생제 내성(AMR)의 부담은 지속적으로 증가하고 있습니다. 2019년 전 세계적으로 약 495만 명이 항생제 내성으로 사망한 것으로 추정된다30. 2050년까지 항생제 내성으로 인한 사망률은 1,000만 명에 이를 것으로 추정된다31. 이러한 위험을 해결하기 위해서는 새로운 항균제를 효율적이고 비용 효율적으로 개발 및 테스트해야 하며, 이를 위해서는 항균 효능을 정확하게 예측하는 전임상 모델을 사용해야 합니다. 임상시험으로 전환하는 동안 관찰되는 높은 감소율은 주요 제한 요인입니다. 한 연구에서는 임상시험에 실패한 13개의 항생제 후보물질에 대해 설명했으며, 이 중 11개는 임상 2상으로 진행하지 못했다.
본 연구는 G. mellonella 전임상 항균제 스크리닝 연구의 최적화를 위한 프레임워크와 항균 효능 평가 방법을 제공합니다. G. mellonella 유충은 약물 독성, MIC 측정 및 독성 검사를 평가하는 데 상당한 유용성을 가지고 있으며 전임상 개발에 사용되는 포유류의 감소에 기여합니다. Galleria mellonella 유충은 처리량이 상대적으로 높고 생물학적으로 관련성이 있으며 더 복잡한 포유류 모델로 잘 변환됩니다. 한편, 야생형 실험용 쥐는 쥐당 ~£7의 주간 유지 보수로 개당 £8에서 £30 사이인 반면, G. mellonella는 유충 50마리당 ~£2입니다. 따라서 G. mellonella 모델에서 10 개의 화합물을 테스트하려면 ~ £ 60의 비용이 드는 반면, 생쥐의 동일한 연구에서는 £ 4000 이상이 소요됩니다. 또한, 이전 연구에서는 새로운 화합물의 독성과 효능을 비교하고 G. mellonella와 마우스에서 급성 독성 사이의 상관 관계를 확인했습니다 8,19,33. 따라서 G. mellonella screen을 구현하여 마우스 모델에서 추가 테스트할 화합물의 우선 순위를 지정하는 것이 권장됩니다.
모델의 명확한 유용성에도 불구하고 성공적인 적용을 보장하기 위해 몇 가지 고려해야 할 사항이 있습니다. 연구용 무균 유충의 부족은 에탄올 멸균이 필요하거나 연구자가 오염 위험을 완화하고 전반적인 실험 품질을 개선할 수 있는 자체 G. mellonella 콜로니를 유지해야 하기 때문에 실험 사용을 위한 준비를 복잡하게 만듭니다 5,6. 부적절한 멸균은 상당한 폐사를 초래할 수 있으며, 에탄올 노출 시간이 길어지면 사망에 이르기 때문에 유기체를 완전히 멸균하는 것은 어렵습니다. 대체 살균 방법에는 감염 전에 각 유충의 앞다리를 70% 에탄올로 면봉으로 닦는 것이 포함되며, 이는 살균 중 사망률을 줄일 수 있지만 더 노동 집약적인 방법입니다. 다른 방부제도 사용할 수 있었지만 에탄올 살균이 최적화되면 <10%의 사망률을 기록했기 때문에 이 연구에서는 대안을 평가하지 않았습니다. 더욱이, 공급업체가 군체를 직접 유지하는 대신 다른 공급업체로부터 유충을 조달할 수 있기 때문에 공급업체가 G. mellonella를 항생제로 처리하는지 여부가 불분명한 경우가 많습니다.
G. mellonella 생물학은 포유류와 상당히 다르기 때문에 유용성에 제한이 있습니다. 이들의 면역 체계는 선천성 면역의 주요 수용성 및 세포 측면이 존재하지만 적응 면역이 없습니다. 혈구는 G. mellonella 의 주요 선천성 면역 방어 물질이며 식세포와 유사한 특성을 나타냅니다. 이들 세포의 다양한 부분집합이 설명되었는데, 그 중에는 과립구(granulocyte) 및 형질세포(plasmatocyte)가 포함되며, 그 중에서도34. G. mellonella 는 또한 호흡기 또는 방광 감염과 같은 관련 감염 부위를 재현할 수 없습니다. 그러나 전임상 파이프라인에서 G. mellonella 는 쥐 모델에 대한 사전 스크리닝 역할을 하여 가장 유망한 화합물만 인간 감염 환경과 더 유사한 복잡한 포유류 시스템으로 진행되도록 합니다. 마지막으로, 이 모델은 G. mellonella의 추가 게놈 특성 분석을 통해 임상적으로 관련된 바이오마커의 변화를 평가하기 위한 적합성을 결정할 수 있습니다. 특히, 이를 위해서는 G. mellonella 면역에 대한 이해를 높일 필요가 있습니다.
전반적으로 Galleria mellonella 감염 모델은 포유류 모델에서 평가하기 전에 새로운 항균 화합물의 전임상 평가를 위한 유용한 도구입니다. 공급 표준화의 부족으로 인해 사용이 복잡하지만, 응용 분야는 처리량이 많고 간단하며 항균 개발 환경 전반에 걸쳐 광범위하게 적용할 수 있습니다. 향후 표준화된 전임상 파이프라인에 이 모델을 통합하면 새로운 항균 화합물 개발을 가속화하여 전임상 평가에서 임상 시험으로 진행되는 후보 물질의 비율을 높일 수 있습니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
TB, AK, JF 및 DN은 전략연구센터(Strategic Research Centre, SRC)의 "낭포성 섬유증에서 항균 치료제 개발을 위한 증거 기반 전임상 프레임워크(An evidence-based preclinical framework for the development of antimicrobial therapeutics in cystic fibrosis)"(PIPE-CF; 프로젝트 번호 SRC 022) 영국 낭포성 섬유증 신탁(UK Cystic Fibrosis Trust) 및 미국 낭포성 섬유증 재단(US Cystic Fibrosis Foundation). LD와 JF는 Kidney Research North West(프로젝트 번호 49/19)의 자금 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
참고문헌
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유