A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التوصيف الشامل لتمعدن الأنسجة في نموذج Ex Vivo
In This Article
Summary
يستلزم البروتوكول المقترح نهجا عالميا لتقييم تكوين العظام في سياق تجديد العظام باستخدام التحليلات متعددة الوسائط. يهدف إلى توفير معلومات نوعية وكمية حول تكوين العظام الجديدة ، وتعزيز صرامة وصلاحية الفحوصات الأساسية وقبل السريرية.
Abstract
يمثل التوصيف الشامل لتمعدن الأنسجة في سياق تجديد العظام تحديا كبيرا ، بالنظر إلى الطرائق العديدة المتاحة حاليا للتحليل. هنا ، نقترح سير عمل لتقييم شامل لتكوين العظام الجديدة باستخدام نبتة عظمية حيوانية كبيرة ذات صلة خارج الجسم الحي . يتم إنشاء عيب عظمي (القطر = 3.75 مم ؛ العمق = 5.0 مم) في رأس عظم الفخذ المزروع وحقنه ببديل عظمي كبير يسهل اختراقه محمل بعامل نمو مؤيد للعظم (بروتين مورفوجيني للعظام 2 - BMP2). بعد ذلك ، يتم الحفاظ على المصنع في الثقافة لمدة 28 يوما ، مما يسمح بالاستعمار الخلوي وتكوين العظام اللاحق. لتقييم جودة وهيكل الأنسجة المعدنية حديثا ، يتم إعداد الطرق المتتالية التالية: (ط) توصيف وصور ثلاثية الأبعاد عالية الدقة للمصنع بأكمله باستخدام التصوير المقطعي المحوسب الدقيق ، متبوعا بتحليلات صور التعلم العميق لتعزيز التمييز بين الأنسجة المعدنية ؛ (ثانيا) المسافة البادئة النانوية لتحديد الخواص الميكانيكية للأنسجة المشكلة حديثا ؛ (ثالثا) الفحوصات النسيجية ، مثل الهيماتوكسيلين / الإيوسين / الزعفران (HES) ، وثلاثي الألوان في غولدنر ، وخماسي موفات لتوفير تقييم نوعي للأنسجة المعدنية ، لا سيما فيما يتعلق بتصور الحاجز العظمي ووجود الخلايا العظمية ؛ (4) رسم خرائط المجهر الإلكتروني الماسح المتناثر الخلفي (SEM) مع مرجع داخلي لتحديد درجة التمعدن وتقديم رؤى مفصلة حول مورفولوجيا السطح والتركيب المعدني وواجهة العظام والمواد الحيوية. (v) التحليل الطيفي رامان لتوصيف التركيب الجزيئي للمصفوفة المعدنية وتقديم رؤى حول ثبات BMP2 داخل الأسمنت من خلال الكشف عن روابط الببتيد. سيوفر هذا التحليل متعدد الوسائط تقييما فعالا للعظام المشكلة حديثا ورؤى نوعية وكمية شاملة للأنسجة المعدنية. من خلال توحيد هذه البروتوكولات ، نهدف إلى تسهيل المقارنات بين الدراسات وتحسين صحة وموثوقية نتائج البحث.
Introduction
تمثل عيوب العظام ، سواء كانت ناجمة عن الصدمة أو استئصال الورم أو التشوهات الخلقية أو العدوى ، تحديا كبيرا للطب التجديدي. تضر هذه التعديلات بالسلامة الهيكلية للنظام الهيكلي ، مما يؤدي إلى عدم الراحة والضعف الوظيفي وانخفاض نوعية حياة المرضى.
للتغلب على هذه التحديات ، ظهرت استراتيجيات مبتكرة لإصلاح العظام ، مع التركيز على تعزيز تكوين العظم وتجديد أنسجة العظام. تشمل هذه الأساليب استخدام بدائل العظام القابلة للزرع أو الحقن أو القابلة للطباعة ثلاثية الأبعاد ، والتي يمكن أن تكون من أصل طبيعي (على سبيل المثال ، الجزيئات الكبيرة من مصادر حيوية ، هيدروكسيباتيت مشتق من) أو اصطناعية (على سبيل المثال ، النظارات الحيوية ، فوسفات الكالسيوم)1. لتعزيز قدرتها المتأصلة المنخفضة على توجيه وتحفيز تجديد العظام ، يمكن تحميل بدائل العظام بعوامل تحريضية للعظم ، مثل البروتينات المورفولوجية للعظام (BMPs) ، لتعزيز التمايز العظمي للخلايا السلفية وتعزيز تكوينالعظام 2.
يعتمد تكوين العظام على التكوين الأولي لمصفوفة الكولاجين ، والتي يتم تمعدنها بعد ذلك بواسطة بلورات هيدروكسيباتيت ، وبالتالي تعزيز بنيةالعظام 3. تمنح هذه العملية صلابة وقوة محددة للعظام. تخضع جودة الأنسجة المعدنية بشكل معقد لخصائصها المجهرية ودرجة التمعدن4. تلعب هذه الجودة دورا محوريا في التئام العظام ووظائف العظام المتجددة5. ومع ذلك ، يظل توصيف تمعدن العظام مهمة صعبة بسبب التباين المتأصل عبر الدراسات متعددة المتغيرات6،7،8.
بالإضافة إلى ذلك ، عادة ما يتم إجراء التقييمات الأولية للتوافق الحيوي والتوافق الخلوي وإمكانية التمايز لبدائل ترقيع العظام في المختبر. ومع ذلك، فإن التفاوتات المنهجية تعوق المقارنة السلسة للنتائج. علاوة على ذلك ، لا تلتقط هذه الدراسات المختبرية بشكل كامل التفاعلات متعددة الخلايا والحوار المعقد بين مجموعات الخلايا ، بما في ذلك خلايا نخاع العظام ، والتي تعتبر ضرورية لتنظيم عملية تجديدالعظام 9. قد يؤدي هذا النقص في التمثيل الدقيق للبيئة المكروية للعظام إلى الإضرار بدقة الدراسات قبل السريريةاللاحقة 10.
على الرغم من أن التقييمات في الجسم الحي توفر تمثيلا أكثر دقة للسياقات الفسيولوجية ، إلا أنها مقيدة بالاعتبارات الأخلاقية واللوجستية والمالية. وبالتالي ، تلعب التقييمات خارج الجسم الحي دورا محوريا كواجهة بين الدراسات في المختبر والدراسات في الجسم الحي ، حيث تعمل كخطوة وسيطة ضرورية قبل الانتقال إلى التجارب على الأشخاص الأحياء11،12،13.
في هذا السياق ، هناك حاجة إلى تنفيذ منهجيات توصيف شاملة لتقييم جودة أنسجة العظام المتجددة والتأكد من ملاءمة الاستراتيجية قبل الانتقال إلى نموذج ما قبل السريري. وبالتالي ، نقترح بروتوكولا يعتمد على تحليل نموذج الزرع باستخدام أنسجة مفصل ركبة الأغنام. تتضمن هذه المنهجية المبتكرة زرع الأسمنت المحمل ب BMP2 في النماذج الخارجية وإجراء تحليل مفصل لتمعدن الأنسجة بعد 28 يوما من الاستزراع.
الأساليب التقنية المستخدمة في هذه الدراسة متنوعة ومتكاملة ، وتوفر مجتمعة نهجا شاملا لتقييم جودة أنسجة العظام المتجددة (الشكل 1). يتيح التصوير المصغر عالي الدقة تصورا ثلاثي الأبعاد مفصلا لبنية العظام ، مما يوفر رؤى قيمة حول كثافة المعادن ومورفولوجيا وسلامة الأنسجة المشكلة حديثا. هذه التقنية ضرورية لتقييم فعالية تجديد العظام ومراقبة تطور التمعدن بمرور الوقت. المسافة البادئة النانوية هي طريقة دقيقة لتحديد الخصائص الميكانيكية للأنسجة ، مثل صلابتها وقوتها. من خلال قياس استجابة المادة للقوة المطبقة على مقياس نانومتري ، تتيح هذه الطريقة تقييم متانة وجودة الأنسجة المعدنية. توفر الفحوصات النسيجية باستخدام تلطيخ شائع مثل الهيماتوكسيلين / اليوزين / الزعفران (HES) ، وثلاثي الألوان لجولدنر ، وخماسي موفات رؤى لا تقدر بثمن حول بنية الأنسجة وتكوينها. تسمح هذه البقع بالتمايز بين مكونات الأنسجة المختلفة ، بما في ذلك الخلايا والمصفوفة خارج الخلية والرواسب المعدنية ، مما يتيح تقييما نوعيا شاملا لعملية تجديد العظام. يوفر رسم خرائط المجهري الإلكتروني الماسح الخلفي (SEM) تصورا عالي الدقة لسطح العينات ، مما يسمح بتحليل مفصل لدرجة تمعدن مصفوفة العظام ، بالإضافة إلى الواجهات بين المادة المزروعة والأنسجة المضيفة. أخيرا ، يوفر التحليل الطيفي رامان معلومات تتعلق بالتركيب الجزيئي للأنسجة ، لا سيما من خلال تحديد مكونات معينة مثل البروتينات والدهون والمعادن. يتيح هذا النهج توصيف المصفوفة المعدنية والكشف عن عوامل النمو مثل BMP2 ، وبالتالي توفير معلومات مهمة حول استمرار المحفزات المؤيدة للعظم في وسط التجديد.
باستخدام نهج متعدد التخصصات ، يدمج تقنيات تحليلية مختلفة ، تهدف دراستنا إلى تقديم تقييم شامل وشامل لجودة أنسجة العظام المتجددة ، وبالتالي توفير أساس متين لتقييم بدائل ترقيع العظام وتطبيقها السريري المحتمل.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على هذه الدراسة من قبل لجنة الأخلاقيات ورعاية والإدارة الوطنية الفرنسية للطب البيطري والأغذية تحت رقم G44171.
1. تحضير واستزراع النثرة العظمية الغضروفي
- حصاد عينات مفاصل الأغنام من الرحيم الطازج في بيئة معقمة. ضع الأغنام في وضع ضعيف وحلق الطرف الخلفي الأيسر. تستعد عن طريق التطهير بالكحول حول مفصل الركبة. استخدم بضع المفاصل الرضفي الجانبي لكشف الأربطة الصليبية الأمامية والخلفية ، متبوعا بخلع الرضفة للكشف عن البكتيريا الفخذية.
- بعد حصاد الأنسجة ، قم بإنشاء عيب قطره 4.75 مم في اللقمة الجانبية باستخدام نظام نقل الطعم الذاتي العظمي الغضروفي.
- باستخدام مطرقة العظام ، قم بإنشاء عيب بعمق 10 مم واسترجع المصباح الخارجي من اللقمة بعد ذلك ، قم بإجراء عيب ثان بقطر 8 مم ، يتمحور حول الأول ، باستخدام نظام نقل الطعم الذاتي العظمي الغضروفي ينتج عن هذا استنساخ عظمي غضروفي بقياس 8 مم × 10 مم ، يحتوي على عيب مركزي يبلغ 4.75 مم × 10.0 مم.
- إذا لزم الأمر لأسباب لوجستية ، انقل المبتئات في محلول الملح المتوازن من هانك (hBSS) المكملة ب 1٪ بنسلين ستربتومايسين وتخزينها في 4 درجات مئوية.
- اشطف النباتات الخارجية 3x بمحلول ملحي مخزن بالفوسفات (PBS) ، ثم قم بحقن عيب 4.75 مم × 10.0 مم بأسمنت فوسفات الكالسيوم المكمل ب 40 ميكروغرام / مل من BMP2. تحضير الأسمنت كما هو موضح أدناه.
- إنتاج فوسفات ثلاثي الكالسيوم α (α-TCP) عن طريق المعالجة الحرارية لقضبان فوسفات ثلاثي الكالسيوم القماشية (مكبس متساوي الساكن عند 120 ميجا باسكال) عند 1364 درجة مئوية لمدة لا تقل عن 12 ساعة ، متبوعا بتبريد الهواء14.
- قم بطحن قضبان α-TCP في الإيثانول المطلق باستخدام كرة مطحنة كوكبية 2x لمدة 5 دقائق عند 500 دورة في الدقيقة لإنتاج مسحوق ناعم من 13.1 ± 1.7 ميكرومتر (يقاس باستخدام حيود الليزر ، كما هو موضحسابقا 14).
- قم بتعقيم مسحوق α-TCP عن طريق تسخينه الجاف عند 180 درجة مئوية لمدة 45 دقيقة. تحضير أسمنت فوسفات الكالسيوم عن طريق خلط مسحوق α-TCP مع محلول مفلتر 2.5٪ (وزن / حجم) Na2HPO4 0.22 ميكرومتر (نسبة السائل / المسحوق 0.35) لمدة 1 دقيقة.
- قم بتحميل معجون الأسمنت في حقنة سعة 3 مل قبل الحقن باستخدام إبرة 18 جرام.
- بعد 10 دقائق في درجة حرارة الغرفة (RT) ، انقل النباتات إلى قارورة مساحتها 25 سم مربع وأضف برفق 10 مل من وسط الاستزراع الكامل الذي يتكون من Dulbecco's Modified Eagle Medium (DMEM) عالي الجلوكوز المكمل بمصل بقري جنيني 10٪ و 1٪ بنسلين ستربتومايسين.
- حافظ على المصانع الخارجية لمدة تصل إلى 28 يوما في حاضنة 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2 وقم بتغيير وسط الاستزراع الكامل كل يومين تحت غطاء التدفق الرقائقي.
- اشطف النباتات الخارجية 3x باستخدام PBS. انقلها إلى أنابيب سعة 50 مل ، وأضف 20 مل من 4٪ بارافورمالدهيد (PFA) ، واحتفظ بها عند 4 درجات مئوية لمدة 3 أيام. ثم اشطف النباتات الخارجية باستخدام PBS وقم بتخزينها في 70٪ من الإيثانول قبل التحليلات اللاحقة.
2. تحليل التصوير المقطعي المحوسب الدقيق
- إجراء تحليلات التصوير المقطعي الدقيق باستخدام الأشعة السينية بالتصوير المقطعي المحوسب. احصل على إسقاطات الأشعة السينية بدقة 10.7 ميكرومتر ، مع وقت تعرض يبلغ 1200 مللي ثانية وفلتر ألومنيوم 1 مم (80 كيلو فولت و 125 ميكرو أمبير). متوسط ثلاث صور لكل زيادة دوران 0.45 درجة من أجل تحسين نسبة الإشارة إلى الضوضاء.
- إعادة بناء الصور ثلاثية الأبعاد (3D) باستخدام برنامج إعادة الإعمار الخاص بالشركة المصنعة بعد محاذاة X / Y مع مسح مرجعي ، مع المعلمات التالية - التنعيم: 0 ، القطعة الأثرية الحلقية: 3 ، تصلب الحزمة: 35٪. قم بتنظيف مكدسات الصور باستخدام برنامج معالجة الصور وراقب باستخدام أدوات التصور ثنائية الأبعاد (2D) و 3D.
3. تحليل صور التعلم العميق
- قم بإجراء تجزئة الصور باستخدام برامج متخصصة مخصصة. استخدم معالج التجزئة المتكامل لتدريب نموذج التعلم العميق للتمييز بين العظام والأسمنت.
- حدد منطقة تمثيلية (أي إطار) تحتوي على العظام والأسمنت والخلفية من صور التصوير المقطعي المحوسب الدقيقة المعاد بناؤها. قم بتقسيم هذا الإطار الأول يدويا باستخدام أدوات بسيطة (على سبيل المثال ، العتبة) أو قوية (مثل الانتشار) التي يوفرها البرنامج.
- قم بإنشاء نموذج التعلم الشامل في علامة التبويب النموذج وحدد 3D-Unet Routine في القائمة المنسدلة. تحديد معلماته التجريبية في المعادلة مع الصور لتحليلها بنقرة بزر الماوس الأيمن على النموذج الذي تم إنشاؤه ؛ هنا: عمق 5 ، حجم التصحيح 32 × 32 ، خوارزمية Adadetla ، نسبة خطوة 0.25 ، زيادة البيانات x10.
- استخدم الإطار المجزأ لتدريب روتين التعلم العميق (انقر فوق زر القطار) ، والذي من المسلم به أنه مناسب لقدراته السريعة والدقيقة في تجزئة الصور 3,15. بمجرد اكتمال التدريب ، حدد منطقة عمل ثانية (إطار) وقم بتقسيمها تلقائيا باستخدام وظيفة التنبؤ.
- قم بتطبيق التصحيح اليدوي إذا لزم الأمر لإنشاء بيانات تدريب أكثر دقة. روتين التدريب مرة أخرى. كرر العملية حتى يتم الحصول على نتيجة مرضية ؛ يتناقص عدد عمليات زيادة البيانات تدريجيا مع زيادة عدد أطر التدريب.
ملاحظة: يعطي مؤشر النرد المقدم أثناء تدريب النموذج مؤشرا على دقة النموذج (مقارنة بمعلومات الإدخال) ولكنه غير كاف. يجب أن يتم تأكيد أهمية النموذج عن طريق التحقق من صحة البيانات المجزأة تلقائيا من قبل 3 باحثين متمرسين مستقلين.
- قم بتطبيق التصحيح اليدوي إذا لزم الأمر لإنشاء بيانات تدريب أكثر دقة. روتين التدريب مرة أخرى. كرر العملية حتى يتم الحصول على نتيجة مرضية ؛ يتناقص عدد عمليات زيادة البيانات تدريجيا مع زيادة عدد أطر التدريب.
- انشر النموذج بالنقر فوق الزر تصدير وقم بتطبيقه على مجموعة بيانات micro -CT بأكملها بالنقر فوق مقطع > نموذج تصدير > شريحة مجموعة بيانات كاملة.
4. التضمين
- قم بتجفيف التركيبات العظمية عن طريق وضعها في قارورة زجاجية سعة 40 مل تحتوي على 25 مل من محلول الجفاف المكون من 70٪ أسيتون و 30٪ زيلين. ضع القارورة الزجاجية على عجلة دوارة لمدة 1 ساعة في RT. كرر هذه الخطوة 3x.
- استبدل محلول الجفاف ب 25 مل من الزيلين وضع القارورة الزجاجية على العجلة الدوارة لمدة 1 ساعة عند RT.
- استبدل محلول الزيلين ب 25 مل من ميثيل ميثاكريلات المخصب (MMA) بنسبة 10٪ بنزويل بيروكسيد (BPO) و 10٪ ثنائي بوتيل فثالات (DBP). ضعه على العجلة الدوارة لمدة 1 ساعة في RT. كرر هذه الخطوة 2x.
- استبدل محلول MMA ب 25 مل من MMA المخصب بنسبة 10٪ BPO و 10٪ DBP و 450 ميكرولتر من N و N dimethylaniline المخفف 1:20 في بروبان-2-ol. ضع القارورة الزجاجية على درجة حرارة -20 درجة مئوية طوال الليل. يصبح المحلول مصفرا.
- ضع المصنع في قالب تضمين متوسط الحجم واسكب MMA-BPO-DBP-N ، N aniline في القالب. ضع القالب في صندوق بلاستيكي وقم بالتهوية بتدفق النيتروجين لمدة 5 دقائق. أغلق الصندوق بإحكام وضعه عند 4 درجات مئوية لمدة 48 ساعة لبلمرة MMA وتصلبها.
- قم بإزالة الراتنج الذي يحتوي على المصنع المخرج من القالب واحتفظ به عند 4 درجات مئوية حتى تتم معالجته للتحليل اللاحق.
5. الفحص المجهري الإلكتروني الماسح (SEM) - التصوير الإلكتروني الكمي المتناثر (qBEI)
- قم بقص كتلة pMMA التي تحتوي على المصنع بمنشار ماسي على طول محورها الطويل. احتفظ بالنصف الأول من الكتلة للتحليل النسيجي. اقطع النصف الآخر أكثر لتوليد قسم بسمك 1.5 مم. قم بإجراء القطع بسرعة 3000 دورة في الدقيقة بسرعة 3 مم / دقيقة.
- قم بطحن القسم بورق كربيد السيليكون بأرقام تصاعدية تتوافق مع حجم الحبوب المنخفض: SiC 320 لمدة 10 ثوان ، SiC 1000 لمدة 15 ثانية ، SiC 2000 لمدة 30 ثانية ، و SiC 4000 لمدة 30 ثانية.
- قم بتلميع القسم بمعجون الماس والملابس المحددة: قطعة قماش تلميع بمحلول ماسي 3 ميكرومتر من Mol B3 لمدة دقيقة واحدة وقطعة قماش من الصوف بمحلول ماسي Nap B1 1 ميكرومتر لمدة 1 دقيقة.
- اشطف القسم تحت الماء المقطر المزدوج ونظف جزيئات الماس بقطعة قطن. جفف القسم تحت غاز النيتروجين.
- قم بتغطية القسم السميك من الكربون (سمك فيلم الكربون 10 نانومتر) وقم بتثبيته على كعب من الألومنيوم بطلاء فضي. اصنع جسرا للطلاء الفضي بين الجزء العلوي من القسم وكعب الروتين للسماح بإخلاء شحن الإلكترون إلى الأرض.
- ضع كعب الروتين على مرحلة SEM. بجانب العينة ، أدخل كعب تحكم يتكون من كوب فاراداي بمعايير الكربون والألمنيوم والسيليكون في غرفة SEM. سيتم استخدام هذا لمعايرة شعاع الإلكترون وتحويل المستويات الرمادية إلى نسب مئوية من Ca. أغلق غرفة SEM والفراغ.
- قم بتشغيل شعاع الإلكترون واضبط معلمات SEM لتشغيلها في وضع الإلكترون المتناثر الخلفي. في الصور المتناثرة ، المستوى الرمادي لمعيار الكربون هو 25 ، ومعيار الألومنيوم هو 225 ، ومعيار السيليكون هو 253. كمؤشر ، على النظام المستخدم ، تعمل معلمات SEM على تسريع الجهد 20 كيلو فولت ، وتيار المسبار المقاس بكوب فاراداي: 250 باسكال ، مسافة العمل: 15 مم ، الفتحة: 30 ميكرومتر ، دقة الصورة: 1024 × 768 بكسل ، الفراغ: < 4.10-4 باسكال ، وقت السكون 100 ميكرو ثانية / بكسل ، السطوع ~ 38 والتباين ~ 72.
- عندما تتم معايرة SEM بالمعايير ، احصل على صور للعينة في وضع الإلكترون المتناثر خلفيا.
- استخدم صورة الإلكترون المتناثرة للعينة لتحويل المستويات الرمادية إلى محتوى الكالسيوم ، كما هو موضح في Roschger et al.16. قم بذلك باستخدام أي برنامج لتحليل الصور.
- ارسم توزيع محتوى الكالسيوم. يظهر توزيع محتوى الكالسيوم توزيعا غاوسيا. يتم حساب ثلاثة معلمات رئيسية ذات أهمية:يعني Ca ، كمتوسط محتوى الكالسيوم في الصورة ،وذروة الكالسيوم كأكثر تركيز الكالسيوم شيوعا في الصورةوعرض الكالسيوم كعرض كامل عند نصف الحد الأقصى لتوزيع محتوى الكالسيوم.
ملاحظة: تم فحص قابلية استنساخ qBEi من خلال تصوير نفس منطقة الاهتمام لمدة 5 أيام متتالية (عملية استحواذ واحدة في اليوم). هذا يعني أنه تم تشغيل حزمة الإلكترون وإيقاف تشغيلها بين الجلسات. تم تقدير نسبة الخطأ فيمتوسط الكالسيوموذروة الكالسيوم والكابري بنسبة 0.5٪ و 0.7٪ و 1.2٪ على التوالي. تم التحقيق في محتوى الكالسيوم أيضا عن طريق تحليل الأشعة السينية المشتتة للطاقة (EDS). تم إنشاء علاقة خطية جيدة جدا بينمتوسط الكالسيوم ومحتوى الكالسيوم المقدر بواسطة EDS بقيمة R² تبلغ 0.99 ، على غرار البيانات التي حصل عليها Roschger et al. سابقا17.
6. علم الأنسجة
- لكل عينة ، قم بقص أقسام 7 ميكرومتر باستخدام ميكروتوم الأنسجة الصلبة بشفرة التنغستن 18،19. أقسام البقع مع صبغة Goldner trichrome و HES و MOVAT باستخدام نظام تلطيخ أوتوماتيكي.
- للاستخلاص ، انقع العينات على التوالي في الأسيتون لمدة 5 دقائق وكرر 2x. اشطف العينات بالماء المقطر لمدة 5 دقائق وكرر 2x.
- قم بإجراء تلوين Goldner Trichrome كما هو موضح أدناه.
- ضع العينات في الهيماتوكسيلين الحديدي Weigert لمدة 20 دقيقة. يغسل بماء الصنبور. اغمر العينات في كحول حمضي بنسبة 0.5٪ لمدة 30 ثانية - 1 دقيقة. يغسل بماء الصنبور لمدة 20 دقيقة.
- ضع العينات في محلول بونسو / حمض الفوشين / آزوفلوكسين لمدة 5 دقائق. اغمر في حمض الأسيتيك 1٪ لمدة 1 دقيقة.
- وصمة عار بحمض الفوسفوروليبديك / محلول أورانج جي لمدة 20 دقيقة. اغمر في حمض الأسيتيك 1٪ لمدة 1 دقيقة.
- وصمة عار بمحلول أخضر سريع لمدة 15 دقيقة في درجة حرارة الغرفة أو 8 دقائق عند 60 درجة مئوية. شطف جيدا بماء الصنبور. كرر 3 مرات.
- قم بتلوين Movat Pentachrome كما هو موضح أدناه.
- تلطيخ ألكيان بلو: اغمر العينات في محلول ألسيان الأزرق لمدة 30 دقيقة. اشطف العينات بماء الصنبور لمدة 5 دقائق. ضع العينات في الإيثانول القلوي لمدة 60 دقيقة. اشطف العينات بماء الصنبور لمدة 10 دقائق. قم بإجراء شطف نهائي بالماء المقطر.
- تلطيخ Weigert Hematoxylin: ضع العينات في Hematoxylin الحديديك Weigert لمدة 20-30 دقيقة. اشطف العينات بماء الصنبور لمدة 15 دقيقة. شطف مرة أخرى بالماء المقطر.
- تلطيخ بحمض كروسين بريليانت / فوكسين: اغمر العينات في محلول كروسين بريليانت / حمض فوكسين لمدة 10 دقائق. اشطفه بحمض الأسيتيك 0.5٪. اغمر العينات في محلول حمض الفوسفوتونغستيك بنسبة 5٪ لمدة 20 دقيقة. اشطفه بحمض الأسيتيك 0.5٪ لمدة دقيقتين. قم بإجراء ثلاث عمليات شطف متتالية باستخدام الإيثانول بنسبة 100٪ ، كل منها لمدة 5 دقائق.
- تلطيخ مع Safran du Gatinais: ضع عينات في Safran du Gatinais لمدة 15 دقيقة. قم بشطف أخير بماء الصنبور.
- قم بإجراء تلوين HES كما هو موضح أدناه.
- تلطيخ الهيماتوكسيلين من Weigert: اغمر العينات في Hematoxylin من Weigert لمدة 30 دقيقة. اشطفها بماء الصنبور لمدة 2 دقيقة.
- إزالة اللون: اغمس العينات في كحول حمض الهيدروكلوريك لمدة 10 ثوان. اشطفها بماء الصنبور لمدة 2 دقيقة.
- التحييد: اغمر العينات في محلول كربونات الليثيوم لمدة 1 دقيقة. اشطفها بماء الصنبور لمدة 2 دقيقة. قم بإجراء شطف نهائي بالماء المقطر لمدة 1 دقيقة.
- تلطيخ بالإيوزين - إريثروزين: ضع العينات في محلول إيوسين إريثروزين لمدة 3 دقائق. اشطفها بماء الصنبور لمدة 10 ثوان.
- الجفاف: اغمر العينات في 95٪ كحول لمدة 15 ثانية. انقله إلى كحول 100٪ لمدة 15 ثانية. كرر الغمر في الكحول بنسبة 100٪ لمدة 30 ثانية.
- التلوين النهائي بالسافرانين الكحولي: اغمر العينات في السافرانين الكحولي لمدة 10 دقائق. قم بشطف أخير بماء الصنبور.
- قم بإجراء تركيب الشرائح كما هو موضح أدناه.
- اشطف العينات بنسبة 95٪ من الإيثانول ، ثم 100٪ من الإيثانول ، ثم ميثيل سيكلوهكسان وكرر هذا 3x لكل خطوة.
- قم بتركيب العينات باستخدام مجموعة أدوات التثبيت وأضف غطاء غطاء. امسح الصور ضوئيا باستخدام ماسح ضوئي رقمي للشرائح.
7. رامان التحليل الطيفي المجهري
- استخدم نفس القسم المستخدم لتحليل رامان مثل SEM. قم بطحن القسم وتلميعه لفترة وجيزة كما هو موضح في الخطوات 5.2 - 5.3 لإزالة طبقة الكربون الرقيقة المضافة ل SEM التي تضعف تبديد الحرارة من العينة.
- ضع القسم على مسرح مطياف رامان المجهري. معايرة الرقم الموجي لضمان الدقة ومحاذاة الليزر قبل القياس. وبما أن هذه الإجراءات خاصة بكل صك، فلن يتم وصفها في هذه المقالة.
- حدد المناطق ذات الأهمية في الأنسجة التي تحتاج إلى تحليل. ضع المنطقة المراد تحليلها في وسط أداة الفيديو واجمع أطياف رامان بالمعلمات التالية: ليزر 785 نانومتر مستخدم عند 30 ميغاواط ، وقت التكامل: 20 ثانية متكررة 3 مرات ، النطاق الطيفي: 350-1800 سم -1 ، صريف 1200 خط / مم.
- اجمع 10 أطياف من راتنج التضمين بنفس إعدادات Raman وقم بمتوسطها. استخدم هذا لطرح مساهمة الراتنج في الخطوة 7.6.
- قم بمعالجة الأطياف مسبقا على النحو التالي لإزالة مساهمة التألق والضوضاء والراتنج: تصحيح خط الأساس مع تركيب متعدد الحدود من خمسة رتب ، ومرشح Savitzky-Golay بدرجة 4 ، وحجم نافذة يتألف بين 17 و 21 ، وطرح الراتنج الرقمي باستخدام ذروة ~ 812 سم -1 من الراتنج. يمكن إجراء هذه المعالجة المسبقة باستخدام برامج مختلفة مصممة لتحليل البيانات وتصورها.
- قم بتحليل الأطياف المعالجة مسبقا لاستخراج معلمات قيمة عن طريق تقنين شدة ذروة الاهتزاز ذي الأهمية مع ذروة شدة الاهتزاز المرجعي. لتحليل العظام ، على سبيل المثال ، استخدم المعلمات التالية لحسابه.
- نسب المعادن إلى المصفوفة: اقسم شدة ذروة اهتزازات v1PO4 عند ~ 960 سم -1 على ذروة شدة Amide I (~ 1668 cm-1) ، أميد III (~ 1250 سم -1) ، CH2-wag (~ 1450 سم -1) أو مجموع البرولين (~ 854 سم -1) وهيدروكسي برولين (Hyp ، ~ 872 سم -1) أوضاع الاهتزاز. يمكن أيضا استخدام v2PO4 ، الموجود عند ~ 430 سم -1 ، أو v4PO4 ، الموجود عند ~ 600 سم -1 ، ونسبته مع اهتزاز AmideIII 20. تمثل هذه المعلمات درجة تمعدن المرحلة العضوية لمصفوفة العظام.
- كربونات / فوسفات: اقسم شدة الذروة ل v1CO3 ، الموجود عند ~ 1070 سم -1 ، على v1PO4. يمثل هذا مقدار استبدال الكربونات من النوع B في شبكة الأباتيت. Hyp / Pro ، يمثل محتوى الهيدروكسي برولين ، ~ 1375 سم -1 / أميد الثالث ، يمثل محتوى البروتيوغليكان ، ~ 1150 سم -1 / CH2-wag و ~ 1495 سم -1 / CH2-wag ، يمثل كمية المنتجات النهائية المتقدمة للجليكاسیون كربوكسي ميثيل يسين والبنتوسيدين ، 1670 سم -1/1690 سم -1 و 1670 سم -1 / 1640 سم -1 تمثل الهيكل الثانوي المضطرب للكولاجين ، المعروف أيضا باسم نضج الكولاجين ، والهياكل المرتبة في شكل حلزون α في النوع الأول من الكولاجين ، على التوالي.
- تقييم قابلية تكرار قياسات رامان من خلال فحص نفس منطقة الاهتمام في 5 عمليات استحواذ متتالية (عملية استحواذ واحدة في اليوم). لكل معلمة تم تحليلها ، كان التباين أقل من 0.2٪ من قيمة المعلمة ، مما يدعم قابلية التكرار الجيدة. تمت مناقشة خصوصية كل ذروة تم التحقيق فيها على نطاق واسع في الميدان ، وتم تقديم نظرة عامة في المراجعة الأخيرة ل Unal21.
8. المسافة البادئة النانوية
ملاحظة: نظرا للطبيعة المدمرة للمسافة البادئة النانوية ، يتم إجراؤها عادة في نهاية روتين تحليل العينة. تم تجهيز نظام المسافة البادئة النانوية الذي نمتلكه بمسافة بادئة هرمية من الماس بيركوفيتش. ومع ذلك ، توجد العديد من أشكال المسافة البادئة ، ولم يتم تحديد أي إجماع في الأدبيات على عينات العظام أو المواد الحيوية.
- قم بترطيب عينة العظام المضمنة في محلول ملحي لمدة 16 ساعة في RT قبل اختبار المسافة البادئة النانوية.
- معايرة نظام المسافة البادئة النانوية باستخدام السيليكا المنصهرة وتسجيل معامل المسافة البادئة الناتجة. بالنسبة للسيليكا المنصهرة ، يبلغ معامل المسافة البادئة حوالي 72 جيجا باسكال باستخدام معامل بواسون 0.17.
- بمجرد معايرة نظام المسافة البادئة النانوية ، ضع العينة المستخدمة في تحليلات رامان في النظام البصري لجهاز المسافة البادئة النانوية للإشارة إلى المواقع التي سيتم فيها إجراء المسافة البادئة النانوية.
ملاحظة: تختلف هذه الطريقة من جهاز إلى آخر؛ نحن لا نفصل كيفية عمل نظام المسافة البادئة النانوية والبرامج ولكننا نقدم نصائح عامة حول الخطوات المختلفة التي يجب تنفيذها. - بمجرد اختيار موقع المسافة البادئة النانوية ، انقل العينة أسفل جهاز المسافة البادئة وقم بإجراء المسافة البادئة. قم بإجراء المسافة البادئة النانوية على عمق ثابت يبلغ 900 نانومتر ، مع سرعة تحميل / تفريغ تبلغ 40 مم / دقيقة وتوقف مؤقت لمدة 15 ثانية بين التحميل والتفريغ. اضبط معامل بواسون لأنسجة العظام على 0.3.
- استرجع المعلمات المختلفة من منحنيات المسافة البادئة النانوية واحسبها وفقا لنظرية أوليفر وفار22.
- معامل المسافة البادئة (EIT) مشتق من الخصائص المعروفة لطرف المسافة البادئة والمعامل المخفض ويجمع بين معامل المرونة المحلي للعينة. احسب المسافة البادئة على النحو التالي:
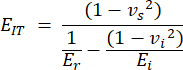
مع vs و vi و Ei و Er التي تمثل معامل بواسون للعينة ، يفترض أن تكون 0.3 للعظم ، يفترض معامل بواسون للمسافة البادئة الماسية ، المفترض أن يكون 0.07 ، معامل المرونة للمسافة البادئة الماسية ، الثابت عند 1140 جيجا باسكال والمعامل المخفض ، محسوبا على النحو التالي: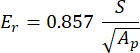
مع S التي تمثل منحدر جزء التفريغ و Ap هي المنطقة المسقطة ويتم حسابها على النحو التالي: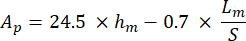
- صلابة (HIT): تتوافق مع مقاومة العظام لبدء وانتشار الشقوق. بمعنى آخر ، إنه مؤشر على صلابة العظام. احسب HIT على النحو التالي:

- معدل زحف المسافة البادئة (CIT): يعكس هذا تشوه العظام بمرور الوقت عند الحمل الثابت ، مما يدل على الخصائص اللزجة المرنة للعينة ، تحسب على النحو التالي:
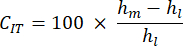
- الحمولة القصوى (Lm): يتوافق هذا مع التحميل المعاكس الضروري لاختراق العمق المشار إليه في مصفوفة العظام المعدنية.
- عمل المسافة البادئة (Wplast): يتوافق هذا مع المنطقة الواقعة تحت منحنى تشوه التحميل / التفريغ. إنه انعكاس مباشر للطاقة المتبددة للحث على تشوه البلاستيك.
ملاحظة: يصعب تقييم قابلية تكرار المسافة البادئة النانوية على عينات العظام بسبب الطبيعة المدمرة لهذه المنهجية. ومع ذلك ، قمنا بتقدير قابلية استنساخ عينة السيليكا المنصهرة القياسية والموحدة. بالنسبة لجميع المعلمات المذكورة أعلاه ، تم تقدير التباين بأقل من 0.26٪ (5 مقاييس متتالية في 5 أيام منفصلة) ، مما يدعم قابلية استنساخ جيدة جدا. من ناحية أخرى ، نظرا للطبيعة متباينة الخواص لعينات العظام ، يصعب تقدير قابليتها للتكاثر.
- معامل المسافة البادئة (EIT) مشتق من الخصائص المعروفة لطرف المسافة البادئة والمعامل المخفض ويجمع بين معامل المرونة المحلي للعينة. احسب المسافة البادئة على النحو التالي:
Access restricted. Please log in or start a trial to view this content.
النتائج
تظهر صورة التصوير المقطعي المحوسب الصغير للنبتة في الشكل 2. لا يمكن أن يؤدي استخدام التجزئة اليدوية إلى فصل العظام عن الأسمنت الموجود في القناة المركزية على النحو الأمثل باستخدام العتبة العالمية. لتحسين التعرف على العظام التربيقية والأسمنت ، نقترح استخ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعد إصلاح عيوب العظام تحديا كبيرا في الطب التجديدي لاستعادة الحركة وتقليل الألم وتحسين نوعية حياة الأفراد المصابين. يوفر استخدام نماذج الاستخراج عددا من المزايا مقارنة بالدراسات في الجسم الحي للتحقيق في إصلاح عيوب العظام. بالإضافة إلى الاعتبارات الأخلاقية ، يسمح ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نود أن نشكر المرافق الفنية المشاركة في جمع العينات ومعالجتها ، بما في ذلك SC3M (SFR Francois Bonamy (UMS 016) ، جامعة نانت) ، SFR ICAT (جامعة أنجيه) ، BIO3 ، HiMolA ، و SC4BIO. يتم دعم Inserm UMR_S 1229 RMeS بمنح من الحكومة الفرنسية من خلال مؤسسات Inserm و Nantes Université و Univ Angers و Oniris VetAgroBio. CL ممتنة أيضا ل HTL Biotechnology.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.20 filters | VWR | 28145-501 | |
| 18 G needle (1,2x40 mm) | Sterican | 4665120 | |
| 3 mL syringe | HENKE-JECT | 8300005762 | |
| 37% hydrochloric acid | VWR | 1.00317.1000 | |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acetone | VWR | 20063-365 | |
| Alcian Blue 8GX | VWR | 361186 | |
| Ammonium hydroxide | VWR | 318612 | |
| Apatitic tricalcium phosphate | Centre for Biomedical and Healthcare Engineering (Mines Saint Etienne, France) | TV26U | |
| Azophloxine | Sigma | 210633 | |
| Benzoyl peroxide | Sigma | 8.01641.0250 | |
| BMP2 | Medtronic | InductOs 1.5 mg/mL | |
| Brillant crocein | Aldrich | 2107507 | |
| CTVox | Bruker | - | |
| DataViewer | Skyscan | - | |
| Diamond blade | Struers | MOD13 | |
| Diamond saw | Struers | Accutom-50 | |
| DiaPro Mol B3 diamond solution | Struers | 40600379 | |
| DiaPro Nap B1 diamond solution | Struers | 40600373 | |
| Dibasic sodium phosphate (Na2HPO4) | Sigma | 102404598 | |
| Dibutyl Phtalate | Chimie-Plus Laboratoires | 28656 | |
| DragonFly software | ORS | 2022.1.0.1231. | |
| Dulbecco's Modified Eagle Medium (DMEM) high glucose, GlutaMAX(TM), pyruvate | ThermoFisher Scientific | 31966-021 | |
| Eosine Y- Surgipath | Sigma | 1002830105 | |
| Erythrosin B | Sigma | 102141057 | |
| Ethanol absolute | VWR | 20820362 | |
| Eukitt | Dutscher | 6.00.01.0003.06.01.01 | |
| Falcon 50 mL | Sarstedt | 62.547.254 | |
| Ferric chloride hexahydrate (FeCl3, 6H2O) | Merck | 1.03943.0250 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF00 | |
| Fuchsine acid | Merck | 1.05231.0025 | |
| Hank's Balanced Salt Solution (HBSS) | Biosera | MS01NG100J | |
| Hematoxylin | Sigma | 86.118.9 | |
| Isostatic press | Nova Suisse | Pmax 1500 bars | |
| Laser diffraction granulometry | Malvern | Mastersizer 3000 | |
| Light green | Prolabo | 28947135 | |
| Lithium carbonate | Sigma | A13149 | |
| MD-Mol polishing cloth | Struers | 40500077 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylmethacrylate | Sigma | 8.00590.2500 | |
| Micro-CT, micro-scanner | Bruker | Skyscan 1272 | |
| Monobasic sodium phosphate (NAH2PO4) | Sigma | 71496 | |
| Mortar | Fritsch | Pulverisette 6 | |
| N,N, Dimethylanilin | Sigma | 803060 | |
| Nanoindentation station | Anton Paar | NHT2 | |
| ND-Nap polishing cloth | Struers | 40500080 | |
| OATS Osteochondral Autograft Transfer System Set, 4,75 mm | Arthrex | AR-1981-04S | |
| OATS Osteochondral Autograft Transfer System Set, 8 mm | Arthrex | AR-1981-08S | |
| Orange G | Ral | M15 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Peel-a-way disposable embbedding moulds | Polysciences, Inc | 18646C-1 | |
| Penicillin/Streptomycin (P/S) | ThermoFisher Scientific | 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| Phosphomolybdic acid | Sigma | 221856-100 g | |
| Phosphotungstic acid | Aldrich | 12863-5 | |
| Polishing machine | Sturers | Dap V | |
| Poupinel | MEMMERT | TV26U | |
| Raman microspectrometer | Renishaw | InVia Qontor | |
| Safran du Gâtinais | Labonord | 11507737 | |
| Scanning electron microscope | Carl Zeiss | Evo LS 10 | |
| SEM | Zeiss | Carl Zeiss Evo LS10 | |
| SiC foils/Grinding papers | Struers | 40400008 (#320), 40400011 (#1000), 40400122 (#2000), 40400182 (#4000) | |
| Silver paint | Electron microscopy sciences | 12686-15 | |
| Standard stub with Faraday cup, carbon, aluminium and silicon standards | Micro-Analysis Consultants Ltd | 8602 | |
| T25 flask | Corning | 430639 | |
| Xylene | VWR | 28975.325 | |
| Xylidine Ponceau | Aldrich | 19.976-1 |
References
- Feroz, S., Cathro, P., Ivanovski, S., Muhammad, N. Biomimetic bone grafts and substitutes: A review of recent advancements and applications. Biomed Eng Adv. 6, 100107(2023).
- Tsuji, K., et al. BMP2 activity, although dispensable for bone formation, is required for the initiation of fracture healing. Nat Genet. 38 (12), 1424-1429 (2006).
- Hadjidakis, D. J., Androulakis, I. I. Boneremodeling. Ann N Y Acad Sci. 1092, 385-396 (2006).
- Boivin, G., Meunier, P. J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcified Tiss Int. 70 (6), 503-511 (2002).
- Boivin, G., et al. Influence of remodeling on the mineralization of bone tissue. Osteoporo Int. 20 (6), 1023-1026 (2009).
- Zanghellini, B., et al. Multimodal analysis and comparison of stoichiometric and structural characteristics of parosteal and conventional osteosarcoma with massive sclerosis in human bone. J Str Biol. 216 (3), 108106(2024).
- Trento, G., et al. formation around two titanium implant surfaces placed in bone defects with and without a bone substitute material: A histological, histomorphometric, and micro-computed tomography evaluation. Clin Implant Dent Relat Res. 22 (2), 177-185 (2020).
- Palmquist, A. A multiscale analytical approach to evaluate osseointegration. J Mater Sci Mater Med. 29 (5), 60(2018).
- Budán, F., et al. Novel radiomics evaluation of bone formation utilizing multimodal (SPECT/X-ray CT) in vivo imaging. PLoS ONE. 13 (9), e0204423(2018).
- Hulsart-Billström, G., et al. A surprisingly poor correlation between in vitro and in vivo testing of biomaterials for bone regeneration: results of a multicentre analysis. Eur Cells Mater. 31, 312-322 (2016).
- Cramer, E. E. A., Ito, K., Hofmann, S. Ex vivo bone models and their potential in preclinical evaluation. Curr Osteoporo Rep. 19 (1), 75-87 (2021).
- Chan, M. E., et al. A trabecular bone explant model of osteocyte-osteoblast co-culture for bone mechanobiology. Cell Mol Bioeng. 2 (3), 405-415 (2009).
- Doke, S. K., Dhawale, S. C. Alternatives to animal testing: A review. Saudi Pharma J. 23 (3), 223-229 (2015).
- Moussi, H., et al. New formulation of injectable and degradable calcium phosphate/silanized hyaluronic acid composite foam: Investigation in a rabbit model of long bone defect. SSRN. , (2024).
- Paré, A., et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta Biomater. 154, 626-640 (2022).
- Roschger, P., Fratzl, P., Eschberger, J., Klaushofer, K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone. 23 (4), 319-326 (1998).
- Roschger, P., Plenk, H., Klaushofer, K., Eschberger, J. A new scanning electron microscopy approach to the quantification of bone mineral distribution: backscattered electron image grey-levels correlated to calcium K alpha-line intensities. Scanning Micro. 9 (1), 75-86 (1995).
- Porter, A., et al. Quick and inexpensive paraffin-embedding method for dynamic bone formation analyses. Sci Rep. 7, 42505(2017).
- Goldschlager, T., Abdelkader, A., Kerr, J., Boundy, I., Jenkin, G. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis. J Vis Exp. (35), e1707(2010).
- Kazanci, M., Roschger, P., Paschalis, E. P., Klaushofer, K., Fratzl, P. Bone osteonal tissues by Raman spectral mapping: Orientation-composition. J Str Biol. 156 (3), 489-496 (2006).
- Unal, M., Ahmed, R., Mahadevan-Jansen, A., Nyman, J. S. Compositional assessment of bone by Raman spectroscopy. Analyst. 146 (24), 7464-7490 (2021).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. J Mater Res. 7 (6), 1564-1583 (1992).
- Proffen, B. L., McElfresh, M., Fleming, B. C., Murray, M. M. A comparative anatomical study of the human knee and six animal species. Knee. 19 (4), 493-499 (2012).
- Allen, M. J., Houlton, J. E. F., Adams, S. B., Rushton, N. The surgical anatomy of the stifle joint in Sheep. Vet Surg. 27 (6), 596-605 (1998).
- Kleuskens, M. W. A., van Donkelaar, C. C., Kock, L. M., Janssen, R. P. A., Ito, K. An ex vivo human osteochondral culture model. J Ortho Res. 39 (4), 871-879 (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved