Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Комплексная характеристика минерализации тканей в модели ex vivo
В этой статье
Резюме
Предлагаемый протокол предполагает глобальный подход к оценке костеобразования в контексте регенерации костной ткани с использованием мультимодальных анализов. Он направлен на предоставление качественной и количественной информации о формировании новой кости, повышение строгости и достоверности основных и доклинических исследований.
Аннотация
Обширная характеристика минерализации тканей в контексте регенерации кости представляет собой серьезную проблему, учитывая многочисленные модальности, которые в настоящее время доступны для анализа. В данной работе мы предлагаем рабочий процесс для всесторонней оценки образования новой кости с использованием соответствующего костного экспланта ex vivo крупного животного. В эксцентрированной головке бедренной кости овцы создают костный дефект (диаметр = 3,75 мм; глубина = 5,0 мм) и вводят макропористый костный заменитель, загруженный проостеогенным фактором роста (костный морфогенетический белок 2 - BMP2). Впоследствии эксплант сохраняется в культуре в течение 28-дневного периода, что позволяет провести клеточную колонизацию и последующее формирование костной ткани. Для оценки качества и структуры вновь минерализованной ткани используются следующие последовательные методы: (i) Характеристика и 3D-изображения всего экспланта с высоким разрешением с использованием микрокомпьютерной томографии с последующим анализом изображений с глубоким обучением для усиления дискриминации минерализованных тканей; ii) наноиндентирование для определения механических свойств вновь образованной ткани; (iii) Гистологические исследования, такие как гематоксилин/эозин/шафран (HES), трихром Гольднера и пентахром Мовата, для качественной оценки минерализованной ткани, в частности, в отношении визуализации остеоидного барьера и наличия костных клеток; (iv) картирование методом сканирующей электронной микроскопии (СЭМ) с методом обратного рассеяния с внутренней привязкой для количественной оценки степени минерализации и получения подробного представления о морфологии поверхности, минеральном составе и границе раздела кости и биоматериала; (v) Спектроскопия комбинационного рассеяния света для определения молекулярного состава минерализованной матрицы и получения представления о стойкости BMP2 в цементе путем обнаружения пептидных связей. Этот мультимодальный анализ обеспечит эффективную оценку вновь образованной кости и всестороннее качественное и количественное понимание минерализованных тканей. Благодаря стандартизации этих протоколов мы стремимся облегчить межисследовательские сравнения и повысить достоверность и надежность результатов исследований.
Введение
Костные дефекты, вызванные травмой, резекцией опухоли, врожденными аномалиями или инфекцией, представляют собой серьезную проблему для регенеративной медицины. Эти изменения нарушают структурную целостность костной системы, что приводит к дискомфорту, функциональным нарушениям и снижению качества жизни пациентов.
Для преодоления этих проблем были разработаны инновационные стратегии восстановления костной ткани, направленные на усиление остеогенеза и регенерацию костной ткани. Эти подходы включают использование имплантируемых, инъекционных или напечатанных на 3D-принтере заменителей кости, которые могут иметь природное происхождение (например, макромолекулы биологического происхождения, гидроксиапатит животного происхождения) или синтетические (например, биоочки, фосфаты кальция)1. Чтобы усилить их низкую врожденную способность направлять и стимулировать регенерацию кости, костные заменители могут быть загружены остеоиндуктивными факторами, такими как костные морфогенетические белки (BMP), чтобы способствовать остеогенной дифференцировке клеток-предшественников и улучшатьформирование кости.
Формирование костной ткани основано на первоначальном образовании коллагенового матрикса, который затем минерализуется кристаллами гидроксиапатита, тем самым укрепляя костную структуру3. Этот процесс придает кости определенную жесткость и прочность. Качество минерализованной ткани в сложной степени определяется ее микроструктурными особенностями и степенью минерализации4. Это качество играет ключевую роль в заживлении кости и функциональности регенерированной кости5. Тем не менее, характеристика костной минерализации остается сложной задачей из-за присущей ей вариабельности в многофакторных исследованиях 6,7,8.
Кроме того, первоначальные оценки биосовместимости, цитосовместимости и дифференцировочного потенциала заменителей костного трансплантата обычно проводятся in vitro. Однако методологические различия препятствуют бесшовному сравнению результатов. Кроме того, эти исследования in vitro не полностью охватывают многоклеточные взаимодействия и сложный диалог между клеточными популяциями, включая клетки костного мозга, которые необходимы для регуляции процесса регенерации кости9. Такое отсутствие точного представления микроокружения кости может поставить под угрозу точность последующих доклинических исследований10.
Несмотря на то, что оценки in vivo обеспечивают более точное представление о физиологических контекстах, они ограничены этическими, логистическими и финансовыми соображениями. Следовательно, оценки ex vivo играют ключевую роль в качестве связующего звена между исследованиями in vitro и in vivo, выступая в качестве необходимого промежуточного шага перед переходом к экспериментам на живых субъектах 11,12,13.
В этом контексте необходимо внедрение комплексных методологий характеризации для оценки качества регенерированной костной ткани и обеспечения актуальности стратегии перед переходом к доклинической модели. Следовательно, мы предлагаем протокол, основанный на анализе модели экспланта с использованием ткани коленного сустава овцы. Эта инновационная методология включает в себя введение в экспланты цемента, загруженного BMP2, и проведение детального анализа минерализации тканей после 28 дней культивирования.
Технические подходы, использованные в этом исследовании, разнообразны и дополняют друг друга, в совокупности обеспечивая комплексный подход к оценке качества регенерированной костной ткани (Рисунок 1). Микрокомпьютерная томография с высоким разрешением позволяет детально визуализировать 3D-структуру кости, предоставляя ценную информацию о минеральной плотности, морфологии и целостности вновь образованной ткани. Этот метод имеет решающее значение для оценки эффективности регенерации кости и мониторинга прогрессирования минерализации с течением времени. Наноиндентирование — это точный подход к определению механических свойств ткани, таких как ее твердость и прочность. Измеряя реакцию материала на приложенную силу в нанометрическом масштабе, этот метод позволяет оценить прочность и качество минерализованной ткани. Гистологические исследования с использованием распространенных красителей, таких как гематоксилин/эозин/шафран (HES), трихром Гольднера и пентахром Мовата, дают бесценную информацию о структуре и составе тканей. Эти окрашивания позволяют дифференцировать различные компоненты тканей, включая клетки, внеклеточный матрикс и минеральные отложения, тем самым позволяя всесторонне качественно оценить процесс регенерации кости. Картирование методом сканирующей электронной микроскопии (СЭМ) с помощью обратного рассеяния обеспечивает визуализацию поверхности образцов с высоким разрешением, что позволяет детально анализировать степень минерализации костного матрикса, а также границы раздела между имплантированным материалом и тканью хозяина. Наконец, рамановская спектроскопия предоставляет информацию о молекулярном составе ткани, в частности, путем идентификации конкретных компонентов, таких как белки, липиды и минералы. Этот подход позволяет охарактеризовать минерализованный матрикс и обнаружить факторы роста, такие как BMP2, тем самым предоставляя важную информацию о стойкости проостеогенных стимулов в регенерационной среде.
Используя междисциплинарный подход, объединяющий различные аналитические методы, наше исследование направлено на то, чтобы обеспечить тщательную и всестороннюю оценку качества регенерированной костной ткани, тем самым обеспечивая прочную основу для оценки заменителей костного трансплантата и их потенциального клинического применения.
Access restricted. Please log in or start a trial to view this content.
протокол
Это исследование было одобрено комитетом по этике и благополучию животных и Национальным управлением ветеринарии и продовольствия Франции под номером G44171.
1. Подготовка и культивирование остеохондральных эксплантов
- Соберите образцы овечьих суставов у только что усыпленных животных в асептической среде. Расположите овцу в положении лежа на спине и оббрейте левую заднюю конечность. Подготовьте путем дезинфекции спиртом вокруг коленного сустава. Используйте латеральную парапателлярную артротомию для обнажения передней и задней крестообразных связок с последующим вывихом надколенника для выявления бедренной трохлеи.
- После забора ткани создайте дефект диаметром 4,75 мм в латеральном мыщелке с помощью системы переноса остеохондрального аутотрансплантата.
- С помощью ортопедического молотка создайте дефект глубиной 10 мм и извлеките эксплант из мыщелка. Затем выполнить второй дефект диаметром 8 мм, центрированный вокруг первого, с использованием системы переноса остеохондрального аутотрансплантата. В результате получаются остеохондральные экспланты размером 8 мм x 10 мм, содержащие центральный дефект 4,75 мм x 10,0 мм.
- Если это необходимо по логистическим причинам, транспортируйте экспланты в сбалансированном солевом растворе Хэнка (hBSS) с добавлением 1% пенициллин-стрептомицина и храните при температуре 4 °C.
- Промойте экспланты 3 раза фосфатно-соевым буфером (PBS), затем введите дефект размером 4,75 мм x 10,0 мм кальциевым фосфатом с добавлением 40 мкг/мл BMP2. Приготовьте цемент, как описано ниже.
- Получить α-трикальцийфосфат (α-TCP) путем термической обработки апатитных стержней трикальцийфосфата (изостатический пресс при 120 МПа) при 1364 °C в течение не менее 12 ч с последующей закалкой на воздухе14.
- Измельчите стержни α-TCP в абсолютном этаноле с помощью планетарного шара мельницы 2 раза в течение 5 мин при 500 об/мин до получения мелкодисперсного порошка размером 13,1 ± 1,7 мкм (измерено с помощью лазерной дифракции, как описано ранее14).
- Стерилизовать порошок α-TCP путем сухого нагрева до 180 °C в течение 45 минут. Приготовьте кальций-фосфатный цемент, смешав порошок α-TCP с фильтрованным раствором 2,5% (масс./об.) Na2HPO4 0,22 мкм (соотношение жидкость/порошок 0,35) в течение 1 минуты.
- Перед инъекцией загрузите цементную пасту в шприц объемом 3 мл с помощью иглы 18 G.
- Через 10 минут при комнатной температуре (RT) переложите экспланты в колбу площадью 25 см² и осторожно добавьте 10 мл полной питательной среды, состоящей из модифицированной орлиной среды Dulbecco (DMEM) с высоким содержанием глюкозы с добавлением 10% фетальной бычьей сыворотки и 1% пенициллин-стрептомицина.
- Экспланты выдерживают до 28 дней в инкубаторе при температуре 37 °C с 5%CO2 и каждые 2 дня меняют всю питательную среду под ламинарным проточным колпаком.
- Промойте экспланты 3 раза с PBS. Переложите их в пробирки объемом 50 мл, добавьте 20 мл 4% параформальдегида (PFA) и держите при температуре 4 °C в течение 3 дней. Затем промойте экспланты PBS и храните их в 70% этаноле перед последующими анализами.
2. Микро-компьютерный анализ
- Проведите микротомографию с использованием микрокомпьютерной томографии и рентгена. Получение рентгеновских проекций с разрешением 10,7 мкм, временем экспозиции 1200 мс и алюминиевым фильтром 1 мм (80 кВ и 125 мкА). Усредняйте три изображения с каждым шагом поворота на 0,45°, чтобы улучшить соотношение сигнал/шум.
- Реконструируйте трехмерные (3D) изображения с помощью программного обеспечения производителя для реконструкции после выравнивания по X/Y с помощью эталонного скана, со следующими параметрами - Сглаживание: 0, Артефакт кольца: 3, Упрочнение луча: 35%. Очистите стопки изображений с помощью программного обеспечения для обработки изображений и наблюдайте с помощью инструментов двухмерной (2D) и 3D-визуализации.
3. Анализ изображений с помощью глубокого обучения
- Проводите сегментацию изображений с помощью специального специализированного программного обеспечения. Используйте встроенный мастер сегментации для обучения модели глубокого обучения для различения костей и цементов.
- Выберите репрезентативную зону (т.е. кадр), содержащую кость, цемент и фон из восстановленных изображений микрокомпьютерной томографии. Сегментируйте этот первый кадр вручную с помощью простых (например, пороговых) или мощных инструментов (например, для распространения), предоставляемых программным обеспечением.
- Создайте модель глубокого обучения на вкладке «Модель» и выберите «Подпрограмма 3D-Unet » в раскрывающемся меню. Определение его экспериментальных параметров в сопоставлении с анализируемыми изображениями путем щелчка правой кнопкой мыши по сгенерированной модели; здесь: глубина 5, размер патча 32 x 32, алгоритм Adadetla, коэффициент шага 0,25, увеличение данных x10.
- Используйте сегментированную рамку для обучения процедуры глубокого обучения (нажмите кнопку «Обучение»), которая признана актуальной благодаря своим возможностям быстрой и точной сегментации изображений 3,15. После завершения обучения определите вторую рабочую зону (кадр) и автоматически сегментируйте с помощью функции прогнозирования.
- При необходимости примените ручную коррекцию для получения более точных обучающих данных. Снова тренируйтесь. Повторяйте процесс до тех пор, пока не будет получен удовлетворительный результат; Количество дополнений данных постепенно уменьшается по мере увеличения числа обучающих кадров.
ПРИМЕЧАНИЕ: Индекс DICE, предоставленный во время обучения модели, дает представление о точности модели (по сравнению с входной информацией), но его недостаточно. Подтверждение актуальности модели должно быть осуществлено путем валидации автоматически сегментированных данных 3 независимыми опытными исследователями.
- При необходимости примените ручную коррекцию для получения более точных обучающих данных. Снова тренируйтесь. Повторяйте процесс до тех пор, пока не будет получен удовлетворительный результат; Количество дополнений данных постепенно уменьшается по мере увеличения числа обучающих кадров.
- Опубликуйте модель, нажав кнопку «Экспорт », и примените ее ко всему набору данных микро-КТ, нажав «Сегментировать > экспортированную модель > сегментировать полный набор данных».
4. Встраивание
- Обезвоживайте костные экспланты, поместив их в стеклянный флакон объемом 40 мл, содержащий 25 мл раствора для обезвоживания, состоящего из 70% ацетона и 30% ксилола. Поместите стеклянный флакон на вращающееся колесо на 1 час при температуре RT. Повторите этот шаг 3 раза.
- Замените раствор для обезвоживания 25 мл ксилола и поместите стеклянный флакон на вращающееся колесо на 1 ч при температуре RT.
- Замените раствор ксилола 25 мл метилметакрилата, обогащенного (MMA) 10% пероксидом бензоила (BPO) и 10% дибутилфталатом (DBP). Поместите его на вращающееся колесо на 1 час в RT. Повторите этот шаг 2 раза.
- Замените раствор ММА 25 мл ММА, обогащенным 10% БПО, 10% ДАД и 450 мкл N, N диметиланилина, разведенного в соотношении 1:20 в пропан-2-оле. Поместите стеклянный флакон при температуре -20 °C на ночь. Раствор приобретает желтоватый оттенок.
- Поместите эксплант в форму для заделки среднего размера и залейте в форму анилин MMA-BPO-DBP-N, N. Поместите форму в пластиковый ящик и проветрите потоком азота в течение 5 минут. Герметично закройте коробку и поместите ее при температуре 4 °C на 48 часов для полимеризации и затвердевания MMA.
- Извлеките смолу, содержащую эксплант, из формы и держите ее при температуре 4 °C до обработки для последующего анализа.
5. Сканирующая электронная микроскопия (СЭМ) - количественная визуализация обратно рассеянных электронов (qBEI)
- Разрежьте блок pMMA, содержащий эксплант, алмазной пилой вдоль его длинной оси. Первую половину блока оставьте для гистологического анализа. Разрежьте вторую половину дальше, чтобы получился участок толщиной 1,5 мм. Выполняйте резку при 3000 об/мин со скоростью 3 мм/мин.
- Измельчите срез бумагой из карбида кремния с возрастающими числами, соответствующими меньшему размеру зерна: SiC 320 в течение 10 с, SiC 1000 в течение 15 с, SiC 2000 в течение 30 с и SiC 4000 в течение 30 с.
- Отполируйте участок алмазной пастой и специальной одеждой: полировальную салфетку раствором алмаза Mol B3 3 мкм в течение 1 минуты и флисовую ткань раствором алмаза Nap B1 1 мкм в течение 1 минуты.
- Промойте секцию под двойной дистиллированной водой и очистите ватной палочкой от частиц алмаза. Просушите секцию под газообразным азотом.
- Нанесите углеродное покрытие на толстый участок (толщина углеродной пленки 10 нм) и установите его на алюминиевый заглушку с серебристой краской. Сделайте серебряный мост между верхней частью секции и заглушкой, чтобы обеспечить эвакуацию заряда электронов на землю.
- Поместите заглушку на сцену SEM. Рядом с образцом вставьте контрольный заглушку, состоящую из чашки Фарадея со стандартами углерода, алюминия и кремния, в камеру SEM. Это будет использоваться для калибровки электронного пучка и преобразования уровней серого в проценты Ca. Закройте камеру SEM и проведите вакуум.
- Включите электронный пучок и настройте параметры SEM для работы в режиме обратного рассеяния электронов. На обратном рассеянии уровень серого стандарта углерода равен 25, стандарта алюминия — 225, а стандарта кремния — 253. В качестве ориентира, на используемой системе используются следующие параметры СЭМ: ускоряющее напряжение 20 кэВ, ток зонда, измеренный с помощью чашки Фарадея: 250 пА, рабочее расстояние: 15 мм, апертура: 30 мкм, разрешение изображения: 1024 x 768 пикселей, вакуум: < 4,10-4 Па, время задержки 100 мкс/пиксель, яркость ~38 и контрастность ~72.
- Когда СЭМ откалиброван в соответствии со стандартами, получите изображения образца в режиме обратного рассеяния электронов.
- Используйте изображение образца с помощью обратного рассеяния электронов, чтобы преобразовать уровни серого в содержание кальция, как описано в Roschger et al.16. Выполните это с помощью любого программного обеспечения для анализа изображений.
- Построен график распределения содержания кальция. Распределение содержания кальция показывает распределение по Гауссу. Рассчитываются три основных параметра, представляющих интерес:среднее значение Ca как среднее содержание кальция на изображении,пик Ca как наиболее частая концентрация кальция, встречающаяся на изображении, иширина Ca как полная ширина при половине максимума распределения содержания кальция.
ПРИМЕЧАНИЕ: Воспроизводимость qBEi была исследована путем визуализации одной и той же области интереса в течение 5 дней подряд (один сбор данных в день). Это означает, что электронный луч включался и выключался между сеансами. Процент ошибокв среднем Ca,пике Ca и Cawidth был оценен как 0,5%, 0,7% и 1,2% соответственно. Содержание кальция также исследовали с помощью энергодисперсионного рентгеновского анализа (EDS). Была установлена очень хорошая линейная зависимость междусредним значением Ca и содержанием кальция, оцененным с помощью EDS со значением R² 0,99, аналогично данным, полученным Roschger et al. ранее17.
6. Гистология
- Для каждого образца вырезают срезы 7 мкм с помощью микротома твердой ткани с вольфрамовым лезвием 18,19. Окрашивайте срезы морилкой Goldner trichrome, HES и MOVAT с помощью автоматической системы окрашивания.
- Для депластификации последовательно замочите образцы в ацетоне на 5 минут и повторите 2 раза. Промойте образцы в дистиллированной воде в течение 5 минут и повторите 2 раза.
- Выполните трихромное окрашивание Голднера, как описано ниже.
- Поместите образцы в гематоксилин железа Вайгерта на 20 минут. Умывайтесь водой из-под крана. Погрузить образцы в 0,5% кислотный спирт на 30 с-1 мин. Умываться водопроводной водой в течение 20 минут.
- Поместите образцы в раствор Понсо/фуксиновой кислоты/азофлоксина на 5 минут. Погрузить в 1% уксусную кислоту на 1 мин.
- Окрашивать фосфомолибдиновой кислотой/раствором Orange G в течение 20 мин. Погрузить в 1% уксусную кислоту на 1 мин.
- Окрашивать быстрым зеленым раствором в течение 15 мин при комнатной температуре или 8 мин при 60 °C. Тщательно промойте водой из-под крана; Повторите 3 раза.
- Выполните окрашивание Movat Pentachrome, как описано ниже.
- Окрашивание Alcian Blue: погрузить образцы в раствор Alcian Blue на 30 минут. Промойте образцы в водопроводной воде в течение 5 минут. Поместите образцы в щелочной этанол на 60 минут. Промойте образцы в водопроводной воде в течение 10 минут. Проведите окончательное полоскание дистиллированной водой.
- Окрашивание гематоксилином Вейгерта: поместите образцы в гематоксилин железа Вейгерта на 20-30 минут. Промойте образцы в водопроводной воде в течение 15 минут. Еще раз промойте дистиллированной водой.
- Окрашивание Crocein Brilliant/фуксиновой кислотой: погрузить образцы в раствор Crocein Brilliant/Acid Fuchsin на 10 минут. Промыть 0,5% уксусной кислотой. Погрузите образцы в 5% раствор фосфовольфрамовой кислоты на 20 минут. Смыть 0,5% уксусной кислотой в течение 2 мин. Выполните три последовательных полоскания 100% этанолом, каждое продолжительностью 5 минут.
- Окрашивание с помощью Safran du Gatinais: поместите образцы в Safran du Gatinais на 15 минут. Проведите заключительное полоскание водой из-под крана.
- Выполните окрашивание HES, как описано ниже.
- Окрашивание гематоксилином Вейгерта: погрузите образцы в гематоксилин Вейгерта на 30 минут. Смыть водой из-под крана в течение 2 минут.
- Обесцвечивание: погрузить образцы в солянокислый спирт на 10 с. Смыть водой из-под крана в течение 2 минут.
- Нейтрализация: погрузить образцы в раствор карбоната лития на 1 мин. Смыть водой из-под крана в течение 2 минут. Заключительное полоскание дистиллированной водой в течение 1 минуты.
- Окрашивание эозин-эритрозином: поместить образцы в раствор эозин-эритрозина на 3 мин. Смыть водой из-под крана в течение 10 с.
- Обезвоживание: Погрузите образцы в 95% спирт на 15 секунд. Переведите на 100% спирт на 15 с. Повторите погружение в 100% спирт в течение 30 с.
- Окончательное окрашивание спиртовым сафранином: погрузить образцы в спиртовой сафранин на 10 минут. Проведите заключительное полоскание водой из-под крана.
- Выполните монтаж на салазках, как описано ниже.
- Промойте образцы в 95% этаноле, затем в 100% этаноле, затем в метилциклогексане и повторите это 3 раза для каждого этапа.
- Установите образцы с помощью монтажного комплекта и добавьте покровное стекло. Отсканируйте изображения с помощью цифрового сканера слайдов.
7. Рамановская микроспектроскопия
- Используйте ту же секцию, которая используется для комбинационного анализа, что и СЭМ. Кратко отшлифуйте и отполируйте срез, как описано в шагах 5.2 - 5.3, чтобы удалить тонкий слой углерода, добавленный для СЭМ, который ухудшает отвод тепла от образца.
- Поместите секцию на столик рамановского микроспектрометра. Откалибруйте волновое число, чтобы обеспечить точность и юстировать лазер перед измерением. Поскольку такие процедуры специфичны для каждого инструмента, они не будут описываться в этой статье.
- Определите интересующие участки ткани, которые необходимо проанализировать. Расположите анализируемую зону в центре видеоприбора и соберите спектры комбинационного рассеяния света со следующими параметрами: используется лазер 785 нм при 30 мВт, время интегрирования: 20 с повторено 3 раза, спектральный диапазон: 350-1800 см-1, решетка 1200 линий/мм.
- Соберите 10 спектров встраиваемой смолы с теми же параметрами комбинационного рассеяния света и усредните их. Используйте это для вычитания вклада смолы на шаге 7.6.
- Предварительная обработка спектров для удаления вклада флуоресценции, шума и смолы выполняется следующим образом: коррекция базовой линии с помощью пятипорядкового полиномиального аппроксимирования, фильтр Савицкого-Голе со степенью 4 и размером окна от 17 до 21, цифровое вычитание смолы с использованием пика смолы ~812 см-1 . Такая предварительная обработка может быть выполнена с помощью различного программного обеспечения, предназначенного для анализа и визуализации данных.
- Дальнейший анализ предварительно обработанных спектров для извлечения ценных параметров путем нормирования пиковой интенсивности интересующей вибрации с пиковой интенсивностью опорной вибрации. Например, для анализа кости используйте следующие параметры для его вычисления.
- Отношение минералов к матрице: разделите пиковую интенсивность колебаний v1PO4 на ~960 см-1 на пиковую интенсивность колебательных мод амида I (~1668 см-1), амида III (~1250 см-1), CH2-wag (~1450 см-1) или суммы колебательных мод пролина (~854 см-1) и гидроксипролина (Hyp, ~872 см-1). v2PO4, расположенный на ~430 см-1, или v4PO4, расположенный на ~600 см-1, также может использоваться и соотносить с Amide III vibration20. Эти параметры представляют собой степень минерализации органической фазы костного матрикса.
- Карбонат/фосфат: разделите пиковую интенсивность v1CO3, расположенного на ~1070 см-1, на v1PO4. Это представляет собой величину замещения карбоната типа B в решетке апатита. Hyp/Pro, представляет содержание гидроксипролина, ~1375 см-1/амид III, представляет содержание протеогликанов, ~1150 см-1/CH2-wag и ~1495 см-1/CH2-wag, представляет количество конечных продуктов гликирования карбоксимелицина и пентозидина, 1670 см-1/1690 см-1 и 1670 см-1/1640 см-1 представляют собой неупорядоченную вторичную структуру коллагена, также известную как коллагеновая зрелость, и упорядоченные структуры в виде α-спирали в коллагене I типа соответственно.
- Оцените воспроизводимость рамановских измерений, исследуя одну и ту же область интереса в 5 последовательных измерениях (по одной регистрации в день). Для каждого анализируемого параметра дисперсия была ниже 0,2% от значения параметра, что обеспечивает хорошую воспроизводимость. Специфика каждого исследуемого пика широко обсуждалась в полевых условиях, и обзор представлен в недавнем обзоре Unal21.
8. Наноиндентирование
ПРИМЕЧАНИЕ: Из-за деструктивной природы наноиндентирования, оно обычно выполняется в конце процедуры анализа образца. Система наноиндентирования, которой мы владеем, оснащена пирамидальным алмазным индентором Берковича. Тем не менее, существует несколько форм инденторов, и в литературе не было достигнуто консенсуса по образцам костей или биоматериалов.
- Гидратируйте внедренный костный образец в физиологическом растворе в течение 16 ч в режиме ЛТ перед испытанием наноиндентированием.
- Откалибруйте систему наноиндентирования с помощью плавленого диоксида кремния и запишите полученный модуль индентирования. Для плавленого диоксида кремния модуль вдавливания составляет примерно 72 ГПа при коэффициенте Пуассона 0,17.
- После калибровки системы наноиндентирования поместите образец, используемый для комбинационного анализа, в оптическую систему устройства для наноиндентирования, чтобы указать места, где будет выполняться наноиндентирование.
ПРИМЕЧАНИЕ: Этот метод варьируется от одного оборудования к другому; Мы не подробно описываем, как работает система наноиндентирования и программное обеспечение, но даем общие советы о различных шагах, которые следует выполнить. - После того, как выбрано место наноиндентирования, переместите образец под устройство для индентирования и выполните индентирование. Выполняйте наноиндентирование на постоянной глубине 900 нм, со скоростью загрузки/разгрузки 40 мм/мин и паузой 15 с между загрузкой и разгрузкой. Установите коэффициент Пуассона для костной ткани равным 0,3.
- Извлеките различные параметры из кривых наноиндентирования и вычислите их в соответствии с теорией Оливера и Фарра22.
- Модуль вдавливания (EIT) выводится из известных свойств наконечника вдавливания и приведенного модуля упругости и сочетает в себе локальный модуль упругости образца. Вычисление отступов следующим образом:
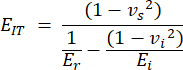
Где vs,v i, Ei и Er представляют коэффициент Пуассона образца, принятый равным 0,3 для кости, коэффициент Пуассона алмазного индентора, принятый равным 0,07, модуль упругости алмазного индентора, зафиксированный на уровне 1140 ГПа, и приведенный модуль, рассчитанный как: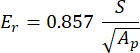
Где S представляет собой наклон разгрузочного сегмента, а Ap — прогнозируемую площадь и вычисляется как: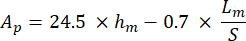
- Твердость (HIT): соответствует устойчивости кости к возникновению и распространению трещин. Другими словами, это показатель прочности костей. Compute HIT как:

- Скорость ползучести вдавливания (CIT): Отражает деформацию кости с течением времени при постоянной нагрузке, указывающую на вязкоупругие свойства образца, рассчитывается как:
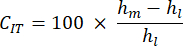
- Максимальная нагрузка (Lm): Это соответствует противоположной нагрузке, необходимой для проникновения на указанную глубину в минерализованный костный матрикс.
- Вдавливание (Wplast): Соответствует площади под кривой деформации нагрузки/разгрузки. Это прямое отражение энергии, рассеиваемой для индуцирования пластической деформации.
ПРИМЕЧАНИЕ: Воспроизводимость наноиндентирования сложнее оценить на образцах кости из-за деструктивного характера этой методологии. Тем не менее, мы оценили воспроизводимость стандартного и однородного образца плавленого диоксида кремния. Для всех вышеуказанных параметров дисперсия была оценена ниже 0,26% (5 последовательных измерений в течение 5 отдельных дней), что свидетельствует об очень хорошей воспроизводимости. С другой стороны, из-за анизотропной природы образцов костей оценить их воспроизводимость сложнее.
- Модуль вдавливания (EIT) выводится из известных свойств наконечника вдавливания и приведенного модуля упругости и сочетает в себе локальный модуль упругости образца. Вычисление отступов следующим образом:
Access restricted. Please log in or start a trial to view this content.
Результаты
Микрокомпьютерная томография экспланта показана на рисунке 2. Использование ручной сегментации не может оптимально отделить кость от цемента, присутствующего в центральном канале, с помощью глобального порога. Чтобы улучшить распознавание трабекул?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Восстановление костных дефектов является основной задачей в регенеративной медицине для восстановления подвижности, уменьшения боли и улучшения качества жизни пострадавших людей. Использование эксплантных моделей дает ряд преимуществ по сравнению с исследования?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы хотим поблагодарить технические средства, участвующие в сборе и обработке образцов, в том числе SC3M (SFR Francois Bonamy (UMS 016), University of Nantes), SFR ICAT (University of Angers), BIO3, HiMolA и SC4BIO. Inserm UMR_S 1229 RMeS поддерживается грантами правительства Франции через учреждения Inserm, Nantes Université, Univ Angers и Oniris VetAgroBio. CL также благодарна компании HTL Biotechnology.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.20 filters | VWR | 28145-501 | |
| 18 G needle (1,2x40 mm) | Sterican | 4665120 | |
| 3 mL syringe | HENKE-JECT | 8300005762 | |
| 37% hydrochloric acid | VWR | 1.00317.1000 | |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acetone | VWR | 20063-365 | |
| Alcian Blue 8GX | VWR | 361186 | |
| Ammonium hydroxide | VWR | 318612 | |
| Apatitic tricalcium phosphate | Centre for Biomedical and Healthcare Engineering (Mines Saint Etienne, France) | TV26U | |
| Azophloxine | Sigma | 210633 | |
| Benzoyl peroxide | Sigma | 8.01641.0250 | |
| BMP2 | Medtronic | InductOs 1.5 mg/mL | |
| Brillant crocein | Aldrich | 2107507 | |
| CTVox | Bruker | - | |
| DataViewer | Skyscan | - | |
| Diamond blade | Struers | MOD13 | |
| Diamond saw | Struers | Accutom-50 | |
| DiaPro Mol B3 diamond solution | Struers | 40600379 | |
| DiaPro Nap B1 diamond solution | Struers | 40600373 | |
| Dibasic sodium phosphate (Na2HPO4) | Sigma | 102404598 | |
| Dibutyl Phtalate | Chimie-Plus Laboratoires | 28656 | |
| DragonFly software | ORS | 2022.1.0.1231. | |
| Dulbecco's Modified Eagle Medium (DMEM) high glucose, GlutaMAX(TM), pyruvate | ThermoFisher Scientific | 31966-021 | |
| Eosine Y- Surgipath | Sigma | 1002830105 | |
| Erythrosin B | Sigma | 102141057 | |
| Ethanol absolute | VWR | 20820362 | |
| Eukitt | Dutscher | 6.00.01.0003.06.01.01 | |
| Falcon 50 mL | Sarstedt | 62.547.254 | |
| Ferric chloride hexahydrate (FeCl3, 6H2O) | Merck | 1.03943.0250 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF00 | |
| Fuchsine acid | Merck | 1.05231.0025 | |
| Hank's Balanced Salt Solution (HBSS) | Biosera | MS01NG100J | |
| Hematoxylin | Sigma | 86.118.9 | |
| Isostatic press | Nova Suisse | Pmax 1500 bars | |
| Laser diffraction granulometry | Malvern | Mastersizer 3000 | |
| Light green | Prolabo | 28947135 | |
| Lithium carbonate | Sigma | A13149 | |
| MD-Mol polishing cloth | Struers | 40500077 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylmethacrylate | Sigma | 8.00590.2500 | |
| Micro-CT, micro-scanner | Bruker | Skyscan 1272 | |
| Monobasic sodium phosphate (NAH2PO4) | Sigma | 71496 | |
| Mortar | Fritsch | Pulverisette 6 | |
| N,N, Dimethylanilin | Sigma | 803060 | |
| Nanoindentation station | Anton Paar | NHT2 | |
| ND-Nap polishing cloth | Struers | 40500080 | |
| OATS Osteochondral Autograft Transfer System Set, 4,75 mm | Arthrex | AR-1981-04S | |
| OATS Osteochondral Autograft Transfer System Set, 8 mm | Arthrex | AR-1981-08S | |
| Orange G | Ral | M15 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Peel-a-way disposable embbedding moulds | Polysciences, Inc | 18646C-1 | |
| Penicillin/Streptomycin (P/S) | ThermoFisher Scientific | 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| Phosphomolybdic acid | Sigma | 221856-100 g | |
| Phosphotungstic acid | Aldrich | 12863-5 | |
| Polishing machine | Sturers | Dap V | |
| Poupinel | MEMMERT | TV26U | |
| Raman microspectrometer | Renishaw | InVia Qontor | |
| Safran du Gâtinais | Labonord | 11507737 | |
| Scanning electron microscope | Carl Zeiss | Evo LS 10 | |
| SEM | Zeiss | Carl Zeiss Evo LS10 | |
| SiC foils/Grinding papers | Struers | 40400008 (#320), 40400011 (#1000), 40400122 (#2000), 40400182 (#4000) | |
| Silver paint | Electron microscopy sciences | 12686-15 | |
| Standard stub with Faraday cup, carbon, aluminium and silicon standards | Micro-Analysis Consultants Ltd | 8602 | |
| T25 flask | Corning | 430639 | |
| Xylene | VWR | 28975.325 | |
| Xylidine Ponceau | Aldrich | 19.976-1 |
Ссылки
- Feroz, S., Cathro, P., Ivanovski, S., Muhammad, N. Biomimetic bone grafts and substitutes: A review of recent advancements and applications. Biomed Eng Adv. 6, 100107(2023).
- Tsuji, K., et al. BMP2 activity, although dispensable for bone formation, is required for the initiation of fracture healing. Nat Genet. 38 (12), 1424-1429 (2006).
- Hadjidakis, D. J., Androulakis, I. I. Boneremodeling. Ann N Y Acad Sci. 1092, 385-396 (2006).
- Boivin, G., Meunier, P. J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcified Tiss Int. 70 (6), 503-511 (2002).
- Boivin, G., et al. Influence of remodeling on the mineralization of bone tissue. Osteoporo Int. 20 (6), 1023-1026 (2009).
- Zanghellini, B., et al. Multimodal analysis and comparison of stoichiometric and structural characteristics of parosteal and conventional osteosarcoma with massive sclerosis in human bone. J Str Biol. 216 (3), 108106(2024).
- Trento, G., et al. formation around two titanium implant surfaces placed in bone defects with and without a bone substitute material: A histological, histomorphometric, and micro-computed tomography evaluation. Clin Implant Dent Relat Res. 22 (2), 177-185 (2020).
- Palmquist, A. A multiscale analytical approach to evaluate osseointegration. J Mater Sci Mater Med. 29 (5), 60(2018).
- Budán, F., et al. Novel radiomics evaluation of bone formation utilizing multimodal (SPECT/X-ray CT) in vivo imaging. PLoS ONE. 13 (9), e0204423(2018).
- Hulsart-Billström, G., et al. A surprisingly poor correlation between in vitro and in vivo testing of biomaterials for bone regeneration: results of a multicentre analysis. Eur Cells Mater. 31, 312-322 (2016).
- Cramer, E. E. A., Ito, K., Hofmann, S. Ex vivo bone models and their potential in preclinical evaluation. Curr Osteoporo Rep. 19 (1), 75-87 (2021).
- Chan, M. E., et al. A trabecular bone explant model of osteocyte-osteoblast co-culture for bone mechanobiology. Cell Mol Bioeng. 2 (3), 405-415 (2009).
- Doke, S. K., Dhawale, S. C. Alternatives to animal testing: A review. Saudi Pharma J. 23 (3), 223-229 (2015).
- Moussi, H., et al. New formulation of injectable and degradable calcium phosphate/silanized hyaluronic acid composite foam: Investigation in a rabbit model of long bone defect. SSRN. , (2024).
- Paré, A., et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta Biomater. 154, 626-640 (2022).
- Roschger, P., Fratzl, P., Eschberger, J., Klaushofer, K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone. 23 (4), 319-326 (1998).
- Roschger, P., Plenk, H., Klaushofer, K., Eschberger, J. A new scanning electron microscopy approach to the quantification of bone mineral distribution: backscattered electron image grey-levels correlated to calcium K alpha-line intensities. Scanning Micro. 9 (1), 75-86 (1995).
- Porter, A., et al. Quick and inexpensive paraffin-embedding method for dynamic bone formation analyses. Sci Rep. 7, 42505(2017).
- Goldschlager, T., Abdelkader, A., Kerr, J., Boundy, I., Jenkin, G. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis. J Vis Exp. (35), e1707(2010).
- Kazanci, M., Roschger, P., Paschalis, E. P., Klaushofer, K., Fratzl, P. Bone osteonal tissues by Raman spectral mapping: Orientation-composition. J Str Biol. 156 (3), 489-496 (2006).
- Unal, M., Ahmed, R., Mahadevan-Jansen, A., Nyman, J. S. Compositional assessment of bone by Raman spectroscopy. Analyst. 146 (24), 7464-7490 (2021).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. J Mater Res. 7 (6), 1564-1583 (1992).
- Proffen, B. L., McElfresh, M., Fleming, B. C., Murray, M. M. A comparative anatomical study of the human knee and six animal species. Knee. 19 (4), 493-499 (2012).
- Allen, M. J., Houlton, J. E. F., Adams, S. B., Rushton, N. The surgical anatomy of the stifle joint in Sheep. Vet Surg. 27 (6), 596-605 (1998).
- Kleuskens, M. W. A., van Donkelaar, C. C., Kock, L. M., Janssen, R. P. A., Ito, K. An ex vivo human osteochondral culture model. J Ortho Res. 39 (4), 871-879 (2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены