JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Ex vivo 모델에서 조직 광물화의 포괄적인 특성 분석
요약
제안된 프로토콜은 다중 모드 분석을 사용하여 뼈 재생의 맥락에서 뼈 형성을 평가하기 위한 글로벌 접근 방식을 수반합니다. 새로운 뼈 형성에 대한 정성적 및 정량적 정보를 제공하여 기초 및 전임상 조사의 엄격성과 타당성을 향상시키는 것을 목표로 합니다.
초록
뼈 재생의 맥락에서 조직 무기질화의 광범위한 특성 분석은 현재 분석에 사용할 수 있는 수많은 양식을 고려할 때 중요한 도전입니다. 여기에서는 관련 대형 동물 골 ex vivo explant를 사용하여 새로운 뼈 형성을 종합적으로 평가하기 위한 워크플로우를 제안합니다. 뼈 결손(직경 = 3.75mm, 깊이 = 5.0mm)은 이식된 양의 대퇴골두에서 생성되고 골형성 촉진 성장 인자(뼈 형태 형성 단백질 2 - BMP2)가 로드된 거대다공성 골 대체품이 주입됩니다. 그 후, 외식물은 28일 동안 배양된 상태로 유지되어 세포 집락화와 후속 뼈 형성을 가능하게 합니다. 새로 광물화된 조직의 품질과 구조를 평가하기 위해 다음과 같은 연속적인 방법을 설정합니다: (i) micro-CT를 사용하여 전체 explant의 특성화 및 고해상도 3D 이미지, 광물화된 조직의 식별을 강화하기 위한 딥 러닝 이미지 분석; (ii) 새로 형성된 조직의 기계적 특성을 결정하기 위한 나노 압흔; (iii) Hematoxylin/Eosin/Saffron (HES), Goldner의 삼색화 및 Movat의 펜타크롬과 같은 조직학적 검사는 특히 파골장벽의 시각화 및 뼈 세포의 존재와 관련하여 광물화된 조직의 정성적 평가를 제공합니다. (iv) 광물화 정도를 정량화하고 표면 형태, 광물 조성 및 뼈-생체 재료 계면에 대한 자세한 통찰력을 제공하기 위해 내부 참조를 사용한 후방 산란 주사 전자 현미경(SEM) 매핑; (v) 광물화된 매트릭스의 분자 조성을 특성화하고 펩타이드 결합 검출을 통해 시멘트 내 BMP2의 지속성에 대한 통찰력을 제공하기 위한 라만 분광법. 이 다중 모드 분석은 새로 형성된 뼈에 대한 효과적인 평가와 광물화된 조직에 대한 포괄적인 정성적 및 정량적 통찰력을 제공합니다. 이러한 프로토콜의 표준화를 통해 우리는 연구 간 비교를 촉진하고 연구 결과의 타당성과 신뢰성을 향상시키는 것을 목표로 합니다.
서문
외상, 종양 절제, 선천성 기형 또는 감염으로 인한 뼈 결손은 재생 의학에 큰 도전 과제입니다. 이러한 변화는 골격계의 구조적 무결성을 손상시켜 불편함, 기능 장애 및 환자의 삶의 질 저하로 이어집니다.
이러한 문제를 극복하기 위해 골형성 및 뼈 조직 재생을 향상시키는 데 중점을 둔 혁신적인 뼈 복구 전략이 등장했습니다. 이러한 접근법에는 자연 유래(예: 바이오 원료 거대분자, 동물 유래 하이드록시아파타이트) 또는 합성(예: 바이오 안경, 인산칼슘)일 수 있는 이식형, 주사형 또는 3D 프린팅 가능한 뼈 대체품의 사용이 포함됩니다1. 뼈 재생을 유도하고 자극하는 낮은 선천적 능력을 향상시키기 위해 뼈 대체물에는 뼈 형태 형성 단백질(BMP)과 같은 골유도 인자를 로드하여 전구 세포의 골형성 분화를 촉진하고 뼈 형성을 향상시킬 수 있습니다2.
뼈 형성은 콜라겐 매트릭스의 초기 형성을 기반으로 하며, 이 매트릭스는 하이드록시아파타이트 결정에 의해 광물화되어 뼈 구조를 강화합니다3. 이 과정은 뼈에 특정한 강성과 강도를 부여합니다. 광물화된 조직의 품질은 미세구조적 특성과 광물화 정도에 의해 복잡하게 좌우된다4. 이 품질은 뼈 치유와 재생된 뼈의 기능에 중추적인 역할을 합니다5. 그러나 뼈 무기질화를 특성화하는 것은 다변량 연구 전반에 걸쳐 내재된 변동성으로 인해 여전히 어려운 과제로 남아 있습니다 6,7,8.
또한, 뼈 이식편 대체물의 생체 적합성, 세포 적합성 및 분화 가능성에 대한 초기 평가는 일반적으로 시험관내에서 수행됩니다. 그러나 방법론적 차이는 결과의 원활한 비교를 방해합니다. 더욱이, 이러한 in vitro 연구는 뼈 재생 과정을 조절하는 데 필수적인 골수 세포를 포함한 세포 집단 간의 다세포 상호 작용 및 복잡한 대화를 완전히 포착하지 못합니다9. 뼈 미세환경에 대한 이러한 정확한 표현의 부족은 후속 전임상 연구의 정확성을 손상시킬 수 있다10.
in vivo 평가는 생리학적 맥락을 보다 정확하게 표현하지만 윤리적, 물류적, 재정적 고려 사항으로 인해 제약을 받습니다. 결과적으로, 체외 평가는 in vitro 연구와 in vivo 연구 사이의 인터페이스로서 중추적인 역할을 하며, 살아있는 피험자에 대한 실험으로 이동하기 전에 필요한 중간 단계 역할을 합니다 11,12,13.
이러한 맥락에서, 재생된 뼈 조직의 품질을 평가하고 전임상 모델로 이동하기 전에 전략의 관련성을 보장하기 위해 포괄적인 특성화 방법론의 구현이 필요합니다. 결과적으로, 우리는 양의 무릎 관절 조직을 이용한 외식(explant) 모델의 분석을 기반으로 한 프로토콜을 제안합니다. 이 혁신적인 방법론에는 BMP2가 함유된 시멘트를 외식에 주입하고 배양 28일 후 조직 광물화에 대한 자세한 분석을 수행하는 것이 포함됩니다.
이 연구에서 사용된 기술적 접근 방식은 다양하고 상호 보완적이며, 재생된 뼈 조직의 품질을 평가하기 위한 포괄적인 접근 방식을 총체적으로 제공합니다(그림 1). 고해상도 마이크로 CT 이미징을 통해 뼈 구조의 상세한 3D 시각화를 가능하게 하여 새로 형성된 조직의 미네랄 밀도, 형태 및 무결성에 대한 귀중한 통찰력을 얻을 수 있습니다. 이 기술은 뼈 재생의 효능을 평가하고 시간 경과에 따른 광물화 진행을 모니터링하는 데 중요합니다. 나노인덴테이션은 조직의 경도 및 강도와 같은 조직의 기계적 특성을 결정하기 위한 정확한 접근 방식입니다. 나노미터 규모로 가해지는 힘에 대한 재료의 반응을 측정함으로써 이 방법을 통해 광물화된 조직의 견고성과 품질을 평가할 수 있습니다. hematoxylin/eosin/saffron (HES), Goldner's trichrome 및 Movat's pentachrome과 같은 일반적인 염색을 사용한 조직학적 검사는 조직 구조 및 구성에 대한 귀중한 통찰력을 제공합니다. 이러한 염색을 통해 세포, 세포외 기질 및 미네랄 침전물을 포함한 다양한 조직 구성 요소를 분화할 수 있으므로 뼈 재생 과정에 대한 포괄적인 정성적 평가가 가능합니다. 후방 산란 주사 전자 현미경(SEM) 매핑은 샘플 표면의 고해상도 시각화를 제공하여 뼈 매트릭스의 광물화 정도와 이식된 재료와 숙주 조직 간의 인터페이스를 자세히 분석할 수 있습니다. 마지막으로, 라만 분광법은 특히 단백질, 지질 및 미네랄과 같은 특정 구성 요소의 식별을 통해 조직의 분자 조성에 관한 정보를 제공합니다. 이 접근법은 광물화된 매트릭스의 특성화와 BMP2와 같은 성장 인자의 검출을 가능하게 하여 재생 매체에서 골형성 자극의 지속성에 대한 중요한 정보를 제공합니다.
본 연구는 다양한 분석 기법을 통합한 다학제적 접근 방식을 사용하여 재생된 뼈 조직의 품질에 대한 철저하고 포괄적인 평가를 제공하는 것을 목표로 하며, 따라서 뼈 이식 대체물 평가 및 잠재적인 임상 적용을 위한 견고한 기반을 제공하는 것을 목표로 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 연구는 윤리 및 동물 복지 위원회와 프랑스 국립 수의학 식품국(National Veterinary and Food Administration)의 번호 G44171에 의해 승인되었습니다.
1. 골연골 외식의 준비 및 배양
- 무균 환경에서 갓 안락사된 동물로부터 양 관절 표본을 채취합니다. 양을 누운 자세로 놓고 왼쪽 뒷다리를 면도합니다. 무릎 관절 주위를 알코올로 소독하여 준비합니다. 외측 슬개골 관절 절개술을 사용하여 전방 및 후방 십자인대를 노출시킨 다음 슬개골 탈구를 사용하여 대퇴 트로클레를 드러냅니다.
- 조직 채취 후 골연골 자가이식편 전달 시스템을 사용하여 외측 과두에 4.75mm 직경의 결손을 생성합니다.
- 정형외과 해머를 사용하여 10mm 깊이의 결함을 만들고 과두에서 외과를 회수합니다. 그 후, 골연골 자가이식 전달 시스템을 사용하여 첫 번째 결함을 중심으로 직경 8mm의 두 번째 결함을 수행합니다. 이를 통해 4.75mm x 10.0mm의 중심 결함을 포함하는 8mm x 10mm 크기의 골연골 외식이 생성됩니다.
- 물류상의 이유로 필요한 경우, 1% 페니실린-스트렙토마이신이 보충된 Hank's Balanced Salt Solution(hBSS)으로 배설물을 운반하고 4°C에서 보관합니다.
- 인산염 완충 식염수(PBS)로 외식물을 3번 헹구고 4.75μg/mL의 BMP2가 보충된 인산칼슘 시멘트로 4.75mm x 10.0mm 결함을 주입합니다. 아래 설명에 따라 시멘트를 준비합니다.
- 1364 °C에서 최소 12 시간 동안 apatitic tricalcium phosphate rods (120 MPa에서 등압 프레스)로 α 인산 삼 칼슘 (α-TCP)을 생산 한 다음 공기 담금질14.
- 500rpm에서 5분 동안 유성 밀 볼로 절대 에탄올에 α-TCP 로드를 2번 갈아서 13.1 ± 1.7μm의 미세한 분말을 생성합니다(이전에 설명한 대로 레이저 회절을 사용하여 측정14).
- α-TCP 분말을 180°C에서 45분 동안 건조 가열하여 살균합니다. α-TCP 분말을 2.5%(w/v) Na2HPO4 0.22 μm 여과 용액(액체/분말 비율 0.35)과 1분 동안 혼합하여 인산칼슘 시멘트를 준비합니다.
- 18G 바늘을 사용하여 주입하기 전에 시멘트 페이스트를 3mL 주사기에 로드합니다.
- 실온(RT)에서 10분 후 외식을 25cm² 플라스크에 옮기고 10% 소 태아 혈청과 1% 페니실린-스트렙토마이신이 보충된 Dulbecco's Modified Eagle Medium(DMEM) 고포도당으로 구성된 완전 배양 배지 10mL를 부드럽게 추가합니다.
- 5%CO2 가 있는 37°C 인큐베이터에서 최대 28일 동안 explant를 유지하고 층류 후드 아래에서 2일마다 전체 배양 배지를 교체합니다.
- PBS로 외식물을 3번 헹굽니다. 50mL 튜브에 옮기고 20mL의 4% 파라포름알데히드(PFA)를 첨가하고 4°C에서 3일 동안 유지합니다. 그런 다음 PBS로 외식물을 헹구고 후속 분석 전에 70% 에탄올에 보관합니다.
2. Micro-CT 분석
- micro-CT X-ray를 사용하여 micro-tomography 분석을 수행합니다. 1200ms의 노출 시간과 1mm 알루미늄 필터(80kV 및 125μA)로 10.7μm 해상도로 X선 투영을 획득합니다. 신호 대 잡음비를 향상시키기 위해 0.45° 회전할 때마다 3개의 이미지를 평균화합니다.
- 참조 스캔으로 X/Y 정렬 후 제조업체의 재구성 소프트웨어를 사용하여 스무딩: 0, 링 아티팩트: 3, 빔 경화: 35% 매개변수를 사용하여 3차원(3D) 이미지를 재구성합니다. 이미지 처리 소프트웨어로 이미지 스택을 청소하고 2차원(2D) 및 3D 시각화 도구로 관찰합니다.
3. 딥러닝 이미지 분석
- 전용 전문 소프트웨어를 사용하여 이미지 분할을 수행합니다. 통합 분할 마법사를 사용하여 뼈 및 시멘트 구별을 위한 딥러닝 모델을 훈련시킬 수 있습니다.
- 재구성된 micro-CT 이미지에서 뼈, 시멘트 및 배경을 포함하는 대표 영역(즉, 프레임)을 선택합니다. 이 첫 번째 프레임은 소프트웨어에서 제공하는 간단한 도구(예: 임계값) 또는 강력한 도구(예: 전파)를 사용하여 수동으로 분할합니다.
- 모델 탭에서 딥 러닝 모델을 생성하고 드롭다운 메뉴에서 3D-Unet 루틴 을 선택합니다. 생성된 모델을 마우스 오른쪽 버튼으로 클릭하여 분석할 이미지와 adequation에서 실험 매개변수를 정의합니다. 여기: 깊이 5, 패치 크기 32 x 32, Adadetla 알고리즘, 보폭 비율 0.25, 데이터 증강 x10.
- 분할된 프레임을 사용하여 딥 러닝 루틴을 훈련시키며(Train Button 클릭), 이는 빠르고 정확한 이미지 분할 기능 3,15과 관련이 있는 것으로 인정됩니다. 훈련이 완료되면 두 번째 작업 영역(프레임)을 정의하고 predict 함수를 사용하여 자동으로 분할합니다.
- 보다 정확한 학습 데이터를 생성하기 위해 필요한 경우 수동 수정을 적용합니다. 다시 한 번 루틴을 훈련하십시오. 만족스러운 결과를 얻을 때까지 이 과정을 반복하십시오. 데이터 증강의 수는 훈련 프레임의 수가 증가함에 따라 점진적으로 감소합니다.
참고: 모델 학습 중에 제공된 DICE 인덱스는 입력 정보와 비교하여 모델의 정확도를 나타내지만 충분하지는 않습니다. 모델의 관련성 확인은 3명의 독립적인 노련한 연구원에 의해 자동으로 분할된 데이터의 검증을 통해 수행되어야 합니다.
- 보다 정확한 학습 데이터를 생성하기 위해 필요한 경우 수동 수정을 적용합니다. 다시 한 번 루틴을 훈련하십시오. 만족스러운 결과를 얻을 때까지 이 과정을 반복하십시오. 데이터 증강의 수는 훈련 프레임의 수가 증가함에 따라 점진적으로 감소합니다.
- Export 버튼을 클릭하여 모델을 게시하고 Segment > Exported Model > Segment Full Dataset를 클릭하여 전체 micro -CT 데이터 세트에 적용합니다.
4. 임베딩
- 70% 아세톤과 30% 자일렌으로 구성된 25mL의 탈수 용액이 들어 있는 40mL 유리 바이알에 넣어 뼈 절출물을 탈수합니다. 유리 바이알을 RT에서 1시간 동안 회전하는 휠에 놓고 이 단계를 3번 반복합니다.
- 탈수 용액을 25mL의 자일렌으로 교체하고 유리 바이알을 RT에서 1시간 동안 회전 휠에 놓습니다.
- 크실렌 용액을 10% 과산화벤조일(BPO) 및 10% 디부틸 프탈레이트(DBP)가 함유된 25mL의 MMA(메틸메타크릴레이트)로 교체합니다. RT에서 1시간 동안 회전 휠에 놓고 이 단계를 2번 반복합니다.
- MMA 용액을 10% BPO, 10% DBP 및 450μL의 N, N 디메틸아닐린으로 농축된 25mL의 MMA로 propan-2-ol에서 1:20으로 희석합니다. 유리 바이알을 -20 °C에서 밤새 둡니다. 용액이 황색을 띱니다.
- 익스플랜트를 중간 크기의 임베딩 몰드에 넣고 MMA-BPO-DBP-N, N 아닐린을 몰드에 붓습니다. 금형을 플라스틱 상자에 넣고 5분 동안 질소 흐름으로 환기시킵니다. 상자를 완전히 닫고 MMA 중합 및 경화를 위해 48시간 동안 4°C에 둡니다.
- 금형에서 엑스플랜트를 함유한 수지를 제거하고 후속 분석을 위해 처리될 때까지 4°C에서 유지합니다.
5. 주사전자현미경(SEM) - 정량적 후방산란 전자 이미징(qBEI)
- 장축을 따라 다이아몬드 톱으로 외식물이 포함된 pMMA 블록을 자릅니다. 조직학적 분석을 위해 블록의 전반부를 보관합니다. 나머지 절반을 더 잘라 1.5mm 두께의 단면을 만듭니다. 3000mm/min 속도로 3rpm에서 절단을 수행합니다.
- 낮은 입자 크기에 해당하는 오름차순 숫자로 실리콘 카바이드 종이로 단면을 연마합니다: 320초 동안 SiC 1000, 15초 동안 SiC 2000, 30초 동안 SiC 4000.
- 다이아몬드 페이스트와 특정 옷으로 단면을 연마하십시오 : 3 μm Mol B3 다이아몬드 용액으로 1 분 동안 연마 천을 닦고 1 μm Nap B1 다이아몬드 용액으로 양털 천을 1 분 동안 연마합니다.
- 이중 증류수로 섹션을 헹구고 면봉으로 다이아몬드 입자를 닦아냅니다. 질소 가스 아래의 부분을 건조시킵니다.
- 두꺼운 부분(10nm 탄소막 두께)을 카본으로 코팅하고 은색 페인트로 알루미늄 스터브에 장착합니다. 단면 상단과 스텁 사이에 은색 페인트 다리를 만들어 전자 충전이 지면으로 배출될 수 있도록 합니다.
- 스텁을 SEM 스테이지에 놓습니다. 샘플 옆에 탄소, 알루미늄 및 실리콘 표준물질이 있는 패러데이 컵으로 구성된 제어 스텁을 SEM 챔버에 삽입합니다. 이것은 전자빔을 보정하고 회색 수준을 Ca의 백분율로 변환하는 데 사용됩니다. SEM 챔버를 닫고 진공합니다.
- 전자빔을 켜고 후방 산란 전자 모드에서 실행되도록 SEM 매개변수를 조정합니다. 후방 산란 이미지에서 탄소 표준의 그레이 레벨은 25, 알루미늄 표준은 225, 실리콘 표준은 253입니다. 참고로, 사용된 시스템에서 SEM 매개변수는 가속 전압 20keV, 패러데이 컵으로 측정한 프로브 전류: 250pA, 작동 거리: 15mm, 조리개: 30μm, 이미지 해상도: 1024 x 768 픽셀, 진공: < 4.10-4 Pa, 체류 시간 100μs/픽셀, 밝기 ~38 및 대비 ~72입니다.
- SEM이 표준물질로 보정되면 후방 산란 전자 모드에서 시편의 이미지를 획득합니다.
- Roschger et al.16에 설명된 대로 표본의 후방 산란 전자 이미지를 사용하여 회색 수준을 칼슘 함량으로 변환합니다. 이미지 분석 소프트웨어를 사용하여 이 작업을 수행합니다.
- 칼슘 함량의 분포를 플로팅합니다. 칼슘 함량 분포는 가우스 분포를 보여줍니다. 관심 있는 세 가지 주요 매개변수가 계산됩니다: Ca평균은 이미지의 평균 칼슘 함량으로, Ca피크 는 이미지에서 가장 빈번한 칼슘 농도로, Ca너비 는 칼슘 함량 분포의 절반 최대값에서 전체 너비로 계산됩니다.
참고: qBEi의 재현성은 연속 5일(하루에 한 번 획득) 동안 동일한 관심 영역을 이미징하여 조사되었습니다. 이것은 전자 빔이 세션 사이에 켜지고 꺼졌다는 것을 의미합니다. Ca평균, Ca피크 및 Cawidth의 오차 비율은 각각 0.5%, 0.7% 및 1.2%로 추정되었습니다. 칼슘 함량은 또한 에너지 분산 X선 분석(EDS)으로 조사되었습니다. EDS에 의해 추정된 Ca평균 과 칼슘 함량 사이에는 R² 값이 0.99로 매우 양호한 선형 관계가 설정되었으며, 이는 Roschger et al. 이전에17에서 얻은 데이터와 유사합니다.
6. 조직학
- 각 샘플에 대해 텅스텐 블레이드 18,19가 있는 경질 조직 마이크로톰을 사용하여 7μm 절편을 절단합니다. 자동 염색 시스템을 사용하여 Goldner trichrome, HES 및 MOVAT 염색으로 단면을 염색합니다.
- 탈플라스틱화(deplastification)를 위해 샘플을 아세톤에 연속적으로 5분 동안 담그고 2회 반복합니다. 샘플을 증류수로 5분 동안 헹구고 2회 반복합니다.
- 아래 설명된 대로 Goldner Trichrome 착색을 수행합니다.
- Weigert 페릭 헤마톡실린에 샘플을 20분 동안 넣습니다. 수돗물로 씻으십시오. 샘플을 0.5% 산성 알코올에 30초-1분 동안 담그십시오. 수돗물로 20분 동안 씻으십시오.
- Ponceau/fuchsine acid/azophloxin 용액에 샘플을 5분 동안 넣습니다. 1% 아세트산에 1분 동안 담그십시오.
- 포스포모릴브딕산/오렌지 G 용액으로 20분 동안 염색합니다. 1% 아세트산에 1분 동안 담그십시오.
- 빠른 녹색 용액으로 실온에서 15분 또는 60°C에서 8분 동안 염색합니다. 수돗물로 철저히 헹굽니다. 3회 반복합니다.
- 아래 설명된 대로 Movat Pentachrome 채색을 수행합니다.
- Alcian Blue 염색: Alcian Blue 용액에 샘플을 30분 동안 담그십시오. 샘플을 수돗물로 5분 동안 헹굽니다. 샘플을 알칼리 에탄올에 60분 동안 넣습니다. 샘플을 수돗물로 10분 동안 헹굽니다. 증류수로 최종 헹굽니다.
- Weigert Hematoxylin 염색: Weigert의 Ferric Hematoxylin에 샘플을 20-30분 동안 넣습니다. 샘플을 수돗물로 15분 동안 헹굽니다. 증류수로 다시 헹굽니다.
- Crocein Brilliant/fuchsine acid로 염색: Crocein Brilliant/Acid Fuchsin 용액에 샘플을 10분 동안 담급니다. 0.5% 아세트산으로 헹굽니다. 5% 포스포텅스텐산 용액에 샘플을 20분 동안 담그십시오. 0.5% 아세트산으로 2분 동안 헹굽니다. 100% 에탄올로 5분 동안 3회 연속 헹굽니다.
- Safran du Gatinais로 염색: 샘플을 Safran du Gatinais에 15분 동안 놓습니다. 수돗물로 최종 헹굽니다.
- 아래 설명에 따라 HES 착색을 수행합니다.
- Weigert의 Hematoxylin으로 염색: 샘플을 Weigert의 Hematoxylin에 30분 동안 담그십시오. 수돗물로 2분 동안 헹굽니다.
- 탈색: 샘플을 염산 알코올에 10초 동안 담그십시오. 수돗물로 2분 동안 헹굽니다.
- 중화: 샘플을 탄산리튬 용액에 1분 동안 담그십시오. 수돗물로 2분 동안 헹굽니다. 증류수로 1분 동안 최종 헹굽니다.
- Eosin-Erythrosine으로 염색: 샘플을 Eosin-Erythrosine 용액에 3분 동안 넣습니다. 수돗물로 10초 동안 헹굽니다.
- 탈수: 샘플을 95% 알코올에 15초 동안 담그십시오. 15초 동안 100% 알코올로 옮깁니다. 100% 알코올에 30초 동안 담그는 것을 반복합니다.
- 알코올성 사프라닌을 사용한 최종 염색: 샘플을 알코올성 사프라닌에 10분 동안 담그십시오. 수돗물로 최종 헹굽니다.
- 아래 설명에 따라 슬라이드 장착을 수행합니다.
- 샘플을 95% 에탄올, 100% 에탄올, 메틸시클로헥산으로 헹구고 각 단계마다 이 작업을 3번 반복합니다.
- 장착 키트를 사용하여 샘플을 장착하고 커버슬립을 추가합니다. 디지털 슬라이드 스캐너를 사용하여 이미지를 스캔합니다.
7. 라만 미세분광법
- SEM과 라만 분석에 사용되는 것과 동일한 섹션을 사용합니다. 5.2 - 5.3단계에 설명된 대로 섹션을 간단히 연마하고 연마하여 샘플의 열 방출을 방해하는 SEM에 추가된 얇은 탄소 층을 제거합니다.
- 섹션을 s에 놓습니다.tage 라만 마이크로분광계의 경우. 정확도를 보장하기 위해 파수를 보정하고 측정 전에 레이저를 정렬합니다. 이러한 절차는 각 기기에 따라 다르므로 이 문서에서는 설명하지 않습니다.
- 분석이 필요한 조직에서 관심 영역을 찾습니다. 분석할 영역을 비디오 도구의 중앙에 배치하고 30mW에서 785nm 레이저 사용, 통합 시간: 20초 3회 반복, 스펙트럼 범위: 350-1800cm-1, 격자 1200lines/mm 매개변수를 사용하여 라만 스펙트럼을 수집합니다.
- 동일한 Raman 설정으로 임베딩 레진의 스펙트럼 10개를 수집하고 평균화합니다. 이 값을 사용하여 7.6단계에서 레진 기여도를 뺍니다.
- 형광, 노이즈 및 수지의 기여를 제거하기 위해 다음과 같이 스펙트럼을 사전 처리합니다: 5차 다항식 피팅을 사용한 기준선 보정, 차수 4의 Savitzky-Golay 필터, 17에서 21 사이로 구성된 창 크기, 수지의 ~812cm-1 피크를 사용한 디지털 수지 빼기. 이러한 전처리는 데이터 분석 및 시각화를 위해 설계된 다양한 소프트웨어를 사용하여 수행할 수 있습니다.
- 또한 전처리된 스펙트럼을 분석하여 관심 진동의 피크 강도를 기준 진동의 피크 강도로 배분하여 중요한 파라미터를 추출합니다. 예를 들어, 골격 분석의 경우 다음 매개 변수를 사용하여 계산합니다.
- 미네랄 대 매트릭스 비율: ~960cm-1에서 v1PO4 진동의 피크 강도를 Amide I(~1668cm-1), 아미드 III(~1250cm-1), CH2-wag(~1450cm-1) 또는 프롤린(~854cm-1) 및 하이드록시프롤린(Hyp, ~872cm-1) 진동 모드의 합. ~430cm-1에 위치한 v2PO4 또는 ~600cm-1에 위치한 v4PO1도 Amide III vibration 20과 함께 사용하고 비율을 맞출 수 있습니다. 이 매개변수는 뼈 기질의 유기 단계의 광물화 정도를 나타냅니다.
- 탄산염/인산염: ~1cm-3에 위치한 v1CO 1070의 피크 강도를 v1PO4로 나눕니다. 이것은 인회석 격자에서 B형 탄산염 치환량을 나타냅니다. Hyp/Pro는 하이드록시프롤린 함량을 나타내고, ~1375cm-1/Amide III는 프로테오글리칸 함량을 나타내고, ~1150cm-1/CH2-wag 및 ~1495cm-1/CH2-wag는 고급 당화 최종 산물인 카르복시메틸리신 및 펜토시딘, 1670cm-1/1690cm-1 및 1670cm-1/1640cm-1의 양을 나타냅니다. 콜라겐 성숙도라고도 하는 콜라겐의 무질서한 2차 구조와 유형 I 콜라겐에서 각각 α-나선 형태의 정렬된 구조를 나타냅니다.
- 5회 연속 획득(1일 1회 획득)에서 동일한 관심 영역을 검사하여 Raman 측정의 재현성을 평가합니다. 분석된 각 매개변수에 대해 분산은 매개변수 값의 0.2% 미만으로 우수한 재현성을 뒷받침합니다. 조사된 각 피크의 특이성은 이 분야에서 광범위하게 논의되었으며, Unal21의 최근 리뷰에서 개요가 제시되었습니다.
8. 나노인덴테이션
참고: 나노인덴테이션의 파괴적인 특성으로 인해 일반적으로 시료 분석 루틴이 끝날 때 수행됩니다. 우리가 소유한 나노인덴테이션 시스템에는 피라미드형 Berkovitch 다이아몬드 압자가 장착되어 있습니다. 그러나 몇 가지 압자 모양이 존재하며 뼈 또는 생체 재료 표본에 대한 문헌의 합의는 결정되지 않았습니다.
- 나노인덴테이션 테스트 전에 내장된 뼈 표본을 RT에서 16시간 동안 식염수에 수화합니다.
- 용융 실리카를 사용하여 나노인덴테이션 시스템을 보정하고 결과 압입 탄성률을 기록합니다. 용융 실리카의 경우 압흔 계수는 푸아송 계수 0.17을 사용하여 약 72GPa입니다.
- 나노인덴테이션 시스템이 보정되면 라만 분석에 사용되는 샘플을 나노인덴테이션 장치의 광학 시스템에 배치하여 나노인덴테이션이 수행될 위치를 지정합니다.
알림: 이 양식은 장비마다 다릅니다. 나노인덴테이션 시스템과 소프트웨어의 작동 방식에 대해서는 자세히 설명하지 않지만, 수행해야 하는 여러 단계에 대한 일반적인 조언을 제공합니다. - 나노인덴테이션 위치가 선택되면 샘플을 압입 장치 아래로 이동하고 압흔을 수행합니다. 900nm의 일정한 깊이에서 40mm/min의 로딩/언로딩 속도와 로딩과 언로딩 사이에 15초의 일시 정지로 나노인덴테이션을 수행합니다. 뼈 조직에 대한 푸아송 계수를 0.3으로 설정합니다.
- 나노인덴테이션 곡선에서 다양한 매개변수를 검색하고 Oliver와 Pharr의 이론22에 따라 계산합니다.
- 압흔 탄성률(EIT)은 압흔 팁과 감소된 탄성률의 알려진 특성에서 파생되며 시편의 국소 탄성 계수를 결합합니다. 들여쓰기를 다음과 같이 계산합니다.
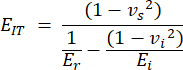
vs, vi, Ei 및 Err은 뼈에 대해 0.3으로 가정되는 샘플의 푸아송 계수를 나타내고, 다이아몬드 압자의 푸아송 계수는 0.07로 가정되며, 다이아몬드 압자의 탄성 계수는 1140 GPa로 고정되고 감소 계수는 다음과 같이 계산됩니다.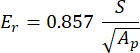
S는 하역 세그먼트의 기울기를 나타내고 Ap는 투영 면적을 나타내며 다음과 같이 계산됩니다.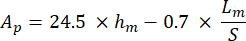
- 경도 (HIT) : 균열의 시작 및 전파에 대한 뼈 저항에 해당합니다. 즉, 뼈 인단도의 지표입니다. H IT 를 다음과 같이 계산합니다.

- 압흔 크리프 속도(CIT): 이것은 일정한 하중에서 시간 경과에 따른 뼈 변형을 반영하며, 시편의 점탄성 특성을 나타내며 다음과 같이 계산됩니다.
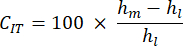
- 최대 하중(LM) : 이것은 표시된 깊이를 광물화 된 뼈 매트릭스로 관통하는 데 필요한 반대 하중에 해당합니다.
- 압입 작업(Wplast): 하중/무부하 변형 곡선 아래 영역에 해당합니다. 소성 변형을 유도하기 위해 발산되는 에너지의 직접적인 반영입니다.
참고: 나노인덴테이션의 재현성은 이 방법론의 파괴적인 특성으로 인해 뼈 샘플에서 평가하기가 더 어렵습니다. 그럼에도 불구하고, 우리는 표준 및 균일한 용융 실리카 샘플의 재현성을 추정했습니다. 위의 모든 매개변수에 대해 분산은 0.26% 미만으로 추정되었으며(5일에 걸쳐 5회 연속 측정) 매우 우수한 재현성을 뒷받침합니다. 반면에, 뼈 샘플의 비등방성 특성으로 인해 재현성을 평가하기가 더 어렵습니다.
- 압흔 탄성률(EIT)은 압흔 팁과 감소된 탄성률의 알려진 특성에서 파생되며 시편의 국소 탄성 계수를 결합합니다. 들여쓰기를 다음과 같이 계산합니다.
Access restricted. Please log in or start a trial to view this content.
결과
식식물의 micro-CT 이미지는 그림 2에 나와 있습니다. 수동 분할을 사용하면 전역 임계값을 사용하여 중앙 운하에 존재하는 시멘트에서 뼈를 최적으로 분리할 수 없습니다. 섬유주 뼈와 시멘트에 대한 인식을 개선하기 위해 딥 러닝을 사용할 것을 제안합니다. 딥 러닝은 생체 재료 특성을 인식하는 데 강력하며 뼈와 시멘트 사이의 분리를 개선하여 시?...
Access restricted. Please log in or start a trial to view this content.
토론
뼈 결손의 복구는 영향을 받는 개인의 이동성을 회복하고 통증을 줄이며 삶의 질을 개선하기 위한 재생 의학의 주요 과제입니다. 외식물 모델의 사용은 뼈 결손 복구를 위한 생체 내 연구에 비해 많은 이점을 제공합니다. 윤리적 고려 사항 외에도 이 모델을 사용하면 실험 조건을 엄격하게 제어하고 생물학적 변동성을 줄일 수 있으므로 보다 정확하고 재현 가능한 ...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
SC3M(SFR Francois Bonamy (UMS 016), University of Nantes), SFR ICAT (University of Angers), BIO3, HiMolA 및 SC4BIO를 포함하여 표본 수집 및 처리와 관련된 기술 시설에 감사드립니다. Inserm UMR_S 1229 RMeS는 Inserm, Nantes Université, Univ Angers 및 Oniris VetAgroBio 기관을 통해 프랑스 정부로부터 보조금을 받아 운영됩니다. CL은 HTL Biotechnology에도 감사의 뜻을 표하고 있습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.20 filters | VWR | 28145-501 | |
| 18 G needle (1,2x40 mm) | Sterican | 4665120 | |
| 3 mL syringe | HENKE-JECT | 8300005762 | |
| 37% hydrochloric acid | VWR | 1.00317.1000 | |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acetone | VWR | 20063-365 | |
| Alcian Blue 8GX | VWR | 361186 | |
| Ammonium hydroxide | VWR | 318612 | |
| Apatitic tricalcium phosphate | Centre for Biomedical and Healthcare Engineering (Mines Saint Etienne, France) | TV26U | |
| Azophloxine | Sigma | 210633 | |
| Benzoyl peroxide | Sigma | 8.01641.0250 | |
| BMP2 | Medtronic | InductOs 1.5 mg/mL | |
| Brillant crocein | Aldrich | 2107507 | |
| CTVox | Bruker | - | |
| DataViewer | Skyscan | - | |
| Diamond blade | Struers | MOD13 | |
| Diamond saw | Struers | Accutom-50 | |
| DiaPro Mol B3 diamond solution | Struers | 40600379 | |
| DiaPro Nap B1 diamond solution | Struers | 40600373 | |
| Dibasic sodium phosphate (Na2HPO4) | Sigma | 102404598 | |
| Dibutyl Phtalate | Chimie-Plus Laboratoires | 28656 | |
| DragonFly software | ORS | 2022.1.0.1231. | |
| Dulbecco's Modified Eagle Medium (DMEM) high glucose, GlutaMAX(TM), pyruvate | ThermoFisher Scientific | 31966-021 | |
| Eosine Y- Surgipath | Sigma | 1002830105 | |
| Erythrosin B | Sigma | 102141057 | |
| Ethanol absolute | VWR | 20820362 | |
| Eukitt | Dutscher | 6.00.01.0003.06.01.01 | |
| Falcon 50 mL | Sarstedt | 62.547.254 | |
| Ferric chloride hexahydrate (FeCl3, 6H2O) | Merck | 1.03943.0250 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF00 | |
| Fuchsine acid | Merck | 1.05231.0025 | |
| Hank's Balanced Salt Solution (HBSS) | Biosera | MS01NG100J | |
| Hematoxylin | Sigma | 86.118.9 | |
| Isostatic press | Nova Suisse | Pmax 1500 bars | |
| Laser diffraction granulometry | Malvern | Mastersizer 3000 | |
| Light green | Prolabo | 28947135 | |
| Lithium carbonate | Sigma | A13149 | |
| MD-Mol polishing cloth | Struers | 40500077 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylmethacrylate | Sigma | 8.00590.2500 | |
| Micro-CT, micro-scanner | Bruker | Skyscan 1272 | |
| Monobasic sodium phosphate (NAH2PO4) | Sigma | 71496 | |
| Mortar | Fritsch | Pulverisette 6 | |
| N,N, Dimethylanilin | Sigma | 803060 | |
| Nanoindentation station | Anton Paar | NHT2 | |
| ND-Nap polishing cloth | Struers | 40500080 | |
| OATS Osteochondral Autograft Transfer System Set, 4,75 mm | Arthrex | AR-1981-04S | |
| OATS Osteochondral Autograft Transfer System Set, 8 mm | Arthrex | AR-1981-08S | |
| Orange G | Ral | M15 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Peel-a-way disposable embbedding moulds | Polysciences, Inc | 18646C-1 | |
| Penicillin/Streptomycin (P/S) | ThermoFisher Scientific | 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| Phosphomolybdic acid | Sigma | 221856-100 g | |
| Phosphotungstic acid | Aldrich | 12863-5 | |
| Polishing machine | Sturers | Dap V | |
| Poupinel | MEMMERT | TV26U | |
| Raman microspectrometer | Renishaw | InVia Qontor | |
| Safran du Gâtinais | Labonord | 11507737 | |
| Scanning electron microscope | Carl Zeiss | Evo LS 10 | |
| SEM | Zeiss | Carl Zeiss Evo LS10 | |
| SiC foils/Grinding papers | Struers | 40400008 (#320), 40400011 (#1000), 40400122 (#2000), 40400182 (#4000) | |
| Silver paint | Electron microscopy sciences | 12686-15 | |
| Standard stub with Faraday cup, carbon, aluminium and silicon standards | Micro-Analysis Consultants Ltd | 8602 | |
| T25 flask | Corning | 430639 | |
| Xylene | VWR | 28975.325 | |
| Xylidine Ponceau | Aldrich | 19.976-1 |
참고문헌
- Feroz, S., Cathro, P., Ivanovski, S., Muhammad, N. Biomimetic bone grafts and substitutes: A review of recent advancements and applications. Biomed Eng Adv. 6, 100107(2023).
- Tsuji, K., et al. BMP2 activity, although dispensable for bone formation, is required for the initiation of fracture healing. Nat Genet. 38 (12), 1424-1429 (2006).
- Hadjidakis, D. J., Androulakis, I. I. Boneremodeling. Ann N Y Acad Sci. 1092, 385-396 (2006).
- Boivin, G., Meunier, P. J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcified Tiss Int. 70 (6), 503-511 (2002).
- Boivin, G., et al. Influence of remodeling on the mineralization of bone tissue. Osteoporo Int. 20 (6), 1023-1026 (2009).
- Zanghellini, B., et al. Multimodal analysis and comparison of stoichiometric and structural characteristics of parosteal and conventional osteosarcoma with massive sclerosis in human bone. J Str Biol. 216 (3), 108106(2024).
- Trento, G., et al. formation around two titanium implant surfaces placed in bone defects with and without a bone substitute material: A histological, histomorphometric, and micro-computed tomography evaluation. Clin Implant Dent Relat Res. 22 (2), 177-185 (2020).
- Palmquist, A. A multiscale analytical approach to evaluate osseointegration. J Mater Sci Mater Med. 29 (5), 60(2018).
- Budán, F., et al. Novel radiomics evaluation of bone formation utilizing multimodal (SPECT/X-ray CT) in vivo imaging. PLoS ONE. 13 (9), e0204423(2018).
- Hulsart-Billström, G., et al. A surprisingly poor correlation between in vitro and in vivo testing of biomaterials for bone regeneration: results of a multicentre analysis. Eur Cells Mater. 31, 312-322 (2016).
- Cramer, E. E. A., Ito, K., Hofmann, S. Ex vivo bone models and their potential in preclinical evaluation. Curr Osteoporo Rep. 19 (1), 75-87 (2021).
- Chan, M. E., et al. A trabecular bone explant model of osteocyte-osteoblast co-culture for bone mechanobiology. Cell Mol Bioeng. 2 (3), 405-415 (2009).
- Doke, S. K., Dhawale, S. C. Alternatives to animal testing: A review. Saudi Pharma J. 23 (3), 223-229 (2015).
- Moussi, H., et al. New formulation of injectable and degradable calcium phosphate/silanized hyaluronic acid composite foam: Investigation in a rabbit model of long bone defect. SSRN. , (2024).
- Paré, A., et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta Biomater. 154, 626-640 (2022).
- Roschger, P., Fratzl, P., Eschberger, J., Klaushofer, K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone. 23 (4), 319-326 (1998).
- Roschger, P., Plenk, H., Klaushofer, K., Eschberger, J. A new scanning electron microscopy approach to the quantification of bone mineral distribution: backscattered electron image grey-levels correlated to calcium K alpha-line intensities. Scanning Micro. 9 (1), 75-86 (1995).
- Porter, A., et al. Quick and inexpensive paraffin-embedding method for dynamic bone formation analyses. Sci Rep. 7, 42505(2017).
- Goldschlager, T., Abdelkader, A., Kerr, J., Boundy, I., Jenkin, G. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis. J Vis Exp. (35), e1707(2010).
- Kazanci, M., Roschger, P., Paschalis, E. P., Klaushofer, K., Fratzl, P. Bone osteonal tissues by Raman spectral mapping: Orientation-composition. J Str Biol. 156 (3), 489-496 (2006).
- Unal, M., Ahmed, R., Mahadevan-Jansen, A., Nyman, J. S. Compositional assessment of bone by Raman spectroscopy. Analyst. 146 (24), 7464-7490 (2021).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. J Mater Res. 7 (6), 1564-1583 (1992).
- Proffen, B. L., McElfresh, M., Fleming, B. C., Murray, M. M. A comparative anatomical study of the human knee and six animal species. Knee. 19 (4), 493-499 (2012).
- Allen, M. J., Houlton, J. E. F., Adams, S. B., Rushton, N. The surgical anatomy of the stifle joint in Sheep. Vet Surg. 27 (6), 596-605 (1998).
- Kleuskens, M. W. A., van Donkelaar, C. C., Kock, L. M., Janssen, R. P. A., Ito, K. An ex vivo human osteochondral culture model. J Ortho Res. 39 (4), 871-879 (2021).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유