A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אפיון מקיף של מינרליזציה של רקמות במודל Ex Vivo
In This Article
Summary
הפרוטוקול המוצע כולל גישה גלובלית להערכת היווצרות עצם בהקשר של התחדשות עצם באמצעות אנליזות מולטימודאליות. מטרתו לספק מידע איכותי וכמותי על היווצרות עצם חדשה, לשפר את הקפדנות והתוקף של מחקרים בסיסיים ופרה-קליניים.
Abstract
האפיון הנרחב של מינרליזציה של רקמות בהקשר של התחדשות עצם מהווה אתגר משמעותי, בהתחשב בשיטות הרבות הזמינות כיום לניתוח. כאן, אנו מציעים זרימת עבודה להערכה מקיפה של היווצרות עצם חדשה באמצעות צמח osseous ex vivo רלוונטי בעל חיים גדול. פגם בעצם (קוטר = 3.75 מ"מ; עומק = 5.0 מ"מ) נוצר בראש עצם הירך של כבשה נטועה ומוזרק לו תחליף עצם מקרונקבובי טעון בגורם גדילה פרו-אוסטאוגני (חלבון מורפוגנטי עצם 2 - BMP2). לאחר מכן, הצמח נשמר בתרבית לתקופה של 28 יום, מה שמאפשר התיישבות תאית ויצירת עצם לאחר מכן. כדי להעריך את האיכות והמבנה של רקמת מינרליזציה חדשה, מוגדרות השיטות העוקבות הבאות: (i) אפיון ותמונות תלת-ממדיות ברזולוציה גבוהה של הצמח כולו באמצעות micro-CT, ולאחר מכן ניתוחי תמונות למידה עמוקה כדי לשפר את ההבחנה של רקמות מינרליות; (ii) ננו-הזחה כדי לקבוע את התכונות המכניות של הרקמה שזה עתה נוצרה; (iii) בדיקות היסטולוגיות, כגון Hematoxylin/Eosin/Saffron (HES), הטריכרום של גולדנר והפנטכרום של Movat כדי לספק הערכה איכותית של רקמה מינרלית, במיוחד בכל הנוגע להדמיה של מחסום האוסטואידים ונוכחות תאי עצם; (iv) מיפוי מיקרוסקופ אלקטרונים סורק פיזור אחורי (SEM) עם התייחסות פנימית לכימות מידת המינרליזציה ולספק תובנות מפורטות לגבי מורפולוגיה של פני השטח, הרכב מינרלים וממשק עצם-ביו-חומר; (v) ספקטרוסקופיית ראמאן כדי לאפיין את ההרכב המולקולרי של המטריצה המינרלית ולספק תובנות לגבי ההתמדה של BMP2 בתוך הצמנט באמצעות זיהוי קשרים פפטידיים. ניתוח רב-מודאלי זה יספק הערכה יעילה של עצם חדשה שנוצרה ותובנות איכותיות וכמותיות מקיפות לגבי רקמות מינרליות. באמצעות סטנדרטיזציה של פרוטוקולים אלה, אנו שואפים להקל על השוואות בין מחקרים ולשפר את התוקף והאמינות של ממצאי מחקר.
Introduction
פגמים בעצמות, בין אם נגרמים על ידי טראומה, כריתת גידול, מומים מולדים או זיהום, מהווים אתגר גדול עבור רפואה רגנרטיבית. שינויים אלה פוגעים בשלמות המבנית של מערכת השלד, ומובילים לאי נוחות, פגיעה תפקודית וירידה באיכות החיים של המטופלים.
כדי להתגבר על אתגרים אלה, התפתחו אסטרטגיות חדשניות לתיקון עצם, תוך התמקדות בשיפור אוסטאוגנזה והתחדשות רקמת עצם. גישות אלה כוללות שימוש בתחליפי עצם מושתלים, ניתנים להזרקה או להדפסה תלת-ממדית, שיכולים להיות ממקור טבעי (למשל, מקרומולקולות ממקור ביולוגי, הידרוקסיאפטיט שמקורו בבעלי חיים) או סינתטיים (למשל, משקפיים ביולוגיים, סידן פוספט)1. כדי לשפר את היכולת הטבועה הנמוכה שלהם להנחות ולהמריץ את התחדשות העצם, ניתן לטעון תחליפי עצם בגורמים אוסטיאואינדוקטיביים, כגון חלבונים מורפוגנטיים של העצם (BMPs), כדי לקדם התמיינות אוסטאוגנית של תאי אב ולשפר את היווצרות העצם2.
היווצרות העצם מבוססת על היווצרות ראשונית של מטריצת קולגן, אשר לאחר מכן מינרליזציה על ידי גבישי הידרוקסיאפטיט, ובכך מחזקת את מבנה העצם3. תהליך זה מעניק נוקשות וחוזק ספציפיים לעצם. איכות הרקמה המינרלית נשלטת באופן מורכב על ידי התכונות המיקרו-מבניות שלה ומידתהמינרליזציה 4. איכות זו ממלאת תפקיד מרכזי בריפוי העצם ובפונקציונליות של העצם המתחדשת5. עם זאת, אפיון מינרליזציה של עצם נותר משימה מאתגרת בשל השונות המובנית בין מחקרים רב-משתניים 6,7,8.
בנוסף, הערכות ראשוניות של תאימות ביולוגית, cytocompatibility, ופוטנציאל התמיינות של תחליפי שתל עצם מתבצעות בדרך כלל במבחנה. עם זאת, פערים מתודולוגיים מעכבים השוואה חלקה של תוצאות. יתר על כן, מחקרי מבחנה אלה אינם לוכדים באופן מלא את האינטראקציות הרב-תאיות ואת הדיאלוג המורכב בין אוכלוסיות תאים, כולל תאי מח עצם, החיוניים לוויסות תהליך התחדשות העצם9. חוסר ייצוג מדויק זה של מיקרו-סביבת העצם עלול לפגוע בדיוק של מחקרים פרה-קליניים הבאים10.
למרות שהערכות in vivo מספקות ייצוג מדויק יותר של הקשרים פיזיולוגיים, הן מוגבלות על ידי שיקולים אתיים, לוגיסטיים ופיננסיים. כתוצאה מכך, הערכות ex vivo ממלאות תפקיד מרכזי כממשק בין מחקרי in vitro ו- in vivo, ומשמשות כשלב ביניים הכרחי לפני המעבר לניסויים בנושאים חיים 11,12,13.
בהקשר זה, יש צורך ביישום מתודולוגיות אפיון מקיפות כדי להעריך את איכות רקמת העצם המתחדשת ולהבטיח את הרלוונטיות של האסטרטגיה לפני המעבר למודל פרה-קליני. כתוצאה מכך, אנו מציעים פרוטוקול המבוסס על ניתוח מודל explant באמצעות רקמת מפרק הברך של הכבשים. מתודולוגיה חדשנית זו כוללת השתלת מלט טעון BMP2 לתוך explants וביצוע ניתוח מפורט של מינרליזציה רקמות לאחר 28 ימים של תרבית.
הגישות הטכניות המשמשות במחקר זה מגוונות ומשלימות, וביחד מספקות גישה מקיפה להערכת האיכות של רקמת עצם מתחדשת (איור 1). הדמיית מיקרו-CT ברזולוציה גבוהה מאפשרת הדמיה תלת-ממדית מפורטת של מבנה העצם, ומספקת תובנות חשובות לגבי צפיפות המינרלים, המורפולוגיה והשלמות של הרקמה החדשה שנוצרה. טכניקה זו חיונית להערכת היעילות של התחדשות העצם ולמעקב אחר התקדמות המינרליזציה לאורך זמן. ננו-הזחה היא גישה מדויקת לקביעת התכונות המכניות של הרקמה, כגון קשיות וחוזק. על ידי מדידת תגובת החומר לכוח המופעל בקנה מידה ננומטרי, שיטה זו מאפשרת להעריך את חוסנה ואיכותה של הרקמה המינרלית. בדיקות היסטולוגיות המשתמשות בכתמים נפוצים כגון המטוקסילין/אאוסין/זעפרן (HES), הטריכרום של גולדנר והפנטכרום של מובאט מספקות תובנות יקרות ערך לגבי מבנה הרקמה והרכבה. כתמים אלה מאפשרים התמיינות של מרכיבי הרקמה השונים, כולל תאים, מטריצה חוץ-תאית ומרבצי מינרלים, ובכך מאפשרים הערכה איכותית מקיפה של תהליך התחדשות העצם. מיפוי מיקרוסקופ אלקטרונים סורק פיזור אחורי (SEM) מציע הדמיה ברזולוציה גבוהה של פני השטח של הדגימות, ומאפשר ניתוח מפורט של מידת המינרליזציה של מטריצת העצם, כמו גם את הממשקים בין החומר המושתל לבין הרקמה המארחת. לבסוף, ספקטרוסקופיית ראמאן מספקת מידע לגבי ההרכב המולקולרי של הרקמה, במיוחד באמצעות זיהוי רכיבים ספציפיים כגון חלבונים, שומנים ומינרלים. גישה זו מאפשרת אפיון של מטריצה מינרלית ואיתור גורמי גדילה כגון BMP2, ובכך מספקת מידע חיוני על התמשכות גירויים פרו-אוסטאוגניים בתווך ההתחדשות.
באמצעות גישה רב-תחומית, המשלבת טכניקות אנליטיות שונות, המחקר שלנו שואף לספק הערכה יסודית ומקיפה של איכות רקמת העצם המתחדשת, ובכך לספק בסיס מוצק להערכת תחליפי שתלי עצם ויישומם הקליני הפוטנציאלי.
Access restricted. Please log in or start a trial to view this content.
Protocol
מחקר זה אושר על ידי ועדת אתיקה ורווחת בעלי חיים ועל ידי מנהל המזון והווטרינריה הלאומי הצרפתי תחת מספר G44171.
1. הכנה ותרבות של צמחים osteochondral
- קצרו דגימות מפרקים של כבשים מבעלי חיים שזה עתה הומתו בסביבה אספטית. מקמו את הכבשה במצב שכיבה וגלחו את הגפה האחורית השמאלית. הכן על ידי חיטוי עם אלכוהול סביב מפרק הברך. השתמש בארתרוטומיה פרפטלרית צידית כדי לחשוף את הרצועות הצולבות הקדמיות והאחוריות, ולאחר מכן נקע פטלרי כדי לחשוף את טרוכלאה הירך.
- לאחר קצירת הרקמות, יש ליצור פגם בקוטר 4.75 מ"מ בקונדיל הצידי באמצעות מערכת העברת השתלה עצמית אוסטאוכונדרלית.
- בעזרת פטיש אורתופדי, יוצרים פגם בעומק 10 מ"מ ושולפים את העציץ מהקונדיל. לאחר מכן, לבצע פגם שני בקוטר 8 מ"מ, מרוכז סביב הראשון, באמצעות מערכת העברת autograft osteochondral. זה מניב חצילים אוסטאוכונדרליים בגודל 8 מ"מ x 10 מ"מ, המכילים פגם מרכזי של 4.75 מ"מ x 10.0 מ"מ.
- אם הדבר נדרש מסיבות לוגיסטיות, יש לשנע את הצמחים בתמיסת מלח מאוזנת של Hank (hBSS) בתוספת 1% פניצילין-סטרפטומיצין ולאחסן בטמפרטורה של 4°C.
- שטפו את הצמחים 3x עם מלח חוצץ פוספט (PBS), ולאחר מכן הזריקו את הפגם בגודל 4.75 מ"מ x 10.0 מ"מ עם מלט סידן פוספט בתוספת 40 מיקרוגרם/מ"ל של BMP2. הכינו את המלט כמתואר להלן.
- לייצר α-טריקלציום פוספט (α-TCP) על ידי טיפול בחום של מוטות טריקלציום פוספט אפטיטיים (מכבש איזוסטטי ב 120 MPa) ב 1364 ° C במשך מינימום של 12 שעות, ולאחר מכן מרווה אוויר14.
- טוחנים את מוטות α-TCP באתנול מוחלט עם כדור טחינה פלנטרי 2x במשך 5 דקות ב-500 סל"ד כדי לייצר אבקה דקה של 13.1 ± 1.7 מיקרומטר (נמדדה באמצעות עקיפה בלייזר, כפי שתואר קודם לכן14).
- יש לעקר את אבקת α-TCP על ידי חימום יבש בטמפרטורה של 180°C למשך 45 דקות. הכינו את צמנט הסידן הזרח על ידי ערבוב אבקת α-TCP עם תמיסה מסוננת 2.5% (w/v) Na2HPO4 0.22 מיקרומטר (יחס נוזל/אבקה של 0.35) למשך דקה אחת.
- יש להעמיס את משחת הצמנט לתוך מזרק בנפח 3 מ"ל לפני ההזרקה באמצעות מחט 18 גרם.
- לאחר 10 דקות בטמפרטורת החדר (RT), מעבירים את החצילים לבקבוק בגודל 25 סמ"ר ומוסיפים בעדינות 10 מ"ל של מדיום תרבית שלם המורכב מגלוקוז גבוה מסוג Modified Eagle Medium (DMEM) של Dulbecco בתוספת 10% נסיוב בקר עוברי ו-1% פניצילין-סטרפטומיצין.
- שמור על הצמחים עד 28 ימים באינקובטור של 37 מעלות צלזיוס עם 5% CO2 ושנה את מדיום התרבית המלא כל יומיים מתחת למכסה מנוע זרימה למינרית.
- שטפו את החצילים 3x עם PBS. מעבירים אותם לתוך צינורות 50 מ"ל, להוסיף 20 מ"ל של 4% paraformaldehyde (PFA), ולשמור אותם ב 4 ° C במשך 3 ימים. לאחר מכן, שטפו את הצמחים עם PBS ואחסנו אותם באתנול 70% לפני הניתוחים הבאים.
2. ניתוח מיקרו-CT
- ביצוע ניתוחי מיקרו-טומוגרפיה באמצעות צילום רנטגן מיקרו-CT. קבל הקרנות רנטגן ברזולוציה של 10.7 מיקרומטר, עם זמן חשיפה של 1200 אלפיות השנייה ומסנן אלומיניום 1 מ"מ (80 kV ו- 125 μA). ממוצע שלוש תמונות עבור כל תוספת סיבוב של 0.45° כדי לשפר את יחס האות לרעש.
- שחזור תמונות תלת מימד (3D) באמצעות תוכנת השחזור של היצרן לאחר יישור X/Y עם סריקת ייחוס, עם הפרמטרים הבאים - החלקה: 0, טבעת חפץ: 3, הקשחת קרן: 35%. נקה את ערימות התמונות באמצעות תוכנת עיבוד תמונה והתבונן באמצעות כלי הדמיה דו-ממדיים (דו-ממדיים) ותלת-ממדיים.
3. ניתוח תמונות למידה עמוקה
- ביצוע פילוח תמונות באמצעות תוכנה ייעודית ייעודית. השתמש באשף הפילוח המשולב כדי לאמן מודל למידה עמוקה להבחנה בין עצמות ומלט.
- בחר אזור מייצג (כלומר, מסגרת) המכיל עצם, מלט ורקע מתמונות המיקרו-CT המשוחזרות. פלח מסגרת ראשונה זו באופן ידני באמצעות כלים פשוטים (למשל, סף) או רבי עוצמה (למשל, התפשטות) המסופקים על ידי התוכנה .
- צור מודל למידה עמוקה בכרטיסיה מודל ובחר שגרת 3D-Unet בתפריט הנפתח. להגדיר את הפרמטרים הניסיוניים שלה במשוואה עם התמונות לנתח על ידי לחיצה ימנית על המודל שנוצר; כאן: עומק של 5, גודל תיקון 32 x 32, אלגוריתם Adadetla, יחס צעדים של 0.25, הגדלת נתונים x10.
- השתמשו במסגרת המקוטעת כדי לאמן את שגרת הלמידה העמוקה (לחצו על כפתור הרכבת), שמוכרת כרלוונטית בזכות יכולות פילוח התמונה המהירות והמדויקות שלה 3,15. לאחר השלמת האימון, הגדר אזור עבודה שני (מסגרת) ופלח באופן אוטומטי באמצעות פונקציית החיזוי.
- החל תיקון ידני במידת הצורך כדי להפיק נתוני אימון מדויקים יותר. שגרת האימונים שוב. חזור על התהליך עד לקבלת תוצאה משביעת רצון; מספר הגדלות הנתונים יורד בהדרגה ככל שמספר מסגרות האימון גדל.
הערה: מדד DICE המסופק במהלך אימון המודל נותן אינדיקציה לדיוק המודל (בהשוואה למידע הקלט) אך אינו מספיק. אישור הרלוונטיות של המודל צריך להתבצע על ידי אימות הנתונים המפולחים אוטומטית על ידי 3 חוקרים מנוסים בלתי תלויים.
- החל תיקון ידני במידת הצורך כדי להפיק נתוני אימון מדויקים יותר. שגרת האימונים שוב. חזור על התהליך עד לקבלת תוצאה משביעת רצון; מספר הגדלות הנתונים יורד בהדרגה ככל שמספר מסגרות האימון גדל.
- פרסם את המודל על ידי לחיצה על כפתור ייצוא והחל אותו על כל מערך הנתונים micro-CT על ידי לחיצה על Segment > Exported Model > Segment Full Dataset.
4. הטבעה
- יש לייבש את צמחי העצם על ידי הכנסתם לבקבוקון זכוכית של 40 מ"ל המכיל 25 מ"ל של תמיסת התייבשות המורכבת מ-70% אצטון ו-30% קסילן. הניחו את בקבוקון הזכוכית על גלגל מסתובב למשך שעה אחת ב-RT. חזרו על שלב זה 3x.
- החלף את תמיסת ההתייבשות ב- 25 מ"ל קסילן והנח את בקבוקון הזכוכית על הגלגל המסתובב למשך שעה אחת ב- RT.
- החלף את תמיסת הקסילן ב-25 מ"ל מתילמתקרילט מועשר (MMA) ב-10% בנזואיל פרוקסיד (BPO) ו-10% דיבוטיל פתלאט (DBP). הנח אותו על הגלגל המסתובב למשך שעה אחת ב- RT. חזור על שלב זה 2x.
- החלף את תמיסת ה-MMA ב-25 מ"ל MMA מועשר ב-10% BPO, 10% DBP ו-450 מיקרוליטר של N, N דימתילאנילין מדולל ביחס 1:20 בפרופאן-2-אול. מניחים את בקבוקון הזכוכית בטמפרטורה של -20°C למשך הלילה. הפתרון הופך צהבהב.
- מניחים את החציל לתוך תבנית הטבעה בגודל בינוני ויוצקים את MMA-BPO-DBP-N, N אנילין לתוך התבנית. מכניסים את התבנית לקופסת פלסטיק ומאווררים בזרימת חנקן למשך 5 דקות. סגור את הקופסה באופן הרמטי והנח אותה על 4 מעלות צלזיוס למשך 48 שעות לפילמור והתקשות MMA.
- מוציאים את השרף המכיל את החציל מהתבנית ושומרים אותו בטמפרטורה של 4 מעלות צלזיוס עד לעיבודו לניתוח הבא.
5. מיקרוסקופ אלקטרונים סורק (SEM) - דימות אלקטרונים כמותי מפוזר לאחור (qBEI)
- חתכו את בלוק ה-pMMA המכיל את החציל עם מסור יהלום לאורך צירו הארוך. שמור את המחצית הראשונה של הבלוק לניתוח היסטולוגי. חותכים את החצי השני עוד יותר כדי ליצור חתך בעובי 1.5 מ"מ. בצע את החיתוך ב-3000 סל"ד במהירות של 3 מ"מ/דקה.
- טוחנים את החלק עם נייר סיליקון קרביד עם מספרים עולים המתאימים לגודל גרגר נמוך יותר: SiC 320 עבור 10 s, SiC 1000 עבור 15 s, SiC 2000 עבור 30 s, ו- SiC 4000 עבור 30 s.
- לטש את החלק עם משחת יהלומים ובגדים ספציפיים: בד ליטוש עם תמיסת יהלום מול B3 3 מיקרומטר למשך דקה אחת ובד פליז עם תמיסת יהלום 1 מיקרומטר Nap B1 למשך דקה אחת.
- יש לשטוף את החלק תחת מים מזוקקים פעמיים ולנקות חלקיקי יהלום עם צמר גפן. יבשו את הקטע תחת גז חנקן.
- מצפים את החלק העבה (עובי סרט פחמן 10 ננומטר) ומרכיבים אותו על גבעולי אלומיניום בצבע כסף. צור גשר בצבע כסף בין החלק העליון לבין הספח כדי לאפשר פינוי מטען אלקטרונים לקרקע.
- הניחו את הספח על במת ה-SEM. לצד הדגימה, הכניסו לתא ה-SEM ספח בקרה המורכב מכוס פאראדיי עם תקני פחמן, אלומיניום וסיליקון. זה ישמש כדי לכייל את קרן האלקטרונים ולהמיר את הרמות האפורות לאחוזים של Ca. סגור את תא SEM ואקום.
- הפעל את קרן האלקטרונים והתאם את פרמטרי SEM כך שיפעלו במצב אלקטרונים מפוזרים לאחור. בתמונות מפוזרות לאחור, הרמה האפורה של תקן הפחמן היא 25, תקן האלומיניום הוא 225 ותקן הסיליקון הוא 253. כאינדיקציה, על המערכת בשימוש, פרמטרים SEM הם מתח מאיץ 20 keV, זרם הבדיקה נמדד עם פאראדיי: 250 pA, מרחק עבודה: 15 מ"מ, צמצם: 30 מיקרומטר, רזולוציית תמונה: 1024 x 768 פיקסלים, ואקום: < 4.10-4 Pa, זמן שהייה של 100 μs / פיקסל, בהירות ~ 38 וניגודיות ~ 72.
- כאשר SEM מכויל עם התקנים, לרכוש תמונות של הדגימה במצב אלקטרונים מפוזרים לאחור.
- השתמש בתמונת האלקטרונים המפוזרת לאחור של הדגימה כדי להמיר את רמות האפור לתכולת סידן, כמתואר ב- Roschger et al.16. בצע זאת באמצעות כל תוכנת ניתוח תמונה.
- התוויית התפלגות תכולת הסידן. התפלגות תכולת הסידן מראה התפלגות גאוסיאנית. שלושה פרמטרים עיקריים מעניינים מחושבים: Caמתכוון, כתכולת הסידן הממוצעת בתמונה, Capeak כריכוז הסידן השכיח ביותר שנתקלים בו בתמונהורוחב Ca כרוחב המלא במחצית מקסימום של התפלגות תכולת הסידן.
הערה: יכולת השחזור של qBEi נחקרה על ידי הדמיה של אותו אזור עניין במשך 5 ימים רצופים (רכישה אחת ביום). משמעות הדבר היא שקרן האלקטרונים הופעלה ונכבתה בין הפעלות. אחוז השגיאהב-Ca mean,Ca peak ו-Cawidth הוערך ב-0.5%, 0.7% ו-1.2%, בהתאמה. תכולת הסידן נחקרה גם על ידי ניתוח קרני רנטגן מפזרות אנרגיה (EDS). קשר ליניארי טוב מאוד נוצר ביןממוצע Ca לבין תכולת הסידן המוערכת על ידי EDS עם ערך R² של 0.99, בדומה לנתונים שהתקבלו על ידי Roschger et al. בעבר17.
6. היסטולוגיה
- עבור כל דגימה, חתכו 7 מקטעים מיקרומטר באמצעות מיקרוטום רקמה קשה עם להב טונגסטן 18,19. מקטעי צביעה עם כתם גולדנר טריכרום, HES ו-MOVAT באמצעות מערכת צביעה אוטומטית.
- לדפלסטיפיקציה, השרו את הדגימות ברצף באצטון למשך 5 דקות וחזרו על הפעולה 2x. שטפו את הדגימות במים מזוקקים במשך 5 דקות וחזרו על הפעולה פעמיים.
- בצע צביעת Goldner Trichrome כמתואר להלן.
- מניחים דגימות ב Weigert ברזל hematoxylin במשך 20 דקות. יש לשטוף במי ברז. יש לטבול דגימות ב-0.5% אלכוהול חומצי למשך 30-1 דקות. יש לשטוף במי ברז למשך 20 דקות.
- מניחים דוגמיות בתמיסת פונסו/חומצה פוקסין/אזופלוקסין למשך 5 דקות. יש לטבול בחומצה אצטית 1% למשך דקה אחת.
- מכתימים עם חומצה פוספו-הומוליבדית/תמיסת תפוז G למשך 20 דקות. יש לטבול בחומצה אצטית 1% למשך דקה אחת.
- יש להכתים בתמיסה ירוקה מהירה למשך 15 דקות בטמפרטורת החדר או 8 דקות ב-60°C. יש לשטוף היטב במי ברז; חזור על הפעולה 3x.
- בצע צביעת Movat Pentachrome כמתואר להלן.
- צביעת Alcian Blue: יש לטבול את הדגימות בתמיסה Alcian Blue למשך 30 דקות. שטפו דגימות במי ברז במשך 5 דקות. מניחים דגימות אתנול אלקליין במשך 60 דקות. יש לשטוף את הדגימות במי ברז במשך 10 דקות. יש לבצע שטיפה סופית במים מזוקקים.
- צביעת Hematoxylin של Weigert: מניחים דגימות ב- Ferric Hematoxylin של Weigert למשך 20-30 דקות. שטפו דגימות במי ברז במשך 15 דקות. יש לשטוף שוב במים מזוקקים.
- צביעה עם Crocein Brilliant/fuchsine Acid: טובלים את הדגימות בתמיסה של Crocein Brilliant/Acid Fuchsin למשך 10 דקות. יש לשטוף עם 0.5% חומצה אצטית. יש לטבול דגימות בתמיסת חומצה פוספוטונגסטית 5% למשך 20 דקות. יש לשטוף עם 0.5% חומצה אצטית במשך 2 דקות. יש לבצע שלוש שטיפות רצופות עם 100% אתנול, שכל אחת מהן נמשכת 5 דקות.
- צביעה עם Safran du Gatinais: מניחים דגימות ב- Safran du Gatinais למשך 15 דקות. יש לבצע שטיפה סופית במי ברז.
- בצע צביעת HES כמתואר להלן.
- צביעה עם Hematoxylin של Weigert: לטבול את הדגימות ב Hematoxylin של Weigert במשך 30 דקות. יש לשטוף במי ברז במשך 2 דקות.
- דה-קולוריזציה: טובלים את הדגימות באלכוהול חומצה הידרוכלורית במשך 10 שניות. יש לשטוף במי ברז במשך 2 דקות.
- נטרול: לטבול את הדגימות בתמיסה של ליתיום פחמתי למשך דקה אחת. יש לשטוף במי ברז במשך 2 דקות. יש לבצע שטיפה סופית במים מזוקקים למשך דקה.
- צביעה עם Eosin-Erythrosine: מניחים את הדגימות בתמיסה של Eosin-Erythrosine במשך 3 דקות. יש לשטוף במי ברז במשך 10 שניות.
- התייבשות: יש לטבול את הדגימות ב-95% אלכוהול למשך 15 שניות. מעבירים ל-100% אלכוהול למשך 15 שניות. חזור על הטבילה ב 100% אלכוהול במשך 30 שניות.
- צביעה סופית עם ספרנין אלכוהולי: טובלים את הדגימות בספרנין אלכוהולי למשך 10 דקות. יש לבצע שטיפה סופית במי ברז.
- בצע הרכבה על שקופיות כמתואר להלן.
- שטפו דגימות ב-95% אתנול, לאחר מכן 100% אתנול, ולאחר מכן מתיל-ציקלוהקסאן וחזרו על פעולה זו 3x עבור כל שלב.
- הרכיבו את הדגימות באמצעות ערכת הרכבה והוסיפו כיסוי. סרוק את התמונות באמצעות סורק שקופיות דיגיטלי.
7. מיקרוספקטרוסקופיית ראמאן
- השתמש באותו מקטע המשמש לניתוח ראמאן כמו ה- SEM. טחון ולטחון בקצרה את החלק כמתואר בשלבים 5.2 - 5.3 כדי להסיר את שכבת הפחמן הדקה שנוספה עבור SEM הפוגעת בפיזור החום מהדגימה.
- מקם את החלק על הבמה של מיקרוספקטרומטר ראמאן. כייל את מספר הגל כדי להבטיח דיוק ויישר את הלייזר לפני המדידה. מכיוון שנהלים כאלה הם ספציפיים לכל מכשיר, הם לא יתוארו במאמר זה.
- אתר אזורי עניין ברקמה שיש לנתח. מקם את האזור לניתוח במרכז כלי הווידאו ואסוף ספקטרום ראמאן עם הפרמטרים הבאים: לייזר 785 ננומטר בשימוש ב 30 mW, זמן אינטגרציה: 20 שניות חוזר 3 פעמים, טווח ספקטרלי: 350-1800 cm-1, סורג 1200 שורות / מ"מ.
- אספו 10 ספקטרום של שרף ההטבעה עם אותן הגדרות ראמאן וממוצעו אותם. השתמש באפשרות זו כדי להחסיר את תרומת השרף בשלב 7.6.
- עבד מראש את הספקטרום באופן הבא כדי להסיר את התרומה של פלואורסצנטיות, רעש ושרף: תיקון קו בסיס עם התאמה פולינומית מסדר חמישי, מסנן סביצקי-גולאי עם דרגה של 4, וגודל חלון המורכב בין 17 ל -21, חיסור שרף דיגיטלי באמצעות שיא ~ 812 ס"מ-1 של השרף. עיבוד מראש כזה יכול להתבצע עם תוכנות שונות המיועדות לניתוח נתונים והדמיה.
- נתח עוד יותר את הספקטרום המעובד מראש כדי לחלץ פרמטרים יקרי ערך על ידי קיצוב עוצמת השיא של רטט העניין עם עוצמת השיא של רטט הייחוס. עבור ניתוח עצם, למשל, השתמש בפרמטרים הבאים כדי לחשב אותו.
- יחסי מינרל-מטריצה: חלק את עוצמת השיא של תנודות v1PO4 ב~960 סמ"מ-1 בעוצמת השיא של מצבי הרטט אמיד I (~1668 ס"מ-1), אמיד III (~1250 ס"מ-1), CH2-WAG (~1450 ס"מ-1) או סכום הפרולין (~854 ס"מ-1) והידרוקסיפרולין (Hyp, ~872 ס"מ-1). v2PO4, הממוקם ב~ 430 cm-1, או v4PO4, הממוקם ב~ 600 cm-1, יכול לשמש גם ביחס עם רטט Amide III20. פרמטרים אלה מייצגים את מידת המינרליזציה של השלב האורגני של מטריצת העצם.
- קרבונט/פוספט: חלק את עוצמת השיא של v1CO3, הממוקם ב~1070 ס"מ-1, ב-v1PO4. זה מייצג את כמות החלפת קרבונט מסוג B בסריג אפטיט. Hyp/Pro, מייצג את תכולת ההידרוקסיפרולין, ~1375 cm-1/Amide III, מייצג את תכולת הפרוטאוגליקן, ~1150 cm-1/CH2-wag ו~1495 cm-1/CH2-wag, מייצג את כמות תוצרי גליקציה סופיים מתקדמים carboxymethylysine ו pentosidine, 1670 cm-1/1690 cm-1 ו 1670 cm-1/1640 cm-1 מייצגים את המבנה המשני הלא מסודר של הקולגן, הידוע גם בשם בגרות קולגן, ומבנים מסודרים בצורה של סליל α בקולגן מסוג I, בהתאמה.
- להעריך את יכולת השחזור של מדידות ראמאן על ידי בחינת אותו אזור עניין ב-5 רכישות רצופות (רכישה אחת ביום). עבור כל פרמטר שנותח, השונות הייתה מתחת ל-0.2% מערך הפרמטר, מה שתומך ביכולת שחזור טובה. הספציפיות של כל שיא נחקר נדונה בהרחבה בתחום, וסקירה מוצגת בסקירה האחרונה של אונאל21.
8. ננו-הזחה
הערה: בשל האופי ההרסני של ננו-הזחה, היא מבוצעת בדרך כלל בסוף שגרת ניתוח הדגימה. מערכת הננו-הזחה שבבעלותנו מצוידת באינדנטור יהלום פירמידלי של ברקוביץ'. עם זאת, קיימות מספר צורות אינדנטריות, ולא נקבע קונצנזוס בספרות לגבי דגימות עצם או ביו-חומר.
- יש ללחח את דגימת העצם המשובצת במי מלח במשך 16 שעות ב-RT לפני בדיקת ננו-הזחה.
- כייל את מערכת הננו-הזחה באמצעות סיליקה מותכת ורשום את מודולוס הכניסה שנוצר. עבור סיליקה מותכת, מודולוס ההזחה הוא בערך 72 GPa באמצעות מקדם פואסון של 0.17.
- לאחר כיול מערכת הננו-הזחה, מקם את הדגימה המשמשת לניתוח ראמאן במערכת האופטית של התקן הננו-הזחה כדי להצביע על מיקומים שבהם תבוצע ננו-הזחה.
הערה: שיטה זו משתנה מציוד אחד למשנהו; איננו מפרטים כיצד פועלות מערכת הננו-הזחה והתוכנה, אך נותנים עצות כלליות לגבי השלבים השונים שיש לבצע. - לאחר בחירת מיקום הננו-הזחה, העבר את הדגימה מתחת להתקן ההזחה ובצע הזחה. בצע ננו-הזחה בעומק קבוע של 900 ננומטר, עם מהירות טעינה/פריקה של 40 מ"מ/דקה והפסקה של 15 שניות בין טעינה לפריקה. הגדר את מקדם פואסון עבור רקמת העצם על 0.3.
- שלפו את הפרמטרים השונים מעקומות הננו-הזחה וחשבו אותם על פי תיאוריה22 של אוליבר ופאר.
- מודולוס הזחה (EIT) נגזר מהתכונות הידועות של קצה ההזחה והמודולוס המוקטן ומשלב את המודולוס האלסטי המקומי של הדגימה. חישוב כניסה כ:
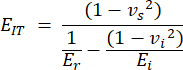
כאשר vs, vi, Ei ו- Er מייצגים את מקדם פואסון של הדגימה, בהנחה שהוא 0.3 עבור עצם, מקדם פואסון של אינדנטר היהלום, בהנחה שהוא 0.07, המודולוס האלסטי של אינדנטר היהלום, קבוע ב- 1140 GPa והמודולוס המופחת, מחושב כ: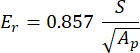
כאשר S מייצג את שיפוע מקטע הפריקה ו-AP הוא השטח המוקרן ומחושב כ: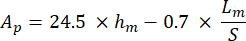
- קשיות (HIT): המקבילה לעמידות העצם לייזום והתפשטות סדקים. במילים אחרות, זהו אינדיקטור לקשיחות העצם. חשב HIT כ:

- קצב זחילת הזחה (CIT): זה משקף את עיוות העצם לאורך זמן בעומס קבוע, המעיד על התכונות הוויסקו-אלסטיות של הדגימה, חישוב כ:
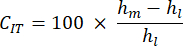
- עומס מרבי (Lm): זה מתאים לעומס המתנגד הדרוש כדי לחדור את העומק המצוין לתוך מטריצת העצם מינרליזציה.
- עבודת הזחה (Wplast): פעולה זו מתאימה לאזור שמתחת לעקומת עיוות העומס/פריקה. זוהי השתקפות ישירה של האנרגיה המתפזרת כדי לגרום לעיוות פלסטי.
הערה: קשה יותר להעריך את יכולת השחזור של ננו-הזחה על דגימות עצם בשל האופי ההרסני של מתודולוגיה זו. עם זאת, הערכנו את יכולת השחזור של דגימת סיליקה מאוחה סטנדרטית ואחידה . עבור כל הפרמטרים הנ"ל, השונות נאמדה מתחת ל-0.26% (5 מדדים רצופים ב-5 ימים נפרדים), מה שתומך ביכולת שחזור טובה מאוד. מצד שני, בשל האופי האנאיזוטרופי של דגימות עצם, קשה יותר להעריך את יכולת השחזור שלהן.
- מודולוס הזחה (EIT) נגזר מהתכונות הידועות של קצה ההזחה והמודולוס המוקטן ומשלב את המודולוס האלסטי המקומי של הדגימה. חישוב כניסה כ:
Access restricted. Please log in or start a trial to view this content.
תוצאות
תמונת מיקרו-CT של הצמח מוצגת באיור 2. באמצעות סגמנטציה ידנית לא ניתן להפריד באופן אופטימלי עצם מצמנט, הנמצאת בתעלה המרכזית, באמצעות סף גלובלי. כדי לשפר את הזיהוי של עצם טרבקולרית וצמנט, אנו מציעים להשתמש בלמידה עמוקה. למידה עמוקה היא רבת עוצמה לזיהוי מאפיינ...
Access restricted. Please log in or start a trial to view this content.
Discussion
תיקון פגמים בעצמות הוא אתגר גדול ברפואה רגנרטיבית כדי להחזיר את הניידות, להפחית את הכאב ולשפר את איכות החיים של אנשים מושפעים. השימוש במודלים של explant מציע מספר יתרונות בהשוואה למחקרי in vivo לחקר תיקון פגמים בעצם. בנוסף לשיקולים אתיים, מודל זה מאפשר בקרה קפדנית של תנאי ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו רוצים להודות למתקנים הטכניים המעורבים באיסוף ועיבוד דגימות, כולל SC3M (SFR פרנסואה בונאמי (UMS 016), אוניברסיטת נאנט), SFR ICAT (אוניברסיטת אנז'ה), BIO3, HiMolA ו- SC4BIO. Inserm UMR_S 1229 RMeS נתמך על ידי מענקים מממשלת צרפת באמצעות Inserm, Nantes Université, Univ Angers ו Oniris VetAgroBio מוסדות. CL אסירת תודה גם ל-HTL Biotechnology.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.20 filters | VWR | 28145-501 | |
| 18 G needle (1,2x40 mm) | Sterican | 4665120 | |
| 3 mL syringe | HENKE-JECT | 8300005762 | |
| 37% hydrochloric acid | VWR | 1.00317.1000 | |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acetone | VWR | 20063-365 | |
| Alcian Blue 8GX | VWR | 361186 | |
| Ammonium hydroxide | VWR | 318612 | |
| Apatitic tricalcium phosphate | Centre for Biomedical and Healthcare Engineering (Mines Saint Etienne, France) | TV26U | |
| Azophloxine | Sigma | 210633 | |
| Benzoyl peroxide | Sigma | 8.01641.0250 | |
| BMP2 | Medtronic | InductOs 1.5 mg/mL | |
| Brillant crocein | Aldrich | 2107507 | |
| CTVox | Bruker | - | |
| DataViewer | Skyscan | - | |
| Diamond blade | Struers | MOD13 | |
| Diamond saw | Struers | Accutom-50 | |
| DiaPro Mol B3 diamond solution | Struers | 40600379 | |
| DiaPro Nap B1 diamond solution | Struers | 40600373 | |
| Dibasic sodium phosphate (Na2HPO4) | Sigma | 102404598 | |
| Dibutyl Phtalate | Chimie-Plus Laboratoires | 28656 | |
| DragonFly software | ORS | 2022.1.0.1231. | |
| Dulbecco's Modified Eagle Medium (DMEM) high glucose, GlutaMAX(TM), pyruvate | ThermoFisher Scientific | 31966-021 | |
| Eosine Y- Surgipath | Sigma | 1002830105 | |
| Erythrosin B | Sigma | 102141057 | |
| Ethanol absolute | VWR | 20820362 | |
| Eukitt | Dutscher | 6.00.01.0003.06.01.01 | |
| Falcon 50 mL | Sarstedt | 62.547.254 | |
| Ferric chloride hexahydrate (FeCl3, 6H2O) | Merck | 1.03943.0250 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF00 | |
| Fuchsine acid | Merck | 1.05231.0025 | |
| Hank's Balanced Salt Solution (HBSS) | Biosera | MS01NG100J | |
| Hematoxylin | Sigma | 86.118.9 | |
| Isostatic press | Nova Suisse | Pmax 1500 bars | |
| Laser diffraction granulometry | Malvern | Mastersizer 3000 | |
| Light green | Prolabo | 28947135 | |
| Lithium carbonate | Sigma | A13149 | |
| MD-Mol polishing cloth | Struers | 40500077 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylmethacrylate | Sigma | 8.00590.2500 | |
| Micro-CT, micro-scanner | Bruker | Skyscan 1272 | |
| Monobasic sodium phosphate (NAH2PO4) | Sigma | 71496 | |
| Mortar | Fritsch | Pulverisette 6 | |
| N,N, Dimethylanilin | Sigma | 803060 | |
| Nanoindentation station | Anton Paar | NHT2 | |
| ND-Nap polishing cloth | Struers | 40500080 | |
| OATS Osteochondral Autograft Transfer System Set, 4,75 mm | Arthrex | AR-1981-04S | |
| OATS Osteochondral Autograft Transfer System Set, 8 mm | Arthrex | AR-1981-08S | |
| Orange G | Ral | M15 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Peel-a-way disposable embbedding moulds | Polysciences, Inc | 18646C-1 | |
| Penicillin/Streptomycin (P/S) | ThermoFisher Scientific | 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| Phosphomolybdic acid | Sigma | 221856-100 g | |
| Phosphotungstic acid | Aldrich | 12863-5 | |
| Polishing machine | Sturers | Dap V | |
| Poupinel | MEMMERT | TV26U | |
| Raman microspectrometer | Renishaw | InVia Qontor | |
| Safran du Gâtinais | Labonord | 11507737 | |
| Scanning electron microscope | Carl Zeiss | Evo LS 10 | |
| SEM | Zeiss | Carl Zeiss Evo LS10 | |
| SiC foils/Grinding papers | Struers | 40400008 (#320), 40400011 (#1000), 40400122 (#2000), 40400182 (#4000) | |
| Silver paint | Electron microscopy sciences | 12686-15 | |
| Standard stub with Faraday cup, carbon, aluminium and silicon standards | Micro-Analysis Consultants Ltd | 8602 | |
| T25 flask | Corning | 430639 | |
| Xylene | VWR | 28975.325 | |
| Xylidine Ponceau | Aldrich | 19.976-1 |
References
- Feroz, S., Cathro, P., Ivanovski, S., Muhammad, N. Biomimetic bone grafts and substitutes: A review of recent advancements and applications. Biomed Eng Adv. 6, 100107(2023).
- Tsuji, K., et al. BMP2 activity, although dispensable for bone formation, is required for the initiation of fracture healing. Nat Genet. 38 (12), 1424-1429 (2006).
- Hadjidakis, D. J., Androulakis, I. I. Boneremodeling. Ann N Y Acad Sci. 1092, 385-396 (2006).
- Boivin, G., Meunier, P. J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcified Tiss Int. 70 (6), 503-511 (2002).
- Boivin, G., et al. Influence of remodeling on the mineralization of bone tissue. Osteoporo Int. 20 (6), 1023-1026 (2009).
- Zanghellini, B., et al. Multimodal analysis and comparison of stoichiometric and structural characteristics of parosteal and conventional osteosarcoma with massive sclerosis in human bone. J Str Biol. 216 (3), 108106(2024).
- Trento, G., et al. formation around two titanium implant surfaces placed in bone defects with and without a bone substitute material: A histological, histomorphometric, and micro-computed tomography evaluation. Clin Implant Dent Relat Res. 22 (2), 177-185 (2020).
- Palmquist, A. A multiscale analytical approach to evaluate osseointegration. J Mater Sci Mater Med. 29 (5), 60(2018).
- Budán, F., et al. Novel radiomics evaluation of bone formation utilizing multimodal (SPECT/X-ray CT) in vivo imaging. PLoS ONE. 13 (9), e0204423(2018).
- Hulsart-Billström, G., et al. A surprisingly poor correlation between in vitro and in vivo testing of biomaterials for bone regeneration: results of a multicentre analysis. Eur Cells Mater. 31, 312-322 (2016).
- Cramer, E. E. A., Ito, K., Hofmann, S. Ex vivo bone models and their potential in preclinical evaluation. Curr Osteoporo Rep. 19 (1), 75-87 (2021).
- Chan, M. E., et al. A trabecular bone explant model of osteocyte-osteoblast co-culture for bone mechanobiology. Cell Mol Bioeng. 2 (3), 405-415 (2009).
- Doke, S. K., Dhawale, S. C. Alternatives to animal testing: A review. Saudi Pharma J. 23 (3), 223-229 (2015).
- Moussi, H., et al. New formulation of injectable and degradable calcium phosphate/silanized hyaluronic acid composite foam: Investigation in a rabbit model of long bone defect. SSRN. , (2024).
- Paré, A., et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta Biomater. 154, 626-640 (2022).
- Roschger, P., Fratzl, P., Eschberger, J., Klaushofer, K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone. 23 (4), 319-326 (1998).
- Roschger, P., Plenk, H., Klaushofer, K., Eschberger, J. A new scanning electron microscopy approach to the quantification of bone mineral distribution: backscattered electron image grey-levels correlated to calcium K alpha-line intensities. Scanning Micro. 9 (1), 75-86 (1995).
- Porter, A., et al. Quick and inexpensive paraffin-embedding method for dynamic bone formation analyses. Sci Rep. 7, 42505(2017).
- Goldschlager, T., Abdelkader, A., Kerr, J., Boundy, I., Jenkin, G. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis. J Vis Exp. (35), e1707(2010).
- Kazanci, M., Roschger, P., Paschalis, E. P., Klaushofer, K., Fratzl, P. Bone osteonal tissues by Raman spectral mapping: Orientation-composition. J Str Biol. 156 (3), 489-496 (2006).
- Unal, M., Ahmed, R., Mahadevan-Jansen, A., Nyman, J. S. Compositional assessment of bone by Raman spectroscopy. Analyst. 146 (24), 7464-7490 (2021).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. J Mater Res. 7 (6), 1564-1583 (1992).
- Proffen, B. L., McElfresh, M., Fleming, B. C., Murray, M. M. A comparative anatomical study of the human knee and six animal species. Knee. 19 (4), 493-499 (2012).
- Allen, M. J., Houlton, J. E. F., Adams, S. B., Rushton, N. The surgical anatomy of the stifle joint in Sheep. Vet Surg. 27 (6), 596-605 (1998).
- Kleuskens, M. W. A., van Donkelaar, C. C., Kock, L. M., Janssen, R. P. A., Ito, K. An ex vivo human osteochondral culture model. J Ortho Res. 39 (4), 871-879 (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved