É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Caracterização abrangente da mineralização tecidual em um modelo ex vivo
Neste Artigo
Resumo
O protocolo proposto envolve uma abordagem global para avaliar a formação óssea no contexto da regeneração óssea usando análises multimodais. Tem como objetivo fornecer informações qualitativas e quantitativas sobre a nova formação óssea, aumentando o rigor e a validade das investigações básicas e pré-clínicas.
Resumo
A extensa caracterização da mineralização tecidual no contexto da regeneração óssea representa um desafio significativo, dadas as inúmeras modalidades atualmente disponíveis para análise. Aqui, propomos um fluxo de trabalho para uma avaliação abrangente da nova formação óssea usando um explante ex vivo ósseo de grande porte animal relevante. Um defeito ósseo (diâmetro = 3,75 mm; profundidade = 5,0 mm) é criado em uma cabeça femoral de ovelha explantada e injetado com um substituto ósseo macroporoso carregado com um fator de crescimento pró-osteogênico (proteína morfogenética óssea 2 - BMP2). Posteriormente, o explante é mantido em cultura por um período de 28 dias, permitindo a colonização celular e posterior formação óssea. Para avaliar a qualidade e a estrutura do tecido recém-mineralizado, os seguintes métodos sucessivos são estabelecidos: (i) Caracterização e imagens 3D de alta resolução de todo o explante usando micro-CT, seguidas de análises de imagem de aprendizado profundo para melhorar a discriminação de tecidos mineralizados; (ii) Nano-indentação para determinar as propriedades mecânicas do tecido recém-formado; (iii) Exames histológicos, como Hematoxilina/Eosina/Açafrão (HES), tricrômico de Goldner e pentacromo de Movat para avaliação qualitativa do tecido mineralizado, particularmente no que diz respeito à visualização da barreira osteóide e à presença de células ósseas; (iv) Mapeamento de microscopia eletrônica de varredura (MEV) de retroespalhamento com referência interna para quantificar o grau de mineralização e fornecer informações detalhadas sobre a morfologia da superfície, composição mineral e interface osso-biomaterial; (v) Espectroscopia Raman para caracterizar a composição molecular da matriz mineralizada e fornecer informações sobre a persistência de BMP2 dentro do cimento através da detecção de ligações peptídicas. Esta análise multimodal fornecerá uma avaliação eficaz do osso recém-formado e insights qualitativos e quantitativos abrangentes sobre tecidos mineralizados. Por meio da padronização desses protocolos, pretendemos facilitar as comparações entre estudos e melhorar a validade e a confiabilidade dos resultados da pesquisa.
Introdução
Os defeitos ósseos, sejam eles causados por trauma, ressecção tumoral, anomalias congênitas ou infecção, representam um grande desafio para a medicina regenerativa. Essas alterações comprometem a integridade estrutural do sistema esquelético, levando a desconforto, comprometimento funcional e redução da qualidade de vida dos pacientes.
Para superar esses desafios, surgiram estratégias inovadoras de reparo ósseo, com foco no aprimoramento da osteogênese e da regeneração do tecido ósseo. Essas abordagens incluem o uso de substitutos ósseos implantáveis, injetáveis ou imprimíveis em 3D, que podem ser de origem natural (por exemplo, macromoléculas de origem biológica, hidroxiapatita de origem animal) ou sintéticos (por exemplo, biovidros, fosfatos de cálcio)1. Para aumentar sua baixa capacidade inerente de guiar e estimular a regeneração óssea, os substitutos ósseos podem ser carregados com fatores osteoindutores, como proteínas morfogenéticas ósseas (BMPs), para promover a diferenciação osteogênica das células progenitoras e aumentar a formação óssea2.
A formação óssea baseia-se na formação inicial de uma matriz de colágeno, que é então mineralizada por cristais de hidroxiapatita, reforçando a estrutura óssea3. Este processo confere rigidez e resistência específicas ao osso. A qualidade do tecido mineralizado é intrinsecamente governada por seus atributos microestruturais e grau de mineralização4. Essa qualidade desempenha um papel fundamental na cicatrização óssea e na funcionalidade do osso regenerado5. No entanto, caracterizar a mineralização óssea continua sendo uma tarefa desafiadora devido à variabilidade inerente entre estudos multivariados 6,7,8.
Além disso, as avaliações iniciais da biocompatibilidade, citocompatibilidade e potencial de diferenciação de substitutos de enxerto ósseo são normalmente conduzidas in vitro. No entanto, as disparidades metodológicas impedem a comparação perfeita dos resultados. Além disso, esses estudos in vitro não capturam totalmente as interações multicelulares e o diálogo complexo entre as populações celulares, incluindo as células da medula óssea, que são essenciais para regular o processo de regeneração óssea9. Essa falta de representação precisa do microambiente ósseo pode comprometer a acurácia dos estudos pré-clínicos subsequentes10.
Embora as avaliações in vivo forneçam uma representação mais precisa dos contextos fisiológicos, elas são limitadas por considerações éticas, logísticas e financeiras. Consequentemente, as avaliações ex vivo desempenham um papel fundamental como interface entre estudos in vitro e in vivo, servindo como uma etapa intermediária necessária antes de passar para experimentos em sujeitos vivos11 , 12 , 13 .
Nesse contexto, a implementação de metodologias abrangentes de caracterização é necessária para avaliar a qualidade do tecido ósseo regenerado e garantir a relevância da estratégia antes de passar para um modelo pré-clínico. Consequentemente, propomos um protocolo baseado na análise de um modelo de explante usando tecido articular do joelho de ovelha. Essa metodologia inovadora envolve a implantação de cimento carregado com BMP2 nos explantes e a realização de uma análise detalhada da mineralização tecidual após 28 dias de cultivo.
As abordagens técnicas empregadas neste estudo são diversas e complementares, fornecendo coletivamente uma abordagem abrangente para avaliar a qualidade do tecido ósseo regenerado (Figura 1). A micro-TC de alta resolução permite a visualização 3D detalhada da estrutura óssea, fornecendo informações valiosas sobre a densidade mineral, morfologia e integridade do tecido recém-formado. Esta técnica é crucial para avaliar a eficácia da regeneração óssea e monitorar a progressão da mineralização ao longo do tempo. A nanoindentação é uma abordagem precisa para determinar as propriedades mecânicas do tecido, como sua dureza e resistência. Ao medir a resposta do material a uma força aplicada em escala nanométrica, esse método permite avaliar a robustez e a qualidade do tecido mineralizado. Exames histológicos usando colorações comuns, como hematoxilina/eosina/açafrão (HES), tricrômico de Goldner e pentacromo de Movat, fornecem informações valiosas sobre a estrutura e composição do tecido. Essas colorações permitem a diferenciação dos vários componentes do tecido, incluindo células, matriz extracelular e depósitos minerais, permitindo assim uma avaliação qualitativa abrangente do processo de regeneração óssea. O mapeamento por microscopia eletrônica de varredura por retroespalhamento (MEV) oferece uma visualização de alta resolução da superfície das amostras, permitindo uma análise detalhada do grau de mineralização da matriz óssea, bem como das interfaces entre o material implantado e o tecido hospedeiro. Finalmente, a espectroscopia Raman fornece informações sobre a composição molecular do tecido, particularmente através da identificação de componentes específicos, como proteínas, lipídios e minerais. Essa abordagem permite a caracterização da matriz mineralizada e a detecção de fatores de crescimento como o BMP2, fornecendo informações cruciais sobre a persistência de estímulos pró-osteogênicos no meio de regeneração.
Utilizando uma abordagem multidisciplinar, integrando várias técnicas analíticas, nosso estudo visa fornecer uma avaliação completa e abrangente da qualidade do tecido ósseo regenerado, fornecendo assim uma base sólida para a avaliação de substitutos de enxerto ósseo e sua potencial aplicação clínica.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este estudo foi aprovado por um comitê de ética e bem-estar animal e pela Administração Nacional Veterinária e Alimentar da França sob o número G44171.
1. Preparação e cultura de explantes osteocondrais
- Colha espécimes de ovelhas de animais recém-sacrificados em um ambiente asséptico. Posicione a ovelha em decúbito dorsal e raspe o membro posterior esquerdo. Prepare-se desinfetando com álcool ao redor da articulação do joelho. Use a artrotomia parapatelar lateral para expor os ligamentos cruzados anterior e posterior, seguida de luxação patelar para revelar a tróclea femoral.
- Após a coleta de tecido, crie um defeito de 4,75 mm de diâmetro no côndilo lateral usando um sistema de transferência de autoenxerto osteocondral.
- Usando um martelo ortopédico, crie um defeito de 10 mm de profundidade e recupere o explante do côndilo. Em seguida, realizar um segundo defeito de 8 mm de diâmetro, centrado em torno do primeiro, utilizando um sistema de transferência de autoenxerto osteocondral. Isso produz explantes osteocondrais medindo 8 mm x 10 mm, contendo um defeito central de 4,75 mm x 10,0 mm.
- Se necessário por razões logísticas, transportar os explantes em solução salina balanceada de Hank (hBSS) suplementada com penicilina-estreptomicina a 1% e armazenar a 4 °C.
- Enxágue os explantes 3x com solução salina tamponada com fosfato (PBS) e, em seguida, injete o defeito de 4,75 mm x 10,0 mm com um cimento de fosfato de cálcio suplementado com 40 μg/mL de BMP2. Prepare o cimento conforme descrito abaixo.
- Produzir fosfato α-tricálcico (α-TCP) por tratamento térmico de barras de fosfato tricálcico apático (prensa isostática a 120 MPa) a 1364 °C durante um mínimo de 12 h, seguido de têmpera ao ar14.
- Moer as hastes α-TCP em etanol absoluto com uma esfera de moinho planetária 2x por 5 min a 500 rpm para produzir um pó fino de 13,1 ± 1,7 μm (medido usando difração a laser, conforme descrito anteriormente14).
- Esterilize o pó de α-TCP aquecendo-o a seco a 180 °C por 45 min. Prepare o cimento de fosfato de cálcio misturando pó de α-TCP com uma solução filtrada de 2,5% (p / v) Na2HPO4 0,22 μm (proporção líquido/pó de 0,35) por 1 min.
- Coloque a pasta de cimento em uma seringa de 3 mL antes da injeção usando uma agulha de 18 G.
- Após 10 min em temperatura ambiente (TR), transfira os explantes para um frasco de 25 cm² e adicione suavemente 10 mL de meio de cultura completo consistindo de meio de Eagle modificado (DMEM) de Dulbecco com alta glicose suplementado com 10% de soro fetal bovino e 1% de penicilina-estreptomicina.
- Manter os explantes por até 28 dias em incubadora a 37 °C com 5% de CO2 e trocar o meio de cultura completo a cada 2 dias sob uma capela de fluxo laminar.
- Enxágue os explantes 3x com PBS. Transfira-os para tubos de 50 mL, adicione 20 mL de paraformaldeído a 4% (PFA) e mantenha-os a 4 ° C por 3 dias. Em seguida, enxágue os explantes com PBS e armazene-os em etanol a 70% antes das análises subsequentes.
2. Análise de micro-CT
- Realize análises de microtomografia utilizando um raio-X de microtomografia computadorizada. Adquira projeções de raios X com resolução de 10,7 μm, com tempo de exposição de 1200 ms e filtro de alumínio de 1 mm (80 kV e 125 μA). Calcule a média de três imagens para cada incremento de rotação de 0,45° para melhorar a relação sinal-ruído.
- Reconstrua imagens tridimensionais (3D) usando o software de reconstrução do fabricante após um alinhamento X/Y com uma varredura de referência, com os seguintes parâmetros - Suavização: 0, Artefato de anel: 3, Endurecimento do feixe: 35%. Limpe as pilhas de imagens com software de processamento de imagem e observe com ferramentas de visualização bidimensional (2D) e 3D.
3. Análises de imagem de aprendizado profundo
- Realize a segmentação de imagens usando software especializado dedicado. Use o Assistente de segmentação integrada para treinar um modelo de aprendizado profundo para discriminação de ossos e cimentos.
- Selecione uma zona representativa (ou seja, quadro) contendo osso, cimento e fundo das imagens de micro-TC reconstruídas. Segmente esse primeiro quadro manualmente usando ferramentas simples (por exemplo, limite) ou poderosas (por exemplo, propagação) fornecidas pelo software.
- Gere um modelo de aprendizado profundo na guia Modelo e selecione Rotina 3D-Unet no menu suspenso. Defina seus parâmetros experimentais em adequação com as imagens a serem analisadas clicando com o botão direito do mouse no modelo gerado; aqui: profundidade de 5, tamanho do patch 32 x 32, algoritmo Adadetla, taxa de passada de 0,25, aumento de dados x10.
- Use o quadro segmentado para treinar a rotina de aprendizado profundo (clique no botão Treinar), que é reconhecida como relevante por seus recursos de segmentação de imagem rápida e precisa 3,15. Uma vez concluído o treinamento, defina uma segunda zona de trabalho (quadro) e segmente automaticamente usando a função de previsão.
- Aplique a correção manual, se necessário, para gerar dados de treinamento mais precisos. Treine a rotina mais uma vez. Repita o processo até obter um resultado satisfatório; O número de aumentos de dados diminui progressivamente à medida que o número de quadros de treinamento aumenta.
NOTA: O índice DICE fornecido durante o treinamento do modelo fornece uma indicação da precisão do modelo (em comparação com as informações de entrada), mas não é suficiente. A confirmação da relevância do modelo deve ser realizada pela validação dos dados segmentados automaticamente por 3 pesquisadores experientes independentes.
- Aplique a correção manual, se necessário, para gerar dados de treinamento mais precisos. Treine a rotina mais uma vez. Repita o processo até obter um resultado satisfatório; O número de aumentos de dados diminui progressivamente à medida que o número de quadros de treinamento aumenta.
- Publique o modelo clicando no botão Exportar e aplique-o a todo o conjunto de dados micro -CT clicando em Segmentar > Modelo exportado > Segmentar conjunto de dados completo.
4. Incorporação
- Desidrate os explantes ósseos colocando-os em um frasco de vidro de 40 mL contendo 25 mL de solução de desidratação composta por 70% de acetona e 30% de xileno. Coloque o frasco de vidro em uma roda giratória por 1 h em RT. Repita esta etapa 3x.
- Substitua a solução de desidratação por 25 ml de xileno e coloque o frasco de vidro na roda rotativa durante 1 h à RT.
- Substitua a solução de xileno por 25 mL de metilmetacrilato enriquecido (MMA) com 10% de peróxido de benzoíla (BPO) e 10% de ftalato de dibutila (DBP). Coloque-o na roda giratória por 1 h em RT. Repita esta etapa 2x.
- Substitua a solução de MMA por 25 mL de MMA enriquecido com 10% de BPO, 10% de DBP e 450 μL de N, N dimetilanilina diluída 1:20 em propan-2-ol. Colocar o frasco para injetáveis de vidro a -20 °C durante a noite. A solução torna-se amarelada.
- Coloque o explante em um molde de incorporação de tamanho médio e despeje o MMA-BPO-DBP-N, N anilina no molde. Coloque o molde em uma caixa plástica e ventile com fluxo de nitrogênio por 5 min. Feche a caixa hermeticamente e coloque-a a 4 °C por 48 h para polimerização e endurecimento do MMA.
- Retirar a resina que contém o explante da forma e mantê-la a 4 °C até ser processada para análise posterior.
5. Microscopia eletrônica de varredura (SEM) - imagem eletrônica retroespalhada quantitativa (qBEI)
- Corte o bloco de pMMA contendo o explante com uma serra diamantada ao longo de seu eixo longo. Guarde a primeira metade do bloco para análise histológica. Corte a outra metade para gerar uma seção de 1,5 mm de espessura. Execute o corte a 3000 rpm com uma velocidade de 3 mm/min.
- Lixe a seção com papel de carboneto de silício com números crescentes correspondentes ao tamanho de grão inferior: SiC 320 por 10 s, SiC 1000 por 15 s, SiC 2000 por 30 s e SiC 4000 por 30 s.
- Polir a seção com pasta de diamante e roupas específicas: pano de polimento com solução de diamante Mol B3 de 3 μm por 1 min e pano de lã com solução de diamante Nap B1 de 1 μm por 1 min.
- Enxágue a seção em água bidestilada e limpe as partículas de diamante com um cotonete. Seque a seção sob gás nitrogênio.
- Cubra a seção grossa (espessura do filme de carbono de 10 nm) e monte-a em um topo de alumínio com tinta prateada. Faça uma ponte de tinta prateada entre o topo da seção e o toco para permitir a evacuação do carregamento de elétrons para o solo.
- Coloque o stub no estágio SEM. Ao lado da amostra, insira um stub de controle composto por um copo de Faraday com padrões de carbono, alumínio e silício na câmara SEM. Isso será usado para calibrar o feixe de elétrons e converter os níveis de cinza em porcentagens de Ca. Feche a câmara SEM e aspire.
- Ligue o feixe de elétrons e ajuste os parâmetros SEM para serem executados no modo de elétrons retroespalhados. Em imagens retroespalhadas, o nível de cinza do padrão de carbono é 25, o padrão de alumínio é 225 e o padrão de silício é 253. Como indicação, no sistema utilizado, os parâmetros SEM são tensão de aceleração 20 keV, corrente da sonda medida com o copo de Faraday: 250 pA, distância de trabalho: 15 mm, abertura: 30 μm, resolução da imagem: 1024 x 768 pixels, vácuo: < 4,10-4 Pa, tempo de permanência de 100 μs/pixel, brilho ~38 e contraste ~72.
- Quando o SEM é calibrado com os padrões, adquira imagens da amostra no modo de elétrons retroespalhados.
- Use a imagem de elétrons retroespalhados do espécime para converter os níveis de cinza em conteúdo de cálcio, conforme descrito em Roschger et al.16. Faça isso usando qualquer software de análise de imagem.
- Traçar a distribuição do teor de cálcio. A distribuição do conteúdo de cálcio mostra uma distribuição gaussiana. Três parâmetros principais de interesse são calculados: Camédio, como o teor médio de cálcio na imagem, pico deCa como a concentração de cálcio mais frequente encontrada na imagem elargura de Ca como a largura total na metade máxima da distribuição do teor de cálcio.
NOTA: A reprodutibilidade do qBEi foi investigada por meio de imagens da mesma região de interesse por 5 dias consecutivos (uma aquisição por dia). Isso significa que o feixe de elétrons foi ligado e desligado entre as sessões. A porcentagem de erro emmédia de Ca,pico de Ca e Cawidth foi estimada em 0,5%, 0,7% e 1,2%, respectivamente. O teor de cálcio também foi investigado por análise de raios-X por dispersão de energia (EDS). Foi estabelecida uma relação linear muito boa entre amédia de Ca e o teor de cálcio estimado pela EDS com um valor de R² de 0,99, semelhante aos dados obtidos por Roschger et al. anteriormente17.
6. Histologia
- Para cada amostra, corte cortes de 7 μm usando um micrótomo de tecido duro com uma lâmina de tungstênio 18,19. Seções de coloração com coloração tricrômica Goldner, HES e MOVAT usando um sistema de coloração automática.
- Para a deplastificação, mergulhe as amostras sucessivamente em acetona por 5 min e repita 2x. Enxágue as amostras em água destilada por 5 min e repita 2x.
- Execute a coloração Goldner Trichrome conforme descrito abaixo.
- Coloque as amostras em hematoxilina férrica Weigert por 20 min. Lave com água da torneira. Mergulhe as amostras em álcool ácido a 0,5% por 30 s-1 min. Lave com água da torneira por 20 min.
- Coloque as amostras em solução de Ponceau/ácido fucsina / azopfloxina por 5 min. Mergulhe em ácido acético a 1% por 1 min.
- Manchar com solução de ácido fosfomolíbdico/Laranja G por 20 min. Mergulhe em ácido acético a 1% por 1 min.
- Manchar com solução verde rápida por 15 min em temperatura ambiente ou 8 min a 60 °C. Enxágue abundantemente com água da torneira; repita 3x.
- Execute a coloração Movat Pentachrome conforme descrito abaixo.
- Coloração Alcian Blue: mergulhe as amostras na solução de Alcian Blue por 30 min. Enxágue as amostras em água da torneira por 5 min. Coloque as amostras em etanol alcalino por 60 min. Enxágue as amostras em água da torneira por 10 min. Faça um enxágue final com água destilada.
- Coloração de hematoxilina de Weigert: coloque amostras na hematoxilina férrica de Weigert por 20-30 min. Enxágue as amostras em água da torneira por 15 min. Enxágüe novamente com água destilada.
- Coloração com Croceína Brilhante/ácido fucsina: mergulhar as amostras em uma solução de Croceína Brilhante/Ácido Fucsina por 10 min. Enxágüe com ácido acético a 0,5%. Mergulhe as amostras em uma solução de ácido fosfotúngstico a 5% por 20 min. Enxágüe com ácido acético a 0,5% por 2 min. Realize três lavagens sucessivas com etanol 100%, cada uma com duração de 5 min.
- Coloração com Safran du Gatinais: coloque amostras em Safran du Gatinais por 15 min. Faça um enxágue final com água da torneira.
- Execute a coloração HES conforme descrito abaixo.
- Coloração com Hematoxilina de Weigert: mergulhe as amostras na Hematoxilina de Weigert por 30 min. Enxágüe com água da torneira por 2 min.
- Descoloração: mergulhar as amostras em álcool ácido clorídrico durante 10 s. Enxágüe com água da torneira por 2 min.
- Neutralização: mergulhe as amostras em uma solução de carbonato de lítio por 1 min. Enxágüe com água da torneira por 2 min. Realize um enxágue final com água destilada por 1 min.
- Coloração com Eosina-Eritrosina: coloque as amostras em uma solução de Eosina-Eritrosina por 3 min. Enxágüe com água da torneira por 10 s.
- Desidratação: Mergulhe as amostras em álcool 95% por 15 s. Transfira para álcool 100% por 15 s. Repita a imersão em álcool 100% por 30 s.
- Coloração final com Safranina Alcoólica: mergulhar as amostras em safranina alcoólica por 10 min. Faça um enxágue final com água da torneira.
- Execute a montagem deslizante conforme descrito abaixo.
- Enxágue as amostras em etanol a 95%, depois em etanol a 100%, depois em metilciclohexano e repita 3x para cada etapa.
- Monte as amostras usando um kit de montagem e adicione uma lamínula. Digitalize as imagens usando um scanner de lâminas digital.
7. Microespectroscopia Raman
- Use a mesma seção usada para análise Raman que o SEM. Lixe e polir brevemente a seção conforme descrito nas etapas 5.2 a 5.3 para remover a fina camada de carbono adicionada para SEM que prejudica a dissipação de calor da amostra.
- Coloque a seção no palco do microespectrômetro Raman. Calibre o número de onda para garantir a precisão e alinhe o laser antes da medição. Como tais procedimentos são específicos para cada instrumento, eles não serão descritos neste artigo.
- Localize regiões de interesse no tecido que precisam ser analisadas. Posicione a zona a ser analisada no centro da ferramenta de vídeo e colete espectros Raman com os seguintes parâmetros: laser de 785 nm usado a 30 mW, tempo de integração: 20 s repetido 3 vezes, faixa espectral: 350-1800 cm-1, grade de 1200 linhas/mm.
- Colete 10 espectros da resina de incorporação com as mesmas configurações Raman e calcule-os em média. Use isso para subtrair a contribuição de resina na etapa 7.6.
- Pré-processe os espectros da seguinte forma para remover a contribuição de fluorescência, ruído e resina: correção de linha de base com um ajuste polinomial de cinco ordens, filtro Savitzky-Golay com um grau de 4 e um tamanho de janela compreendido entre 17 e 21, subtração de resina digital usando o pico de ~ 812 cm-1 da resina. Esse pré-processamento pode ser realizado com diferentes softwares projetados para análise e visualização de dados.
- Analise ainda mais os espectros pré-processados para extrair parâmetros valiosos, racionando a intensidade de pico da vibração de interesse com a intensidade de pico da vibração de referência. Para análise óssea, por exemplo, use os seguintes parâmetros para calculá-la.
- Proporções mineral-matriz: divida a intensidade de pico das vibrações v1PO4 em ~ 960 cm-1 pela intensidade de pico dos modos vibracionais Amida I (~ 1668 cm-1), amida III (~ 1250 cm-1), CH2-wag (~ 1450 cm-1) ou a soma dos modos vibracionais de prolina (~ 854 cm-1) e hidroxiprolina (Hyp, ~ 872 cm-1). O v2PO4, localizado a ~430 cm-1, ou o v4PO4, localizado a ~600 cm-1, também pode ser usado e racionado com a vibração Amide III20. Esses parâmetros representam o grau de mineralização da fase orgânica da matriz óssea.
- Carbonato/Fosfato: divida a intensidade de pico do v1CO3, localizado a ~1070 cm-1, pelo v1PO4. Isso representa a quantidade de substituição de carbonato do tipo B na rede de apatita. Hyp/Pro, representa o conteúdo de hidroxiprolina, ~1375 cm-1/Amida III, representa o conteúdo de proteoglicanos, ~1150 cm-1/CH2-wag e ~1495 cm-1/CH2-wag, representa a quantidade dos produtos finais de glicação avançada carboximetilisina e pentosidina, 1670 cm-1/1690 cm-1 e 1670 cm-1/1640 cm-1 representam a estrutura secundária desordenada do colágeno, também conhecida como maturidade do colágeno, e estruturas ordenadas na forma de α-hélice no colágeno tipo I, respectivamente.
- Avalie a reprodutibilidade das medições Raman examinando a mesma região de interesse em 5 aquisições consecutivas (uma aquisição por dia). Para cada parâmetro analisado, a variância foi inferior a 0,2% do valor do parâmetro, apoiando boa reprodutibilidade. A especificidade de cada pico investigado tem sido amplamente discutida em campo, e uma visão geral é apresentada na recente revisão do Unal21.
8. Nanoindentação
NOTA: Devido à natureza destrutiva da nanoindentação, geralmente é realizada no final da rotina de análise da amostra. O sistema de nanoindentação que possuímos está equipado com um penetrador de diamante de Berkovitch piramidal. No entanto, existem várias formas de penetradores e nenhum consenso na literatura foi determinado para espécimes ósseos ou biomateriais.
- Hidratar a amostra de osso embebida em solução salina durante 16 h a RT antes do ensaio de nanoindentação.
- Calibre o sistema de nanoindentação usando sílica fundida e registre o módulo de indentação resultante. Para sílica fundida, o módulo de indentação é de aproximadamente 72 GPa usando um coeficiente de Poisson de 0,17.
- Uma vez calibrado o sistema de nanoindentação, coloque a amostra usada para análises Raman no sistema óptico do dispositivo de nanoindentação para apontar os locais onde a nanoindentação será realizada.
NOTA: Esta modalidade varia de um equipamento para outro; Não detalhamos como o sistema de nanoindentação e o software funcionam, mas damos conselhos gerais sobre as diferentes etapas que devem ser executadas. - Uma vez escolhido o local da nanoindentação, mova a amostra sob o dispositivo de indentação e execute a indentação. Realize nanoindentação a uma profundidade constante de 900 nm, com uma velocidade de carga/descarga de 40 mm/min e uma pausa de 15 s entre carga e descarga. Defina o coeficiente de Poisson para o tecido ósseo em 0,3.
- Recupere os diferentes parâmetros das curvas de nanoindentação e calcule-os de acordo com a teoria de Oliver e Pharr22.
- O módulo de indentação (EIT) é derivado das propriedades conhecidas da ponta de indentação e do módulo reduzido e combina o módulo de elasticidade local do corpo de prova. Calcule o recuo como:
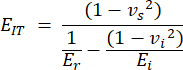
Com vs, vi, Ei e Er representando o coeficiente de Poisson da amostra, assumido como 0,3 para osso, o coeficiente de Poisson do penetrador de diamante, assumido como 0,07, o módulo de elasticidade do penetrador de diamante, fixado em 1140 GPa e o módulo reduzido, calculado como: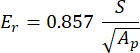
Com S representando a inclinação do segmento de descarga e Ap sendo a área projetada e calculada como: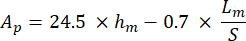
- Dureza (HIT): corresponde à resistência óssea à iniciação e propagação de trincas. Em outras palavras, é um indicador de resistência óssea. Compute HIT como:

- Taxa de fluência de indentação (CIT): Isso reflete a deformação óssea ao longo do tempo em carga constante, indicativa das propriedades viscoelásticas do corpo de prova, calculadas como:
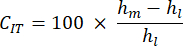
- Carga máxima (Lm): Corresponde à carga oposta necessária para penetrar na profundidade indicada na matriz óssea mineralizada.
- Trabalho de indentação (Wplast): corresponde à área sob a curva de deformação de carga/descarga. É um reflexo direto da energia dissipada para induzir a deformação plástica.
NOTA: A reprodutibilidade da nanoindentação é mais difícil de avaliar em amostras de osso devido à natureza destrutiva desta metodologia. No entanto, estimamos a reprodutibilidade da amostra de sílica fundida padrão e uniforme. Para todos os parâmetros acima, a variância foi estimada abaixo de 0,26% (5 medidas consecutivas em 5 dias separados), apoiando uma reprodutibilidade muito boa. Por outro lado, devido à natureza anisotrópica das amostras ósseas, é mais difícil avaliar sua reprodutibilidade.
- O módulo de indentação (EIT) é derivado das propriedades conhecidas da ponta de indentação e do módulo reduzido e combina o módulo de elasticidade local do corpo de prova. Calcule o recuo como:
Access restricted. Please log in or start a trial to view this content.
Resultados
Uma imagem de micro-TC do explante é mostrada na Figura 2. O uso da segmentação manual não pode separar de forma ideal o osso do cimento, presente no canal central, usando o limiar global. Para melhorar o reconhecimento do osso trabecular e do cimento, propomos o uso de aprendizado profundo. O deep learning é poderoso para reconhecer as características do biomaterial e ajuda a melhorar a separação entre osso e cimento, permitindo uma melhor avaliaç?...
Access restricted. Please log in or start a trial to view this content.
Discussão
O reparo de defeitos ósseos é um grande desafio na medicina regenerativa para restaurar a mobilidade, reduzir a dor e melhorar a qualidade de vida dos indivíduos afetados. O uso de modelos de explante oferece uma série de vantagens em relação aos estudos in vivo para a investigação do reparo de defeitos ósseos. Além das considerações éticas, esse modelo permite o controle rigoroso das condições experimentais e a redução da variabilidade biológica, facilitando a...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Queremos agradecer às instalações técnicas envolvidas na coleta e processamento de espécimes, incluindo SC3M (SFR François Bonamy (UMS 016), Universidade de Nantes), SFR ICAT (Universidade de Angers), BIO3, HiMolA e SC4BIO. O Inserm UMR_S 1229 RMeS é apoiado por doações do governo francês por meio das instituições Inserm, Nantes Université, Univ Angers e Oniris VetAgroBio. CL também é grata à HTL Biotechnology.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.20 filters | VWR | 28145-501 | |
| 18 G needle (1,2x40 mm) | Sterican | 4665120 | |
| 3 mL syringe | HENKE-JECT | 8300005762 | |
| 37% hydrochloric acid | VWR | 1.00317.1000 | |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acetone | VWR | 20063-365 | |
| Alcian Blue 8GX | VWR | 361186 | |
| Ammonium hydroxide | VWR | 318612 | |
| Apatitic tricalcium phosphate | Centre for Biomedical and Healthcare Engineering (Mines Saint Etienne, France) | TV26U | |
| Azophloxine | Sigma | 210633 | |
| Benzoyl peroxide | Sigma | 8.01641.0250 | |
| BMP2 | Medtronic | InductOs 1.5 mg/mL | |
| Brillant crocein | Aldrich | 2107507 | |
| CTVox | Bruker | - | |
| DataViewer | Skyscan | - | |
| Diamond blade | Struers | MOD13 | |
| Diamond saw | Struers | Accutom-50 | |
| DiaPro Mol B3 diamond solution | Struers | 40600379 | |
| DiaPro Nap B1 diamond solution | Struers | 40600373 | |
| Dibasic sodium phosphate (Na2HPO4) | Sigma | 102404598 | |
| Dibutyl Phtalate | Chimie-Plus Laboratoires | 28656 | |
| DragonFly software | ORS | 2022.1.0.1231. | |
| Dulbecco's Modified Eagle Medium (DMEM) high glucose, GlutaMAX(TM), pyruvate | ThermoFisher Scientific | 31966-021 | |
| Eosine Y- Surgipath | Sigma | 1002830105 | |
| Erythrosin B | Sigma | 102141057 | |
| Ethanol absolute | VWR | 20820362 | |
| Eukitt | Dutscher | 6.00.01.0003.06.01.01 | |
| Falcon 50 mL | Sarstedt | 62.547.254 | |
| Ferric chloride hexahydrate (FeCl3, 6H2O) | Merck | 1.03943.0250 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF00 | |
| Fuchsine acid | Merck | 1.05231.0025 | |
| Hank's Balanced Salt Solution (HBSS) | Biosera | MS01NG100J | |
| Hematoxylin | Sigma | 86.118.9 | |
| Isostatic press | Nova Suisse | Pmax 1500 bars | |
| Laser diffraction granulometry | Malvern | Mastersizer 3000 | |
| Light green | Prolabo | 28947135 | |
| Lithium carbonate | Sigma | A13149 | |
| MD-Mol polishing cloth | Struers | 40500077 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylcyclohexane | VWR | 8.06147.1000 | |
| Methylmethacrylate | Sigma | 8.00590.2500 | |
| Micro-CT, micro-scanner | Bruker | Skyscan 1272 | |
| Monobasic sodium phosphate (NAH2PO4) | Sigma | 71496 | |
| Mortar | Fritsch | Pulverisette 6 | |
| N,N, Dimethylanilin | Sigma | 803060 | |
| Nanoindentation station | Anton Paar | NHT2 | |
| ND-Nap polishing cloth | Struers | 40500080 | |
| OATS Osteochondral Autograft Transfer System Set, 4,75 mm | Arthrex | AR-1981-04S | |
| OATS Osteochondral Autograft Transfer System Set, 8 mm | Arthrex | AR-1981-08S | |
| Orange G | Ral | M15 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Peel-a-way disposable embbedding moulds | Polysciences, Inc | 18646C-1 | |
| Penicillin/Streptomycin (P/S) | ThermoFisher Scientific | 15140122 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| Phosphomolybdic acid | Sigma | 221856-100 g | |
| Phosphotungstic acid | Aldrich | 12863-5 | |
| Polishing machine | Sturers | Dap V | |
| Poupinel | MEMMERT | TV26U | |
| Raman microspectrometer | Renishaw | InVia Qontor | |
| Safran du Gâtinais | Labonord | 11507737 | |
| Scanning electron microscope | Carl Zeiss | Evo LS 10 | |
| SEM | Zeiss | Carl Zeiss Evo LS10 | |
| SiC foils/Grinding papers | Struers | 40400008 (#320), 40400011 (#1000), 40400122 (#2000), 40400182 (#4000) | |
| Silver paint | Electron microscopy sciences | 12686-15 | |
| Standard stub with Faraday cup, carbon, aluminium and silicon standards | Micro-Analysis Consultants Ltd | 8602 | |
| T25 flask | Corning | 430639 | |
| Xylene | VWR | 28975.325 | |
| Xylidine Ponceau | Aldrich | 19.976-1 |
Referências
- Feroz, S., Cathro, P., Ivanovski, S., Muhammad, N. Biomimetic bone grafts and substitutes: A review of recent advancements and applications. Biomed Eng Adv. 6, 100107(2023).
- Tsuji, K., et al. BMP2 activity, although dispensable for bone formation, is required for the initiation of fracture healing. Nat Genet. 38 (12), 1424-1429 (2006).
- Hadjidakis, D. J., Androulakis, I. I. Boneremodeling. Ann N Y Acad Sci. 1092, 385-396 (2006).
- Boivin, G., Meunier, P. J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcified Tiss Int. 70 (6), 503-511 (2002).
- Boivin, G., et al. Influence of remodeling on the mineralization of bone tissue. Osteoporo Int. 20 (6), 1023-1026 (2009).
- Zanghellini, B., et al. Multimodal analysis and comparison of stoichiometric and structural characteristics of parosteal and conventional osteosarcoma with massive sclerosis in human bone. J Str Biol. 216 (3), 108106(2024).
- Trento, G., et al. formation around two titanium implant surfaces placed in bone defects with and without a bone substitute material: A histological, histomorphometric, and micro-computed tomography evaluation. Clin Implant Dent Relat Res. 22 (2), 177-185 (2020).
- Palmquist, A. A multiscale analytical approach to evaluate osseointegration. J Mater Sci Mater Med. 29 (5), 60(2018).
- Budán, F., et al. Novel radiomics evaluation of bone formation utilizing multimodal (SPECT/X-ray CT) in vivo imaging. PLoS ONE. 13 (9), e0204423(2018).
- Hulsart-Billström, G., et al. A surprisingly poor correlation between in vitro and in vivo testing of biomaterials for bone regeneration: results of a multicentre analysis. Eur Cells Mater. 31, 312-322 (2016).
- Cramer, E. E. A., Ito, K., Hofmann, S. Ex vivo bone models and their potential in preclinical evaluation. Curr Osteoporo Rep. 19 (1), 75-87 (2021).
- Chan, M. E., et al. A trabecular bone explant model of osteocyte-osteoblast co-culture for bone mechanobiology. Cell Mol Bioeng. 2 (3), 405-415 (2009).
- Doke, S. K., Dhawale, S. C. Alternatives to animal testing: A review. Saudi Pharma J. 23 (3), 223-229 (2015).
- Moussi, H., et al. New formulation of injectable and degradable calcium phosphate/silanized hyaluronic acid composite foam: Investigation in a rabbit model of long bone defect. SSRN. , (2024).
- Paré, A., et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta Biomater. 154, 626-640 (2022).
- Roschger, P., Fratzl, P., Eschberger, J., Klaushofer, K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies. Bone. 23 (4), 319-326 (1998).
- Roschger, P., Plenk, H., Klaushofer, K., Eschberger, J. A new scanning electron microscopy approach to the quantification of bone mineral distribution: backscattered electron image grey-levels correlated to calcium K alpha-line intensities. Scanning Micro. 9 (1), 75-86 (1995).
- Porter, A., et al. Quick and inexpensive paraffin-embedding method for dynamic bone formation analyses. Sci Rep. 7, 42505(2017).
- Goldschlager, T., Abdelkader, A., Kerr, J., Boundy, I., Jenkin, G. Undecalcified bone preparation for histology, histomorphometry and fluorochrome analysis. J Vis Exp. (35), e1707(2010).
- Kazanci, M., Roschger, P., Paschalis, E. P., Klaushofer, K., Fratzl, P. Bone osteonal tissues by Raman spectral mapping: Orientation-composition. J Str Biol. 156 (3), 489-496 (2006).
- Unal, M., Ahmed, R., Mahadevan-Jansen, A., Nyman, J. S. Compositional assessment of bone by Raman spectroscopy. Analyst. 146 (24), 7464-7490 (2021).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. J Mater Res. 7 (6), 1564-1583 (1992).
- Proffen, B. L., McElfresh, M., Fleming, B. C., Murray, M. M. A comparative anatomical study of the human knee and six animal species. Knee. 19 (4), 493-499 (2012).
- Allen, M. J., Houlton, J. E. F., Adams, S. B., Rushton, N. The surgical anatomy of the stifle joint in Sheep. Vet Surg. 27 (6), 596-605 (1998).
- Kleuskens, M. W. A., van Donkelaar, C. C., Kock, L. M., Janssen, R. P. A., Ito, K. An ex vivo human osteochondral culture model. J Ortho Res. 39 (4), 871-879 (2021).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados