A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحسين تحضير المستضد لمقايسة تثبيط التخثر الدموي لعلم مصل فيروس مرض نيوكاسل
In This Article
Summary
تقدم هذه المقالة طريقة مبسطة لإعداد 4 مستضد لوحدات تضخم الدم للاختبار المصلي لفيروس مرض نيوكاسل. من خلال التحديد الدقيق لعيار التخثر الدموي للمستضد ، جنبا إلى جنب مع طريقة المعايرة بالتحليل الحجمي الخلفي الأكثر صرامة ، وعملية ضبط محددة جيدا ، فإنه يعزز كفاءة الاختبار ، ويقلل من الإيجابيات الكاذبة ، ويحسن مراقبة الأمراض في الدواجن.
Abstract
يعد التقييم الدقيق لعيارات الأجسام المضادة لفيروس مرض نيوكاسل (NDV) أمرا بالغ الأهمية لمكافحة أمراض الدواجن وترميتها بشكل فعال. تقدم هذه المقالة طريقة محسنة لإعداد 4 وحدات تضخم الدم (4-HAU) محلول مستضد ، وهو مكون رئيسي لمقايسة تثبيط التضخم الدموي (HI) المستخدمة في الكشف المصلي عن NDV. على عكس الطرق التقليدية، التي تنطوي على خطوات معايرة بالتحليل الحجمي الخلفي غير المحددة التي تستغرق وقتا طويلا وغير محددة، يعمل هذا النهج على تبسيط هذه العملية عن طريق قياس عيار HA بدقة باستخدام سلسلة أولية من التخفيفات (1:3 و1:5 و1:7 و1:9). كما نقدم طريقة محددة للتعديل أو إعادة الصياغة بناء على نتائج المعايرة بالتحليل الحجمي الخلفي، مما يقلل من الحاجة إلى المعايرة بالتحليل الحجمي العكسي المتكررة. بالإضافة إلى ذلك ، قمنا بتقييم تأثير دقة محلول مستضد 4-HAU على عيار HI في الدم ووجدنا أنه عندما كان عيار مستضد 4-HAU أقل من 3 ، أدى ذلك إلى ظهور عينات HI إيجابية كاذبة. من خلال توفير طريقة دقيقة وتقليل المهام الحسابية إلى أدنى حد ، يزيد هذا النهج من كفاءة الاختبار وموثوقيته ، مما يساهم في تحسين مراقبة الأمراض ومكافحتها في مجموعات الدواجن.
Introduction
مرض نيوكاسل (ND) هو مرض دواجن واسع الانتشار وشديد معترف به عالميا1،2،3. يتجلى من خلال أعراض مختلفة مثل ارتفاع درجة الحرارة وضيق التنفس والدوسنتاريا والاضطرابات العصبية والنزيف المخاطي4. استمر العامل المسبب ، فيروس مرض نيوكاسل (NDV) ، لما يقرب من قرن من الزمان ، حيث أصاب أكثر من 200 نوع من الطيور ، بما في ذلك الدجاج والبط والإوز والحمام5. يحدث الانتقال في المقام الأول من خلال الاتصال المباشر أو غير المباشر بالطيور المصابة ، حيث تعمل الدواجن والحمام والطيور الحرة كخزاناتمحتملة 6. على الرغم من النمط المصلي الفردي ل NDV ، فإن تنوعه الجيني يشكل تحديات كبيرة لإدارة المرض وجهود السيطرةعليه 3،7.
يعمل التطعيم كاستراتيجية أساسية للسيطرة على الكثافة المنخفضة ، تكملها تدابير صارمة للأمن البيولوجي5،8. تتوفر لقاحات تجارية مختلفة على مستوى العالم للدواجن ، مما يثير استجابات قوية للأجسام المضادة في الدم بعد التمنيع9. تلعب هذه الأجسام المضادة دورا مهما في التخفيف من شدة الأعراض عند التعرض لسلالات خبيثة وفي الحد من انتقال القطيع10. تعد بروتوكولات إعادة التطعيم القياسية ، التي تتضمن عادة لقاحات حية موهنة تعطى كل 6-12 أسبوعا ، ممارسة قياسية في المناطق الموبوءة ب ND9. تعد المراقبة الروتينية لعيارات الأجسام المضادة بعد التطعيم في قطعان الدواجن التجارية ضرورية لتقييم فعالية اللقاح11 ، 12 ، 13. قد يشير انخفاض عيار الأجسام المضادة بعد التطعيم إلى فشل اللقاح ، مما يؤدي إلى اتخاذ تدابير تصحيحية في الوقت المناسب مثل التطعيم التكميلي أو التحقيق في العوامل المثبطة للمناعة المحتملة التي تؤثر على الاستجابة المناعية14.
يتم استخدام تقنيات متعددة للكشف عن الأجسام المضادة في المصل ضد NDV ، بما في ذلك مقايسة الممتز المناعي المرتبط بالإنزيم ، وتثبيط التضخم الدموي (HI) ، ومقايسة التحييد9،13،15،16. تقدم كل طريقة مزايا وقيودا فريدة فيما يتعلق بالحساسية والخصوصية والفعالية من حيث التكلفة.
تحدد هذه المقالة بروتوكولا خطوة بخطوة يعتمد على بروتوكول المنظمة العالمية لصحة (OIE) لإجراء HI لتحديد عيار الأجسام المضادة الخاصة بالمصل ضد NDV11. يتضمن التضخم الدموي (HA) ، وهي ظاهرة تسببها بعض الفيروسات المغلفة مثل NDV ، تكتل خلايا الدم الحمراء (RBCs)9. يتفاعل بروتين الهيماجلوتينين-نيورامينيداز (HN) الموجود على سطح NDV مع كرات الدم الحمراء ، مما يؤدي إلى تكتل الخلايا وتكوين الشبكة2. يفضل اختبار HI كطريقة مصلية نظرا لقدرته على تقييم خصوصية الجسم المضاد في الدم تجاه بروتين HN ل NDV8،9. علاوة على ذلك ، فإن فعاليته من حيث التكلفة واستقلاله عن الأجهزة المتخصصة يجعلانه متاحا وعمليا للاستخدام الروتيني.
لتحسين كفاءة الفحص ، قمنا بتحسين سير عمل بروتوكول OIE11 ، مع التركيز على الحصول على عيارات HA أكثر دقة للمستضد وتقديم تعديلات مفصلة لمحلول مستضد 4 وحدات تضخم الدم (4-HAU). بالإضافة إلى ذلك ، من خلال التحليل المقارن ، قمنا بتقييم تأثير دقة 4-HAU على نتائج HI ، مما يوفر رؤى قيمة للممارسين الميدانيين. لا يقتصر هذا النهج على اختبار الأجسام المضادة NDV ولكنه يمتد إلى الكشف عن الأنواع الفرعية الفيروسية والفيروسات الأخرى المكتثة للدم ، بما في ذلك الحصبة وفيروس الورم المتعدد والنكاف والحصبة الألمانية.
Protocol
تم منح الموافقة على البروتوكول من قبل اللجنة المؤسسية المحلية لرعاية واستخدامها. تم إجراء جميع الإجراءات التي تنطوي على مستضدات الفيروس الحية وعينات المصل السريري في مختبر السلامة البيولوجية من المستوى 2 ، وفقا لبروتوكولات السلامة المعمول بها.
1. تحضير 1٪ معلق كرات الدم الحمراء للدجاج
- أضف 3 مل من محلول Alserver (مضاد للتخثر) في أنبوب طرد مركزي مخروطي معقم سعة 15 مل.
- اجمع 1 مل من الدم من الوريد الجناحي لكل من الدجاجات الثلاثة غير المناعية (بدون الأجسام المضادة ل NDV). انقل الدم على الفور إلى الأنبوب الذي يحتوي على مضاد التخثر واخلطه برفق.
- املأ الأنبوب بمحلول ملحي معقم 1x مخزن بالفوسفات (PBS ، درجة الحموضة 7.2-7.4) إلى حجم إجمالي يبلغ 12 مل ، واخلطه برفق. جهاز طرد مركزي عند 500 × جم لمدة 10 دقائق باستخدام دوار أفقي.
- قم بإزالة المادة الطافية وطبقة خلايا الدم البيضاء بعناية. كرر الخطوتين 1.3 و 1.4 2x للحصول على حبيبات كرات الدم الحمراء.
- قم بعكس الماصة 1 مل من حبيبات كرات الدم الحمراء إلى 99 مل من PBS المعقم، لتحضير معلق كرات الدم الحمراء بنسبة 1٪.
ملاحظة: يقدر الحجم المطلوب لتعليق كرات الدم الحمراء للدجاج بنسبة 1٪ ب 3 مل / لوح (25 ميكرولتر / بئر × 96 بئرا × 1.25 = 3.0 مل ؛ حيث يمثل 1.25 هدر الماصات لضمان الحجم الكافي).
2. إعادة تكوين المستضد أو المصل المجفف بالتجميد
- أضف 2 مل من PBS المعقم إلى الأمبولة التي تحتوي على المستضد أو المصل المجفف. رج الأمبولة برفق واتركها تقف لمدة 2-3 دقائق لتقليل الفقاعات وضمان الذوبان الكامل.
ملاحظة: اتبع تعليمات الشركة المصنعة المحددة ، حيث لم تتم مقارنة أنواع مختلفة من المواد المجففة بالتجميد في هذه الدراسة. - قم بتقسيم المحلول المعاد تكوينه إلى أنابيب طرد مركزي سعة 1.5 مل وقم بتجميده عند -20 درجة مئوية حتى الاستخدام.
ملاحظة: أعد تحديد عيار HA في كل مرة يتم فيها إذابة المستضد واستخدامه، أو عند تحضير معلق كرات الدم الحمراء الجديد.
3. معايرة HA للمستضدات
- قم بتوزيع 40 و 80 و 120 و 160 ميكرولتر من PBS ، على التوالي ، في أربعة آبار متجاورة من لوحة ميكروتيتر قاع 96 بئرا يمكن التخلص منها ، ثم أضف 20 ميكرولتر من المستضد إلى كل بئر ، واخلطها عن طريق سحب العينات لأعلى ولأسفل 10x لتحقيق تخفيفات 1: 3 و 1: 5 و 1: 7 و 1: 9 ، على التوالي. يظهر رسم تخطيطي لعملية التخفيف في الشكل 1.
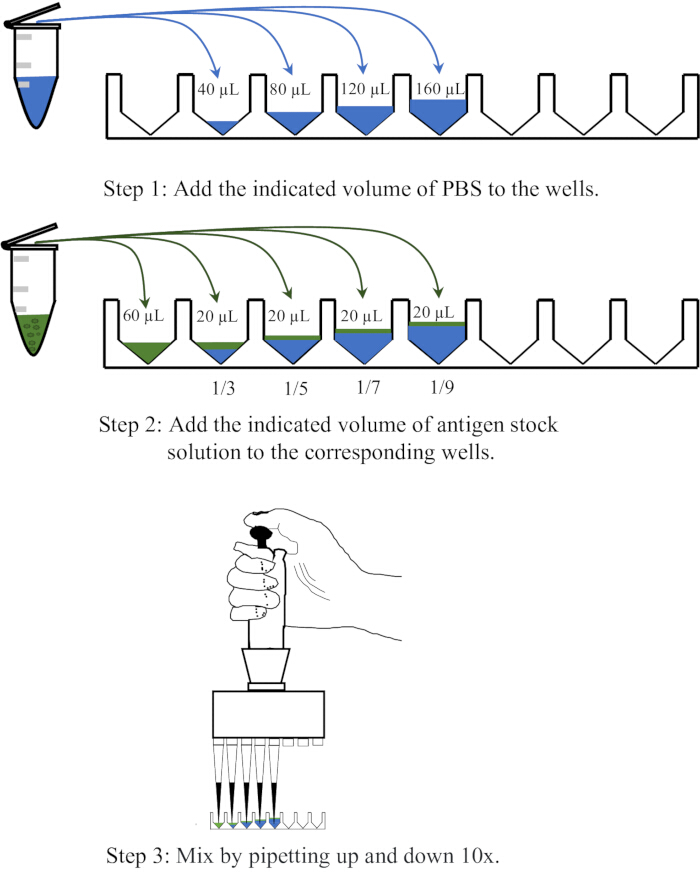
الشكل 1: رسم تخطيطي يوضح إجراء تخفيف محلول المستضد في مقايسة التضخم الدموي. يتم تخفيف محلول المستضد في PBS بنسب 1: 3 و 1: 5 و 1: 7 و 1: 9 على التوالي. يتم تمثيل PBS في الآبار أو أنابيب الطرد المركزي باللون الأزرق ، بينما تظهر المستضدات باللون الأخضر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتسمية لوحة ميكروتيتر جديدة. أضف 25 ميكرولتر من PBS إلى كل بئر في الصفوف 1-5.
- ضع 25 ميكرولتر من محاليل المستضد المخففة في الآبار الأولى من الصفوف من 1 إلى 5 باستخدام ماصة متعددة القنوات، واخلطها عن طريق سحب العينات لأعلى ولأسفل 5 مرات على الأقل.
- انقل 25 ميكرولتر من البئر الأول من كل صف إلى البئر الثاني ، واخلطه جيدا. استمر في الانتقال من بئر إلى آخر ، إلى العمود الحادي عشر ، لإنشاء تخفيفات تسلسلية مزدوجة (1: 2 إلى 1: 2048). تجاهل 25 ميكرولتر بعد العمود الحادي عشر.
- أضف 25 ميكرولتر من PBS إلى كل بئر ، بدءا من الآبار التي تحتوي على أقل تركيز للمستضد.
- أضف 25 ميكرولتر من معلق كرات الدم الحمراء للدجاج بنسبة 1٪ إلى كل بئر ، بدءا من الآبار التي تحتوي على أقل تركيز للمستضد.
- رج الطبق على شاكر دقيق لمدة ~ 20 ثانية لخلطها جيدا.
- اتركه دون إزعاج على سطح الطاولة في درجة حرارة الغرفة (20-25 درجة مئوية) لمدة ~ 30 دقيقة حتى يستقر RBC للعمود 12 تماما. للحصول على تخطيط اللوحة ، راجع الشكل 2.
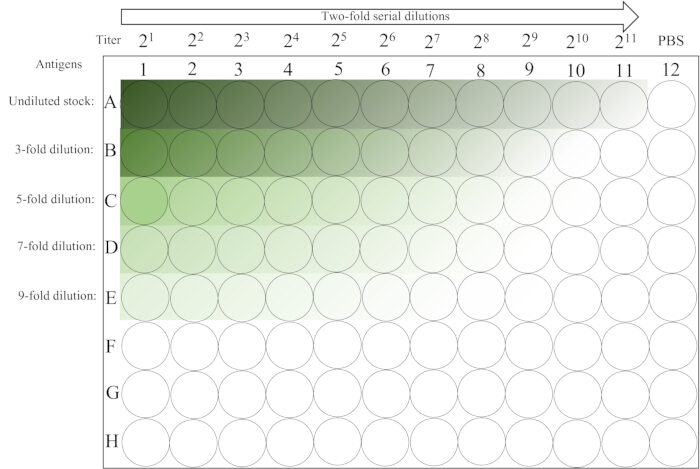
الشكل 2: تخطيط تخطيطي لصفيحة دقيقة مستخدمة في مقايسة التضخم .يحتوي العمود الأول من الصفوف 1-5 على تخفيفات أولية غير مخففة ومختلفة لمحلول المستضد ، متبوعا بتخفيف تسلسلي مزدوج من اليسار إلى اليمين حتى العمود 11. يتم وضع عنصر تحكم PBS في العمود الأخير. يشير التدرج من الظلام إلى الضوء إلى انخفاض تركيز المستضد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اقرأ النتائج وسجلها. يتم تحديد HA عن طريق إمالة اللوحة بمقدار 90 درجة لمدة ~ 25 ثانية ومراقبة وجود أو عدم وجود تدفق على شكل دموع لكرات الدم الحمراء. أعلى تخفيف يظهر تضخم الدم الكامل (بدون دفق) ، يمثل 1 وحدة HA. تعمل الآبار الموجودة في العمود 12 كعناصر تحكم RBC (سلبية).
- احسب عيار HA لكل صف باستخدام الجدول 1 ، والذي يستخدم الحد الأقصى لتحضير محلول مستضد 4-HAU. على سبيل المثال ، إذا كانت a و b و c و d و e تساوي 9 و 8 و 7 و 6 و 6 على التوالي ، فإن 3 × 28 = 768 هي القيمة القصوى ، وهي عيار HA لمخزون المستضد.
| مستضدات | أعلى عمود تخفيف من HA الكامل | عيارية HA للمخزون غير المخفف |
| مخزون غير مخفف | a | 2أ |
| تخفيف 3 أضعاف | b | 3 × 2ب |
| تخفيف 5 أضعاف | c | 5 × 2ج |
| تخفيف 7 أضعاف | d | 7 × 2د |
| تخفيف 9 أضعاف | e | 9 × 2ه |
الجدول 1: نتائج فحص HA وحساب عيار HA لمحلول المخزون.
4. تحضير محلول مستضد 4-HAU
- احسب عامل التخفيف لتحضير محلول مستضد 4-HAU:
 . حدد إجمالي حجم 4-HAU المطلوب: V = 3 مل × عدد الألواح الدقيقة. بعد ذلك ، احسب الأحجام المطلوبة لمحلول مخزون المستضد:
. حدد إجمالي حجم 4-HAU المطلوب: V = 3 مل × عدد الألواح الدقيقة. بعد ذلك ، احسب الأحجام المطلوبة لمحلول مخزون المستضد: 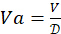 ، و PBS: Vp = V - Va.
، و PBS: Vp = V - Va.
ملاحظة: تقاس الأحجام بالملليلتر. قدر 3 مل لكل صفيحة ميكروتيتر من 4-HAU (25 ميكرولتر / بئر × 96 بئرا × 1.25 = 3 مل). - قم بضرب الحجم المحسوب ل PBS في حاوية ، ثم أضف الحجم المقابل لمحلول مخزون المستضد واخلطه جيدا للحصول على محلول مستضد 4-HAU.
ملاحظة: يجب استخدام محلول مستضد 4-HAU في أسرع وقت ممكن.
5. المعايرة بالتحليل الحجمي الخلفي لمحلول مستضد 4-HAU
- قم بتوزيع 25 و 50 و 75 و 100 و 125 و 150 ميكرولتر من PBS في ستة آبار متجاورة من صفيحة ميكروتيتر ، ثم أضف 25 ميكرولتر من محلول مستضد 4-HAU إلى كل بئر ، واخلطها عن طريق سحب العينات لأعلى ولأسفل 10x.
ملاحظة: قم بتخفيف محلول مستضد 4-HAU باستخدام PBS عند تخفيفات 1: 2 و 1: 3 و 1: 4 و 1: 5 و 1: 6 و 1: 7. يظهر رسم تخطيطي لعملية التخفيف في الشكل 3.
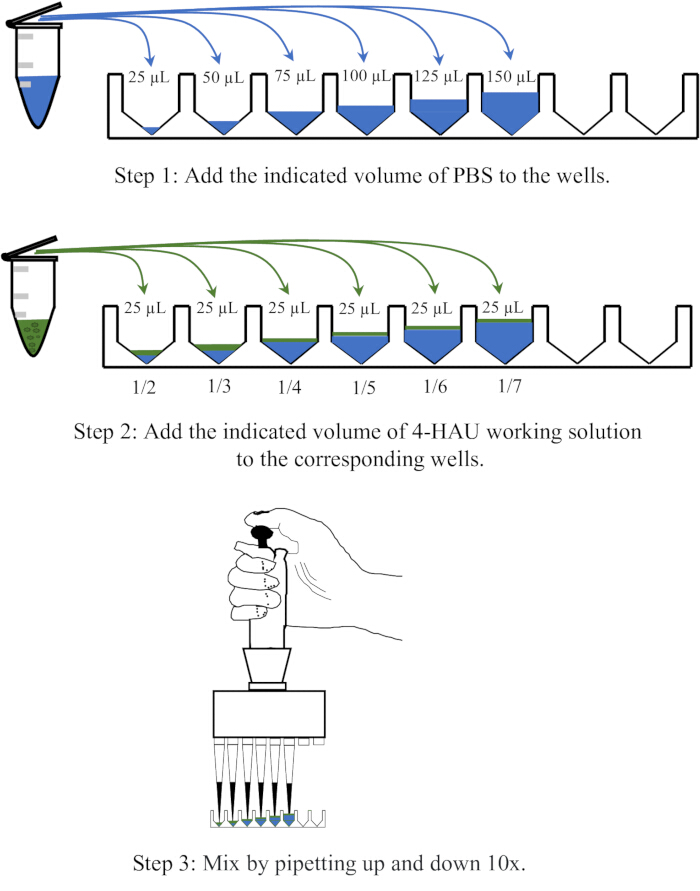
الشكل 3: رسم تخطيطي لإجراء التخفيف لمحلول 4 وحدات تضخم الدم في المعايرة بالتحليل الحجمي الخلفي. يتم تخفيف حل العمل 4-HAU باستخدام PBS بنسب 1: 2 و 1: 3 و 1: 4 و 1: 5 و 1: 6 و 1: 7. تم تصوير PBS باللون الأزرق والمستضدات باللون الأخضر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- انقل 25 ميكرولتر من كل محلول مستضد مخفف إلى آبار صف آخر باستخدام ماصة متعددة القنوات. أضف 25 ميكرولتر من PBS إلى بئر إضافي كعنصر تحكم سلبي.
- أضف 25 ميكرولتر من PBS إلى كل بئر ، ثم أضف 25 ميكرولتر من كرات الدم الحمراء للدجاج بنسبة 1٪ إلى كل بئر.
- رج الطبق على شاكر ميكروبليت لمدة ~ 20 ثانية للخلط.
- اتركه دون إزعاج على سطح الطاولة في درجة حرارة الغرفة (20-25 درجة مئوية) لمدة ~ 30 دقيقة حتى يتم تسوية كرات الدم الحمراء للتحكم السلبي تماما.
- اقرأ النتائج وسجلها.
ملاحظة: يجب ألا يظهر بئر التحكم السلبي HA. من الناحية المثالية ، فإن التخفيف 1: 4 هو بالضبط أعلى تخفيف مع HA كامل. إذا كان عيار محلول 4-HAU أكثر من 4 ، فقد يكون أعلى تخفيف 1: 5 أو 1: 6 أو 1: 7 ؛ إذا كان أقل ، فقد يكون 1: 2 أو 1: 3. يظهر الشكل 4 تخطيطا تخطيطيا للمعايرة بالتحليل الحجمي الخلفي والنتائج التمثيلية.
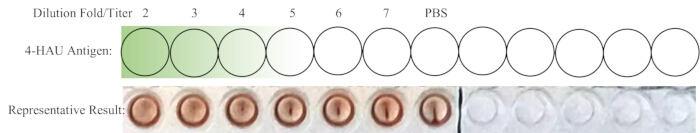
الشكل 4: تخطيط تخطيطي للآبار من أجل المعايرة بالتحليل الحجمي الخلفي والنتيجة التمثيلية. يتم نقل حل العمل 4-HAU المخفف إلى صف جديد ، مع إضافة تحكم PBS إضافي. يشير التدرج من الأخضر الداكن إلى الأخضر الفاتح إلى تركيز المستضد من الأعلى إلى المنخفض. تظهر النتائج التمثيلية أن التخفيف 1: 4 هو أعلى تخفيف يظهر تضخما كاملا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اضبط أو أعد صياغة محلول مستضد 4-HAU إذا لزم الأمر.
ملاحظة: إذا كان حجم محلول مستضد 4-HAU المستخدم في المعايرة بالتحليل الحجمي الخلفي ≤1٪ من الحجم الكلي (حجم محلول مستضد 4-HAU ≥ 15 مل)، فراجع الجدول 2 للحصول على تعديلات محددة. على سبيل المثال ، إذا كان أعلى تخفيف مع HA كامل هو 1: 2 ، فإن عيار محلول مستضد 4-HAU هو الآن 2 ، ويجب إضافة حجم متساو من المستضد كما في التحضير السابق لمحلول مستضد 4-HAU. على العكس من ذلك ، إذا كان أعلى تخفيف ل HA الكامل هو 1: 6 ، فإن العيار الآن هو 6 ، ويجب تجديد نصف حجم PBS.
إذا تجاوز الحجم المستخدم في المعايرة بالتحليل الحجمي الخلفي 1٪ من الإجمالي (حجم محلول مستضد 4-HAU < 15 مل)، فأعد صياغة محلول مستضد 4-HAU باستخدام عامل التخفيف المصحح. انظر الجدول 3 للاطلاع على التصويبات المحددة. على سبيل المثال ، إذا كان أعلى تخفيف ل HA الكامل هو 1: 2 ، فإن عيار محلول مستضد 4-HAU هو الآن 2 ويجب تعديل عامل التخفيف إلى 1/2 من الأصل. على العكس من ذلك ، إذا كان أعلى تخفيف ل HA الكامل هو 1: 6 ، فإن عيار محلول مستضد 4-HAU هو الآن 6 ، ويتم ضبط عامل التخفيف إلى 3/2 من الأصل.
| عيارية HA للمعايرة بالتحليل الحجمي الخلفي | تجديد المستضد أو PBS |
| 1:2 | خامسا |
| 1:3 | [فا/3] |
| 1:5 | نائب الرئيس / 4 |
| 1:6 | نائب الرئيس / 2 |
| 1:7 | 3 فولت / 4 |
الجدول 2: الجدول المرجعي لضبط تركيز 4-HAU بناء على نتائج المعايرة بالتحليل الحجمي الخلفي. يمثل Va و Vp أحجام المستضد و PBS المستخدمة في صياغة محلول مستضد 4-HAU ، على التوالي.
| عيارية HA للمعايرة بالتحليل الحجمي الخلفي | تصحيح عامل التخفيف |
| 1:2 | د/2 |
| 1:3 | 3D / 4 |
| 1:5 | 5 د / 4 |
| 1:6 | 3D / 2 |
| 1:7 | 7 د / 4 |
الجدول 3: الجدول المرجعي لتصحيح عامل التخفيف لإعادة تحضير مستضد 4-HAU. يمثل D عامل التخفيف المستخدم سابقا في تحضير مستضد 4-HAU.
6. تحضير المصل
- اجمع ~ 1 مل من الدم من أجنحة الدجاج دون استخدام مضاد للتخثر.
- انقل الدم إلى أنبوب طرد مركزي سعة 1.5 مل واحتضنه عند 37 درجة مئوية لمدة ~2 ساعة. جهاز طرد مركزي عند 3,000 × جم لمدة 10 دقائق ، وشفط المادة الطافية بعناية إلى أنبوب جديد.
7. اختبار HI
- قم بتسمية لوحات microtiter وفقا لتخطيط الفحص. أضف 25 ميكرولتر من PBS إلى كل بئر في الأعمدة 1-11، و 50 ميكرولتر إلى الآبار في العمود 12، باستخدام ماصة متعددة القنوات.
- أضف 25 ميكرولتر من المصل إلى البئر الأول من كل صف ، بما في ذلك صفوف التحكم في المصل الإيجابية والسلبية. تخلط جيدا عن طريق سحب العينات لأعلى ولأسفل لمدة 5 مرات على الأقل.
- انقل 25 ميكرولتر من البئر الأول من كل صف إلى البئر الثاني واخلطه جيدا. استمر في النقل والخلط من البئر الثاني إلى الثالث ، وهكذا ، حتى العمود العاشر. تخلص من 25 ميكرولتر من السائل من البئر في العمود العاشر بعد الخلط.
- أضف 25 ميكرولتر من مستضد 4-HAU إلى كل بئر في الأعمدة 1-11 في اتجاه تركيز المصل المنخفض إلى العالي.
- رج الطبق على شاكر ميكروبليت لمدة ~ 20 ثانية. اتركه دون إزعاج على سطح الطاولة لمدة ~ 30 دقيقة.
- أضف 25 ميكرولتر من كرات الدم الحمراء للدجاج 1٪ إلى كل بئر في اتجاه تركيز الدم المنخفض إلى العالي.
- رج الطبق على شاكر دقيق لمدة ~ 20 ثانية لخلطها جيدا. اتركه دون إزعاج على سطح الطاولة لمدة ~ 30 دقيقة حتى يتم تسوية كرات الدم الحمراء لآبار التحكم في PBS تماما.
- اقرأ النتائج وسجلها.
ملاحظة: عيار HI هو أعلى تخفيف في المصل يمنع تماما تضخم الدم لمستضد 4-HAU. يمكن ملاحظة تدفق كرات الدم الحمراء على شكل دموع في العمود الأخير من كل صف ، عن طريق إمالة اللوحة 90 درجة لمدة 25 ثانية. يمكن ملاحظة HA الكامل (بدون بث) في البئر الثاني الأخير من نهاية كل صف. تتطلب نتائج الاختبار الصحيحة أن يكون عيار HI للتحكم الإيجابي في المصل ضمن تخفيف واحد من عيار HI المعروف. عيار HI للتحكم السلبي في المصل ليكون ≤ 2 log2 ؛ وغياب HA الذاتي للتحكم في كرات الدم الحمراء. للحصول على رسم تخطيطي لسير عمل مقايسة HA، راجع الشكل 5.
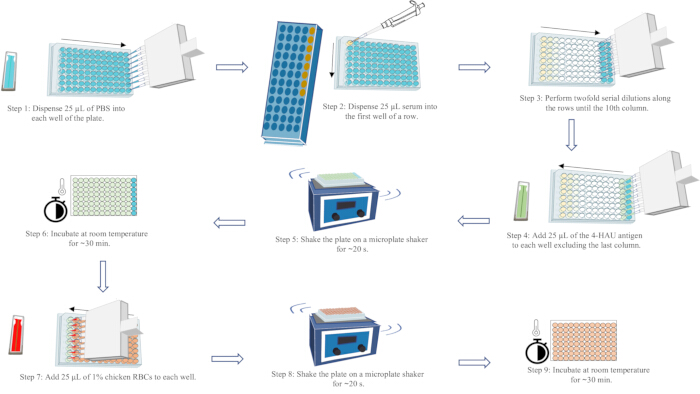
الشكل 5: رسم تخطيطي لسير عمل مقايسة التضخم. يتم تمثيل PBS باللون الأزرق ، والمصل باللون الأصفر ، ومحلول المستضد 4-HAU باللون الأخضر ، وتعليق كرات الدم الحمراء للدجاج بنسبة 1٪ باللون الأحمر. تشير الأسهم إلى ترتيب توزيع السائل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
التحقق من صحة عيار محلول مستضد 4-HAU المصمم باستخدام الطريقة المحسنة
استخدمت الدراسة تخفيفات مختلفة لمحلول مخزون المستضد لتحديد عيار HA بدقة ، مما يسهل حساب عامل التخفيف لتحضير محلول مستضد 4-HAU. تكشف النتائج أن الطريقة المحسنة فعالة ودقيقة على حد سواء، مما يقلل م?...
Discussion
تقدم الطريقة المحسنة المقترحة في هذه المقالة نهجا لإعداد محلول مستضد 4-HAU بدقة. على الرغم من أن إرشادات المنظمة العالمية لصحة والاتحاد الأوروبي تقترح تخفيفات أولية للمعايرة بالتحليل الحجمي HA ، إلا أنها لا تقدم تفاصيل دقيقة فيما يتعلق بنسب التخفيف التي سيتم استخدامها أو تقدم منهجيا?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم CC من قبل برنامج Taicang Technology (TC2021JC16) ، وصناديق فريق الابتكار في معهد Suzhou Chien-shiung للتكنولوجيا (2023JXKYTD01). تم دعم H.Y. من قبل برنامج Taicang Technology (TC2021JC11). كلاهما مدعوم من قبل صندوق بدء التشغيل للدكتوراه الجدد الباحثين في معهد سوتشو شين شيونغ للتكنولوجيا.
Materials
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
References
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved