Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Optimierung der Antigenpräparation für den Hämagglutinationshemmungsassay der Newcastle-Disease-Virus-Serologie
In diesem Artikel
Zusammenfassung
In diesem Artikel wird eine vereinfachte Methode zur Herstellung von 4 Hämagglutinationseinheiten Antigen für serologische Tests auf das Virus der Newcastle-Krankheit vorgestellt. Durch die genaue Bestimmung des Hämagglutinationstiters des Antigens, kombiniert mit einer strengeren Rücktitrationsmethode und einem genau definierten Anpassungsprozess, erhöht es die Testeffizienz, reduziert falsch positive Ergebnisse und verbessert die Krankheitsüberwachung bei Geflügel.
Zusammenfassung
Die genaue Bestimmung der Antikörpertiter des Newcastle-Disease-Virus (NDV) ist entscheidend für eine wirksame Bekämpfung und Überwachung von Geflügelkrankheiten. In diesem Artikel wird eine optimierte Methode zur Herstellung einer 4-Hämagglutinationseinheiten (4-HAU)-Antigenlösung vorgestellt, einer Schlüsselkomponente des Hämagglutinationshemmungsassays (HI), der beim serologischen NDV-Nachweis verwendet wird. Im Gegensatz zu herkömmlichen Methoden, die zeitaufwändige und undefinierte Rücktitrations- und Anpassungsschritte erfordern, rationalisiert dieser Ansatz diesen Prozess, indem der HA-Titer anhand einer ersten Reihe von Verdünnungen (1:3, 1:5, 1:7 und 1:9) genau gemessen wird. Wir bieten auch eine spezielle Methode zur Anpassung oder Neuformulierung basierend auf den Ergebnissen der Rücktitration an, um die Notwendigkeit wiederholter Rücktitrationen zu reduzieren. Darüber hinaus untersuchten wir den Einfluss der Genauigkeit der 4-HAU-Antigenlösung auf den HI-Titer im Serum und stellten fest, dass ein Titer des 4-HAU-Antigens unter 3 zum Auftreten falsch-positiver HI-Proben führte. Durch die Bereitstellung einer genauen Methode und die Minimierung von Rechenaufgaben erhöht dieser Ansatz die Effizienz und Zuverlässigkeit der Tests und trägt zu einer verbesserten Krankheitsüberwachung und -kontrolle in Geflügelpopulationen bei.
Einleitung
Die Newcastle-Krankheit (ND) ist eine weit verbreitete und schwere Geflügelkrankheit, die weltweit bekannt ist 1,2,3. Sie äußert sich durch verschiedene Symptome wie hohes Fieber, Atemnot, Ruhr, nervöse Störungen und Schleimhautblutungen4. Der Erreger, das Newcastle-Disease-Virus (NDV), hält sich seit fast einem Jahrhundert und befällt mehr als 200 Vogelarten, darunter Hühner, Enten, Gänse und Tauben5. Die Übertragung erfolgt hauptsächlich durch direkten oder indirekten Kontakt mit infizierten Vögeln, wobei Geflügel, Tauben und freilaufende Vögel als potenzielle Reservoire dienen6. Trotz des einzigen Serotyps von NDV stellt seine genetische Vielfalt erhebliche Herausforderungen für das Krankheitsmanagement und die Krankheitsbekämpfungdar 3,7.
Die Impfung dient als primäre Strategie zur Kontrolle der Nacktnarbenkrankheit und wird durch strenge Biosicherheitsmaßnahmen ergänzt 5,8. Für Geflügel sind weltweit verschiedene kommerzielle Impfstoffe verfügbar, die nach der Immunisierung robuste Serum-Antikörperreaktionen hervorrufen9. Diese Antikörper spielen eine entscheidende Rolle bei der Milderung der Schwere der Symptome bei Exposition gegenüber virulenten Stämmen und bei der Eindämmung der Übertragung zwischen den Herden10. Standard-Wiederholungsimpfprotokolle, bei denen in der Regel abgeschwächte Lebendimpfstoffe alle 6-12 Wochen verabreicht werden, sind in Regionen, die endemisch für ND9 sind, Standard. Die routinemäßige Überwachung der Antikörpertiter nach der Impfung in kommerziellen Geflügelherden ist für die Beurteilung der Wirksamkeit des Impfstoffs von entscheidender Bedeutung 11,12,13. Niedrige Antikörpertiter nach der Impfung können auf ein Versagen des Impfstoffs hinweisen, was rechtzeitige Korrekturmaßnahmen wie eine Zusatzimpfung oder die Untersuchung potenzieller immunsuppressiver Faktoren, die die Immunantwort beeinflussen, erforderlich macht14.
Für den Nachweis von Serumantikörpern gegen NDV werden mehrere Techniken eingesetzt, darunter der enzymgebundene Immunsorbent-Assay, die Hämagglutinationshemmung (HI) und der Neutralisationsassay 9,13,15,16. Jede Methode bietet einzigartige Vorteile und Einschränkungen in Bezug auf Sensitivität, Spezifität und Kosteneffizienz.
In diesem Artikel wird ein Schritt-für-Schritt-Protokoll beschrieben, das auf dem Protokoll der Weltorganisation für Tiergesundheit (OIE) für die Durchführung von HI basiert, um serumspezifische Antikörpertiter gegen NDV11 zu quantifizieren. Bei der Hämagglutination (HA), einem Phänomen, das durch bestimmte behüllte Viren wie NDV hervorgerufen wird, kommt es zur Verklumpung der roten Blutkörperchen (RBCs)9. Das Hämagglutinin-Neuraminidase-Protein (HN) auf der NDV-Oberfläche interagiert mit Erythrozyten, was zu Zellverklumpung und Gitterbildung führt2. Der HI-Assay wird als serologische Methode bevorzugt, da er die Serum-Antikörperspezifität gegenüber dem HN-Protein von NDV 8,9 beurteilen kann. Darüber hinaus ist es aufgrund seiner Kosteneffizienz und Unabhängigkeit von Spezialinstrumenten für den Routineeinsatz zugänglich und praktisch.
Um die Effizienz des Assays zu verbessern, haben wir den Arbeitsablauf des OIE-Protokolls11 verfeinert, wobei der Schwerpunkt auf der Erzielung genauerer Antigen-HA-Titer lag und detaillierte Anpassungen für die Antigenlösung mit 4 Hämagglutinationseinheiten (4-HAU) angeboten wurden. Darüber hinaus bewerteten wir durch vergleichende Analysen den Einfluss der 4-HAU-Genauigkeit auf die HI-Ergebnisse, was wertvolle Erkenntnisse für Feldpraktiker lieferte. Dieser Ansatz ist nicht auf NDV-Antikörpertests beschränkt, sondern erstreckt sich auch auf den Nachweis von viralen Subtypen und anderen hämagglutinierenden Viren, einschließlich Masern, Polyomaviren, Mumps und Röteln.
Protokoll
Die Genehmigung für das Protokoll wurde vom örtlichen institutionellen Ausschuss für Tierpflege und -verwendung erteilt. Alle Verfahren mit lebenden Virusantigenen und klinischen Serumproben wurden in einem Labor der Biosicherheitsstufe 2 in Übereinstimmung mit den festgelegten Sicherheitsprotokollen durchgeführt.
1. Zubereitung von 1% Hühner-RBC-Suspension
- Geben Sie 3 mL Alserver-Lösung (Antikoagulans) in ein steriles konisches 15-ml-Zentrifugenröhrchen.
- Entnehmen Sie 1 ml Blut aus der Flügelvene jedes der drei nicht immunen Hühner (ohne NDV-Antikörper). Übertragen Sie das Blut sofort in das Röhrchen mit dem Antikoagulans und mischen Sie es vorsichtig.
- Füllen Sie das Röhrchen mit steriler 1x phosphatgepufferter Kochsalzlösung (PBS, pH 7,2-7,4) auf ein Gesamtvolumen von 12 mL und mischen Sie vorsichtig. Zentrifugieren Sie bei 500 × g für 10 min mit einem horizontalen Rotor.
- Entfernen Sie vorsichtig den Überstand und die weiße Blutkörperchenschicht. Wiederholen Sie die Schritte 1.3 und 1.4 2x, um das RBC-Pellet zu erhalten.
- Pipettieren Sie 1 ml des Erythrozyten-Pellets in 99 ml steriles PBS, um eine 1%ige Erythrozytensuspension herzustellen.
HINWEIS: Das erforderliche Volumen der 1%igen Hühner-Erythrc-Suspension wird auf 3 ml/Platte geschätzt (25 μl/Vertiefung x 96 Vertiefungen x 1,25 = 3,0 ml; wobei 1,25 die Pipettierverschwendung berücksichtigt, um ein ausreichendes Volumen zu gewährleisten).
2. Rekonstitution von lyophilisiertem Antigen oder Serum
- Geben Sie 2 ml steriles PBS in die Ampulle, die das lyophilisierte Antigen oder Serum enthält. Schütteln Sie die Ampulle vorsichtig und lassen Sie sie 2-3 Minuten stehen, um Blasen zu minimieren und eine vollständige Auflösung zu gewährleisten.
HINWEIS: Befolgen Sie die spezifischen Anweisungen des Herstellers, da die verschiedenen Arten von lyophilisierten Materialien in dieser Studie nicht verglichen wurden. - Die rekonstituierte Lösung wird in 1,5-ml-Zentrifugenröhrchen aliquotiert und bis zur Verwendung bei -20 °C eingefroren.
HINWEIS: Bestimmen Sie den HA-Titer jedes Mal neu, wenn das Antigen aufgetaut und verwendet wird oder wenn eine neue Erythrozytensuspension hergestellt wird.
3. HA-Titration von Antigenen
- Dispensieren Sie 40, 80, 120 bzw. 160 μl PBS in vier benachbarte Vertiefungen einer Einweg-96-Well-Mikrotiterplatte mit V-Boden, fügen Sie dann 20 μl Antigen in jede Vertiefung hinzu und mischen Sie, indem Sie 10x auf und ab pipettieren, um Verdünnungen von 1:3, 1:5, 1:7 bzw. 1:9 zu erreichen. Ein schematisches Diagramm des Verdünnungsvorgangs ist in Abbildung 1 dargestellt.
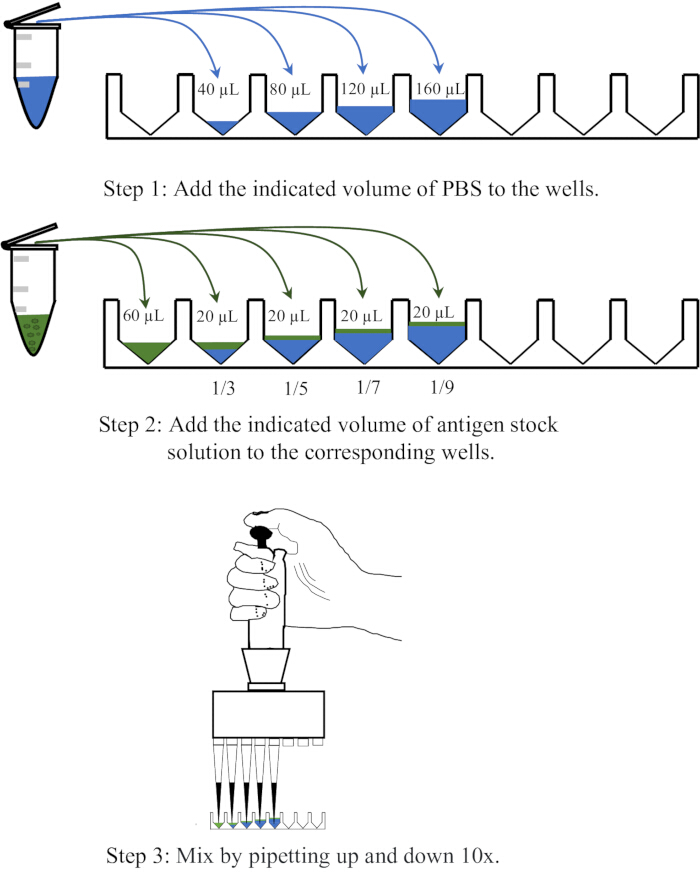
Abbildung 1: Schematische Darstellung des Verfahrens zur Verdünnung der Antigenlösung im Hämagglutinationsassay. Die Antigenlösung wird in PBS im Verhältnis 1:3, 1:5, 1:7 bzw. 1:9 verdünnt. PBS in Vertiefungen oder Zentrifugenröhrchen ist blau dargestellt, während Antigene in grün dargestellt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Beschriften Sie eine neue Mikrotiterplatte. Geben Sie 25 μl PBS in jede Vertiefung in den Reihen 1-5.
- 25 μl der verdünnten Antigenlösungen mit einer Mehrkanalpipette in die ersten Vertiefungen der Reihen 1 bis 5 geben und durch Auf- und Abpipettieren mindestens 5x mischen.
- Übertragen Sie 25 μl aus der ersten Vertiefung jeder Reihe in die zweite Vertiefung und mischen Sie sie gründlich. Fahren Sie mit dem Transfer von einer Vertiefung zur nächsten bis zur 11. Säule fort, um zweifache serielle Verdünnungen (1:2 bis 1:2048) zu erzeugen. 25 μl nach der 11. Spalte verwerfen.
- Geben Sie 25 μl PBS in jede Vertiefung, beginnend mit der Vertiefung mit der niedrigsten Antigenkonzentration.
- Geben Sie 25 μl 1%ige Hühner-RBC-Suspension in jede Vertiefung, beginnend mit den Vertiefungen mit der niedrigsten Antigenkonzentration.
- Schütteln Sie die Platte auf einem Mikroplatten-Shaker für ~20 s, um sie gründlich zu mischen.
- Lassen Sie es ungestört auf der Tischplatte bei Raumtemperatur (20-25 °C) für ~30 min, bis sich die RBC der 12. Säule vollständig abgesetzt haben. Für das Plattenlayout siehe Abbildung 2.
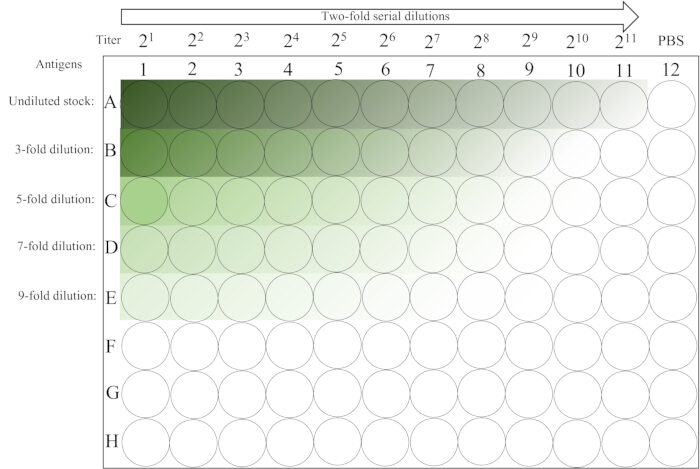
Abbildung 2: Schematischer Aufbau einer Mikroplatte, die im Hämagglutinationsassay verwendet wird. Die erste Spalte der Zeilen 1-5 enthält unverdünnte und verschiedene Anfangsverdünnungen der Antigenlösung, gefolgt von einer zweifachen seriellen Verdünnung von links nach rechts bis Spalte 11. Das PBS-Steuerelement wird in der letzten Spalte platziert. Der Gradient von dunkel nach hell deutet auf eine abnehmende Antigenkonzentration hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Lesen und notieren Sie die Ergebnisse. HA wird bestimmt, indem die Platte um 90° für ~25 s gekippt wird und das Vorhandensein oder Fehlen von tränenförmigen Strömungen der Erythrozyten beobachtet wird. Die höchste Verdünnung mit vollständiger Hämagglutination (kein Strömen) entspricht 1 HA-Einheit. Vertiefungen in der 12. Spalte dienen als RBC-Kontrollen (Negativkontrolle).
- Berechnen Sie den HA-Titer jeder Reihe anhand von Tabelle 1, deren Maximum für die Herstellung der 4-HAU-Antigenlösung verwendet wird. Wenn z. B. a, b, c, d und e gleich 9, 8, 7, 6, 6 sind, dann ist 3 x 28 = 768 der Maximalwert und der HA-Titer des Antigenbestands.
| Antigene | Säule mit der höchsten Verdünnung von kompletter HA | HA-Titer der unverwässerten Aktien |
| Unverwässerte Aktien | ein | 2A |
| 3-fache Verdünnung | b | 3 x 2B |
| 5-fache Verdünnung | c | 5 x 2cm |
| 7-fache Verdünnung | d | 7 x 2d |
| 9-fache Verdünnung | e | 9 x 2e |
Tabelle 1: Ergebnisse des HA-Assays und Berechnung des HA-Titers der Stammlösung.
4. Herstellung der 4-HAU-Antigenlösung
- Berechnen Sie den Verdünnungsfaktor für die Herstellung der 4-HAU-Antigenlösung:
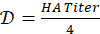 . Bestimmen Sie das insgesamt benötigte 4-HAU-Volumen: V = 3 ml x Anzahl der Mikrotiterplatten. Berechnen Sie dann die erforderlichen Volumina der Antigen-Stammlösung:
. Bestimmen Sie das insgesamt benötigte 4-HAU-Volumen: V = 3 ml x Anzahl der Mikrotiterplatten. Berechnen Sie dann die erforderlichen Volumina der Antigen-Stammlösung: 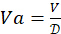 und PBS: Vp = V - Va.
und PBS: Vp = V - Va.
HINWEIS: Die Volumina werden in Millilitern gemessen. Schätzen Sie 3 mL pro Mikrotiterplatte des 4-HAU (25 μl/Vertiefung x 96 Vertiefungen x 1,25 = 3 ml). - Pipettieren Sie das berechnete PBS-Volumen in einen Behälter, fügen Sie dann das entsprechende Volumen der Antigen-Stammlösung hinzu und mischen Sie gut, um die 4-HAU-Antigenlösung zu erhalten.
HINWEIS: Die 4-HAU-Antigenlösung sollte so bald wie möglich verwendet werden.
5. Rücktitration der 4-HAU-Antigenlösung
- Dispensieren Sie 25, 50, 75, 100, 125 und 150 μl PBS in sechs benachbarte Vertiefungen einer Mikrotiterplatte, fügen Sie dann 25 μl der 4-HAU-Antigenlösung in jede Vertiefung hinzu und mischen Sie, indem Sie 10x auf und ab pipettieren.
HINWEIS: Verdünnen Sie die 4-HAU-Antigenlösung mit PBS in Verdünnungen von 1:2, 1:3, 1:4, 1:5, 1:6 und 1:7. Ein schematisches Diagramm des Verdünnungsvorgangs ist in Abbildung 3 dargestellt.
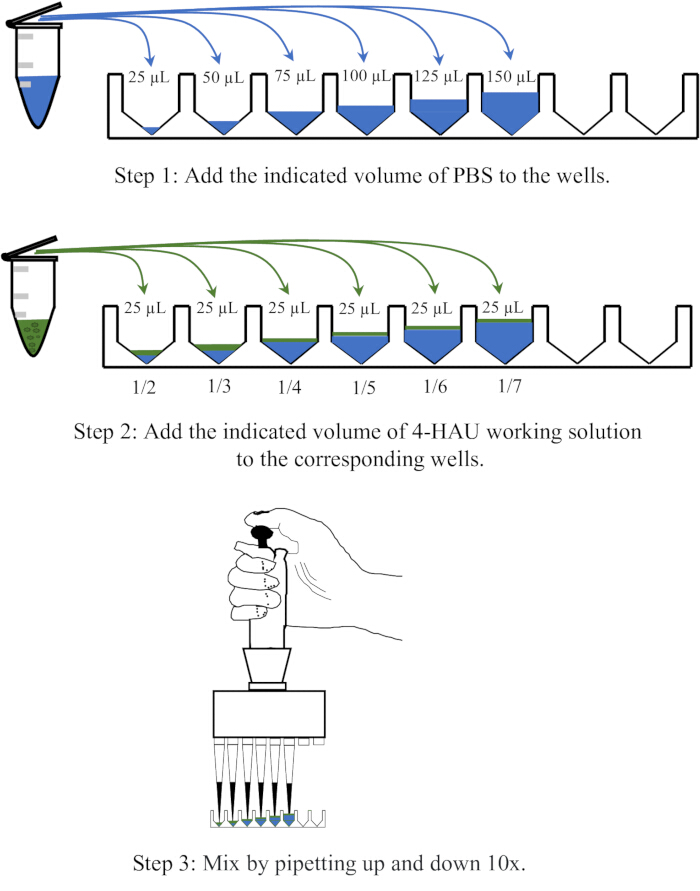
Abbildung 3: Schematische Darstellung des Verdünnungsverfahrens der Lösung von 4 Hämagglutinationseinheiten bei der Rücktitration. Die 4-HAU-Arbeitslösung wird mit PBS im Verhältnis 1:2, 1:3, 1:4, 1:5, 1:6 und 1:7 verdünnt. PBS ist in Blau und Antigene in Grün dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Übertragen Sie 25 μl jeder verdünnten Antigenlösung mit einer Mehrkanalpipette in die Vertiefungen einer anderen Reihe. Geben Sie 25 μl PBS als Negativkontrolle in eine zusätzliche Vertiefung.
- Geben Sie 25 μl PBS in jede Vertiefung und fügen Sie dann 25 μl 1 % Hühnerfleisch in jede Vertiefung hinzu.
- Schütteln Sie die Platte auf einem Mikroplatten-Shaker für ~20 s zum Mischen.
- Lassen Sie es ungestört bei Raumtemperatur (20-25 °C) für ~30 min, bis sich die Erythrozyten der Negativkontrolle vollständig abgesetzt haben.
- Lesen und notieren Sie die Ergebnisse.
HINWEIS: Die Vertiefung der Negativkontrolle sollte keine HA anzeigen. Im Idealfall ist die 1:4-Verdünnung genau die höchste Verdünnung mit vollständiger HA. Wenn der Titer der 4-HAU-Lösung mehr als 4 beträgt, kann die höchste Verdünnung 1:5, 1:6 oder 1:7 betragen; Wenn weniger, kann es 1:2 oder 1:3 sein. Ein schematischer Aufbau der Rücktitration und repräsentative Ergebnisse sind in Abbildung 4 dargestellt.
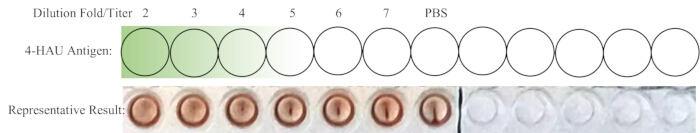
Abbildung 4: Schematische Anordnung der Vertiefungen für die Rücktitration und repräsentatives Ergebnis. Die verdünnte 4-HAU-Arbeitslösung wird in eine neue Reihe überführt, wobei eine zusätzliche PBS-Steuerung hinzugefügt wird. Der Gradient von dunkel zu hellgrün zeigt die Antigenkonzentration von hoch nach niedrig an. Repräsentative Ergebnisse zeigen, dass die 1:4-Verdünnung die höchste Verdünnung ist, die eine vollständige Hämagglutination zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Passen Sie die 4-HAU-Antigenlösung bei Bedarf an oder formulieren Sie sie neu.
HINWEIS: Wenn das Volumen der 4-HAU-Antigenlösung, die bei der Rücktitration verwendet wird, ≤1 % des Gesamtvolumens beträgt (das Volumen der 4-HAU-Antigenlösung ≥ 15 ml), finden Sie in Tabelle 2 spezifische Anpassungen. Wenn beispielsweise die höchste Verdünnung mit vollständiger HA 1:2 beträgt, beträgt der Titer der 4-HAU-Antigenlösung nun 2, und es sollte das gleiche Volumen Antigen hinzugefügt werden wie bei der vorherigen Herstellung der 4-HAU-Antigenlösung. Umgekehrt, wenn die höchste Verdünnung der vollständigen HA 1:6 beträgt, beträgt der Titer jetzt 6, und die Hälfte des PBS-Volumens sollte wieder aufgefüllt werden.
Wenn das für die Rücktitration verwendete Volumen 1 % des Gesamtvolumens (das Volumen der 4-HAU-Antigenlösung < 15 ml) übersteigt, wird die 4-HAU-Antigenlösung unter Verwendung des korrigierten Verdünnungsfaktors neu formuliert. Die spezifischen Korrekturen finden Sie in Tabelle 3 . Wenn beispielsweise die höchste Verdünnung der vollständigen HA 1:2 beträgt, beträgt der Titer der 4-HAU-Antigenlösung jetzt 2 und der Verdünnungsfaktor sollte auf 1/2 des Originals angepasst werden. Beträgt die höchste Verdünnung der vollständigen HA hingegen 1:6, beträgt der Titer der 4-HAU-Antigenlösung nun 6, und der Verdünnungsfaktor wird auf 3/2 des Originals eingestellt.
| HA-Titer der Rücktitration | Auffüllung von Antigen oder PBS |
| 1:2 | Va |
| 1:3 | VA/3 |
| 1:5 | Vp/4 |
| 1:6 | Vp/2 |
| 1:7 | 3Vp/4 |
Tabelle 2: Referenztabelle zur Anpassung der 4-HAU-Konzentration auf der Grundlage der Rücktitrationsergebnisse. Va und Vp repräsentieren die Volumina an Antigen und PBS, die bei der Formulierung der 4-HAU-Antigenlösung verwendet werden.
| HA-Titer der Rücktitration | Korrektur des Verdünnungsfaktors |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5T/4 |
| 1:6 | 3D/2 |
| 1:7 | 7T/4 |
Tabelle 3: Referenztabelle der Verdünnungsfaktorkorrektur für die erneute Aufbereitung des 4-HAU-Antigens. D steht für den Verdünnungsfaktor, der zuvor bei der Herstellung von 4-HAU-Antigenen verwendet wurde.
6. Zubereitung des Serums
- Sammeln Sie ~1 ml Blut aus Hühnerflügeln, ohne ein Antikoagulans zu verwenden.
- Übertragen Sie das Blut in ein 1,5-ml-Zentrifugenröhrchen und inkubieren Sie es bei 37 °C für ~2 h. Bei 3.000 x g für 10 min zentrifugieren und den Überstand vorsichtig in ein neues Röhrchen ansaugen.
7. HI-Assay
- Markieren Sie Mikrotiterplatten entsprechend dem Assay-Layout. Geben Sie mit einer Mehrkanalpipette 25 μl PBS in jede Vertiefung in den Spalten 1-11 und 50 μl in die Vertiefungen in Spalte 12.
- Geben Sie 25 μl Serum in die erste Vertiefung jeder Reihe, einschließlich positiver und negativer Serumkontrollreihen. Mischen Sie gründlich, indem Sie mindestens 5x auf und ab pipettieren.
- Übertragen Sie 25 μl aus der ersten Vertiefung jeder Reihe in die zweite Vertiefung und mischen Sie sie gründlich. Fahren Sie mit dem Übertragen und Mischen von der zweiten Vertiefung in die dritte Vertiefung usw. fort, bis zur 10. Spalte. 25 μl Flüssigkeit aus der Vertiefung in der 10. Säule nach dem Mischen verwerfen.
- Geben Sie 25 μl 4-HAU-Antigen in jede Vertiefung in den Spalten 1-11 in Richtung einer niedrigen bis hohen Serumkonzentration.
- Schütteln Sie die Platte auf einem Mikrotiterplatten-Shaker für ~20 s. Lassen Sie es für ~30 min ungestört auf der Arbeitsplatte.
- Geben Sie 25 μl 1 % Hühner-Erythrozyten in jede Vertiefung in Richtung einer niedrigen bis hohen Serumkonzentration.
- Schütteln Sie die Platte auf einem Mikroplatten-Shaker für ~20 s, um sie gründlich zu mischen. Lassen Sie es ~30 min lang ungestört auf dem Labortisch, bis sich die Erythrozyten der PBS-Kontrollwellen vollständig abgesetzt haben.
- Lesen und notieren Sie die Ergebnisse.
HINWEIS: Der HI-Titer ist die höchste Serumverdünnung, die die Hämagglutination des 4-HAU-Antigens vollständig hemmt. Eine tränenförmige Strömung von Erythrozyten kann in der letzten Spalte jeder Reihe beobachtet werden, indem die Platte um 25 s um 90° gekippt wird. Vollständiges HA (kein Streaming) kann in der vorletzten Vertiefung ab dem Ende jeder Reihe beobachtet werden. Gültige Testergebnisse setzen voraus, dass der HI-Titer der positiven Serumkontrolle innerhalb einer Verdünnung des bekannten HI-Titers liegt; der HI-Titer der negativen Serumkontrolle muss ≤ 2 log2 betragen; und das Fehlen von Selbst-HA der RBC-Kontrolle. Ein schematisches Diagramm des Arbeitsablaufs des HA-Assays finden Sie in Abbildung 5.
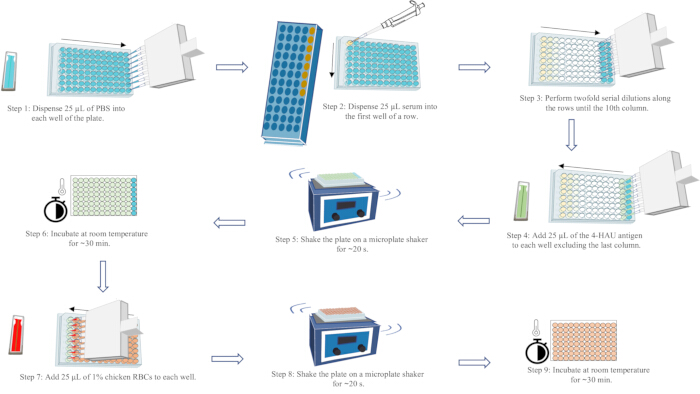
Abbildung 5: Schematische Darstellung des Arbeitsablaufs des Hämagglutinationsassays. PBS ist in blau, Serum in gelb, die 4-HAU-Antigenlösung in grün und die 1%ige Hühner-Erythrozyten-Suspension in rot dargestellt. Pfeile zeigen die Reihenfolge der Flüssigkeitsabgabe an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Validierung des Titers der 4-HAU-Antigenlösung, die nach der optimierten Methode formuliert wurde
In der Studie wurden verschiedene Verdünnungen der Antigen-Stammlösung verwendet, um den HA-Titer genau zu bestimmen und die Berechnung des Verdünnungsfaktors für die Herstellung der 4-HAU-Antigenlösung zu erleichtern. Die Ergebnisse zeigen, dass die optimierte Methode sowohl effizient als auch präzise ist und die Anzahl der sich wiederholenden Rücktitrations- und...
Diskussion
Die in diesem Artikel vorgeschlagene optimierte Methode stellt einen Ansatz zur genauen Herstellung der 4-HAU-Antigenlösung dar. Die OIE- und EU-Leitlinien schlagen zwar anfängliche Verdünnungen für die HA-Titration vor, enthalten jedoch keine genauen Angaben zu den zu verwendenden Verdünnungsverhältnissen und bieten keine spezifischen Methoden an11,12. Darüber hinaus empfehlen die FAO und die OIE zwar die Rücktitration als Mittel zur Verbess...
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
C.C. wurde vom Taicang Technology Program (TC2021JC16) und den Innovation Team Funds des Suzhou Chien-shiung Institute of Technology (2023JXKYTD01) unterstützt. H.Y. wurde durch das Taicang Technology Program (TC2021JC11) unterstützt. Beide wurden vom Start-up Fund for New Ph.D. Researchers des Suzhou Chien-Shiung Institute of Technology unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
Referenzen
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten