このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ニューカッスル病ウイルス血清学の血球凝集阻害アッセイのための抗原調製物の最適化
要約
この記事では、ニューカッスル病ウイルス血清学的検査のために4つの赤血球凝集ユニット抗原を調製するための簡略化された方法を紹介します。抗原の赤血球凝集力価を正確に決定し、より厳密なバック滴定法と明確に定義された調整プロセスを組み合わせることで、検査効率を高め、偽陽性を減らし、家禽の疾患監視を改善します。
要約
ニューカッスル病ウイルス(NDV)抗体価の正確な評価は、効果的な家禽病の制御と監視に不可欠です。この記事では、NDV 血清学的検出に使用される赤血球凝集阻害アッセイ(HI)の主要成分である 4 つの赤血球凝集ユニット(4-HAU)抗原溶液の調製に最適な方法を紹介します。時間のかかる未定義のバック滴定と調整ステップを伴う従来の方法とは異なり、このアプローチでは、最初の一連の希釈(1:3、1:5、1:7、1:9)を使用してHA力価を正確に測定することにより、このプロセスを合理化します。また、バック滴定結果に基づいて調整または再配合するための特定の方法を提供し、バック滴定を繰り返す必要性を減らします。また、4-HAU抗原溶液の精度が血清HI力価に及ぼす影響を評価したところ、4-HAU抗原の力価が3より低い場合、偽陽性のHI検体が出現する結果となることを見出しました。このアプローチは、正確な方法を提供し、計算タスクを最小限に抑えることで、検査の効率と信頼性を向上させ、家禽集団の疾病監視と制御の改善に貢献します。
概要
ニューカッスル病(ND)は、世界的に認識されている広範で深刻な家禽の病気です1,2,3。高熱、呼吸困難、赤痢、神経障害、粘膜出血など、さまざまな症状を呈します4。原因物質であるニューカッスル病ウイルス(NDV)は、ほぼ1世紀にわたって存続し、ニワトリ、アヒル、ガチョウ、ハトなど200種以上の鳥類を苦しめてきました5。感染は主に感染した鳥との直接的または間接的な接触を通じて発生し、家禽、ハト、放し飼いの鳥が潜在的な貯水池として機能します6。NDVの単一の血清型にもかかわらず、その遺伝的多様性は、疾病管理および制御の取り組みに重大な課題を提起しています3,7。
ワクチン接種は、NDを制御するための主要な戦略として機能し、厳格なバイオセキュリティ対策によって補完されます5,8。家禽にはさまざまな市販ワクチンが世界中で入手可能であり、免疫後の強力な血清抗体反応を引き起こします9。これらの抗体は、毒性株への曝露による症状の重症化を緩和し、群れ間感染を抑制する上で重要な役割を果たす10。標準的な再ワクチン接種プロトコルは、通常、6〜12週間ごとに投与される弱毒生ワクチンを含み、ND9の風土病地域では標準的な実践です。商業用家禽の群れにおけるワクチン接種後の抗体価の定期的なモニタリングは、ワクチンの有効性を評価するために不可欠である11,12,13。ワクチン接種後の抗体価の低下は、ワクチンの失敗を示している可能性があり、追加ワクチン接種や免疫応答に影響を与える可能性のある免疫抑制因子の調査などのタイムリーな是正措置が促されます14。
NDVに対する血清抗体の検出には、酵素結合免疫吸着アッセイ、赤血球凝集阻害(HI)、中和アッセイ9,13,15,16など、複数の技術が利用されています。各分析法には、感度、特異性、費用対効果に関して独自の利点と制限があります。
この記事では、NDV11に対する血清特異的抗体価を定量化するためのHIを実施するための国際獣疫事務局(OIE)のプロトコルに基づく段階的なプロトコルについて説明します。NDVのような特定のエンベロープウイルスによって誘発される現象であるヘマグルチン化(HA)は、赤血球(RBC)の凝集を伴います9。NDV表面のヘマグルチニン-ノイラミニダーゼ(HN)タンパク質はRBCと相互作用し、細胞凝集と格子形成をもたらします2。HIアッセイは、NDV 8,9のHNタンパク質に対する血清抗体特異性を評価する能力があるため、血清学的方法として好まれています。さらに、その費用対効果と特殊な計装からの独立性により、日常的な使用にもアクセス可能で実用的です。
アッセイ効率を向上させるために、OIEプロトコル11のワークフローを改良し、より正確な抗原HA力価の達成と、4つの赤血球凝集ユニット(4-HAU)抗原溶液の詳細な調整に重点を置きました。さらに、比較分析を通じて、4-HAUの精度がHIの結果に与える影響を評価し、現場の実務家に貴重な洞察を提供しました。このアプローチは、NDV抗体検査に限定されず、ウイルスサブタイプや、はしか、ポリオーマウイルス、おたふくかぜ、風疹などの他の赤血球凝集性ウイルスの検出にまで及びます。
プロトコル
このプロトコルの承認は、地元の施設の動物管理および使用委員会によって付与されました。生ウイルス抗原と臨床血清サンプルを含むすべての手順は、確立された安全プロトコルに準拠して、バイオセーフティレベル2の実験室で行われました。
1. 1%チキンRBC懸濁液の調製
- 3 mLのAlserverの溶液(抗凝固剤)を滅菌済みの15 mLコニカル遠心チューブに加えます。.
- 3つの非免疫鶏(NDV抗体なし)のそれぞれの翼静脈から1mLの血液を採取します。すぐに抗凝固剤の入ったチューブに血液を移し、穏やかに混合します。
- 滅菌済みの1倍リン酸緩衝生理食塩水(PBS、pH 7.2-7.4)をチューブに全容量12 mLまで充填し、穏やかに混合します。水平ローターを使用して、500 × g で10分間遠心分離します。
- 上清と白血球層を慎重に取り除きます。手順1.3と1.4を2x繰り返して、RBCペレットを取得します。
- 1 mLのRBCペレットを99 mLの滅菌PBSに逆ピペットで移し、1% RBC懸濁液を調製します。
注:1%チキンRBC懸濁液の必要容量は、3 mL/プレート(25 μL/ウェル x 96ウェル x 1.25 = 3.0 mL;ここで、1.25は十分な容量を確保するためのピペッティングの無駄分)と見積もられます。
2. 凍結乾燥抗原または血清の再構成
- 凍結乾燥抗原または血清を含むアンプルに2mLの滅菌PBSを加えます。アンプルを静かに振って2〜3分間放置し、気泡を最小限に抑え、完全に溶解させます。
注:この研究ではさまざまな種類の凍結乾燥材料は比較されていないため、特定の製造元の指示に従ってください。 - 再構成した溶液を1.5 mLの遠心チューブに分注し、使用するまで-20°Cで凍結します。
注:抗原を解凍して使用するたびに、または新しいRBC懸濁液を調製するたびに、HA力価を再決定します。
3. 抗原のHA滴定
- 40、80、120、160 μLのPBSを、使い捨ての96ウェルV底マイクロタイタープレートの隣接する4つのウェルに分注し、各ウェルに20 μLの抗原を加え、10倍と10倍にピペッティングして混合し、それぞれ1:3、1:5、1:7、1:9の希釈を達成します。希釈操作の概略図を 図1に示します。
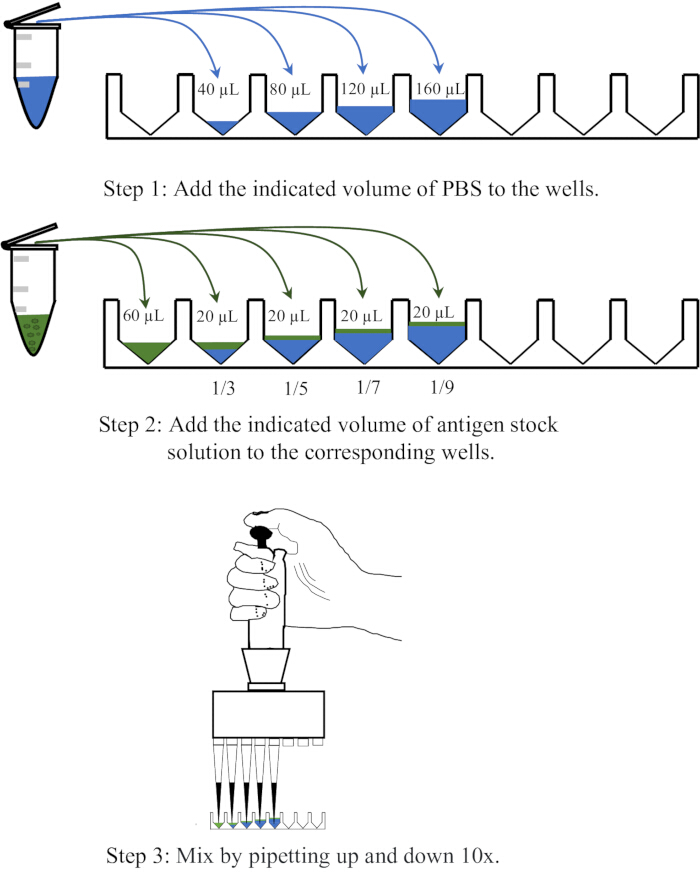
図1:赤血球凝集アッセイにおける抗原溶液の希釈手順を示す概略図。 抗原溶液をPBSでそれぞれ1:3、1:5、1:7、1:9の比率で希釈します。ウェルまたは遠心チューブ内のPBSは青色で、抗原は緑色で示されます。 この図の拡大版を表示するには、ここをクリックしてください。
- 新しいマイクロタイタープレートにラベルを付けます。25 μLのPBSを各ウェルの列1〜5に添加します。
- 希釈した抗原溶液25 μLをマルチチャンネルピペットを使用して列1〜5の最初のウェルに入れ、ピペッティングで少なくとも5回上下させて混合します。
- 各列の最初のウェルから2番目のウェルに25μLを移し、完全に混合します。1つのウェルから次のウェルへ、そして11番目のカラムまで移し続けて、2倍段階希釈(1:2から1:2048)を作成します。11列目以降、25μLを廃棄します。
- 各ウェルに25 μLのPBSを、抗原濃度が最も低いウェルから追加します。
- 1%チキンRBC懸濁液25 μLを各ウェルに加え、抗原濃度が最も低いウェルから再度追加します。
- マイクロプレートシェーカーでプレートを~20秒間振って、完全に混合します。
- ベンチトップの室温(20-25 °C)で、12列目のRBCが完全に落ち着くまで、~30分間放置します。プレートのレイアウトについては、 図2を参照してください。
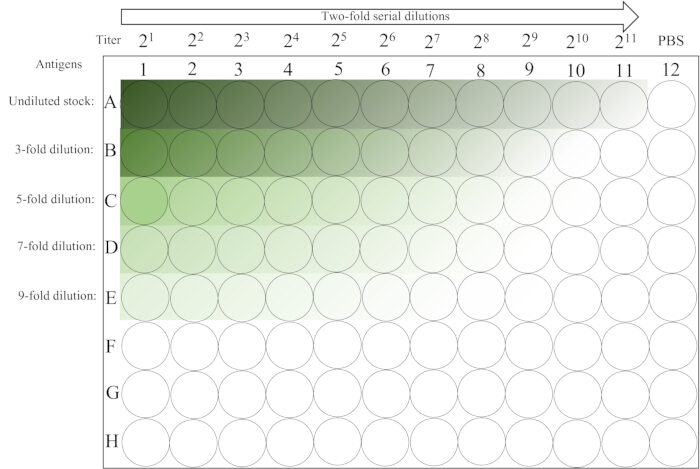
図2:赤血球凝集アッセイに使用したマイクロプレートの概略図。 行1〜5の1列目には、抗原溶液の未希釈液および種々の初期希釈液が含まれており、続いて左から右への2倍の段階希釈が11列目まで続いています。PBS コントロールは最後の列に配置されます。暗い色から明るい色への勾配は、抗原濃度の低下を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
- 結果を読み取り、記録します。HAは、プレートを90°~25秒間傾け、RBCの涙状の流れの有無を観察することで決定されます。完全な赤血球凝集(ストリーミングなし)を示す最高希釈は、1 HA単位に相当します。12列目のウェルはRBC(陰性)コントロールとして機能します。
- 表1を使用して各行のHA力価を計算し、その最大値が4-HAU抗原溶液の調製に使用されます。例えば、a、b、c、d、eがそれぞれ9、8、7、6、6に等しい場合、3 x 28 = 768が最大値であり、抗原ストックのHA力価です。
| 抗原 | 完全HAの最高希釈カラム | 原液のHA力価 |
| 原液 | ある | 2a |
| 3倍希釈 | b | 3 x 2b |
| 5倍希釈 | c | 5 x 2c |
| 7倍希釈 | d | 7 x 2d |
| 9倍希釈 | e | 9 x 2e |
表1:HAアッセイ結果と原液のHA力価の計算。
4. 4-HAU抗原溶液の調製
- 4-HAU抗原溶液の調製のための希釈係数を計算します:
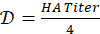 。必要な4-HAUの総容量を決定します: V = 3mL xマイクロプレートの数。次に、抗原ストック溶液の必要量を計算します:
。必要な4-HAUの総容量を決定します: V = 3mL xマイクロプレートの数。次に、抗原ストック溶液の必要量を計算します: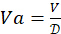 、PBS:Vp = V - Va。
、PBS:Vp = V - Va。
注意: 容量はミリリットルで測定されます。4-HAUのマイクロタイタープレートあたり3mLを推定します(25μL/ウェル×96ウェル×1.25=3mL)。 - 計算された量のPBSを容器にピペットで入れ、対応する量の抗原ストック溶液を加えてよく混合し、4-HAU抗原溶液を得ます。
注:4-HAU抗原溶液はできるだけ早く使用する必要があります。
5. 4-HAU抗原溶液の逆滴定
- 25、50、75、100、125、150 μLのPBSをマイクロタイタープレートの隣接する6つのウェルに分注し、各ウェルに25 μLの4-HAU抗原溶液を加え、10回ピペッティングして混合します。
注:4-HAU抗原溶液をPBSで1:2、1:3、1:4、1:5、1:6、および1:7の希釈で希釈します。希釈操作の概略図を図3に示します。
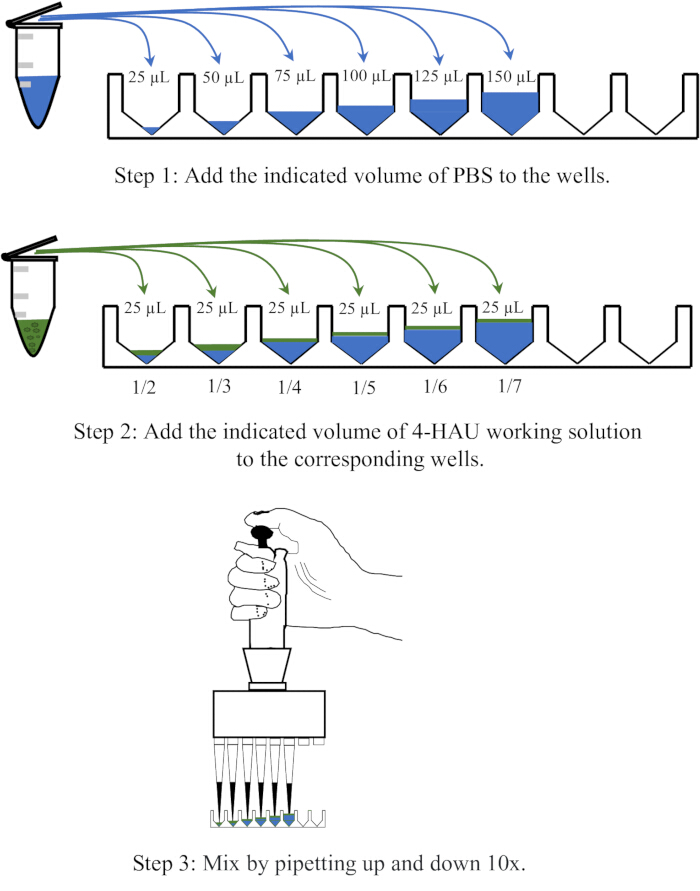
図3:逆滴定における4つの赤血球凝集ユニット溶液の希釈手順の概略図。 4-HAUワーキング溶液は、PBSで1:2、1:3、1:4、1:5、1:6、および1:7の比率で希釈されます。PBSは青で、抗原は緑で描かれています。 この図の拡大版を表示するには、ここをクリックしてください。
- 希釈した各抗原溶液25 μLをマルチチャンネルピペットを使用して別の列のウェルに移します。25 μLのPBSをネガティブコントロールとしてエクストラウェルに加えます。
- 各ウェルに25 μLのPBSを加え、次に各ウェルに25 μLの1%チキンRBCを加えます。
- マイクロプレートシェーカーでプレートを~20秒間振って混合します。
- ネガティブコントロールのRBCが完全に落ち着くまで、室温(20-25°C)のベンチトップで~30分間放置します。
- 結果を読み取り、記録します。
注:ネガティブコントロールウェルはHAを示していないはずです。理想的には、1:4の希釈が完全なHAでの最高希釈です。4-HAU溶液の力価が4を超える場合、最高希釈率は1:5、1:6、または1:7です。それより少ない場合は、1:2または1:3になります。バック滴定と代表的な結果の概略レイアウトを図4に示します。
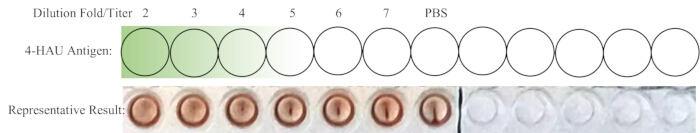
図4:バック滴定のためのウェルの概略レイアウトと代表的な結果。 希釈した4-HAUワーキング溶液を新しい列に移し、PBSコントロールを追加します。濃い緑色から薄い緑色への勾配は、抗原濃度が高いものから低いものまでを示しています。代表的な結果は、1:4希釈が完全な赤血球凝集を示す最高希釈であることを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
- 必要に応じて、4-HAU抗原溶液を調整または再処方します。
注:逆滴定に使用した4-HAU抗原溶液の容量が全容量の≤1%(4-HAU抗原溶液の容量≥15mL)の場合は、表2で具体的な調整を参照してください。例えば、完全HAでの最高希釈率が1:2の場合、4-HAU抗原溶液の力価は2となり、以前の4-HAU抗原溶液の調製時と同様に同量の抗原を添加する必要があります。逆に、完全なHAの最高希釈率が1:6の場合、力価は6になり、PBSの半分の量を補充する必要があります。
逆滴定に使用した量が全体の1%を超える場合(4-HAU抗原溶液の容量<15mL)は、補正した希釈係数を使用して4-HAU抗原溶液を再定式化します。具体的な修正については、 表 3 を参照してください。例えば、完全なHAの最高希釈率が1:2の場合、4-HAU抗原溶液の力価は2になり、希釈係数を元の1/2に調整する必要があります。逆に、完全HAの最高希釈率が1:6の場合、4-HAU抗原溶液の力価は6になり、希釈係数は元の3/2に調整されます。
| 背滴定のHA力価 | 抗原またはPBSの補充 |
| 1:2 | VAの |
| 1:3 | VA/3 |
| 1:5 | 副社長/4名 |
| 1:6 | 副社長/2名 |
| 1:7 | 3VP/4 |
表2:逆滴定結果に基づいて4-HAU濃度を調整するための参考表。 VaとVpは、それぞれ4-HAU抗原溶液の製剤に使用される抗原とPBSの量を表します。
| 背滴定のHA力価 | 希釈係数の補正 |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5D/4 |
| 1:6 | 3D/2 |
| 1:7 | 7D/4 |
表3:4-HAU抗原の再調製のための希釈係数補正の参照表。 Dは、以前に4-HAU抗原調製で使用されていた希釈係数を表します。
6. 血清の調製
- 抗凝固剤を使用せずに手羽先から~1mLの血液を採取します。
- 血液を1.5 mLの遠心チューブに移し、37°Cで~2時間インキュベートします。3,000 x gで10分間遠心分離し、上清を新しいチューブに慎重に吸引します。
7. HIアッセイ
- アッセイレイアウトに従ってマイクロタイタープレートを標識します。マルチチャンネルピペットを使用して、カラム1〜11の各ウェルに25 μLのPBSを、カラム12のウェルに50 μLを添加します。
- 25 μLの血清を、陽性および陰性の血清コントロール列を含む各列の最初のウェルに添加します。ピペッティングを5回以上行って十分に混合します。
- 各列の最初のウェルから2番目のウェルに25μLを移し、完全に混合します。2番目のウェルから3番目のウェルへ、そして10番目のカラムまで、移し替えと混合を続けます。混合後、ウェルから25 μLの液体を10列目に捨てます。
- 25 μLの4-HAU抗原をカラム1-11の各ウェルに、血清濃度が低い方向から高い方向に添加します。
- マイクロプレートシェーカーでプレートを~20秒間振とうします。ベンチトップに放置して~30分間放置します。
- 25 μLの1%チキン赤血球を各ウェルに、血清濃度が低い方向から高い方向に添加します。
- マイクロプレートシェーカーでプレートを~20秒間振って、完全に混合します。PBSコントロールウェルのRBCが完全に落ち着くまで、ベンチトップで~30分間そのままにしておきます。
- 結果を読み取り、記録します。
注:HI力価は、4-HAU抗原の赤血球凝集を完全に阻害する最高の血清希釈値です。RBCの涙の形をした流れは、プレートを90°25秒間傾けることにより、各行の最後の列で観察できます。完全なHA(ストリーミングなし)は、各行の最後から2番目のウェルで観察できます。有効なテスト結果を得るには、陽性の血清コントロールのHI力価が既知のHI力価の1希釈以内である必要があります。陰性血清コントロールのHI力価は≤ 2 log2;RBCコントロールの自己HAの欠如。HAアッセイのワークフローの概略図については、図5を参照してください。
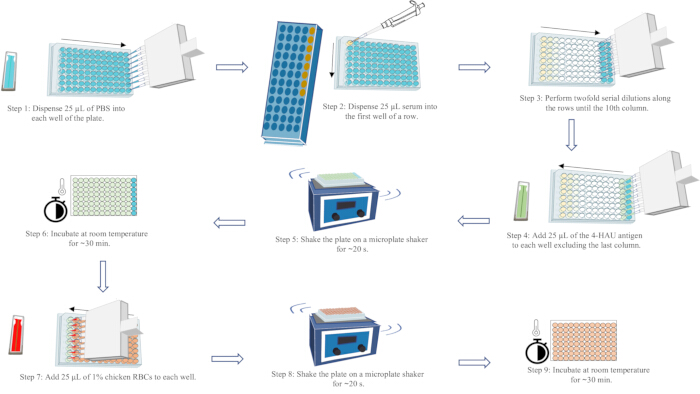
図5:赤血球凝集アッセイのワークフローの概略図。 PBSは青、血清は黄色、4-HAU抗原溶液は緑、1%チキンRBC懸濁液は赤で表されています。矢印は液体の分配の順序を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
結果
最適化法を用いて製剤化された4-HAU抗原溶液の力価の検証
この研究では、HA力価を正確に決定するために抗原ストック溶液のさまざまな希釈液を使用し、4-HAU抗原溶液を調製するための希釈係数の計算を容易にしました。その結果、最適化された分析法は効率的かつ正確であり、バック滴定と調整の手順を繰り返す回数を減らすことができることが明ら...
ディスカッション
本稿で提案する最適化された方法は、4-HAU抗原溶液を正確に調製するためのアプローチを示しています。OIEおよびEUのガイドラインでは、HA滴定の初期希釈を推奨していますが、使用する希釈比に関する正確な詳細は提供されておらず、特定の方法論も提供されていません11,12。さらに、FAOとOIEは、4-HAUの精度を高める手段としてバック滴定...
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
C.C.は、太倉技術プログラム(TC2021JC16)と蘇州建雄理工大学のイノベーションチームファンド(2023JXKYTD01)の支援を受けました。H.Y.はTaicang Technologyプログラム(TC2021JC11)の支援を受けました。両博士とも、蘇州建市工業大学の新人博士研究者のためのスタートアップ基金の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
参考文献
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved