需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
新城疫病毒血清学血凝抑制测定抗原制备的优化
摘要
本文介绍了一种用于新城疫病毒血清学检测的 4 种血凝单位抗原制备的简化方法。通过准确测定抗原的血凝滴度,结合更严格的反滴定方法和明确的调整过程,它提高了检测效率,减少了假阳性,并改善了家禽的疾病监测。
摘要
准确评估新城疫病毒 (NDV) 抗体滴度对于有效的家禽疾病控制和监测至关重要。本文介绍了一种制备 4 种血凝单位 (4-HAU) 抗原溶液的优化方法,该溶液是 NDV 血清学检测中使用的血凝抑制测定 (HI) 的关键成分。与涉及耗时且未定义的返滴定和调整步骤的传统方法不同,这种方法通过使用初始稀释系列(1:3、1:5、1:7 和 1:9)准确测量 HA 滴度来简化这一过程。我们还提供了一种根据返滴定结果进行调整或重新配制的特定方法,从而减少了重复返滴定的需要。此外,我们评估了 4-HAU 抗原溶液准确性对血清 HI 滴度的影响,发现当 4-HAU 抗原的滴度低于 3 时,会导致假阳性 HI 样本的出现。通过提供准确的方法并最大限度地减少计算任务,这种方法提高了测试效率和可靠性,有助于改善家禽种群的疾病监测和控制。
引言
新城疫 (ND) 是一种全球公认的广泛而严重的家禽疾病 1,2,3。它表现为高烧、呼吸窘迫、痢疾、神经紊乱和粘膜出血4 等各种症状。病原体新城疫病毒 (NDV) 已经存在了近一个世纪,折磨了 200 多种鸟类,包括鸡、鸭、鹅和鸽子5。传播主要通过直接或间接接触受感染的鸟类发生,家禽、鸽子和自由放养的鸟类是潜在的宿主6。尽管 NDV 的血清型单一,但其遗传多样性对疾病管理和控制工作构成了重大挑战 3,7。
疫苗接种是控制 ND 的主要策略,辅以严格的生物安全措施 5,8。全球有各种商业疫苗可用于家禽,在免疫接种后引发强烈的血清抗体反应9。这些抗体在减轻暴露于毒力菌株后的症状严重程度和抑制羊群间传播方面起着关键作用10。标准的再接种方案,通常包括每 6-12 周接种一次减毒活疫苗,是 ND9 流行地区的标准做法。常规监测商业家禽群的疫苗接种后抗体滴度对于评估疫苗有效性至关重要 11,12,13。接种疫苗后抗体滴度低可能表明疫苗失败,促使及时采取纠正措施,例如补充疫苗接种或调查影响免疫反应的潜在免疫抑制因素14。
多种技术用于检测抗 NDV 的血清抗体,包括酶联免疫吸附测定、血凝抑制 (HI) 和中和测定 9,13,15,16。每种方法在灵敏度、特异性和成本效益方面都有独特的优势和局限性。
本文描述了基于世界动物卫生组织 (OIE) 进行 HI 以量化针对 NDV11 的血清特异性抗体滴度的分步方案。血凝 (HA) 是一种由某些包膜病毒(如 NDV)诱导的现象,涉及红细胞 (RBC) 的聚集9。NDV 表面的血凝素-神经氨酸酶 (HN) 蛋白与红细胞相互作用,导致细胞聚集和晶格形成2。HI 检测是首选的血清学方法,因为它能够评估血清抗体对 NDV 的 HN 蛋白的特异性 8,9。此外,它的成本效益和独立于专用仪器的特点使其易于日常使用且实用。
为了提高检测效率,我们改进了 OIE 方案11 的工作流程,重点是获得更准确的抗原 HA 滴度,并为 4 个血凝单位 (4-HAU) 抗原溶液提供详细调整。此外,通过比较分析,我们评估了 4-HAU 准确性对 HI 结果的影响,为现场从业者提供了有价值的见解。这种方法不仅限于 NDV 抗体检测,还扩展到病毒亚型和其他血凝病毒的检测,包括麻疹、多瘤病毒、腮腺炎和风疹。
研究方案
当地机构动物护理和使用委员会批准了该协议。所有涉及活病毒抗原和临床血清样本的程序均在生物安全 2 级实验室中进行,符合既定的安全方案。
1. 1% 鸡 RBC 混悬液的制备
- 将 3 mL Alserver 溶液(抗凝剂)加入无菌 15 mL 锥形离心管中。
- 从三只非免疫鸡(无 NDV 抗体)中每只的翼静脉收集 1 mL 血液。立即将血液转移到含有抗凝剂的试管中,轻轻混匀。
- 用无菌 1x 磷酸盐缓冲盐水溶液(PBS,pH 7.2-7.4)填充试管,使总体积为 12 mL,然后轻轻混合。使用水平转子以 500 × g 离心 10 分钟。
- 小心去除上清液和白细胞层。重复步骤 1.3 和 1.4 2 次以获得 RBC 沉淀。
- 将 1 mL RBC 沉淀反向移液到 99 mL 无菌 PBS 中,以制备 1% RBC 悬浮液。
注:1% 鸡 RBC 悬液的所需体积估计为 3 mL/板(25 μL/孔 x 96 孔 x 1.25 = 3.0 mL;其中 1.25 是移液浪费,以确保足够的体积)。
2. 冻干抗原或血清的重建
- 将 2 mL 无菌 PBS 添加到含有冻干抗原或血清的安瓿瓶中。轻轻摇动安瓿瓶,静置 2-3 分钟,以减少气泡并确保完全溶解。
注意:请遵循特定制造商的说明,因为本研究未比较不同类型的冻干材料。 - 将复溶溶液分装到 1.5 mL 离心管中,并在 -20 °C 下冷冻直至使用。
注:每次解冻和使用抗原或制备新的 RBC 悬液时,请重新测定 HA 滴度。
3. 抗原的 HA 滴定
- 将 40、80、120 和 160 μL PBS 分别分配到一次性 96 孔 V 形底微量滴定板的四个相邻孔中,然后向每个孔中加入 20 μL 抗原,并通过上下移液 10 次混合,以达到 1:3、1:5、1:7 和 1:9 的稀释度,分别达到 1:3、1:5、1:7 和 1:9。稀释作的示意图如图 1 所示。
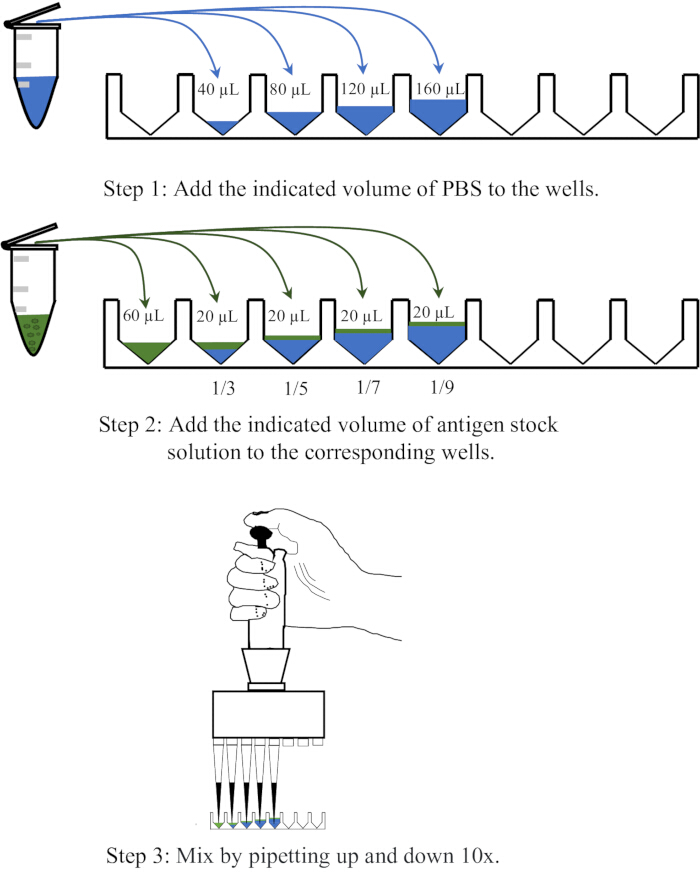
图 1:示意图说明了血凝测定中抗原溶液的稀释程序。 抗原溶液在 PBS 中分别以 1:3、1:5、1:7 和 1:9 的比例稀释。孔或离心管中的 PBS 以蓝色表示,而抗原以绿色表示。 请单击此处查看此图的较大版本。
- 标记新的微量滴定板。向第 1-5 行的每个孔中加入 25 μL PBS。
- 使用多通道移液器将 25 μL 稀释的抗原溶液放入第 1-5 行的第一个孔中,并通过上下吹打至少 5 次进行混合。
- 将 25 μL 从每行的第一个孔转移到第二个孔中,充分混合。继续从一个孔转移到另一个孔,直到第 11 个色谱柱,以产生两倍连续稀释液(1:2 至 1:2048)。丢弃第 11 根色谱柱后 25 μL。
- 向每个孔中加入 25 μL PBS,从抗原浓度最低的孔开始。
- 向每个孔中加入 25 μL 1% 鸡 RBC 悬液,再次从抗原浓度最低的孔开始。
- 在微孔板振荡器上摇动板 ~20 秒以充分混合。
- 在室温 (20-25 °C) 的工作台上不受干扰地放置 ~30 分钟,直到第 12 根色谱柱的 RBC 完全沉淀。有关板布局,请参阅 图 2。
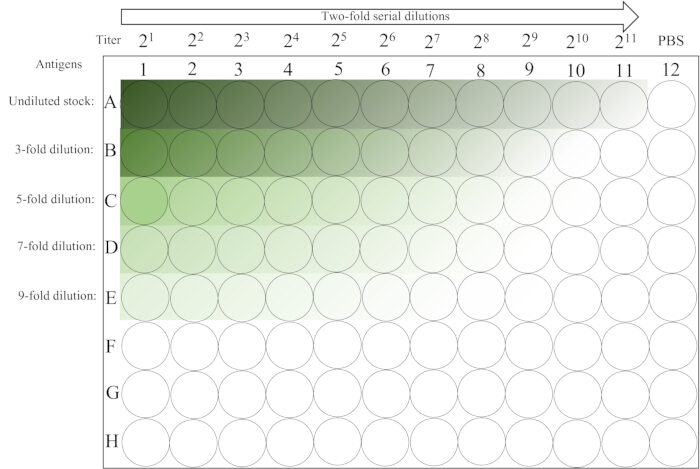
图 2:血凝测定中使用的微孔板的示意图。 第 1-5 行的第一列包含抗原溶液的未稀释和各种初始稀释液,然后是从左到右进行两倍连续稀释,直到第 11 列。PBS 对照放在最后一列。从暗到亮的梯度表示抗原浓度降低。 请单击此处查看此图的较大版本。
- 读取并记录结果。通过将板倾斜 90° ~25 秒并观察红细胞是否存在泪状流来确定 HA。显示完全血凝(无流)的最高稀释度代表 1 HA 单位。第 12 列中的孔用作 RBC(阴性)对照。
- 使用 表 1 计算每行的 HA 滴度,其中最大值用于制备 4-HAU 抗原溶液。例如,如果 a、b、c、d 和 e 分别等于 9、8、7、6、6,则 3 x 28 = 768 是最大值,是抗原原液的 HA 滴度。
| 抗原 | 完全 HA 的最高稀释柱 | 未稀释储备液的 HA 滴度 |
| 未稀释的原液 | 一个 | 一个 2 |
| 3 倍稀释 | b | 3 x 2乙 |
| 5 倍稀释 | c | 5 x 2摄氏度 |
| 7 倍稀释 | d | 7 x 2天 |
| 9 倍稀释 | e | 9 x 2e |
表 1:HA 测定结果和储备液 HA 滴度的计算。
4. 4-HAU 抗原溶液的制备
- 计算制备 4-HAU 抗原溶液的稀释因子:
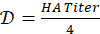 。确定所需的总 4-HAU 体积: V = 3mL x 微孔板数量。然后,计算所需的抗原原液体积:
。确定所需的总 4-HAU 体积: V = 3mL x 微孔板数量。然后,计算所需的抗原原液体积: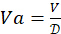 和 PBS:Vp = V - Va。
和 PBS:Vp = V - Va。
注意:体积以毫升为单位。估计每个微量滴定板的 4-HAU 为 3 mL(25 μL/孔 x 96 孔 x 1.25 = 3 mL)。 - 将计算体积的 PBS 移液到容器中,然后加入相应体积的抗原储备溶液并充分混合,得到 4-HAU 抗原溶液。
注意:应尽快使用 4-HAU 抗原溶液。
5. 4-HAU 抗原溶液的返滴定
- 将 25、50、75、100、125 和 150 μL PBS 分配到微量滴定板的六个相邻孔中,然后向每个孔中加入 25 μL 4-HAU 抗原溶液,并通过上下吹打 10 次混合。
注:用 PBS 稀释 1:2、1:3、1:4、1:5、1:6 和 1:7 稀释的 4-HAU 抗原溶液。稀释作的示意图如图 3 所示。
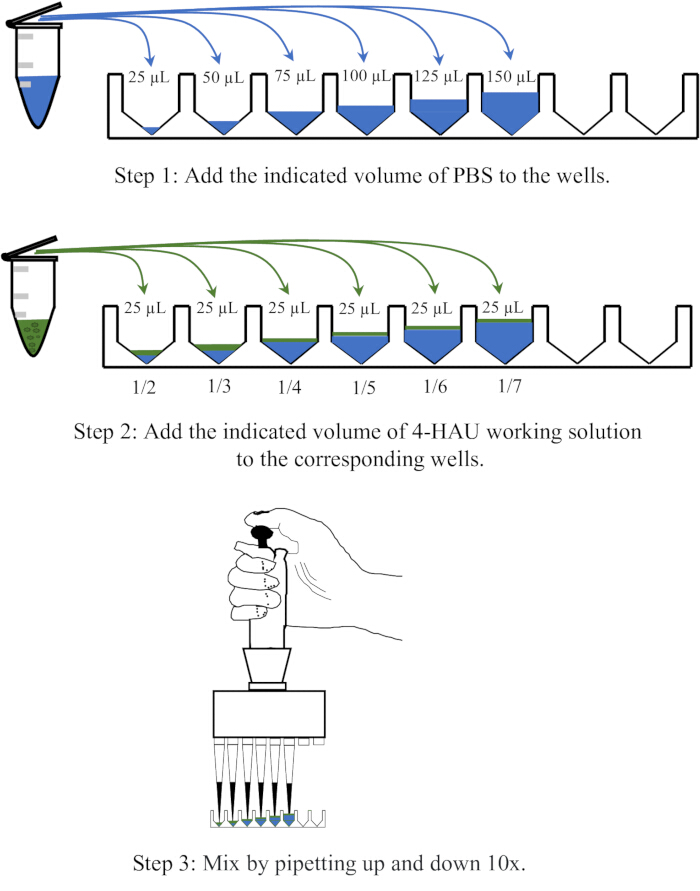
图 3:4 个血凝单元溶液在返滴定中的稀释程序示意图。 用 PBS 以 1:2、1:3、1:4、1:5、1:6 和 1:7 的比例稀释 4-HAU 工作溶液。PBS 以蓝色表示,抗原以绿色表示。 请单击此处查看此图的较大版本。
- 使用多通道移液器将 25 μL 每种稀释的抗原溶液转移到另一排的孔中。向额外的孔中加入 25 μL PBS 作为阴性对照。
- 向每个孔中加入 25 μL PBS,然后向每个孔中加入 25 μL 1% 鸡 RBC。
- 在微孔板振荡器上摇动板 ~20 秒以混合。
- 将其在室温 (20-25 °C) 的工作台上不受干扰地放置 ~30 分钟,直到阴性对照的红细胞完全沉淀。
- 读取并记录结果。
注意:阴性对照孔应显示无 HA。理想情况下,1:4 的稀释度恰好是完全透明质酸的最高稀释度。如果 4-HAU 溶液的滴度大于 4,则最高稀释度为 1:5、1:6 或 1:7;如果小于 1:2 或 1:3,则可能是 1:3。返滴定的示意图和代表性结果如图 4 所示。
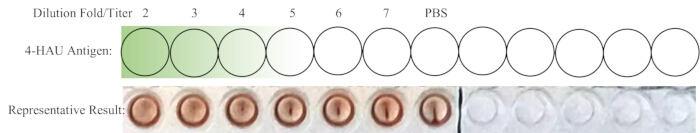
图 4:返滴定孔的示意图和代表性结果。 将稀释的 4-HAU 工作溶液转移到新行,并添加额外的 PBS 对照。从深绿色到浅绿色的梯度表示抗原浓度从高到低。代表性结果表明,1:4 稀释度是显示完全血凝的最高稀释度。 请单击此处查看此图的较大版本。
- 如有必要,调整或重新配制 4-HAU 抗原溶液。
注意:如果用于返滴定的 4-HAU 抗原溶液的体积为总体积的 ≤1%(4-HAU 抗原溶液的体积≥ 15 mL),请参阅表 2 进行具体调整。例如,如果完全 HA 的最高稀释度为 1:2,则 4-HAU 抗原溶液的滴度现在为 2,并且应添加等体积的抗原,就像先前制备的 4-HAU 抗原溶液一样。相反,如果完全 HA 的最高稀释度为 1:6,则滴度现在为 6,应补充一半体积的 PBS。
如果返滴定中使用的体积超过总体积的 1%(4-HAU 抗原溶液的体积< 15 mL),则使用校正后的稀释因子重新配制 4-HAU 抗原溶液。有关具体更正,请参阅 表 3 。例如,如果完全 HA 的最高稀释度为 1:2,则 4-HAU 抗原溶液的滴度现在为 2,稀释因子应调整为原始浓度的 1/2。相反,如果完全 HA 的最高稀释度为 1:6,则 4-HAU 抗原溶液的滴度现在为 6,稀释因子调整为原始浓度的 3/2。
| 返滴定的 HA 滴定度 | 补充抗原或 PBS |
| 1:2 | 瓦 |
| 1:3 | va/3 |
| 1:5 | VP/4 |
| 1:6 | VP/2 |
| 1:7 | 3VP/4 |
表 2:根据返滴定结果调整 4-HAU 浓度的参考表。 Va 和 Vp 分别代表用于配制 4-HAU 抗原溶液的抗原和 PBS 的体积。
| 返滴定的 HA 滴定度 | 稀释因子校正 |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5 天 / 4 |
| 1:6 | 3D/2 |
| 1:7 | 7 天 / 4 |
表 3:重新制备 4-HAU 抗原的稀释因子校正参考表。 D 代表先前用于 4-HAU 抗原制备的稀释因子。
6. 血清的制备
- 从鸡翅中收集 ~1 mL 血液,而不使用抗凝剂。
- 将血液转移到 1.5 mL 离心管中,并在 37 °C 下孵育 ~2 小时。以 3,000 x g 离心 10 分钟,然后小心地将上清液吸入新管中。
7. HI 检测
- 根据检测布局标记微量滴定板。使用多通道移液器,向第 1-11 列的每个孔中加入 25 μL PBS,向第 12 列的每个孔中加入 50 μL。
- 向每行的第一个孔中加入 25 μL 血清,包括阳性和阴性血清对照行。通过上下吹打至少 5 次充分混合。
- 将 25 μL 从每行的第一个孔转移到第二个孔中,并充分混合。继续从第二个孔转移到第三个孔,依此类推,直到第 10 个色谱柱。混合后,从第 10 列的孔中弃去 25 μL 液体。
- 按血清浓度从低到高的方向向第 1-11 列的每个孔中加入 25 μL 4-HAU 抗原。
- 在微孔板振荡器上摇动板 ~20 秒。将其在工作台上不受干扰 ~30 分钟。
- 按血清浓度从低到高的方向向每个孔中加入 25 μL 1% 鸡红细胞。
- 在微孔板振荡器上摇动板 ~20 秒以充分混合。将其在工作台上不受干扰 ~30 分钟,直到 PBS 对照孔的 RBC 完全沉淀。
- 读取并记录结果。
注:HI 滴度是完全抑制 4-HAU 抗原血凝的最高血清稀释度。通过将板倾斜 90° 25 秒,可以在每行的最后一列观察到泪状红细胞流。可以在每行末尾的倒数第二个井中观察到 Complete HA (no streaming)。有效的检测结果要求阳性血清对照的 HI 滴度在已知 HI 滴度的一个稀释度范围内;阴性血清对照的 HI 滴度≤ 2 log2;以及 RBC 对照不存在 self-HA。有关 HA 分析工作流程的示意图,请参见图 5。
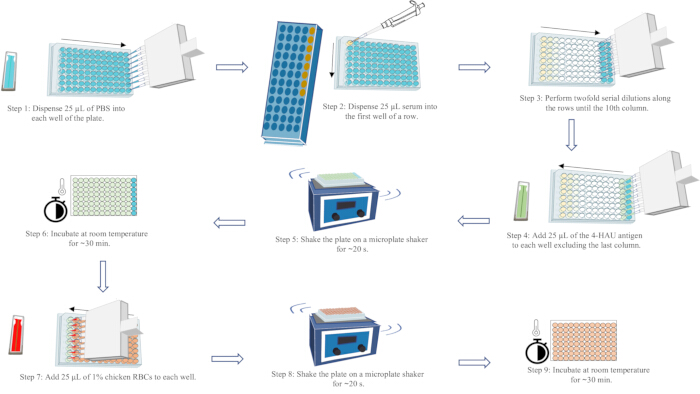
图 5:血凝分析工作流程示意图。 PBS 以蓝色表示,血清以黄色表示,4-HAU 抗原溶液以绿色表示,1% 鸡 RBC 悬浮液以红色表示。箭头表示液体分配的顺序。 请单击此处查看此图的较大版本。
结果
验证使用优化方法配制的 4-HAU 抗原溶液的滴度
该研究采用各种稀释的抗原储备液来准确测定 HA 滴度,便于计算制备 4-HAU 抗原溶液的稀释因子。结果表明,优化后的方法既高效又精确,减少了重复的返滴定和调整程序的数量。在第一种情况下,初始 HA 滴度为 ~512,最终滴度为 768,符合 4-HAU 抗原溶液的要求(图 6)。同样,在第二个?...
讨论
本文提出的优化方法提出了一种准确制备 4-HAU 抗原溶液的方法。尽管 OIE 和 EU 指南建议对 HA 滴定进行初始稀释,但它们没有提供有关要使用的稀释比率的准确细节,也没有提供具体方法11,12。此外,尽管 FAO 和 OIE 建议将返滴定作为提高 4-HAU 准确性的一种手段,但他们缺乏明确的方案11,13。本文通过...
披露声明
作者没有需要声明的利益冲突。
致谢
C.C. 得到了太仓科技计划 (TC2021JC16) 和苏州健雄理工学院创新团队基金 (2023JXKYTD01) 的支持。H.Y. 得到太仓科技计划 (TC2021JC11) 的支持。他们都得到了苏州健雄理工学院新博士生启动基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
参考文献
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。