A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אופטימיזציה של הכנת אנטיגן לבדיקת עיכוב המגלוטינציה של סרולוגיה של נגיף מחלת ניוקאסל
In This Article
Summary
מאמר זה מציג שיטה פשוטה להכנת אנטיגן של 4 יחידות המגלוטינציה לבדיקה סרולוגית של נגיף מחלת ניוקאסל. על ידי קביעה מדויקת של טיטר ההמגלוטינציה של האנטיגן, בשילוב עם שיטת טיטרציה לאחור קפדנית יותר, ותהליך התאמה מוגדר היטב, הוא משפר את יעילות הבדיקה, מפחית תוצאות חיוביות כוזבות ומשפר את מעקב המחלות בעופות.
Abstract
הערכה מדויקת של טיטר הנוגדנים של נגיף מחלת ניוקאסל (NDV) היא חיונית לבקרה ומעקב יעילים אחר מחלות עופות. מאמר זה מציג שיטה אופטימלית להכנת תמיסת אנטיגן של 4 יחידות המגלוטינציה (4-HAU), מרכיב מרכזי בבדיקת עיכוב המגלוטינציה (HI) המשמשת בזיהוי סרולוגי של NDV. בניגוד לשיטות קונבנציונליות, הכוללות שלבי טיטרציה והתאמה לאחור גוזלי זמן ולא מוגדרים, גישה זו מייעלת תהליך זה על ידי מדידה מדויקת של טיטר HA באמצעות סדרה ראשונית של דילולים (1:3, 1:5, 1:7 ו-1:9). אנו מספקים גם שיטה ספציפית להתאמה או ניסוח מחדש על סמך תוצאות הטיטרציה לאחור, מה שמפחית את הצורך בטיטרציות חוזרות ונשנות לאחור. בנוסף, הערכנו את השפעת הדיוק של תמיסת האנטיגן 4-HAU על טיטר HI בסרום ומצאנו שכאשר הטיטר של אנטיגן 4-HAU היה נמוך מ-3, זה הביא להופעת דגימות HI חיוביות כוזבות. על ידי מתן שיטה מדויקת ומזעור משימות חישוביות, גישה זו מגבירה את יעילות הבדיקה ואמינותה, ותורמת לשיפור המעקב והבקרה על מחלות באוכלוסיות העופות.
Introduction
מחלת ניוקאסל (ND) היא מחלת עופות נרחבת וחמורה המוכרת ברחבי העולם 1,2,3. זה מתבטא בתסמינים שונים כגון חום גבוה, מצוקה נשימתית, דיזנטריה, הפרעות עצבים ודימום רירי4. הגורם הסיבתי, נגיף מחלת ניוקאסל (NDV), החזיק מעמד במשך כמעט מאה שנה, ופגע ביותר מ-200 מיני עופות, כולל תרנגולות, ברווזים, אווזים ויונים. העברה מתרחשת בעיקר באמצעות מגע ישיר או עקיף עם ציפורים נגועות, כאשר עופות, יונים וציפורים חופשיות משמשים כמאגרים פוטנציאליים6. למרות הסרוטיפ היחיד של NDV, המגוון הגנטי שלו מציב אתגרים משמעותיים למאמצי ניהול ובקרה של מחלות 3,7.
החיסון משמש כאסטרטגיה העיקרית לשליטה ב-ND, בתוספת אמצעי ביטחון ביולוגי מחמירים 5,8. חיסונים מסחריים שונים זמינים ברחבי העולם לעופות, ומעוררים תגובות נוגדנים חזקות בסרום לאחר חיסון9. נוגדנים אלה ממלאים תפקיד קריטי בהפחתת חומרת התסמינים בחשיפה לזנים אלימים ובבלימת העברת להקות10. פרוטוקולי חיסון חוזר סטנדרטיים, הכוללים בדרך כלל חיסונים חיים מוחלשים הניתנים כל 6-12 שבועות, הם נוהג סטנדרטי באזורים אנדמיים ל-ND9. ניטור שגרתי של נוגדנים לאחר חיסון בלהקות עופות מסחריות חיוני להערכת יעילות החיסון 11,12,13. רמות נוגדנים נמוכות לאחר החיסון עשויות להצביע על כישלון החיסון, מה שמוביל לצעדים מתקנים בזמן כגון חיסון משלים או חקירה של גורמים מדכאי חיסון פוטנציאליים המשפיעים על התגובה החיסונית14.
נעשה שימוש בטכניקות מרובות לאיתור נוגדנים בסרום כנגד NDV, כולל בדיקת אימונוסורבנט מקושר לאנזים, עיכוב המגלוטינציה (HI) ובדיקת נטרול 9,13,15,16. כל שיטה מציגה יתרונות ומגבלות ייחודיים מבחינת רגישות, ספציפיות ועלות-תועלת.
מאמר זה מתאר פרוטוקול שלב אחר שלב המבוסס על פרוטוקול הארגון העולמי לבריאות בעלי חיים (OIE) לביצוע HI לכימות טיטרים של נוגדנים ספציפיים לסרום כנגד NDV11. המגלוטינציה (HA), תופעה הנגרמת על ידי נגיפים מסוימים כמו NDV, כרוכה בגוש של תאי דם אדומים (RBCs)9. חלבון ההמגלוטינין-נוירמינידאז (HN) על פני ה- NDV מקיים אינטראקציה עם RBCs, וכתוצאה מכך גוש תאים והיווצרות סריג2. בדיקת HI מועדפת כשיטה סרולוגית בשל יכולתה להעריך את ספציפיות הנוגדנים בסרום כלפי חלבון HN של NDV 8,9. יתר על כן, עלות-תועלת ועצמאות ממכשור מיוחד הופכים אותו לנגיש ופרקטי לשימוש שגרתי.
כדי לשפר את יעילות הבדיקה, חידדנו את זרימת העבודה של פרוטוקול OIE11, תוך התמקדות בהשגת טיטרים מדויקים יותר של HA אנטיגן והצעת התאמות מפורטות לפתרון האנטיגן של 4 יחידות המגלוטינציה (4-HAU). בנוסף, באמצעות ניתוח השוואתי, הערכנו את ההשפעה של דיוק 4-HAU על תוצאות HI, וסיפקנו תובנות חשובות לעוסקים בשטח. גישה זו אינה מוגבלת לבדיקת נוגדנים NDV אלא משתרעת על זיהוי תת-סוגים נגיפיים ונגיפים המגלוטינציה אחרים, כולל חצבת, נגיף פוליומה, חזרת ואדמת.
Protocol
האישור לפרוטוקול ניתן על ידי הוועדה המוסדית המקומית לטיפול ושימוש בבעלי חיים. כל ההליכים הכוללים אנטיגנים של נגיפים חיים ודגימות סרום קליניות בוצעו במעבדה ברמת בטיחות ביולוגית 2, בהתאם לפרוטוקולי הבטיחות שנקבעו.
1. הכנת תרחיף RBC עוף 1%
- הוסף 3 מ"ל של תמיסה של Alserver (נוגד קרישה) לתוך צינור צנטריפוגה חרוטי סטרילי של 15 מ"ל.
- אספו 1 מ"ל דם מווריד הכנף של כל אחת משלוש התרנגולות הלא מחוסנות (ללא נוגדנים ל-NDV). העבירו מיד את הדם לצינור המכיל את נוגד הקרישה וערבבו בעדינות.
- מלאו את הצינור בתמיסת מלח סטרילית 1x חוצץ פוספט (PBS, pH 7.2-7.4) לנפח כולל של 12 מ"ל, וערבבו בעדינות. צנטריפוגה במשקל 500 × גרם למשך 10 דקות באמצעות רוטור אופקי.
- הסירו בזהירות את הסופרנטנט ואת שכבת תאי הדם הלבנים. חזור על שלבים 1.3 ו-1.4 2x כדי להשיג את גלולת ה-RBC.
- פיפטה הפוכה 1 מ"ל של גלולת ה-RBC ל-99 מ"ל של PBS סטרילי, להכנת תרחיף RBC של 1%.
הערה: הנפח הנדרש של תרחיף RBC עוף 1% מוערך ב-3 מ"ל/צלחת (25 מיקרוליטר/באר x 96 בארות x 1.25 = 3.0 מ"ל; כאשר 1.25 מסביר בזבוז פיפטינג כדי להבטיח נפח מספיק).
2. בנייה מחדש של אנטיגן או סרום ליופיליזציה
- הוסף 2 מ"ל של PBS סטרילי לאמפולה המכילה את האנטיגן או הסרום הליופילי. יש לנער בעדינות את האמפולה ולהניח לה לעמוד במשך 2-3 דקות כדי למזער בועות ולהבטיח התמוססות מלאה.
הערה: עקוב אחר הוראות היצרן הספציפי, מכיוון שסוגים שונים של חומרים ליופיליים לא הושוו במחקר זה. - יש לשים את התמיסה המחודשת לצינורות צנטריפוגה של 1.5 מ"ל ולהקפיא בטמפרטורה של -20 מעלות צלזיוס עד לשימוש.
הערה: קבע מחדש את טיטר ה-HA בכל פעם שהאנטיגן מופשר ונעשה בו שימוש, או כאשר מכינים תרחיף RBC חדש.
3. טיטרציה של HA של אנטיגנים
- מחלקים 40, 80, 120 ו-160 מיקרוליטר של PBS, בהתאמה, לארבע בארות סמוכות של צלחת מיקרוטיטר חד פעמית של 96 בארות V-bottom, ואז מוסיפים 20 מיקרוליטר אנטיגן לכל באר, ומערבבים על ידי פיפטינג למעלה ולמטה פי 10 כדי להשיג דילולים של 1:3, 1:5, 1:7 ו-1:9, בהתאמה. תרשים סכמטי של פעולת הדילול מוצג באיור 1.
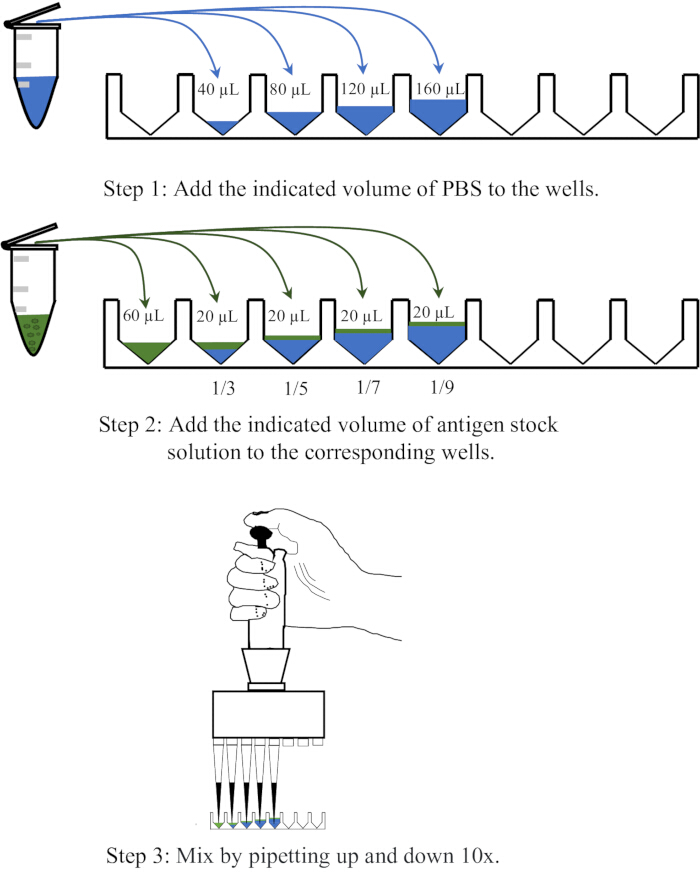
איור 1: תרשים סכמטי הממחיש את הליך דילול תמיסת האנטיגן בבדיקת ההמגלוטינציה. תמיסת האנטיגן מדוללת ב-PBS ביחסים של 1:3, 1:5, 1:7 ו-1:9, בהתאמה. PBS בבארות או בצינורות צנטריפוגה מיוצג בכחול, בעוד שאנטיגנים מוצגים בירוק. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- סמן לוחית מיקרוטיטר חדשה. הוסף 25 מיקרוליטר PBS לכל באר בשורות 1-5.
- מניחים 25 מיקרוליטר מתמיסות האנטיגן המדוללות לבארות הראשונות של שורות 1-5 באמצעות פיפטה רב-ערוצית, ומערבבים על ידי פיפטה למעלה ולמטה לפחות פי 5.
- מעבירים 25 מיקרוליטר מהבאר הראשונה של כל שורה לבאר השנייה, מערבבים היטב. המשיכו לעבור מבאר אחת לשנייה, עד לעמודה ה-11, כדי ליצור דילולים טוריים כפולים (1:2 עד 1:2048). השלך 25 מיקרוליטר אחרי העמודה ה-11.
- הוסף 25 מיקרוליטר PBS לכל באר, החל מהבארות המכילות את ריכוז האנטיגן הנמוך ביותר.
- הוסף 25 מיקרוליטר של תרחיף RBC עוף 1% לכל באר, שוב החל מהבארות המכילות את ריכוז האנטיגן הנמוך ביותר.
- מנערים את הצלחת על שייקר מיקרופלייט למשך ~20 שניות לערבוב יסודי.
- השאירו אותו ללא הפרעה על הספסל בטמפרטורת החדר (20-25 מעלות צלזיוס) למשך ~30 דקות עד שה-RBC של העמודה ה-12 התייצב לחלוטין. לפריסת הצלחת עיין באיור 2.
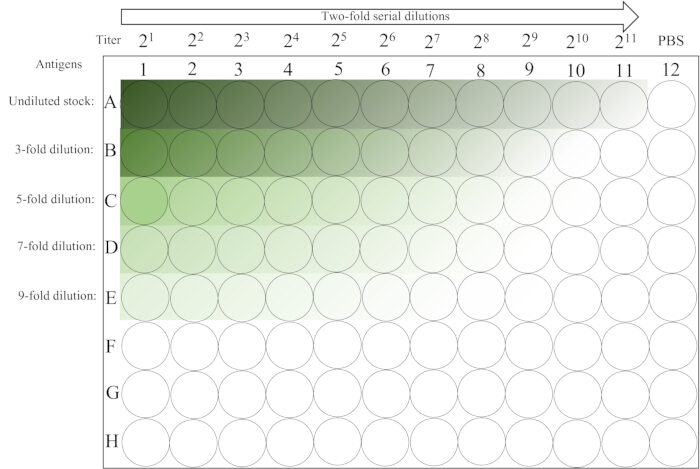
איור 2: פריסה סכמטית של מיקרו-לוח המשמש בבדיקת ההמגלוטינציה. העמודה הראשונה של שורות 1-5 מכילה דילולים ראשוניים לא מדוללים ושונים של תמיסת האנטיגן, ואחריה דילול סדרתי כפול משמאל לימין עד עמודה 11. פקד PBS ממוקם בעמודה האחרונה. השיפוע מחושך לבהיר מצביע על ירידה בריכוז האנטיגן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- קרא ורשום את התוצאות. HA נקבע על ידי הטיית הצלחת ב-90 מעלות למשך ~25 שניות והתבוננות בנוכחות או היעדר זרימה בצורת דמעה של ה-RBCs. הדילול הגבוה ביותר המראה המגלוטינציה מלאה (ללא סטרימינג), מייצג יחידת HA אחת. בארות בעמודה ה-12 משמשות כבקרות RBC (שליליות).
- חשב את טיטר ה-HA של כל שורה באמצעות טבלה 1, שהמקסימום שלה משמש להכנת תמיסת האנטיגן 4-HAU. לדוגמה, אם a, b, c, d ו-e שווים ל-9, 8, 7, 6, 6, בהתאמה, אז 3 x 28 = 768 הוא הערך המקסימלי, והוא טיטר ה-HA של מלאי האנטיגן.
| אנטיגנים | עמודת הדילול הגבוהה ביותר של HA שלם | טיטר HA של מלאי לא מדולל |
| מלאי לא מדולל | a | 2א |
| דילול פי 3 | b | 3 x 2ב |
| דילול פי 5 | c | 5 x 2צלזיוס |
| דילול פי 7 | d | 7 x 2D |
| דילול פי 9 | e | 9 x 2e |
טבלה 1: תוצאות בדיקת HA וחישוב טיטר HA של תמיסת מלאי.
4. הכנת תמיסת האנטיגן 4-HAU
- חשב את גורם הדילול להכנת תמיסת האנטיגן 4-HAU:
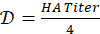 . קבע את נפח ה-4-HAU הכולל הדרוש: V = 3 מ"ל x מספר המיקרו-לוחות. לאחר מכן, חשב את הנפחים הנדרשים של תמיסת מלאי אנטיגן:
. קבע את נפח ה-4-HAU הכולל הדרוש: V = 3 מ"ל x מספר המיקרו-לוחות. לאחר מכן, חשב את הנפחים הנדרשים של תמיסת מלאי אנטיגן: 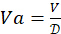 , ו-PBS: Vp = V - Va.
, ו-PBS: Vp = V - Va.
הערה: הנפחים נמדדים במיליליטר. העריכו 3 מ"ל לכל לוחית מיקרוטיטר של 4-HAU (25 מיקרוליטר / באר x 96 בארות x 1.25 = 3 מ"ל). - פיפטו את הנפח המחושב של PBS למיכל, ואז הוסיפו את הנפח המתאים של תמיסת מלאי האנטיגן וערבבו היטב כדי לקבל את תמיסת האנטיגן 4-HAU.
הערה: יש להשתמש בתמיסת האנטיגן 4-HAU בהקדם האפשרי.
5. טיטרציה לאחור של תמיסת האנטיגן 4-HAU
- הוציאו 25, 50, 75, 100, 125 ו-150 מיקרוליטר של PBS לשש בארות סמוכות של לוחית מיקרוטיטר, ואז הוסיפו 25 מיקרוליטר מתמיסת האנטיגן 4-HAU לכל באר, וערבבו על ידי פיפטינג למעלה ולמטה פי 10.
הערה: יש לדלל את תמיסת האנטיגן 4-HAU עם PBS בדילולים של 1:2, 1:3, 1:4, 1:5, 1:6 ו-1:7. תרשים סכמטי של פעולת הדילול מוצג באיור 3.
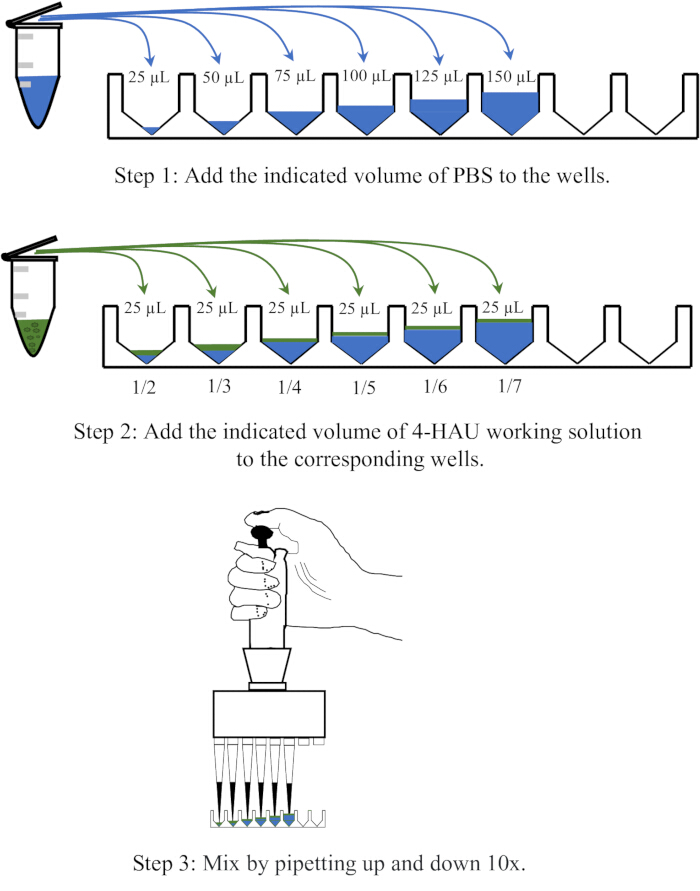
איור 3: תרשים סכמטי של הליך דילול של תמיסת 4 יחידות המגלוטינציה בטיטרציה לאחור. פתרון העבודה 4-HAU מדולל עם PBS ביחסים של 1:2, 1:3, 1:4, 1:5, 1:6 ו-1:7. PBS מתואר בכחול, ואנטיגנים בירוק. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- העבירו 25 מיקרוליטר מכל תמיסת אנטיגן מדוללת לבארות של שורה אחרת באמצעות פיפטה רב-ערוצית. הוסף 25 מיקרוליטר של PBS לבאר נוספת כבקרה שלילית.
- מוסיפים 25 מיקרוליטר PBS לכל באר, ואז מוסיפים 25 מיקרוליטר של RBC עוף 1% לכל באר.
- נענע את הצלחת על שייקר מיקרופלייט למשך ~20 שניות לערבוב.
- השאירו אותו ללא הפרעה על הספסל בטמפרטורת החדר (20-25 מעלות צלזיוס) למשך ~30 דקות עד שה-RBCs של הבקרה השלילית מתייצבים לחלוטין.
- קרא ורשום את התוצאות.
הערה: באר הבקרה השלילית לא אמורה להראות HA. באופן אידיאלי, הדילול של 1:4 הוא בדיוק הדילול הגבוה ביותר עם HA מלא. אם הטיטר של תמיסת 4-HAU הוא יותר מ-4, הדילול הגבוה ביותר עשוי להיות 1:5, 1:6 או 1:7; אם פחות, זה יכול להיות 1:2 או 1:3. פריסה סכמטית של הטיטרציה האחורית והתוצאות המייצגות מוצגות באיור 4.
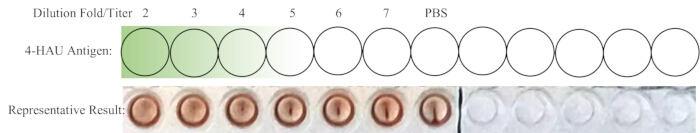
איור 4: פריסה סכמטית של הבארות עבור טיטרציה לאחור ותוצאה מייצגת. פתרון העבודה המדולל של 4-HAU מועבר לשורה חדשה, עם בקרת PBS נוספת. השיפוע מכהה לירוק בהיר מציין את ריכוז האנטיגן מגבוה לנמוך. תוצאות מייצגות מראות כי דילול 1:4 הוא הדילול הגבוה ביותר המציג המגלוטינציה מלאה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- התאם או נסח מחדש את תמיסת האנטיגן 4-HAU במידת הצורך.
הערה: אם הנפח של תמיסת האנטיגן 4-HAU המשמשת בטיטרציה לאחור הוא ≤1% מהנפח הכולל (נפח תמיסת אנטיגן 4-HAU ≥ 15 מ"ל), עיין בטבלה 2 להתאמות ספציפיות. לדוגמה, אם הדילול הגבוה ביותר עם HA מלא הוא 1:2, הטיטר של תמיסת האנטיגן 4-HAU הוא כעת 2, ויש להוסיף נפח שווה של אנטיגן כמו בהכנה הקודמת של תמיסת האנטיגן 4-HAU. לעומת זאת, אם הדילול הגבוה ביותר של HA מלא הוא 1:6, הטיטר הוא כעת 6, ויש לחדש מחצית מנפח ה-PBS.
אם הנפח המשמש בטיטרציה האחורית עולה על 1% מהסך הכולל (נפח תמיסת אנטיגן 4-HAU < 15 מ"ל), נסח מחדש את תמיסת האנטיגן 4-HAU באמצעות גורם הדילול המתוקן. עיין בטבלה 3 לתיקונים הספציפיים. לדוגמה, אם הדילול הגבוה ביותר של HA מלא הוא 1:2, הטיטר של תמיסת האנטיגן 4-HAU הוא כעת 2 ויש להתאים את גורם הדילול ל-1/2 מהמקור. לעומת זאת, אם הדילול הגבוה ביותר של HA מלא הוא 1:6, הטיטר של תמיסת האנטיגן 4-HAU הוא כעת 6, ומקדם הדילול מותאם ל-3/2 מהמקור.
| טיטר HA של טיטרציה אחורית | חידוש מלאי אנטיגן או PBS |
| 1:2 | Va |
| 1:3 | ו/3 |
| 1:5 | סמנכ"ל/4 |
| 1:6 | סמנכ"ל/2 |
| 1:7 | 3Vp/4 |
טבלה 2: טבלת ייחוס להתאמת ריכוז 4-HAU על סמך תוצאות טיטרציה לאחור. Va ו-Vp מייצגים את נפחי האנטיגן וה-PBS המשמשים בניסוח תמיסת אנטיגן 4-HAU, בהתאמה.
| טיטר HA של טיטרציה אחורית | תיקון גורם דילול |
| 1:2 | ד/2 |
| 1:3 | תלת-ממד/4 |
| 1:5 | 5 י'/4 |
| 1:6 | תלת מימד/2 |
| 1:7 | 7 י'/4 |
טבלה 3: טבלת ייחוס של תיקון גורם דילול להכנה מחדש של אנטיגן 4-HAU. D מייצג את גורם הדילול ששימש בעבר בהכנת אנטיגן 4-HAU.
6. הכנת סרום
- אוספים ~1 מ"ל דם מכנפי עוף ללא שימוש בנוגד קרישה.
- העבירו את הדם לצינור צנטריפוגה של 1.5 מ"ל ודגרו בטמפרטורה של 37 מעלות צלזיוס למשך ~2 שעות. צנטריפוגה ב-3,000 x גרם למשך 10 דקות, ולשאוף בזהירות את הסופרנטנט לתוך צינור חדש.
7. בדיקת HI
- סמן לוחות מיקרוטיטר בהתאם לפריסת הבדיקה. הוסף 25 מיקרוליטר של PBS לכל באר בעמודות 1-11, ו-50 מיקרוליטר לבארות בעמודה 12, באמצעות פיפטה רב-ערוצית.
- הוסף 25 מיקרוליטר של סרום לבאר הראשונה של כל שורה, כולל שורות בקרת סרום חיוביות ושליליות. מערבבים היטב על ידי פיפטינג למעלה ולמטה לפחות פי 5.
- מעבירים 25 מיקרוליטר מהבאר הראשונה של כל שורה לבאר השנייה ומערבבים היטב. המשיכו להעביר ולערבב מהבאר השנייה לשלישית, וכן הלאה, עד העמודה העשירית. השליכו 25 מיקרוליטר נוזל מהבאר בעמודה העשירית לאחר הערבוב.
- הוסף 25 מיקרוליטר של אנטיגן 4-HAU לכל באר בעמודות 1-11 בכיוון ריכוז סרום נמוך עד גבוה.
- לנער את הצלחת על שייקר מיקרופלייט למשך ~20 שניות. השאירו אותו ללא הפרעה על הספסל למשך ~30 דקות.
- הוסף 25 מיקרוליטר של 1% RBCs עוף לכל באר בכיוון ריכוז סרום נמוך עד גבוה.
- מנערים את הצלחת על שייקר מיקרופלייט למשך ~20 שניות לערבוב יסודי. השאירו אותו ללא הפרעה על הספסל למשך ~30 דקות עד ש-RBCs של בארות הבקרה PBS יתייצבו לחלוטין.
- קרא ורשום את התוצאות.
הערה: טיטר HI הוא דילול הסרום הגבוה ביותר שמעכב לחלוטין את ההמגלוטינציה של אנטיגן 4-HAU. ניתן להבחין בזרימה בצורת דמעה של RBCs בעמודה האחרונה של כל שורה, על ידי הטיית הלוח ב-90° למשך 25 שניות. ניתן לצפות ב-HA מלא (ללא זרימה) בבאר השנייה האחרונה מסוף כל שורה. תוצאות בדיקה תקפות דורשות שטיטר ה-HI של בקרת הסרום החיובית יהיה בטווח של דילול אחד מטיטר ה-HI הידוע; טיטר ה-HI של בקרת הסרום השלילי יהיה ≤ 2 log2; והיעדר HA עצמי של בקרת RBC. לקבלת דיאגרמה סכמטית של זרימת העבודה של בדיקת HA, ראה איור 5.
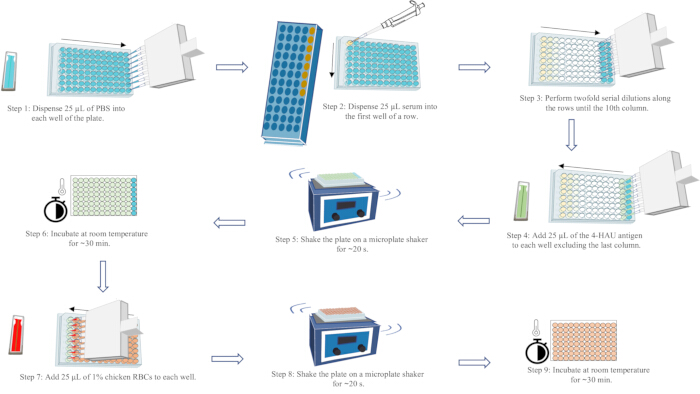
איור 5: דיאגרמה סכמטית של זרימת עבודה של בדיקת המגלוטינציה. PBS מיוצג בכחול, סרום בצהוב, תמיסת אנטיגן 4-HAU בירוק ותרחיף RBC עוף 1% באדום. החצים מציינים את סדר חלוקת הנוזלים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
אימות הטיטר של תמיסת אנטיגן 4-HAU שנוסחה בשיטה האופטימלית
המחקר השתמש בדילולים שונים של תמיסת מלאי האנטיגן כדי לקבוע במדויק את טיטר ה-HA, מה שהקל על חישוב גורם הדילול להכנת תמיסת האנטיגן 4-HAU. התוצאות מגלות כי השיטה האופטימלית יעילה ומדויקת כאחד, ומפחיתה את מספר הל...
Discussion
השיטה האופטימלית המוצעת במאמר זה מציגה גישה להכנה מדויקת של תמיסת האנטיגן 4-HAU. למרות שהנחיות ה-OIE והאיחוד האירופי מציעות דילול ראשוני לטיטרציה של HA, הן אינן מספקות פרטים מדויקים לגבי יחסי הדילול שיש להשתמש בהם או מציעות מתודולוגיות ספציפיות11,12. יתר ע?...
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
C.C. נתמכה על ידי תוכנית Taicang Technology (TC2021JC16), וקרנות צוות החדשנות של המכון הטכנולוגי Suzhou Chien-shiung (2023JXKYTD01). ח.י. נתמך על ידי תוכנית Taicang Technology (TC2021JC11). שניהם נתמכו על ידי קרן הסטארט-אפ לחוקרי דוקטורט חדשים של המכון הטכנולוגי סוג'ואו צ'ין-שיונג.
Materials
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
References
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved