Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизация антигенного препарата для анализа ингибирования гемагглютинации серологического исследования вируса болезни Ньюкасла
В этой статье
Резюме
В данной статье представлен упрощенный способ получения антигена 4 единиц гемагглютинации для серологического тестирования на вирус болезни Ньюкасла. Точное определение титра гемагглютинации антигена в сочетании с более строгим методом обратного титрования и четко определенным процессом корректировки повышает эффективность теста, снижает количество ложноположительных результатов и улучшает эпиднадзор за болезнями домашней птицы.
Аннотация
Точная оценка титров антител к вирусу болезни Ньюкасла (NDV) имеет решающее значение для эффективного контроля и надзора за болезнями домашней птицы. В данной статье представлен оптимизированный метод получения антигенного раствора 4 единиц гемагглютинации (4-HAU), ключевого компонента анализа ингибирования гемагглютинации (HI), используемого при серологическом детектировании NDV. В отличие от традиционных методов, которые включают в себя трудоемкие и неопределенные этапы обратного титрования и корректировки, этот подход оптимизирует этот процесс за счет точного измерения титра HA с использованием начальной серии разведений (1:3, 1:5, 1:7 и 1:9). Мы также предлагаем специальный метод корректировки или изменения формулы на основе результатов обратного титрования, что снижает потребность в повторном обратном титровании. Кроме того, мы оценили влияние точности раствора антигена 4-HAU на титр HI в сыворотке крови и обнаружили, что когда титр антигена 4-HAU был ниже 3, это приводило к появлению ложноположительных образцов HI. Обеспечивая точный метод и сводя к минимуму вычислительные задачи, этот подход повышает эффективность и надежность тестов, способствуя улучшению эпиднадзора и контроля заболеваний в популяциях домашней птицы.
Введение
Болезнь Ньюкасла (НД) является широко распространенным и тяжелым заболеванием домашней птицы, признанным во всем мире 1,2,3. Он проявляется различными симптомами, такими как высокая температура, респираторный дистресс, дизентерия, нервные расстройства и кровоизлияние в слизистую оболочку4. Возбудитель, вирус болезни Ньюкасла (NDV), сохраняется уже почти столетие, поражая более 200 видов птиц, включая кур, уток, гусей иголубей. Передача инфекции происходит в основном при прямом или косвенном контакте с инфицированными птицами, при этом домашняя птица, голуби и птицы, живущие на свободном выгуле, служат потенциальными резервуарами6. Несмотря на то, что NDV является единственным серотипом, его генетическое разнообразие создает значительные проблемы для ведения и контроля заболеваний 3,7.
Вакцинация служит основной стратегией борьбы с НД, дополненной строгими мерами биобезопасности 5,8. Во всем мире доступны различные коммерческие вакцины для домашней птицы, которые вызывают устойчивый ответ сывороточных антител после иммунизации9. Эти антитела играют решающую роль в смягчении тяжести симптомов при контакте с вирулентными штаммами и в сдерживании передачи между стадами10. Стандартные протоколы ревакцинации, обычно включающие живые аттенуированные вакцины, вводимые каждые 6-12 недель, являются стандартной практикой в регионах, эндемичных по ND9. Регулярный мониторинг титров антител после вакцинации в коммерческом поголовье птицы имеет важное значение для оценки эффективности вакцины 11,12,13. Низкие титры антител после вакцинации могут указывать на неэффективность вакцины, что порождает необходимость принятия своевременных корректирующих мер, таких как дополнительная вакцинация или исследование потенциальных иммуносупрессивных факторов, влияющих на иммунный ответ14.
Для выявления сывороточных антител против NDV используются различные методы, включая иммуноферментный анализ, ингибирование гемагглютинации (HI) и анализ нейтрализации 9,13,15,16. Каждый метод имеет уникальные преимущества и ограничения в отношении чувствительности, специфичности и экономической эффективности.
В данной статье описан пошаговый протокол, основанный на протоколе Всемирной организации по охране здоровья животных (МЭБ) по проведению ГИ для количественного определения титров сывороточных специфических антител против NDV11. Гемагглютинация (ГК), явление, вызванное некоторыми оболочечными вирусами, такими как NDV, включает в себя слипание эритроцитов (эритроцитов)9. Белок гемагглютинин-нейраминидаза (HN) на поверхности NDV взаимодействует с эритроцитами, что приводит к слипанию клеток и образованию решетки2. Анализ HI является предпочтительным серологическим методом из-за его способности оценивать специфичность сывороточных антител к белку HN NDV 8,9. Кроме того, его экономичность и независимость от специализированных приборов делают его доступным и практичным для повседневного использования.
Чтобы повысить эффективность анализа, мы усовершенствовали рабочий процесс протокола OIE11, уделив особое внимание получению более точных титров антигена HA и предложив подробные корректировки для решения антигена с 4 единицами гемагглютинации (4-HAU). Кроме того, с помощью сравнительного анализа мы оценили влияние точности 4-HAU на результаты HI, что предоставило ценную информацию для практикующих врачей. Этот подход не ограничивается тестированием на антитела к NDV, но распространяется на выявление вирусных подтипов и других гемагглютинирующих вирусов, включая корь, полиомавирус, эпидемический паротит и краснуху.
протокол
Одобрение протокола было предоставлено местным институциональным комитетом по уходу за животными и их использованию. Все процедуры с использованием живых вирусных антигенов и клинических образцов сыворотки проводились в лаборатории уровня биобезопасности 2 в соответствии с установленными протоколами безопасности.
1. Приготовление 1% куриной суспензии эритроцитов
- Добавьте 3 мл раствора Алсервера (антикоагулянта) в стерильную коническую центрифужную пробирку объемом 15 мл.
- Соберите по 1 мл крови из крыльевой вены каждого из трех неиммунных цыплят (без антител к NDV). Немедленно переложите кровь в пробирку, содержащую антикоагулянт, и аккуратно перемешайте.
- Заполните пробирку стерильным 1x фосфатно-буферным физиологическим раствором (PBS, pH 7,2-7,4) до общего объема 12 мл и осторожно перемешайте. Центрифугируйте при 500 × г в течение 10 мин с помощью горизонтального ротора.
- Осторожно удалите надосадочную жидкость и слой лейкоцитов. Повторите шаги 1.3 и 1.4 2 раза, чтобы получить гранулу эритроцитов.
- Переверните пипеткой 1 мл гранулы эритроцитов в 99 мл стерильного PBS, чтобы получить 1% суспензию эритроцитов.
ПРИМЕЧАНИЕ: Требуемый объем 1% куриной суспензии эритроцитов оценивается в 3 мл/планшет (25 мкл/лунка x 96 лунок x 1,25 = 3,0 мл; где 1,25 приходится на отходы пипетирования для обеспечения достаточного объема).
2. Восстановление лиофилизированного антигена или сыворотки крови
- Добавьте 2 мл стерильного PBS в ампулу, содержащую лиофилизированный антиген или сыворотку. Осторожно встряхните ампулу и дайте ей постоять 2-3 минуты, чтобы свести к минимуму образование пузырьков и обеспечить полное растворение.
ПРИМЕЧАНИЕ: Следуйте инструкциям конкретного производителя, так как в этом исследовании не сравнивались различные типы лиофилизированных материалов. - Восстановившийся раствор разложить по 1,5 мл центрифужных пробирок и заморозить при температуре -20 °C до использования.
ПРИМЕЧАНИЕ: Повторно определяйте титр ГК каждый раз, когда антиген размораживается и используется, или когда готовится новая суспензия эритроцитов.
3. Титрование антигенов ГК
- Диспонируйте 40, 80, 120 и 160 мкл PBS соответственно в четыре соседние лунки одноразового 96-луночного планшета для микротитрования с V-образным дном, затем добавьте по 20 мкл антигена в каждую лунку и перемешайте пипетированием вверх и вниз 10 раз для получения разведений 1:3, 1:5, 1:7 и 1:9 соответственно. Принципиальная схема операции разведения представлена на рисунке 1.
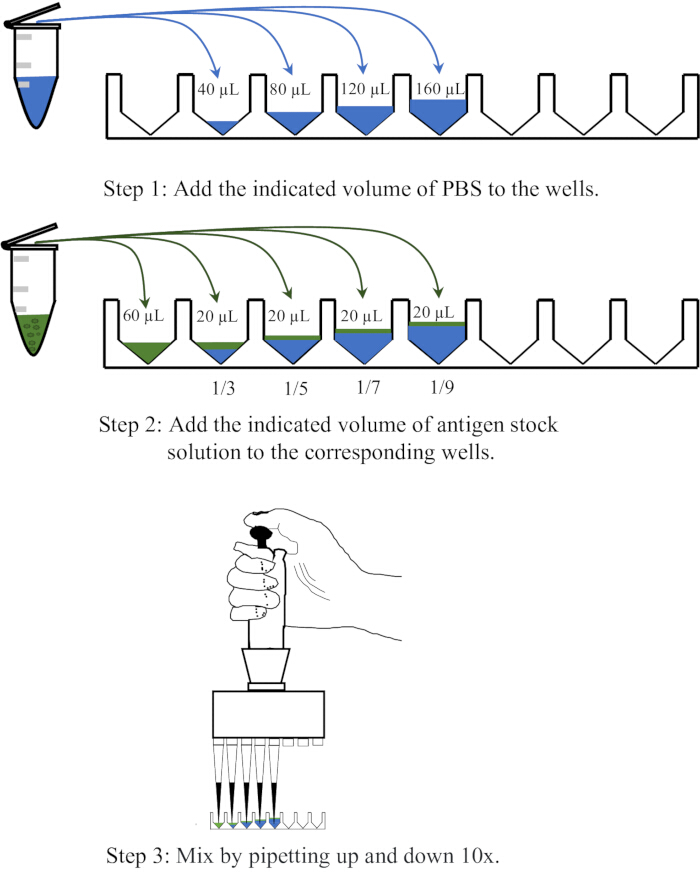
Рисунок 1: Принципиальная схема, иллюстрирующая процедуру разбавления раствора антигена в анализе гемагглютинации. Раствор антигена разводят в PBS в соотношении 1:3, 1:5, 1:7 и 1:9 соответственно. PBS в лунках или центрифужных пробирках представлен синим цветом, а антигены — зеленым. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Наклейте этикетку на новую микротитровальную пластину. Добавьте по 25 мкл PBS в каждую лунку рядами 1-5.
- Поместите 25 мкл разбавленных растворов антигена в первые лунки рядов 1-5 с помощью многоканальной пипетки и перемешайте пипетированием вверх и вниз не менее 5 раз.
- Перелейте по 25 мкл из первой лунки каждого ряда во вторую, тщательно перемешивая. Продолжайте перекачивать из одной скважины в другую, вплоть до 11-й колонны, чтобы получить двукратное серийное разведение (от 1:2 до 1:2048). Выбросьте 25 мкл после 11-й колонки.
- Добавьте 25 μL PBS в каждую лунку, начиная с лунок с самой низкой концентрацией антигена.
- Добавьте 25 мкл 1% куриной суспензии эритроцитов в каждую лунку, опять же, начиная с лунок, содержащих самую низкую концентрацию антигена.
- Встряхните пластину на вибростенде для микропланшетов в течение ~20 секунд, чтобы тщательно перемешать.
- Оставьте его в покое на столе при комнатной температуре (20-25 °C) на ~30 минут до полного закрепления эритроцитов 12-й колонны. Схема расположения пластин приведена на рисунке 2.
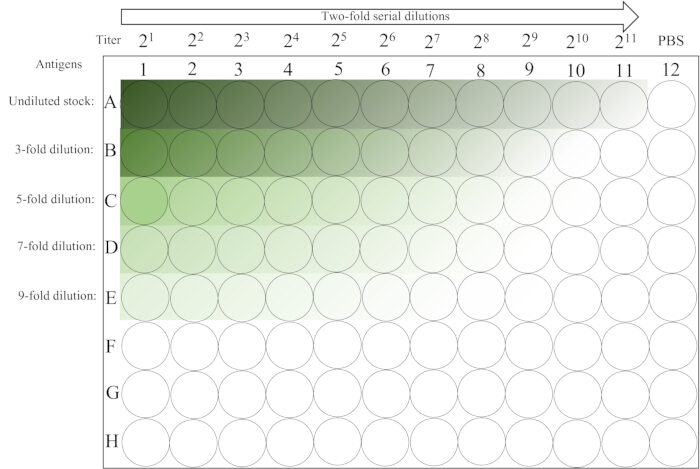
Рисунок 2: Схематическое расположение микропланшета, используемого в анализе гемагглютинации. Первый столбец строк 1-5 содержит неразбавленные и различные исходные разведения раствора антигена, за которыми следует двукратное серийное разведение слева направо до столбца 11. Элемент управления PBS размещается в последнем столбце. Градиент от темного к светлому указывает на снижение концентрации антигена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Чтение и запись результатов. ГК определяется путем наклона пластины на 90° в течение ~25 с и наблюдения за наличием или отсутствием каплевидного потока эритроцитов. Наибольшее разведение, показывающее полную гемагглютинацию (без потока), соответствует 1 единице HA. Скважины в 12-й колонне служат в качестве эритроцитов (отрицательных) контролей.
- Рассчитайте титр ГК каждой строки с помощью таблицы 1, максимальное значение которой используется для приготовления раствора антигена 4-HAU. Например, если a, b, c, d и e равны 9, 8, 7, 6, 6 соответственно, то 3 x 28 = 768 является максимальным значением, а титр HA запаса антигена.
| Антигенов | Самая высокая колонна разбавления полной ГК | Титр гиалуроновой кислоты неразбавленного сырья |
| Неразбавленный запас | a | 2а |
| 3-кратное разведение | b | 3 х 2б |
| 5-кратное разведение | c | 5 х 2с |
| 7-кратное разведение | d | 7 х 2д |
| 9-кратное разведение | e | 9 x 2e |
Таблица 1: Результаты анализа ГК и расчет титра ГК исходного раствора.
4. Приготовление раствора антигена 4-HAU
- Рассчитайте коэффициент разведения для приготовления раствора антигена 4-HAU:
 . Определите общий необходимый объем 4-HAU: V = 3 мл x Количество микропланшетов. Затем рассчитаем необходимые объемы антигенного стокового раствора:
. Определите общий необходимый объем 4-HAU: V = 3 мл x Количество микропланшетов. Затем рассчитаем необходимые объемы антигенного стокового раствора: 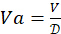 , и PBS: Vp = V - Va.
, и PBS: Vp = V - Va.
ПРИМЕЧАНИЕ: Объемы измеряются в миллилитрах. Оцените концентрацию 3 мл на микротитровальный планшет 4-HAU (25 мкл/лунка x 96 лунок x 1,25 = 3 мл). - Пипеткой наберите рассчитанный объем PBS в контейнер, затем добавьте соответствующий объем исходного раствора антигена и хорошо перемешайте до получения раствора антигена 4-HAU.
ПРИМЕЧАНИЕ: Раствор антигена 4-HAU следует использовать как можно скорее.
5. Обратное титрование раствора антигена 4-HAU
- Диспонируйте 25, 50, 75, 100, 125 и 150 мкл PBS в шесть соседних лунок микротитровального планшета, затем добавьте 25 мкл раствора антигена 4-HAU в каждую лунку и перемешайте пипетированием вверх и вниз в 10 раз.
ПРИМЕЧАНИЕ: Разбавьте раствор антигена 4-HAU PBS в дозах 1:2, 1:3, 1:4, 1:5, 1:6 и 1:7. Принципиальная схема операции разубоживания представлена на рисунке 3.
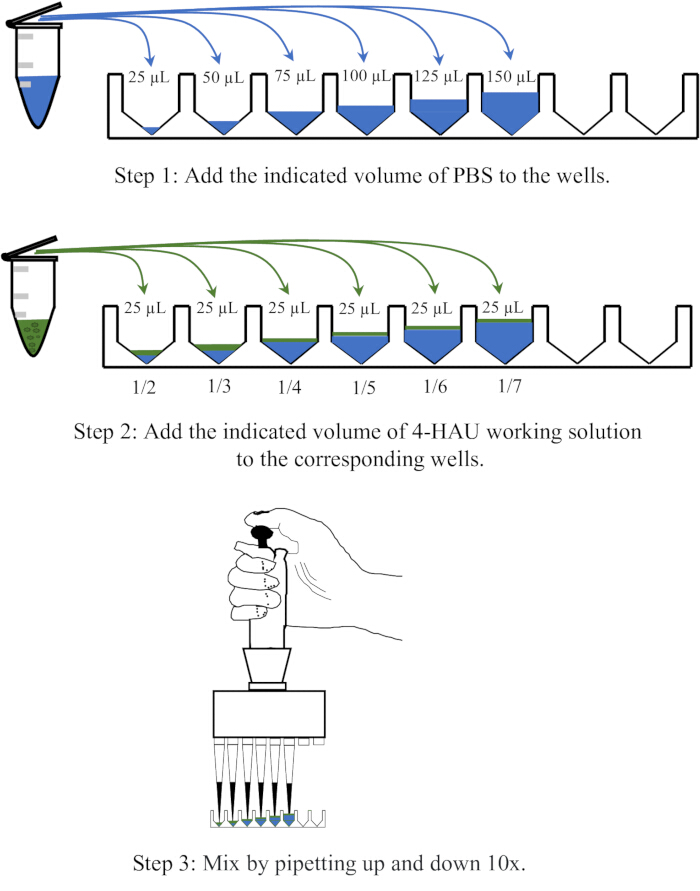
Рисунок 3: Принципиальная схема процедуры разведения раствора 4 единиц гемагглютинации при обратном титровании. Рабочий раствор 4-HAU разбавляют PBS в соотношении 1:2, 1:3, 1:4, 1:5, 1:6 и 1:7. PBS изображен синим цветом, а антигены — зеленым. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- С помощью многоканальной пипетки переведите по 25 мкл каждого разбавленного раствора антигена в лунки другого ряда. Добавьте 25 мкл PBS в дополнительную лунку в качестве отрицательного контроля.
- Добавьте 25 μL PBS в каждую лунку, затем добавьте 25 μL 1% куриных эритроцитов в каждую лунку.
- Встряхните пластину на вибростенде в течение ~20 секунд для смешивания.
- Оставьте его в покое на столе при комнатной температуре (20-25 °C) на ~30 минут, пока эритроциты отрицательного контроля полностью не осядут.
- Чтение и запись результатов.
ПРИМЕЧАНИЕ: Отрицательная контрольная лунка не должна показывать HA. В идеале разведение 1:4 — это именно самое высокое разведение с полной ГК. Если титр раствора 4-HAU больше 4, то наибольшее разведение может составлять 1:5, 1:6 или 1:7; Если меньше, то это может быть 1:2 или 1:3. Схематическая схема обратного титрования и репрезентативные результаты показаны на рисунке 4.
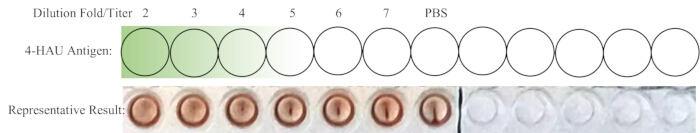
Иллюстрация 4: Схематическая схема расположения скважин для обратного титрования и получения репрезентативного результата. Разбавленный рабочий раствор 4-HAU переносится в новый ряд, с добавлением дополнительного регулятора PBS. Градиент от темно-зеленого к светло-зеленому указывает на концентрацию антигена от высокой до низкой. Репрезентативные результаты показывают, что разведение 1:4 является самым высоким разведением, демонстрирующим полную гемагглютинацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- При необходимости скорректируйте или измените рецептуру раствора антигена 4-HAU.
ПРИМЕЧАНИЕ: Если объем раствора антигена 4-HAU, используемого при обратном титровании, составляет ≤1% от общего объема (объем раствора антигена 4-HAU ≥ 15 мл), обратитесь к таблице 2 для конкретных корректировок. Например, если наибольшее разведение с полной ГК составляет 1:2, то титр раствора антигена 4-HAU теперь равен 2, и следует добавить такой же объем антигена, как и при предыдущем приготовлении раствора антигена 4-HAU. И наоборот, если максимальное разбавление полной ГК равно 1:6, то титр теперь равен 6, и следует восполнить половину объема ПБС.
Если объем, используемый при обратном титровании, превышает 1% от общего (объем раствора антигена 4-HAU < 15 мл), раствор антигена 4-HAU переформулирован с использованием скорректированного коэффициента разведения. Конкретные исправления см. в таблице 3 . Например, если наибольшее разведение полной ГК составляет 1:2, то титр раствора антигена 4-HAU теперь равен 2, и коэффициент разведения должен быть скорректирован до 1/2 от исходного. И наоборот, если максимальное разведение полной ГК составляет 1:6, титр раствора антигена 4-HAU теперь равен 6, а коэффициент разведения корректируется до 3/2 от исходного.
| Титр обратного титрования ГК | Пополнение антигена или PBS |
| 1:2 | Ва |
| 1:3 | ВА/3 |
| 1:5 | Vp/4 |
| 1:6 | Vp/2 |
| 1:7 | 3 В (размах)/4 |
Таблица 2: Справочная таблица для корректировки концентрации 4-HAU на основе результатов обратного титрования. Va и Vp представляют собой объемы антигена и PBS, используемые в рецептуре раствора антигена 4-HAU соответственно.
| Титр обратного титрования ГК | Коррекция коэффициента разбавления |
| 1:2 | Д/2 |
| 1:3 | 3D/4 |
| 1:5 | 5D/4 |
| 1:6 | 3D/2 |
| 1:7 | 7D/4 |
Таблица 3: Справочная таблица коррекции коэффициента разведения для повторного получения антигена 4-HAU. D представляет собой фактор разведения, ранее использовавшийся в препарате антигена 4-HAU.
6. Приготовление сыворотки
- Соберите ~1 мл крови из куриных крылышек без использования антикоагулянта.
- Перелейте кровь в центрифужную пробирку объемом 1,5 мл и инкубируйте при 37 °C в течение ~2 ч. Центрифугируйте при 3000 x g в течение 10 минут и осторожно отсасывайте надосадочную жидкость в новую пробирку.
7. Анализ HI
- Маркируйте микротитровальные планшеты в соответствии с схемой анализа. Добавьте 25 мкл PBS в каждую лунку в колонках 1-11 и 50 мкл в лунки в колонке 12 с помощью многоканальной пипетки.
- Добавьте 25 мкл сыворотки в первую лунку каждого ряда, включая положительные и отрицательные ряды контроля сыворотки. Тщательно перемешайте, пипетируя вверх и вниз не менее 5 раз.
- Перелейте по 25 мкл из первой лунки каждого ряда во вторую лунку и тщательно перемешайте. Продолжайте перекладывать и перемешивать из второй лунки в третью, и так далее, до 10-й колонны. После смешивания слейте 25 мкл жидкости из лунки в 10-й колонне.
- Добавьте по 25 мкл антигена 4-HAU в каждую лунку в столбцах 1-11 в направлении низкой и высокой концентрации в сыворотке крови.
- Встряхните тарелку на шейкере для микропланшетов в течение ~20 с. Оставьте его в покое на столе на ~30 минут.
- Добавьте 25 мкл 1% куриных эритроцитов в каждую лунку в направлении низкой и высокой концентрации в сыворотке крови.
- Встряхните пластину на вибростенде для микропланшетов в течение ~20 секунд, чтобы тщательно перемешать. Оставьте его нетронутым на столе на ~30 минут, пока эритроциты контрольных скважин PBS полностью не устоятся.
- Чтение и запись результатов.
ПРИМЕЧАНИЕ: Титр HI является самым высоким разбавлением сыворотки, которое полностью ингибирует гемагглютинацию антигена 4-HAU. Каплевидное течение эритроцитов можно наблюдать в последнем столбце каждого ряда, при наклоне пластины на 90° в течение 25 с. Полная ГК (без протока) может наблюдаться во второй, предпоследней лунке с конца каждого ряда. Достоверные результаты теста требуют, чтобы титр HI положительного сывороточного контроля находился в пределах одного разведения от известного титра HI; титр HI отрицательного сывороточного контроля должен составлять ≤ 2 log2; и отсутствие самооценки ГА управления РБК. Принципиальная схема рабочего процесса анализа ГК приведена на рисунке 5.
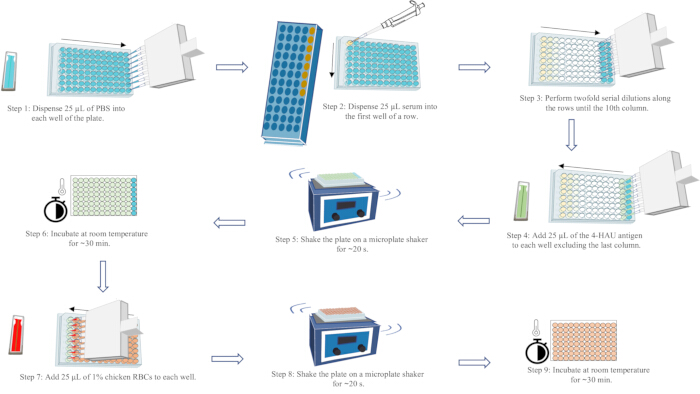
Рисунок 5: Принципиальная схема рабочего процесса анализа гемагглютинации. PBS представлен синим цветом, сыворотка — желтым, раствор антигена 4-HAU — зеленым, а 1% суспензия куриных эритроцитов — красным. Стрелками обозначен порядок выдачи жидкости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Валидация титра раствора антигена 4-HAU, полученного по оптимизированному методу
В исследовании использовались различные разведения стокового раствора антигена для точного определения титра HA, что облегчает расчет коэффициента разведения для приготовлен?...
Обсуждение
Предложенный в данной статье оптимизированный метод представляет собой подход к точному приготовлению раствора антигена 4-HAU. Несмотря на то, что в руководящих принципах МЭБ и ЕС предлагаются первоначальные разведения для титрования ГК, они не содержат точных подробностей отно?...
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
C.C. был поддержан программой Taicang Technology (TC2021JC16) и фондами инновационной команды Технологического института Сучжоу Чен-шунг (2023JXKYTD01). H.Y. был поддержан программой Taicang Technology (TC2021JC11). Оба они были поддержаны Фондом стартапов для новых исследователей Сучжоу Чиен-Шунг Технологического института.
Материалы
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
Ссылки
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены