É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Otimização da preparação do antígeno para ensaio de inibição da hemaglutinação da sorologia do vírus da doença de Newcastle
Neste Artigo
Resumo
Este artigo apresenta um método simplificado para preparar o antígeno de 4 unidades de hemaglutinação para o teste sorológico do vírus da doença de Newcastle. Ao determinar com precisão o título de hemaglutinação do antígeno, combinado com um método de titulação reversa mais rigoroso e um processo de ajuste bem definido, aumenta a eficiência do teste, reduz os falsos positivos e melhora a vigilância da doença em aves.
Resumo
A avaliação precisa dos títulos de anticorpos do vírus da doença de Newcastle (NDV) é crucial para o controle e vigilância eficazes da doença avícola. Este artigo apresenta um método otimizado para preparar solução de antígeno de 4 unidades de hemaglutinação (4-HAU), um componente-chave do ensaio de inibição da hemaglutinação (HI) usado na detecção sorológica de NDV. Ao contrário dos métodos convencionais, que envolvem etapas de retrotitulação e ajuste demoradas e indefinidas, essa abordagem agiliza esse processo medindo com precisão o título de HA usando uma série inicial de diluições (1:3, 1:5, 1:7 e 1:9). Também fornecemos um método específico para ajustar ou reformular com base nos resultados da titulação reversa, reduzindo a necessidade de titulações reversas repetidas. Além disso, avaliamos o efeito da acurácia da solução do antígeno 4-HAU no título sérico de HI e descobrimos que, quando o título do antígeno 4-HAU era menor que 3, resultava no aparecimento de amostras de HI falso-positivas. Ao fornecer um método preciso e minimizar as tarefas computacionais, essa abordagem aumenta a eficiência e a confiabilidade dos testes, contribuindo para melhorar a vigilância e o controle de doenças em populações de aves.
Introdução
A doença de Newcastle (DN) é uma doença avícola generalizada e grave reconhecida globalmente 1,2,3. Manifesta-se através de vários sintomas, como febre alta, desconforto respiratório, disenteria, distúrbios nervosos e hemorragia mucosa4. O agente causador, o vírus da doença de Newcastle (NDV), perdura há quase um século, afligindo mais de 200 espécies de aves, incluindo galinhas, patos, gansos epombos. A transmissão ocorre principalmente por meio do contato direto ou indireto com aves infectadas, com aves, pombos e aves de vida livre servindo como reservatórios potenciais6. Apesar do sorotipo único do NDV, sua diversidade genética apresenta desafios significativos para os esforços de gerenciamento e controle da doença 3,7.
A vacinação serve como estratégia primária para o controle do ND, complementada por medidas rigorosas de biossegurança 5,8. Várias vacinas comerciais estão disponíveis globalmente para aves, provocando respostas robustas de anticorpos séricos após a imunização9. Esses anticorpos desempenham um papel crítico na mitigação da gravidade dos sintomas após a exposição a cepas virulentas e na redução da transmissão entre lotes10. Protocolos padrão de revacinação, geralmente envolvendo vacinas vivas atenuadas administradas a cada 6-12 semanas, são prática padrão em regiões endêmicas para ND9. O monitoramento rotineiro dos títulos de anticorpos pós-vacinação em lotes de aves comerciais é essencial para avaliar a eficácia da vacina 11,12,13. Baixos títulos de anticorpos pós-vacinação podem indicar falha vacinal, levando a medidas corretivas oportunas, como vacinação suplementar ou investigação de potenciais fatores imunossupressores que afetam a resposta imune14.
Várias técnicas são utilizadas para detectar anticorpos séricos contra NDV, incluindo ensaio imunoenzimático, inibição da hemaglutinação (HI) e ensaio de neutralização 9,13,15,16. Cada método apresenta vantagens e limitações únicas em relação à sensibilidade, especificidade e custo-efetividade.
Este artigo delineia um protocolo passo a passo baseado no protocolo da Organização Mundial de Saúde Animal (OIE) para a realização de HI para quantificar títulos de anticorpos específicos do soro contra o NDV11. A hemaglutinação (AH), um fenômeno induzido por certos vírus envelopados como o NDV, envolve a aglomeração de glóbulos vermelhos (RBCs)9. A proteína hemaglutinina-neuraminidase (HN) na superfície do NDV interage com as hemácias, resultando em aglomeração celular e formação de rede2. O ensaio HI é preferido como método sorológico devido à sua capacidade de avaliar a especificidade do anticorpo sérico em relação à proteína HN do NDV 8,9. Além disso, sua relação custo-benefício e independência de instrumentação especializada o tornam acessível e prático para uso rotineiro.
Para melhorar a eficiência do ensaio, refinamos o fluxo de trabalho do protocolo OIE11, com foco na obtenção de títulos de antígeno HA mais precisos e oferecendo ajustes detalhados para a solução de antígeno de 4 unidades de hemaglutinação (4-HAU). Além disso, por meio de análise comparativa, avaliamos o impacto da precisão do 4-HAU nos resultados de HI, fornecendo informações valiosas para os profissionais de campo. Essa abordagem não se limita ao teste de anticorpos NDV, mas se estende à detecção de subtipos virais e outros vírus hemaglutinantes, incluindo sarampo, poliomavírus, caxumba e rubéola.
Protocolo
A aprovação do protocolo foi concedida pelo comitê institucional local de cuidados e uso de animais. Todos os procedimentos envolvendo antígenos de vírus vivos e amostras de soro clínico foram realizados em laboratório de Nível 2 de Biossegurança, em conformidade com os protocolos de segurança estabelecidos.
1. Preparação de suspensão de hemácias de frango a 1%
- Adicione 3 mL de solução de Alserver (anticoagulante) em um tubo de centrífuga cônico estéril de 15 mL.
- Colete 1 mL de sangue da veia da asa de cada uma das três galinhas não imunes (sem anticorpos NDV). Transfira imediatamente o sangue para o tubo que contém o anticoagulante e misture suavemente.
- Encha o tubo com solução salina estéril 1x tamponada com fosfato (PBS, pH 7,2-7,4) até um volume total de 12 mL e misture delicadamente. Centrifugue a 500 × g por 10 min usando um rotor horizontal.
- Remova cuidadosamente o sobrenadante e a camada de glóbulos brancos. Repita as etapas 1.3 e 1.4 2x para obter o pellet RBC.
- Pipete reversa 1 mL do pellet de hemácias em 99 mL de PBS estéril, para preparar uma suspensão de 1% de hemácias.
NOTA: O volume necessário da suspensão de hemácias de frango a 1% é estimado em 3 mL / placa (25 μL / poço x 96 poços x 1,25 = 3,0 mL; onde 1,25 é responsável pelo desperdício de pipetagem para garantir volume suficiente).
2. Reconstituição do antígeno ou soro liofilizado
- Adicione 2 mL de PBS estéril à ampola que contém o antígeno ou soro liofilizado. Agite suavemente a ampola e deixe-a repousar por 2-3 min para minimizar as bolhas e garantir a dissolução completa.
NOTA: Siga as instruções específicas do fabricante, pois diferentes tipos de materiais liofilizados não foram comparados neste estudo. - Aliquotar a solução reconstituída em tubos de centrífuga de 1,5 ml e congelar a -20 °C até à utilização.
NOTA: Redetermine o título de HA cada vez que o antígeno for descongelado e usado, ou quando uma nova suspensão de hemácias for preparada.
3. Titulação de antígenos de HA
- Dispense 40, 80, 120 e 160 μL de PBS, respectivamente, em quatro poços adjacentes de uma placa microtituladora descartável de 96 poços com fundo em V, adicione 20 μL de antígeno a cada poço e misture pipetando para cima e para baixo 10x para obter diluições de 1:3, 1:5, 1:7 e 1:9, respectivamente. Na figura 1 é apresentado um diagrama esquemático da operação de diluição.
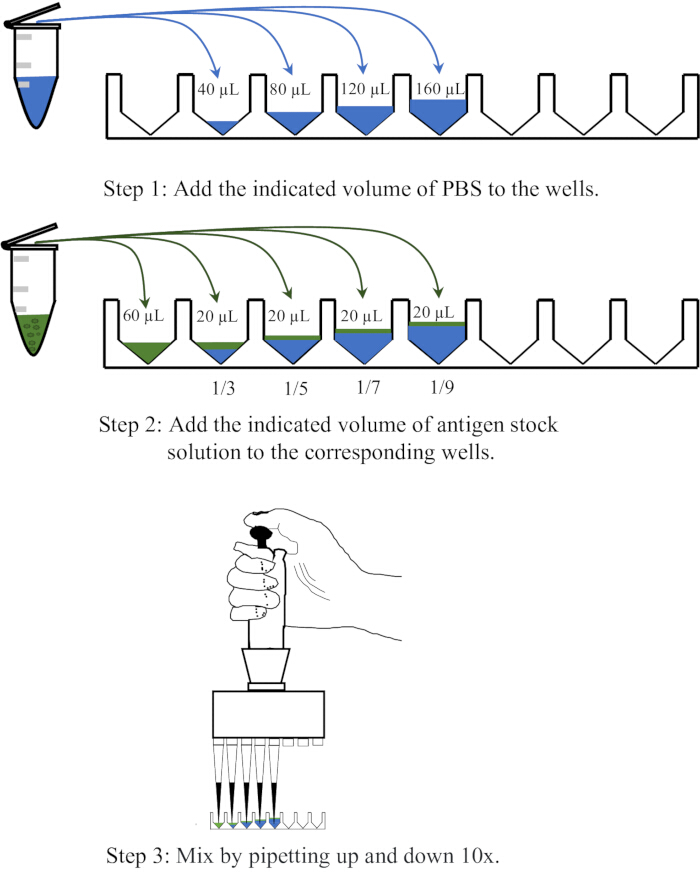
Figura 1: Diagrama esquemático ilustrando o procedimento de diluição da solução de antígeno no ensaio de hemaglutinação. A solução de antígeno é diluída em PBS nas proporções de 1:3, 1:5, 1:7 e 1:9, respectivamente. O PBS em poços ou tubos de centrífuga é representado em azul, enquanto os antígenos são mostrados em verde. Clique aqui para ver uma versão maior desta figura.
- Rotule uma nova placa de microtitulação. Adicione 25 μL de PBS a cada poço nas linhas 1-5.
- Colocar 25 μl das soluções diluídas de antigénio nos primeiros alvéolos das fileiras 1-5 utilizando uma pipeta multicanal e misturar pipetando para cima e para baixo pelo menos 5x.
- Transferir 25 μL do primeiro alvéolo de cada fileira para o segundo alvéolo, misturando bem. Continue transferindo de um poço para o outro, até a 11ª coluna, para criar diluições seriais duplas (1:2 a 1:2048). Rejeitar 25 μL após a 11.a coluna.
- Adicione 25 μL de PBS a cada poço, começando com os poços que contêm a menor concentração de antígeno.
- Adicione 25 μL de suspensão de hemácias de frango a 1% a cada poço, novamente começando com os poços contendo a menor concentração de antígeno.
- Agite a placa em um agitador de microplacas por ~ 20 s para misturar bem.
- Deixe-o intacto na bancada em temperatura ambiente (20-25 °C) por ~30 min até que as hemácias da 12ª coluna se estabilizem completamente. Para o layout da placa, consulte a Figura 2.
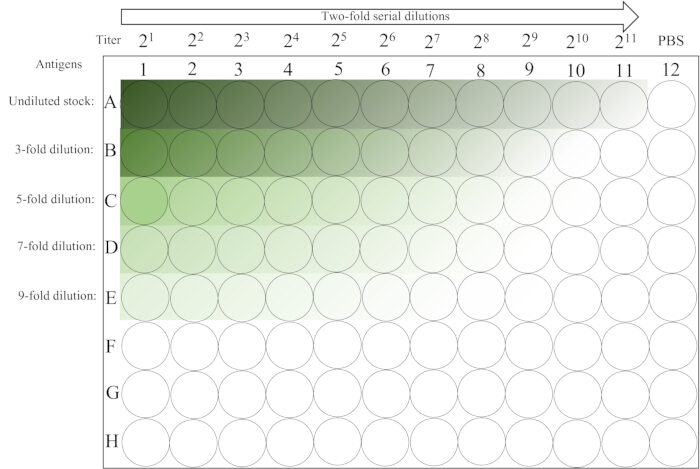
Figura 2: Layout esquemático de uma microplaca usada no ensaio de hemaglutinação. A primeira coluna das linhas 1-5 contém diluições iniciais não diluídas e várias diluições da solução de antigénio, seguidas de uma diluição em série dupla da esquerda para a direita até à coluna 11. O controle PBS é colocado na última coluna. O gradiente de escuro para claro indica diminuição da concentração de antígeno. Clique aqui para ver uma versão maior desta figura.
- Leia e registre os resultados. O AH é determinado inclinando a placa em 90° por ~25 s e observando a presença ou ausência de fluxo em forma de lágrima das hemácias. A diluição mais alta mostrando hemaglutinação completa (sem streaming), representa 1 unidade de HA. Os poços na 12ª coluna servem como controles RBC (negativos).
- Calcular o título de HA de cada linha utilizando o quadro 1, cujo máximo é utilizado para a preparação da solução do antigénio 4-HAU. Por exemplo, se a, b, c, d e e são iguais a 9, 8, 7, 6, 6, respectivamente, então 3 x 28 = 768 é o valor máximo e é o título de HA do estoque de antígeno.
| Antígenos | Coluna de diluição mais elevada de AH total | Título de HA das existências não diluídas |
| Estoque não diluído | um | 2a |
| Diluição de 3 vezes | b | 3 x 2b |
| Diluição de 5 vezes | c | 5 x 2c |
| Diluição de 7 vezes | d | 7 x 2d |
| Diluição de 9 vezes | e | 9 x 2e |
Tabela 1: Resultados do ensaio de HA e cálculo do título de HA da solução estoque.
4. Preparação da solução do antigénio 4-HAU
- Calcular o factor de diluição para a preparação da solução de antigénio 4-HAU:
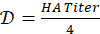 . Determine o volume total de 4-HAU necessário: V = 3mL x Número de microplacas. Em seguida, calcule os volumes necessários de solução estoque de antígeno:
. Determine o volume total de 4-HAU necessário: V = 3mL x Número de microplacas. Em seguida, calcule os volumes necessários de solução estoque de antígeno: 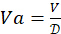 , e PBS: Vp = V - Va.
, e PBS: Vp = V - Va.
NOTA: Os volumes são medidos em mililitros. Estimar 3 mL por placa de microtitulação do 4-HAU (25 μL/poço x 96 poços x 1,25 = 3 mL). - Pipetar o volume calculado de PBS para um recipiente, adicionar o volume correspondente de solução de reserva de antigénio e misturar bem para obter a solução de antigénio 4-HAU.
NOTA: A solução de antígeno 4-HAU deve ser usada o mais rápido possível.
5. Titulação a posteriori da solução do antigénio 4-HAU
- Dispense 25, 50, 75, 100, 125 e 150 μL de PBS em seis poços adjacentes de uma placa de microtitulação, adicione 25 μL da solução de antígeno 4-HAU a cada poço e misture pipetando para cima e para baixo 10x.
NOTA: Dilua a solução de antígeno 4-HAU com PBS em diluições de 1:2, 1:3, 1:4, 1:5, 1:6 e 1:7. Na figura 3 é apresentado um diagrama esquemático da operação de diluição.
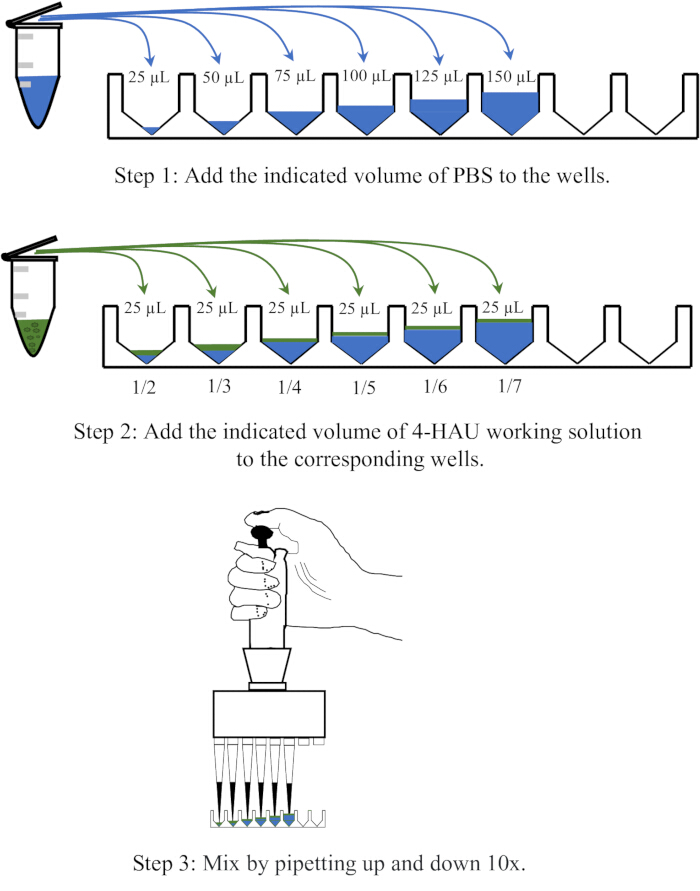
Figura 3: Diagrama esquemático do processo de diluição da solução de 4 unidades de hemaglutinação em titulação posterior. A solução de trabalho 4-HAU é diluída com PBS nas proporções de 1:2, 1:3, 1:4, 1:5, 1:6 e 1:7. O PBS é representado em azul e os antígenos em verde. Clique aqui para ver uma versão maior desta figura.
- Transferir 25 μl de cada solução diluída de antigénio para os alvéolos de outra fileira utilizando uma pipeta multicanal. Adicione 25 μL de PBS a um poço extra como controle negativo.
- Adicione 25 μL de PBS a cada poço e, em seguida, adicione 25 μL de hemácias a 1% de frango a cada poço.
- Agite a placa em um agitador de microplacas por ~ 20 s para misturar.
- Deixe-o sem ser perturbado na bancada à temperatura ambiente (20-25 °C) por ~ 30 min até que as hemácias do controle negativo estejam completamente assentadas.
- Leia e registre os resultados.
NOTA: O poço de controle negativo não deve mostrar HA. Idealmente, a diluição 1:4 é exatamente a diluição mais alta com AH completo. Se o título da solução de 4-HAU for superior a 4, a diluição mais elevada pode ser de 1:5, 1:6 ou 1:7; se menor, pode ser 1:2 ou 1:3. Um layout esquemático da retrotitulação e resultados representativos são mostrados na Figura 4.
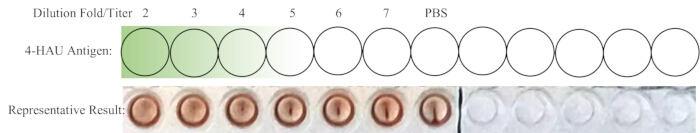
Figura 4: Layout esquemático dos poços para retrotitulação e resultado representativo. A solução de trabalho 4-HAU diluída é transferida para uma nova linha, com um controle PBS adicional adicionado. O gradiente de verde escuro para verde claro indica concentração de antígeno de alta a baixa. Os resultados representativos demonstram que a diluição 1:4 é a diluição mais alta, mostrando hemaglutinação completa. Clique aqui para ver uma versão maior desta figura.
- Ajustar ou reformular a solução de antigénio 4-HAU, se necessário.
NOTA: Se o volume da solução de antígeno 4-HAU usada na titulação reversa for ≤1% do volume total (o volume da solução de antígeno 4-HAU ≥ 15 mL), consulte a Tabela 2 para ajustes específicos. Por exemplo, se a diluição mais alta com AH completo for 1:2, o título da solução de antígeno 4-HAU agora é 2, e um volume igual de antígeno deve ser adicionado como na preparação anterior da solução de antígeno 4-HAU. Por outro lado, se a diluição mais alta de AH completo for de 1:6, o título agora é 6 e metade do volume de PBS deve ser reabastecido.
Se o volume utilizado na titulação a posteriori exceder 1% do total (o volume da solução de antigénio 4-HAU < 15 ml), reformular a solução de antigénio 4-HAU utilizando o factor de diluição corrigido. Consulte a Tabela 3 para as correções específicas. Por exemplo, se a diluição mais alta do AH completo for 1:2, o título da solução de antígeno 4-HAU agora é 2 e o fator de diluição deve ser ajustado para 1/2 do original. Por outro lado, se a diluição mais alta do AH completo for 1:6, o título da solução de antígeno 4-HAU agora é 6 e o fator de diluição é ajustado para 3/2 do original.
| Título de HA da titulação reversa | Reabastecimento de antígeno ou PBS |
| 1:2 | Va |
| 1:3 | Va/3 |
| 1:5 | VP/4 |
| 1:6 | Vp / 2 |
| 1:7 | 3Vp/4 |
Tabela 2: Tabela de referência para ajustar a concentração de 4-HAU com base nos resultados da titulação reversa. Va e Vp representam os volumes de antígeno e PBS usados na formulação da solução de antígeno 4-HAU, respectivamente.
| Título de HA da titulação reversa | Correcção do factor de diluição |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5D/4 |
| 1:6 | 3D/2 |
| 1:7 | 7D/4 |
Quadro 3: Quadro de referência da correcção do factor de diluição para a repreparação do antigénio 4-HAU. D representa o fator de diluição usado anteriormente na preparação do antígeno 4-HAU.
6. Preparação do soro
- Colete ~ 1 mL de sangue de asas de frango sem usar um anticoagulante.
- Transfira o sangue para um tubo de centrífuga de 1,5 mL e incube a 37 ° C por ~ 2 h. Centrifugue a 3.000 x g por 10 min e aspire cuidadosamente o sobrenadante para um novo tubo.
7. Ensaio HI
- Rotule as placas de microtitulação de acordo com o layout do ensaio. Adicione 25 μL de PBS a cada poço nas colunas 1-11 e 50 μL aos poços na coluna 12, usando uma pipeta multicanal.
- Adicione 25 μL de soro ao primeiro poço de cada fileira, incluindo fileiras de controle de soro positivo e negativo. Misture bem pipetando para cima e para baixo pelo menos 5x.
- Transferir 25 μL do primeiro alvéolo de cada fileira para o segundo alvéolo e homogeneizar. Continue transferindo e misturando do segundo poço para o terceiro, e assim por diante, até a 10ª coluna. Descarte 25 μL de líquido do poço na 10ª coluna após a mistura.
- Adicione 25 μL de antígeno 4-HAU a cada poço nas colunas 1-11 na direção da concentração sérica baixa a alta.
- Agite a placa em um agitador de microplacas por ~ 20 s. Deixe-o intacto na bancada por ~ 30 min.
- Adicione 25 μL de hemácias de frango a 1% a cada poço na direção de uma concentração sérica baixa a alta.
- Agite a placa em um agitador de microplacas por ~ 20 s para misturar bem. Deixe-o intacto na bancada por ~ 30 min até que os glóbulos vermelhos dos poços de controle PBS estejam completamente assentados.
- Leia e registre os resultados.
NOTA: O título de HI é a diluição sérica mais alta que inibe completamente a hemaglutinação do antígeno 4-HAU. O fluxo de hemácias em forma de lágrima pode ser observado na última coluna de cada fileira, inclinando a placa 90° por 25 s. O AH completo (sem streaming) pode ser observado no penúltimo poço a partir do final de cada linha. Os resultados dos testes válidos exigem que o título de HI do controle de soro positivo esteja dentro de uma diluição do título de HI conhecido; o título de HI do controlo sérico negativo deve ser ≤ 2 log2; e a ausência de auto-HA do controle de hemácias. Para obter um diagrama esquemático do fluxo de trabalho do ensaio HA, consulte a Figura 5.
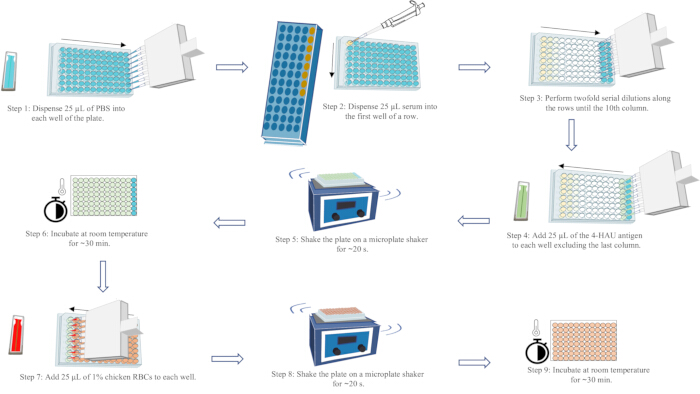
Figura 5: Diagrama esquemático do fluxo de trabalho do ensaio de hemaglutinação. O PBS é representado em azul, o soro em amarelo, a solução de antígeno 4-HAU em verde e a suspensão de hemácias de frango a 1% em vermelho. As setas indicam a ordem de dispensação do líquido. Clique aqui para ver uma versão maior desta figura.
Resultados
Validação do título da solução de antígeno 4-HAU formulada pelo método otimizado
O estudo empregou várias diluições da solução estoque de antígeno para determinar com precisão o título de HA, facilitando o cálculo do fator de diluição para preparar a solução de antígeno 4-HAU. Os resultados revelam que o método otimizado é eficiente e preciso, reduzindo o número de procedimentos repetitivos de retrotitulação e ajuste. No primeiro cenário, um...
Discussão
O método otimizado proposto neste artigo apresenta uma abordagem para preparar com precisão a solução de antígeno 4-HAU. Embora as diretrizes da OIE e da UE sugiram diluições iniciais para titulação de AH, elas não fornecem detalhes precisos sobre as razões de diluição a serem utilizadas ou oferecem metodologias específicas11,12. Além disso, embora a FAO e a OIE recomendem a retrotitulação como meio de aumentar a precisão do 4-HAU, ...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
O CC foi apoiado pelo programa de Tecnologia Taicang (TC2021JC16) e pelos Fundos da Equipe de Inovação do Instituto de Tecnologia Suzhou Chien-shiung (2023JXKYTD01). H.Y. foi apoiado pelo programa Taicang Technology (TC2021JC11). Ambos foram apoiados pelo Fundo Start-up para Novos Ph.D. Pesquisadores do Instituto de Tecnologia Suzhou Chien-Shiung.
Materiais
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
Referências
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados