JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
뉴캐슬 질병 바이러스 혈청학의 혈구 응집 억제 분석을 위한 항원 준비의 최적화
요약
이 기사는 뉴캐슬병 바이러스 혈청학적 검사를 위해 4개의 혈구응집소 항원을 준비하는 간단한 방법을 제시합니다. 보다 엄격한 역적정 방법 및 잘 정의된 조정 프로세스와 결합하여 항원의 혈구응집역가를 정확하게 측정함으로써 테스트 효율성을 높이고 위양성을 줄이며 가금류의 질병 감시를 개선합니다.
초록
뉴캐슬병 바이러스(NDV) 항체 역가의 정확한 평가는 효과적인 가금류 질병 통제 및 감시에 매우 중요합니다. 본 논문에서는 NDV 혈청학적 검출에 사용되는 혈구응집억제분석법(HI)의 핵심 성분인 4-HAU(hemagglutination units) 항원 용액을 준비하기 위한 최적화된 방법을 소개합니다. 시간이 많이 걸리고 정의되지 않은 역적정 및 조정 단계를 포함하는 기존 방법과 달리, 이 접근법은 초기 일련의 희석(1:3, 1:5, 1:7 및 1:9)을 사용하여 HA 역가를 정확하게 측정하여 이 프로세스를 간소화합니다. 또한 역적정 결과를 기반으로 조정하거나 재공식화하기 위한 특정 방법을 제공하여 반복적인 역적정의 필요성을 줄입니다. 또한, 혈청 HI 역가에 대한 4-HAU 항원 용액의 정확도 효과를 평가한 결과, 4-HAU 항원의 역가가 3 미만일 때 위양성 HI 샘플이 나타나는 것을 발견했습니다. 이 접근 방식은 정확한 방법을 제공하고 계산 작업을 최소화함으로써 테스트 효율성과 신뢰성을 높여 가금류 개체군의 질병 감시 및 통제를 개선하는 데 기여합니다.
서문
뉴캐슬병(ND)은 전 세계적으로 널리 퍼져 있는 심각한 가금류 질환입니다 1,2,3. 고열, 호흡곤란, 이질, 신경 장애, 점막 출혈 등 다양한 증상으로 나타난다4. 원인균인 뉴캐슬병 바이러스(NDV)는 거의 한 세기 동안 지속되어 닭, 오리, 거위, 비둘기 등 200여 종의 조류를 괴롭혀 왔다5. 전염은 주로 감염된 조류와의 직간접적인 접촉을 통해 발생하며, 가금류, 비둘기, 방목조류 등이 잠재적인 매개체 역할을 한다6. NDV의 단일 혈청형에도 불구하고 유전적 다양성은 질병 관리 및 통제 노력에 상당한 어려움을 제기합니다 3,7.
백신 접종은 ND를 통제하기 위한 주요 전략으로 작용하며, 엄격한 생물 보안 조치로 보완됩니다 5,8. 전 세계적으로 가금류를 대상으로 다양한 상용 백신을 사용할 수 있으며, 이는 면역 접종 후 강력한 혈청 항체 반응을 유발합니다9. 이러한 항체는 악성 균주에 노출되었을 때 증상의 중증도를 완화하고 집단 간 전염을 억제하는 데 중요한 역할을 합니다10. 일반적으로 6-12주마다 약독화 생백신을 투여하는 표준 재접종 프로토콜은 ND9 발병 지역에서 표준 관행입니다. 상업용 가금류 무리에서 백신 접종 후 항체 역가에 대한 정기적인 모니터링은 백신 효과를 평가하는 데 필수적입니다 11,12,13. 백신 접종 후 항체 역가가 낮으면 백신의 실패를 나타낼 수 있으며, 이는 추가 접종 또는 면역 반응에 영향을 미치는 잠재적 면역억제 요인에 대한 조사와 같은 시정 조치를 적시에 취해야 함을 의미할 수 있다14.
NDV에 대한 혈청 항체를 검출하기 위해 효소 결합 면역 흡착 분석, 혈구 응집 억제 (HI) 및 중화 분석9 , 13 , 15 , 16 등 여러 기술이 사용됩니다. 각 방법은 민감도, 특이성 및 비용 효율성과 관련하여 고유한 장점과 한계를 제시합니다.
이 논문은 NDV11에 대한 혈청 특이적 항체 역가를 정량화하기 위해 HI를 수행하기 위한 세계동물보건기구(OIE)의 프로토콜을 기반으로 하는 단계별 프로토콜을 설명합니다. NDV와 같은 특정 외피 바이러스에 의해 유발되는 현상인 혈응집(HA)은 적혈구(RBC)의 응집과 관련이 있습니다9. NDV 표면의 헤마글루티닌-뉴라미니다아제(hemagglutinin-neuraminidase, HN) 단백질은 적혈구와 상호 작용하여 세포 응집 및 격자 형성을 일으킵니다2. HI 분석은 NDV 8,9의 HN 단백질에 대한 혈청 항체 특이성을 평가할 수 있는 능력으로 인해 혈청학적 방법으로 선호됩니다. 또한 비용 효율성과 특수 기기로부터의 독립성으로 인해 일상적인 사용에 쉽게 접근할 수 있고 실용적입니다.
분석 효율성을 개선하기 위해 보다 정확한 항원 HA 역가를 확보하고 4-HAU(4 hemagglutination units) 항원 용액에 대한 세부 조정을 제공하는 데 중점을 두고 OIE 프로토콜11의 워크플로우를 개선했습니다. 또한 비교 분석을 통해 4-HAU 정확도가 HI 결과에 미치는 영향을 평가하여 현장 실무자에게 귀중한 통찰력을 제공했습니다. 이 접근법은 NDV 항체 검사에만 국한되지 않고 바이러스 아형 및 홍역, 폴리오마바이러스, 볼거리 및 풍진을 포함한 기타 혈응집 바이러스의 검출로 확장됩니다.
프로토콜
프로토콜에 대한 승인은 지역 기관 동물 관리 및 사용 위원회에서 부여되었습니다. 살아있는 바이러스 항원 및 임상 혈청 샘플과 관련된 모든 절차는 확립된 안전 프로토콜에 따라 생물안전 레벨 2 실험실에서 수행되었습니다.
1. 1% 닭 RBC 현탁액의 준비
- Alserver의 용액(항응고제) 3mL를 멸균된 15mL 원추형 원심분리 튜브에 추가합니다.
- 면역이 없는 닭 3마리(NDV 항체가 없음) 각각의 날개 정맥에서 혈액 1mL를 수집합니다. 즉시 항응고제가 들어 있는 튜브에 혈액을 옮기고 부드럽게 섞습니다.
- 튜브에 멸균 1x 인산염 완충 식염수(PBS, pH 7.2-7.4)를 총 부피 12mL까지 채우고 부드럽게 혼합합니다. 수평 로터를 사용하여 500 × g 에서 10분 동안 원심분리기를 합니다.
- 상층액과 백혈구층을 조심스럽게 제거합니다. 1.3 및 1.4 2x 단계를 반복하여 RBC 펠릿을 얻습니다.
- 1mL의 RBC 펠릿을 99mL의 멸균 PBS로 역피펫팅하여 1% RBC 현탁액을 준비합니다.
참고: 1% 닭 RBC 현탁액의 필요한 부피는 3mL/플레이트(25μL/웰 x 96웰 x 1.25 = 3.0mL, 여기서 1.25는 충분한 부피를 보장하기 위한 피펫팅 낭비를 고려함)로 추정됩니다.
2. 동결건조된 항원 또는 혈청의 재구성
- 동결건조된 항원 또는 혈청이 들어 있는 앰플에 멸균 PBS 2mL를 추가합니다. 앰플을 부드럽게 흔들고 거품을 최소화하고 완전히 용해되도록 2-3분 동안 그대로 두십시오.
참고: 이 연구에서는 다양한 유형의 동결 건조 물질이 비교되지 않았으므로 특정 제조업체의 지침을 따르십시오. - 재구성된 용액을 1.5mL 원심분리 튜브에 분취하고 사용할 때까지 -20°C에서 동결합니다.
참고: 항원을 해동하여 사용할 때마다 또는 새로운 RBC 현탁액을 준비할 때마다 HA 역가를 다시 측정합니다.
3. 항원의 HA 적정
- 일회용 96웰 V-바닥 마이크로타이터 플레이트의 인접한 웰 4개에 각각 40, 80, 120, 160μL의 PBS를 분주한 다음 각 웰에 20μL의 항원을 첨가하고 10배 위아래로 피펫팅하여 혼합하여 각각 1:3, 1:5, 1:7 및 1:9의 희석을 달성합니다. 희석 작업의 개략도는 그림 1에 나와 있습니다.
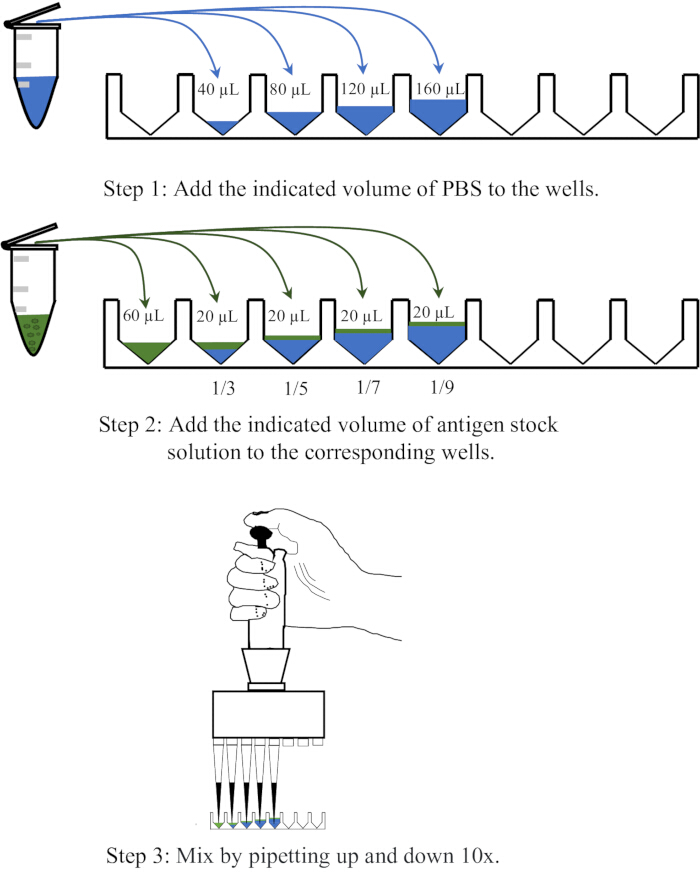
그림 1: 적혈구 응집 분석에서 항원 용액을 희석하는 절차를 보여주는 개략도. 항원 용액은 PBS에서 각각 1:3, 1:5, 1:7 및 1:9의 비율로 희석됩니다. 웰 또는 원심분리기 튜브의 PBS는 파란색으로 표시되고 항원은 녹색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 새 마이크로타이터 플레이트에 라벨을 붙입니다. 25μL의 PBS를 1-5열의 각 웰에 추가합니다.
- 다채널 피펫을 사용하여 25μL의 희석된 항원 용액을 1-5열의 첫 번째 웰에 넣고 최소 5회 위아래로 피펫팅하여 혼합합니다.
- 각 행의 첫 번째 웰에서 두 번째 웰로 25μL를 완전히 혼합하여 이동합니다. 한 웰에서 다음 웰로, 11번째 열로 계속 이동시켜 2배 연속 희석액(1:2 - 1:2048)을 생성합니다. 11번째 열 뒤에 25μL를 버립니다.
- 항원 농도가 가장 낮은 웰부터 시작하여 각 웰에 25μL의 PBS를 추가합니다.
- 항원 농도가 가장 낮은 웰부터 시작하여 각 웰에 25μL의 1% 닭 RBC 현탁액을 추가합니다.
- 마이크로플레이트 셰이커에서 플레이트를 ~20초 동안 흔들어 완전히 섞습니다.
- 12번째 기둥의 적혈구가 완전히 가라앉을 때까지 20-25°C의 실온(20-25°C)에서 ~30분 동안 벤치탑에 그대로 두십시오. 플레이트 레이아웃은 그림 2를 참조하십시오.
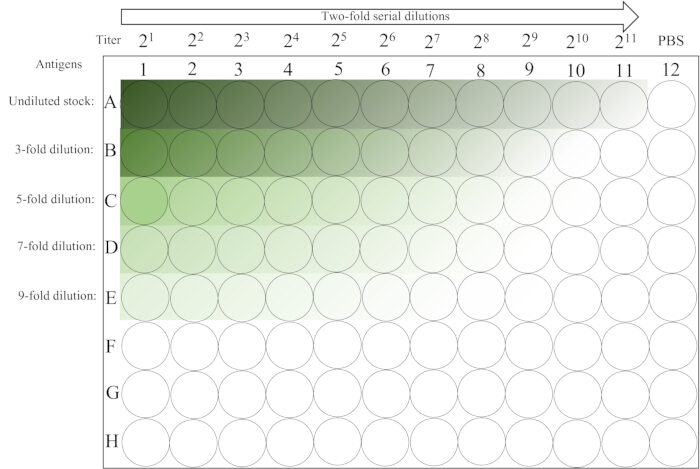
그림 2: 혈응집 분석에 사용된 마이크로플레이트의 개략적 레이아웃. 1-5행의 첫 번째 열에는 항원 용액의 희석되지 않은 다양한 초기 희석액이 포함된 후 11열까지 왼쪽에서 오른쪽으로 2배 연속 희석이 포함됩니다. PBS 컨트롤은 마지막 열에 배치됩니다. 어두운 곳에서 밝은 곳으로 구배가 있으면 항원 농도가 감소함을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 결과를 읽고 기록합니다. HA는 플레이트를 ~25초 동안 90° 기울이고 적혈구의 눈물 모양 흐름의 유무를 관찰하여 결정됩니다. 완전한 혈구응집(스트리밍 없음)을 나타내는 가장 높은 희석은 1HA 단위를 나타냅니다. 12번째 열의 웰은 RBC(음수) 대조군 역할을 합니다.
- 표 1을 사용하여 각 행의 HA 역가를 계산하며, 그 최대값은 4-HAU 항원 용액의 준비에 사용됩니다. 예를 들어, a, b, c, d 및 e가 각각 9, 8, 7, 6, 6과 같으면 3 x 28 = 768이 최대값이고 는 항원 스톡의 HA 역가입니다.
| 항 | 완전한 HA의 최고 희석 컬럼 | 희석되지 않은 원유의 HA 역가 |
| 원액 | a | 2암페어 |
| 3배 희석 | b | 3 x 2b |
| 5배 희석 | c | 5 엑스 2C |
| 7배 희석 | d | 7 엑스 2d |
| 9배 희석 | e | 9 엑스 2전자 |
표 1: HA 분석 결과 및 원액의 HA 역가 계산.
4. 4-HAU 항원 용액의 제조
- 4-HAU 항원 용액 준비를 위한 희석 계수를 계산합니다.
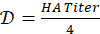 필요한 총 4-HAU 부피 결정: V = 3mL x 마이크로플레이트 수. 그런 다음 항원 원액의 필요한 부피를 계산합니다 :
필요한 총 4-HAU 부피 결정: V = 3mL x 마이크로플레이트 수. 그런 다음 항원 원액의 필요한 부피를 계산합니다 : 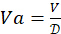 , 및 PBS : Vp = V-Va.
, 및 PBS : Vp = V-Va.
참고: 부피는 밀리리터 단위로 측정됩니다. 4-HAU의 마이크로타이터 플레이트당 3mL를 추정합니다(25μL/웰 x 96웰 x 1.25 = 3mL). - 계산된 부피의 PBS를 용기에 피펫팅한 다음 해당 부피의 항원 원액을 넣고 잘 섞어 4-HAU 항원 용액을 얻습니다.
알림: 4-HAU 항원 용액은 가능한 한 빨리 사용해야 합니다.
5. 4-HAU 항원 용액의 역적정
- 25, 50, 75, 100, 125 및 150 μL의 PBS를 마이크로타이터 플레이트의 인접한 6개의 웰에 분주한 다음 각 웰에 25μL의 4-HAU 항원 용액을 추가하고 10배 위아래로 피펫팅하여 혼합합니다.
참고: 4-HAU 항원 용액을 1:2, 1:3, 1:4, 1:5, 1:6 및 1:7의 희석으로 PBS로 희석합니다. 희석 작업의 개략도는 그림 3에 나와 있습니다.
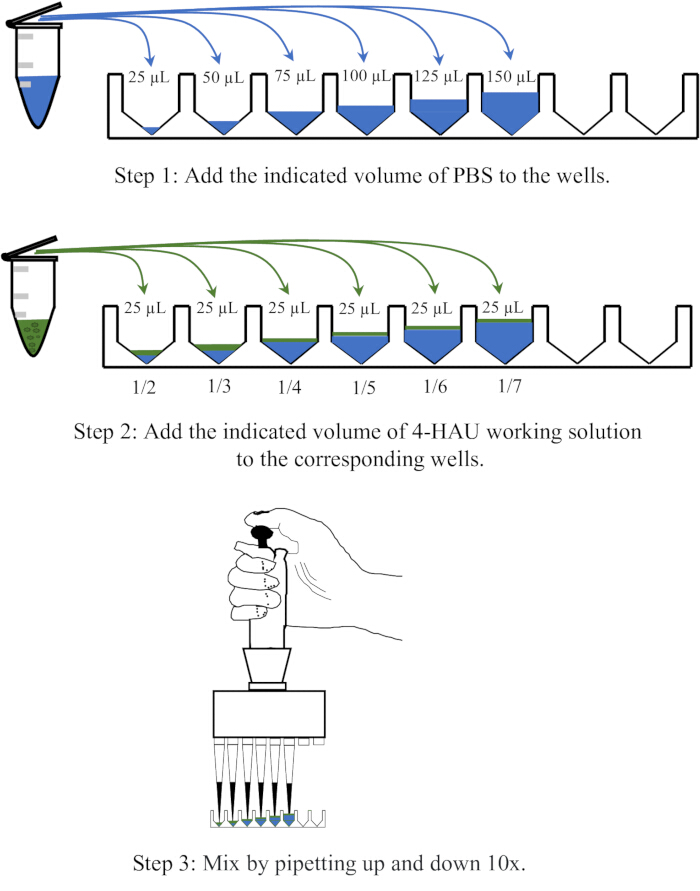
그림 3: 역적정에서 4개의 적혈구 단위 용액의 희석 절차의 개략도. 4-HAU 작업 용액은 1:2, 1:3, 1:4, 1:5, 1:6 및 1:7의 비율로 PBS로 희석됩니다. PBS는 파란색으로, 항원은 녹색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 멀티채널 피펫을 사용하여 25μL의 각 희석된 항원 용액을 다른 열의 well로 옮깁니다. 25μL의 PBS를 음성 대조군으로 추가 웰에 추가합니다.
- 각 웰에 PBS 25μL를 추가한 다음 각 웰에 25μL의 1% 닭 RBC를 추가합니다.
- 마이크로플레이트 셰이커에서 플레이트를 ~20초 동안 흔들어 섞습니다.
- 네거티브 대조군의 적혈구가 완전히 가라앉을 때까지 실온(20-25 °C)에서 ~30분 동안 벤치탑에 그대로 두십시오.
- 결과를 읽고 기록합니다.
알림: 네거티브 컨트롤 웰에는 HA가 표시되지 않아야 합니다. 이상적으로는 1:4 희석이 완전 HA에서 가장 높은 희석입니다. 4-HAU 용액의 역가가 4 이상인 경우 최대 희석은 1:5, 1:6 또는 1:7일 수 있습니다. 더 작으면 1:2 또는 1:3일 수 있습니다. 역적정과 대표적인 결과의 개략도는 그림 4에 나와 있습니다.
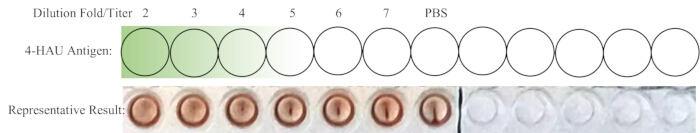
그림 4: 역적정을 위한 well의 개략적 레이아웃과 대표 결과. 희석된 4-HAU 작업 솔루션은 PBS 제어 기능이 추가된 새 행으로 이전됩니다. 짙은 녹색에서 연한 녹색으로의 구배는 항원 농도가 높은 것에서 낮은 것까지 나타냅니다. 대표적인 결과는 1:4 희석이 완전한 혈구응집화를 보여주는 가장 높은 희석임을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 필요한 경우 4-HAU 항원 용액을 조정하거나 다시 공식화합니다.
참고: 역적정에 사용된 4-HAU 항원 용액의 부피가 총 부피의 ≤1%(4-HAU 항원 용액의 부피 ≥ 15mL)인 경우 구체적인 조정은 표 2를 참조하십시오. 예를 들어, 완전 HA에서 가장 높은 희석률이 1:2인 경우 4-HAU 항원 용액의 역가는 이제 2가 되며, 이전에 4-HAU 항원 용액을 준비할 때와 동일한 부피의 항원을 추가해야 합니다. 반대로, 완전 HA의 최대 희석이 1:6인 경우 역가는 이제 6이고 PBS 부피의 절반이 보충되어야 합니다.
역적정에 사용된 부피가 전체의 1%(4-HAU 항원 용액의 부피 < 15mL)를 초과하는 경우, 보정된 희석 계수를 사용하여 4-HAU 항원 용액을 다시 제형화합니다. 구체적인 수정 사항은 표 3 을 참조하십시오. 예를 들어, 완전 HA의 최대 희석률이 1:2인 경우 4-HAU 항원 용액의 역가는 이제 2이고 희석 계수는 원래의 1/2로 조정해야 합니다. 반대로, 완전 HA의 최대 희석률이 1:6인 경우 4-HAU 항원 용액의 역가는 이제 6이 되고 희석 계수는 원래의 3/2로 조정됩니다.
| 역적정의 HA 역가 | 항원 또는 PBS 보충 |
| 1:2 | 버지니아 |
| 1:3 | VA/3 |
| 1:5 | 부통령/4 |
| 1:6 | 부사장/2 |
| 1:7 | 3VP/4 |
표 2: 역적정 결과를 기반으로 4-HAU 농도를 조정하기 위한 참조 표. Va와 Vp는 각각 4-HAU 항원 용액의 제형에 사용되는 항원 및 PBS의 부피를 나타냅니다.
| 역적정의 HA 역가 | 희석 계수 보정 |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5차원/4 |
| 1:6 | 3D/2 |
| 1:7 | 7D/4 |
표 3: 4-HAU 항원의 재준비를 위한 희석 계수 보정의 참조 표. D는 이전에 4-HAU 항원 준비에 사용된 희석 계수를 나타냅니다.
6. 세럼의 준비
- 항응고제를 사용하지 않고 닭 날개에서 ~1mL의 혈액을 모으십시오.
- 혈액을 1.5mL 원심분리 튜브로 옮기고 37°C에서 ~2시간 동안 배양합니다. 3,000 x g에서 10분 동안 원심분리기를 진행하고 상층액을 새 튜브에 조심스럽게 흡입합니다.
7. 안녕 분석실험
- 분석 레이아웃에 따라 마이크로타이터 플레이트에 라벨을 부착합니다. 멀티채널 피펫을 사용하여 25μL의 PBS를 1-11열의 각 웰에 추가하고 50μL를 12열의 웰에 추가합니다.
- 양성 및 음성 혈청 대조군 열을 포함하여 각 열의 첫 번째 well에 25μL의 혈청을 추가합니다. 최소 5회 이상 위아래로 피펫팅하여 철저히 혼합합니다.
- 각 행의 첫 번째 웰에서 두 번째 웰로 25μL를 옮기고 철저히 혼합합니다. 두 번째 웰에서 세 번째 웰로 10번째 열까지 계속 옮기고 믹싱합니다. 혼합 후 10번째 컬럼의 웰에서 25μL의 액체를 버립니다.
- 25μL의 4-HAU 항원을 컬럼 1-11의 각 웰에 혈청 농도가 낮거나 높은 방향으로 첨가합니다.
- 마이크로플레이트 셰이커에서 플레이트를 ~20초 동안 흔듭니다. ~30분 동안 벤치탑에 방해받지 않고 그대로 두십시오.
- 25μL의 1% 닭 적혈구를 혈청 농도가 낮거나 높은 방향으로 각 웰에 추가합니다.
- 마이크로플레이트 셰이커에서 플레이트를 ~20초 동안 흔들어 완전히 섞습니다. PBS 제어 우물의 적혈구가 완전히 가라앉을 때까지 ~30분 동안 벤치탑에 그대로 두십시오.
- 결과를 읽고 기록합니다.
참고: HI 역가는 4-HAU 항원의 혈응집화를 완전히 억제하는 가장 높은 혈청 희석액입니다. 적혈구의 눈물 모양 흐름은 플레이트를 25초 동안 90° 기울이면 각 열의 마지막 열에서 관찰할 수 있습니다. 전체 HA(스트리밍 없음)는 각 행의 끝에서 두 번째 마지막 웰에서 관찰할 수 있습니다. 유효한 검사 결과는 양성 혈청 대조군의 HI 역가가 알려진 HI 역가의 1회 희석 이내여야 합니다. 음성 혈청 대조군의 HI 역가는 ≤ 2 log2이고; 및 RBC 제어의 자체 HA가 없습니다. HA 분석 워크플로우의 개략도는 그림 5를 참조하십시오.
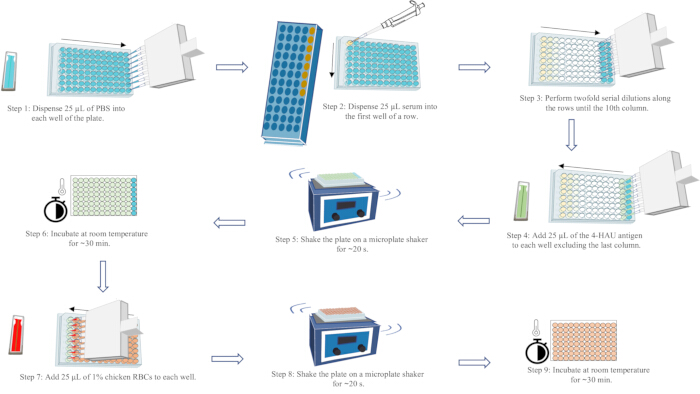
그림 5: hemagglutination assay workflow의 개략도. PBS는 파란색, 혈청은 노란색, 4-HAU 항원 용액은 녹색, 1% 닭 RBC 현탁액은 빨간색으로 표시됩니다. 화살표는 액체 분배의 순서를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
최적화된 방법을 사용하여 제조된 4-HAU 항원 용액의 역가 검증
이 연구는 HA 역가를 정확하게 측정하기 위해 항원 원액의 다양한 희석액을 사용하여 4-HAU 항원 용액을 준비하기 위한 희석 계수 계산을 용이하게 했습니다. 그 결과, 최적화된 분석법이 효율적이고 정밀하여 반복적인 역적정 및 조정 절차의 횟수를 줄일 수 있는 것으로 나타났습니다. 첫 번째 ?...
토론
이 기사에서 제안하는 최적화된 방법은 4-HAU 항원 용액을 정확하게 준비하기 위한 접근 방식을 제시합니다. OIE와 EU 가이드라인은 HA 적정을 위한 초기 희석을 제안하지만, 사용되는 희석 비율에 대한 정확한 세부 정보를 제공하거나 특정 방법론을 제공하지 않습니다11,12. 또한, FAO와 OIE는 4-HAU의 정확도를 높이기 위한 수단으로 역적정을 권장하...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
C.C.는 Taicang Technology 프로그램(TC2021JC16)과 Suzhou Chien-shiung Institute of Technology의 Innovation Team Funds(2023JXKYTD01)의 지원을 받았습니다. H.Y.는 Taicang Technology 프로그램(TC2021JC11)의 지원을 받았습니다. 두 논문 모두 쑤저우 치엔슝 공과대학(Suzhou Chien-Shiung Institute of Technology)의 신임 박사 연구원을 위한 스타트업 펀드(Start-up Fund for New Ph.D. Research)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
참고문헌
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유