Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hemaglutinasyon İnhibisyonu için Antijen Preparatının Optimizasyonu: Newcastle Hastalığı Virüsü Serolojisinin Testi
Bu Makalede
Özet
Bu makale, Newcastle hastalığı virüsü serolojik testi için 4 hemaglutinasyon ünitesi antijen hazırlamak için basitleştirilmiş bir yöntem sunmaktadır. Antijenin hemaglutinasyon titresini doğru bir şekilde belirleyerek, daha titiz bir geri titrasyon yöntemi ve iyi tanımlanmış bir ayarlama süreci ile birleştiğinde, test verimliliğini artırır, yanlış pozitifleri azaltır ve kümes hayvanlarında hastalık sürveyansını iyileştirir.
Özet
Newcastle hastalığı virüsü (NDV) antikor titrelerinin doğru değerlendirilmesi, etkili kanatlı hastalığı kontrolü ve sürveyansı için çok önemlidir. Bu makale, NDV serolojik tespitinde kullanılan hemaglutinasyon inhibisyon testinin (HI) önemli bir bileşeni olan 4 hemaglutinasyon ünitesi (4-HAU) antijen çözeltisinin hazırlanması için optimize edilmiş bir yöntem sunmaktadır. Zaman alıcı ve tanımlanmamış geri titrasyon ve ayarlama adımlarını içeren geleneksel yöntemlerin aksine, bu yaklaşım, bir başlangıç seyreltme serisi (1:3, 1:5, 1:7 ve 1:9) kullanarak HA titresini doğru bir şekilde ölçerek bu işlemi kolaylaştırır. Ayrıca, geri titrasyon sonuçlarına dayalı olarak ayarlama veya yeniden formüle etme için özel bir metot sunarak tekrarlanan geri titrasyonlara olan ihtiyacı azaltıyoruz. Ek olarak, 4-HAU antijen çözeltisinin doğruluğunun serum HI titresi üzerindeki etkisini değerlendirdik ve 4-HAU antijeninin titresi 3'ten düşük olduğunda, yanlış pozitif HI örneklerinin ortaya çıkmasına neden olduğunu bulduk. Bu yaklaşım, doğru bir yöntem sağlayarak ve hesaplama görevlerini en aza indirerek, test verimliliğini ve güvenilirliğini artırarak kanatlı popülasyonlarında hastalık sürveyansı ve kontrolünün iyileştirilmesine katkıda bulunur.
Giriş
Newcastle Hastalığı (ND), dünya çapında tanınan yaygın ve şiddetli bir kanatlı hastalığıdır 1,2,3. Yüksek ateş, solunum sıkıntısı, dizanteri, sinirsel bozukluklar ve mukozal kanama gibi çeşitli semptomlarla kendini gösterir4. Etken ajan olan Newcastle Hastalığı Virüsü (NDV), tavuklar, ördekler, kazlar ve güvercinler de dahil olmak üzere 200'den fazla kuş türünü etkileyerek neredeyse bir yüzyıl boyunca devam etmiştir5. Bulaşma öncelikle enfekte kuşlarla, kümes hayvanlarıyla, güvercinlerle ve potansiyel rezervuar görevi gören serbest dolaşan kuşlarla doğrudan veya dolaylı temas yoluyla gerçekleşir6. NDV'nin tek serotipine rağmen, genetik çeşitliliği hastalık yönetimi ve kontrol çabaları için önemli zorluklar doğurmaktadır 3,7.
Aşılama, ND'yi kontrol etmek için birincil strateji olarak hizmet eder ve sıkı biyogüvenlik önlemleri ile tamamlanır 5,8. Kümes hayvanları için küresel olarak çeşitli ticari aşılar mevcuttur ve bağışıklamayı takiben güçlü serum antikor tepkilerine neden olur9. Bu antikorlar, virülan suşlara maruz kaldığında semptom şiddetini azaltmada ve sürüler arası bulaşmayı engellemede kritik bir rol oynar10. Tipik olarak her 6-12 haftada bir uygulanan canlı zayıflatılmış aşıları içeren standart yeniden aşılama protokolleri, ND9'a endemik bölgelerde standart uygulamadır. Ticari kanatlı sürülerinde aşılama sonrası antikor titrelerinin rutin olarak izlenmesi, aşı etkinliğinin değerlendirilmesi için esastır 11,12,13. Aşılama sonrası düşük antikor titreleri, aşı başarısızlığını gösterebilir ve ek aşılama veya bağışıklık tepkisini etkileyen potansiyel immünosupresif faktörlerin araştırılması gibi zamanında düzeltici önlemlere yol açabilir14.
NDV'ye karşı serum antikorlarını tespit etmek için enzime bağlı immünosorbent testi, hemaglutinasyon inhibisyonu (HI) ve nötralizasyon testi 9,13,15,16 dahil olmak üzere çoklu teknikler kullanılır. Her yöntem, duyarlılık, özgüllük ve maliyet etkinliği ile ilgili benzersiz avantajlar ve sınırlamalar sunar.
Bu makale, Dünya Hayvan Sağlığı Örgütü'nün (OIE) NDV11'e karşı seruma özgü antikor titrelerini ölçmek için HI yürütme protokolüne dayanan adım adım bir protokolü açıklamaktadır. NDV gibi belirli zarflı virüslerin neden olduğu bir fenomen olan hemaglutinasyon (HA), kırmızı kan hücrelerinin (RBC'ler) kümelenmesini içerir9. NDV yüzeyindeki hemaglutinin-nöraminidaz (HN) proteini, RBC'lerle etkileşime girerek hücre kümelenmesi ve kafes oluşumuile sonuçlanır 2. HI testi, NDV8,9'un HN proteinine karşı serum antikor özgüllüğünü değerlendirme yeteneği nedeniyle serolojik bir yöntem olarak tercih edilir. Ayrıca, maliyet etkinliği ve özel enstrümantasyondan bağımsız olması, onu rutin kullanım için erişilebilir ve pratik hale getirir.
Test verimliliğini artırmak için, daha doğru antijen HA titreleri elde etmeye ve 4 hemaglutinasyon ünitesi (4-HAU) antijen çözeltisi için ayrıntılı ayarlamalar sunmaya odaklanarak OIE protokolü11'in iş akışını iyileştirdik. Ek olarak, karşılaştırmalı analiz yoluyla, 4-HAU doğruluğunun HI sonuçları üzerindeki etkisini değerlendirerek saha uygulayıcıları için değerli bilgiler sağladık. Bu yaklaşım NDV antikor testi ile sınırlı değildir, aynı zamanda viral alt tiplerin ve kızamık, polyomavirüs, kabakulak ve kızamıkçık dahil olmak üzere diğer hemaglutinasyon virüslerinin saptanmasına kadar uzanır.
Protokol
Protokol için onay, yerel kurumsal hayvan bakım ve kullanım komitesi tarafından verildi. Canlı virüs antijenleri ve klinik serum örneklerini içeren tüm prosedürler, belirlenmiş güvenlik protokollerine uygun olarak bir Biyogüvenlik Seviye 2 laboratuvarında gerçekleştirildi.
1.% 1 tavuk RBC süspansiyonunun hazırlanması
- Steril 15 mL'lik konik santrifüj tüpüne 3 mL Alserver solüsyonu (antikoagülan) ekleyin.
- Bağışık olmayan üç tavuğun her birinin kanat damarından 1 mL kan toplayın (NDV antikorları olmadan). Kanı hemen antikoagülan içeren tüpe aktarın ve yavaşça karıştırın.
- Tüpü steril 1x fosfat tamponlu tuzlu su çözeltisi (PBS, pH 7.2-7.4) ile toplam 12 mL hacme kadar doldurun ve hafifçe karıştırın. Yatay bir rotor kullanarak 500 × g'da 10 dakika santrifüjleyin.
- Süpernatanı ve beyaz kan hücresi tabakasını dikkatlice çıkarın. RBC peletini elde etmek için 1.3 ve 1.4 2x adımlarını tekrarlayın.
- %1'lik bir RBC süspansiyonu hazırlamak için 1 mL RBC peletini 99 mL steril PBS'ye ters pipetleyin.
NOT: %1'lik tavuk RBC süspansiyonunun gerekli hacmi 3 mL/plaka olarak tahmin edilmektedir (25 μL/kuyu x 96 kuyucuk x 1,25 = 3,0 mL; burada 1,25, yeterli hacmi sağlamak için pipetleme israfını hesaba katar).
2. Liyofilize antijen veya serumun sulandırılması
- Liyofilize antijen veya serum içeren ampule 2 mL steril PBS ekleyin. Ampulü hafifçe sallayın ve kabarcıkları en aza indirmek ve tamamen çözünmesini sağlamak için 2-3 dakika bekletin.
NOT: Bu çalışmada farklı liyofilize malzeme türleri karşılaştırılmadığından, ilgili üreticinin talimatlarına uyun. - Sulandırılmış çözeltiyi 1.5 mL santrifüj tüplerine alın ve kullanılana kadar -20 ° C'de dondurun.
NOT: Antijen her çözüldüğünde ve kullanıldığında veya yeni bir RBC süspansiyonu hazırlandığında HA titresini yeniden belirleyin.
3. Antijenlerin HA titrasyonu
- Sırasıyla 40, 80, 120 ve 160 μL PBS'yi, tek kullanımlık 96 oyuklu V-tabanlı mikrotitre plakasının dört bitişik kuyucuğuna dağıtın, ardından her bir oyuğa 20 μL antijen ekleyin ve sırasıyla 1:3, 1:5, 1:7 ve 1:9 seyreltmeler elde etmek için 10 kat yukarı ve aşağı pipetleyerek karıştırın. Seyreltme işleminin şematik bir diyagramı Şekil 1'de gösterilmiştir.
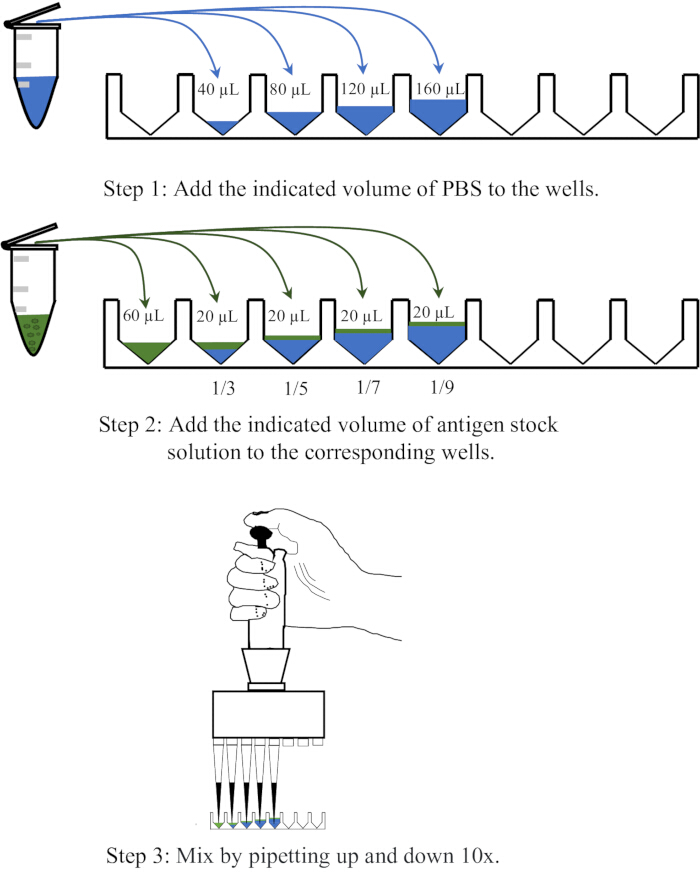
Şekil 1: Hemaglutinasyon testinde antijen çözeltisinin seyreltilmesi prosedürünü gösteren şematik diyagram. Antijen çözeltisi PBS içinde sırasıyla 1:3, 1:5, 1:7 ve 1:9 oranlarında seyreltilir. Kuyucuklardaki veya santrifüj tüplerindeki PBS mavi renkle gösterilirken, antijenler yeşil renkle gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Yeni bir mikrotitre plakasını etiketleyin. 1-5. sıralardaki her bir oyuğa 25 μL PBS ekleyin.
- 25 μL seyreltilmiş antijen solüsyonlarını çok kanallı bir pipet kullanarak 1-5. sıraların ilk kuyucuklarına yerleştirin ve en az 5 kez yukarı ve aşağı pipetleyerek karıştırın.
- Her sıranın birinci kuyucuğundan ikinci kuyucuğa 25 μL aktarın ve iyice karıştırın. İki katlı seri seyreltmeler (1:2 ila 1:2048) oluşturmak için bir kuyudan diğerine, 11. sütuna aktarmaya devam edin. 11. sütundan sonra 25 μL atın.
- En düşük antijen konsantrasyonunu içeren kuyucuklardan başlayarak her oyuğa 25 μL PBS ekleyin.
- Her bir oyuka 25 μL% 1 tavuk RBC süspansiyonu ekleyin, yine en düşük antijen konsantrasyonunu içeren kuyucuklardan başlayın.
- İyice karıştırmak için plakayı bir mikroplaka çalkalayıcı üzerinde ~ 20 s çalkalayın.
- 20. sütunun RBC'si tamamen yerleşene kadar ~ 30 dakika oda sıcaklığında (12-12 ° C) tezgah üzerinde rahatsız edilmeden bırakın. Plaka düzeni için Şekil 2'ye bakın.
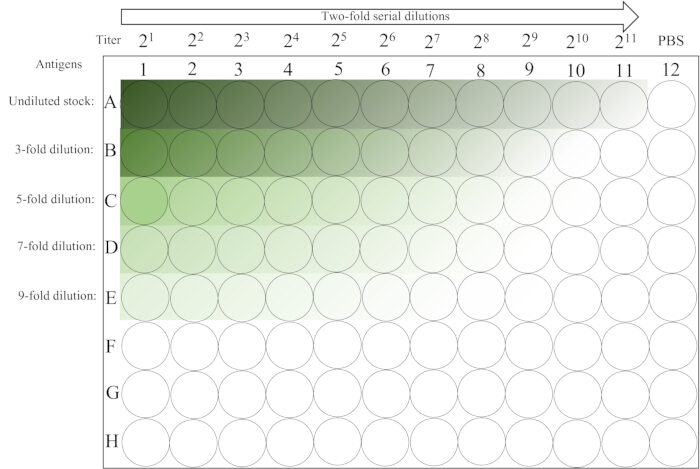
Şekil 2: Hemaglutinasyon testinde kullanılan bir mikroplakanın şematik yerleşimi. 1-5. sıraların ilk sütunu, antijen çözeltisinin seyreltilmemiş ve çeşitli başlangıç seyreltmelerini içerir, ardından sütun 11'e kadar soldan sağa iki katlı bir seri seyreltme yapılır. PBS kontrolü son sütuna yerleştirilir. Karanlıktan aydınlığa geçiş, antijen konsantrasyonunun azaldığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Sonuçları okuyun ve kaydedin. HA, plakanın ~25 s boyunca 90° eğilmesi ve RBC'lerin yırtılma şeklinde akışının varlığının veya yokluğunun gözlemlenmesiyle belirlenir. Tam hemaglutinasyon (akış yok) gösteren en yüksek seyreltme, 1 HA Birimini temsil eder. 12. sütundaki kuyular RBC (negatif) kontroller olarak işlev görür.
- Tablo 1'i kullanarak her sıranın HA titresini hesaplayın, maksimum 4-HAU antijen çözeltisinin hazırlanması için kullanılır. Örneğin, a, b, c, d ve e sırasıyla 9, 8, 7, 6, 6'ya eşitse, 3 x 28 = 768 maksimum değerdir ve antijen stoğunun HA titresidir.
| Antijen | Tam HA'nın en yüksek seyreltme sütunu | Seyreltilmemiş stoğun HA titresi |
| Seyreltilmemiş stok | a | 2bir |
| 3 kat seyreltme | b | 3 x 2b |
| 5 kat seyreltme | c | 5 x 2c |
| 7 kat seyreltme | d | 7 x 2gün |
| 9 kat seyreltme | e | 9 x 2e |
Tablo 1: HA tahlil sonuçları ve stok çözeltisinin HA titresinin hesaplanması.
4. 4-HAU antijen çözeltisinin hazırlanması
- 4-HAU antijen çözeltisinin hazırlanması için seyreltme faktörünü hesaplayın:
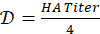 . Gereken toplam 4-HAU hacmini belirleyin: V = 3mL x Mikroplaka sayısı. Ardından, gerekli antijen stok çözeltisi hacimlerini hesaplayın:
. Gereken toplam 4-HAU hacmini belirleyin: V = 3mL x Mikroplaka sayısı. Ardından, gerekli antijen stok çözeltisi hacimlerini hesaplayın: 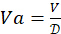 ve PBS: Vp = V - Va.
ve PBS: Vp = V - Va.
NOT: Hacimler mililitre cinsinden ölçülür. 4-HAU'nun mikrotitre plakası başına 3 mL tahmin edin (25 μL/kuyu x 96 kuyucuk x 1.25 = 3 mL). - Hesaplanan PBS hacmini bir kaba pipetleyin, ardından karşılık gelen hacimde antijen stok solüsyonunu ekleyin ve 4-HAU antijen solüsyonunu elde etmek için iyice karıştırın.
NOT: 4-HAU antijen çözeltisi mümkün olan en kısa sürede kullanılmalıdır.
5. 4-HAU antijen çözeltisinin geri titrasyonu
- 25, 50, 75, 100, 125 ve 150 μL PBS'yi bir mikrotitre plakasının altı bitişik kuyucuğuna dağıtın, ardından her bir oyuğa 25 μL 4-HAU antijen çözeltisi ekleyin ve 10 kat yukarı ve aşağı pipetleyerek karıştırın.
NOT: 4-HAU antijen çözeltisini 1: 2, 1: 3, 1: 4, 1: 5, 1: 6 ve 1: 7 dilüsyonlarında PBS ile seyreltin. Seyreltme işleminin şematik bir diyagramı Şekil 3'te gösterilmiştir.
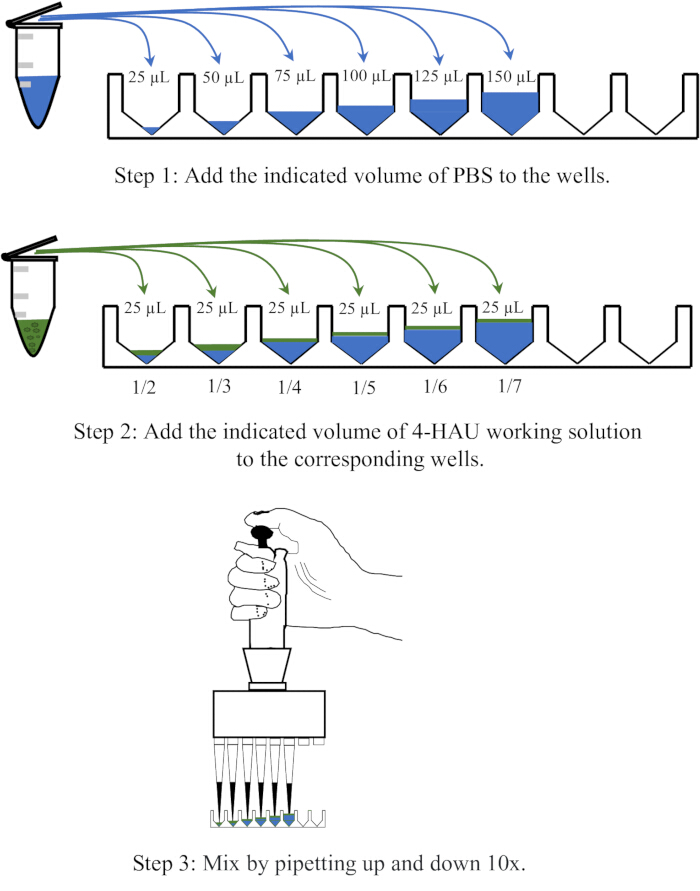
Şekil 3: Geri titrasyonda 4 hemaglutinasyon ünitesinin çözeltisinin seyreltme prosedürünün şematik diyagramı. 4-HAU çalışma çözeltisi, 1:2, 1:3, 1:4, 1:5, 1:6 ve 1:7 oranlarında PBS ile seyreltilir. PBS mavi renkle ve antijenler yeşil renkle gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Her seyreltilmiş antijen çözeltisinin 25 μL'sini çok kanallı bir pipet kullanarak başka bir sıranın kuyucuklarına aktarın. Negatif kontrol olarak ekstra bir kuyuya 25 μL PBS ekleyin.
- Her oyuğa 25 μL PBS ekleyin, ardından her oyuğa 25 μL% 1 tavuk RBC ekleyin.
- Karıştırmak için plakayı bir mikroplaka çalkalayıcı üzerinde ~ 20 s çalkalayın.
- Negatif kontrolün RBC'leri tamamen yerleşene kadar ~ 30 dakika boyunca oda sıcaklığında (20-25 ° C) tezgah üzerinde rahatsız edilmeden bırakın.
- Sonuçları okuyun ve kaydedin.
NOT: Negatif kontrol kuyusu HA göstermemelidir. İdeal olarak, 1:4 seyreltme, tam HA ile tam olarak en yüksek seyreltmedir. 4-HAU çözeltisinin titresi 4'ten fazlaysa, en yüksek seyreltme 1:5, 1:6 veya 1:7 olabilir; Daha az ise, 1:2 veya 1:3 olabilir. Geri titrasyonun şematik bir düzeni ve temsili sonuçlar Şekil 4'te gösterilmiştir.
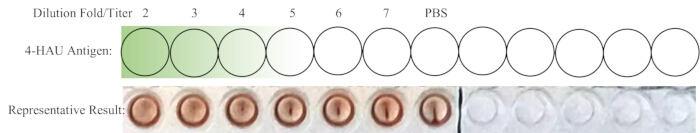
Şekil 4: Geri titrasyon ve temsili sonuç için kuyucukların şematik yerleşimi. Seyreltilmiş 4-HAU çalışma çözümü, ek bir PBS kontrolü eklenerek yeni bir sıraya aktarılır. Koyudan açık yeşile geçiş, yüksekten düşüğe antijen konsantrasyonunu gösterir. Temsili sonuçlar, 1: 4 seyreltmenin tam hemaglutinasyon gösteren en yüksek seyreltme olduğunu göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Gerekirse 4-HAU antijen çözeltisini ayarlayın veya yeniden formüle edin.
NOT: Geri titrasyonda kullanılan 4-HAU antijen çözeltisinin hacmi toplam hacmin %≤1'i ise (4-HAU antijen çözeltisinin hacmi ≥ 15 mL), özel ayarlamalar için Tablo 2'ye bakın. Örneğin, tam HA ile en yüksek seyreltme 1: 2 ise, 4-HAU antijen çözeltisinin titresi şimdi 2'dir ve 4-HAU antijen çözeltisinin önceki hazırlığında olduğu gibi eşit hacimde bir antijen eklenmelidir. Tersine, tam HA'nın en yüksek seyreltilmesi 1: 6 ise, titre şimdi 6'dır ve PBS hacminin yarısı yenilenmelidir.
Geri titrasyonda kullanılan hacim toplamın %1'ini aşarsa (4-HAU antijen çözeltisinin hacmi < 15 mL), düzeltilmiş seyreltme faktörünü kullanarak 4-HAU antijen çözeltisini yeniden formüle edin. Özel düzeltmeler için Tablo 3'e bakın. Örneğin, tam HA'nın en yüksek seyreltilmesi 1:2 ise, 4-HAU antijen çözeltisinin titresi şimdi 2'dir ve seyreltme faktörü orijinalin 1/2'sine ayarlanmalıdır. Tersine, tam HA'nın en yüksek seyreltilmesi 1: 6 ise, 4-HAU antijen çözeltisinin titresi şimdi 6'dır ve seyreltme faktörü orijinalin 3 / 2'sine ayarlanır.
| Geri titrasyonun HA titresi | Antijen veya PBS'nin yenilenmesi |
| 1:2 | Va |
| 1:3 | Va/3 |
| 1:5 | Başkan Yardımcısı/4 |
| 1:6 | Başkan Yardımcısı/2 |
| 1:7 | 3Vp/4 |
Tablo 2: Geri titrasyon sonuçlarına dayalı olarak 4-HAU konsantrasyonunu ayarlamak için referans tablosu. Va ve Vp, sırasıyla 4-HAU antijen çözeltisinin formülasyonunda kullanılan antijen ve PBS hacimlerini temsil eder.
| Geri titrasyonun HA titresi | Seyreltme faktörü düzeltmesi |
| 1:2 | D/2 |
| 1:3 | 3 boyutlu/4 |
| 1:5 | 5D/4 |
| 1:6 | 3 boyutlu/2 |
| 1:7 | 7 BOYUTLU/4 BOYUTLUDUR |
Tablo 3: 4-HAU antijeninin yeniden hazırlanması için seyreltme faktörü düzeltmesinin referans tablosu. D, daha önce 4-HAU antijen preparatında kullanılan seyreltme faktörünü temsil eder.
6. Serumun hazırlanması
- Antikoagülan kullanmadan tavuk kanatlarından ~ 1 mL kan toplayın.
- Kanı 1.5 mL'lik bir santrifüj tüpüne aktarın ve 37 ° C'de ~ 2 saat inkübe edin. 10 dakika boyunca 3.000 x g'da santrifüjleyin ve süpernatanı dikkatlice yeni bir tüpe aspire edin.
7. HI testi
- Mikrotitre plakalarını tahlil düzenine göre etiketleyin. Çok kanallı bir pipet kullanarak 1-11 sütunlarındaki her bir oyuğa 25 μL PBS ve sütun 12'deki kuyucuklara 50 μL ekleyin.
- Pozitif ve negatif serum kontrol sıraları dahil olmak üzere her sıranın ilk oyuğuna 25 μL serum ekleyin. En az 5 kez yukarı ve aşağı pipetleyerek iyice karıştırın.
- Her sıranın ilk kuyucuğundan ikinci kuyucuğa 25 μL aktarın ve iyice karıştırın. İkinci kuyudan üçüncüye aktarmaya ve karıştırmaya devam edin ve 10. sütuna kadar devam edin. Karıştırdıktan sonra 10. sütundaki kuyudan 25 μL sıvıyı atın.
- Düşük ila yüksek serum konsantrasyonu yönünde 1-11 sütunlarındaki her bir oyuğa 25 μL 4-HAU antijeni ekleyin.
- Plakayı bir mikroplaka çalkalayıcı üzerinde ~20 saniye çalkalayın. ~ 30 dakika boyunca tezgah üzerinde rahatsız edilmeden bırakın.
- Her bir oyuğa düşük ila yüksek serum konsantrasyonu yönünde 25 μL% 1 tavuk RBC ekleyin.
- İyice karıştırmak için plakayı bir mikroplaka çalkalayıcı üzerinde ~ 20 s çalkalayın. PBS kontrol kuyularının RBC'leri tamamen yerleşene kadar ~ 30 dakika boyunca tezgah üzerinde rahatsız edilmeden bırakın.
- Sonuçları okuyun ve kaydedin.
NOT: HI titresi, 4-HAU antijeninin hemaglutinasyonunu tamamen inhibe eden en yüksek serum dilüsyonudur. RBC'lerin yırtılma şeklindeki akışı, plakayı 25 saniye boyunca 90° eğerek her sıranın son sütununda gözlemlenebilir. Her sıranın sonundan itibaren sondan ikinci kuyuda tam HA (akış yok) gözlemlenebilir. Geçerli test sonuçları, pozitif serum kontrolünün HI titresinin bilinen HI titresinin bir seyreltilmesi içinde olmasını gerektirir; negatif serum kontrolünün HI titresi ≤ 2 log2; ve RBC kontrolünün kendi kendine HA'sının olmaması. HA tahlili iş akışının şematik diyagramı için Şekil 5'e bakın.
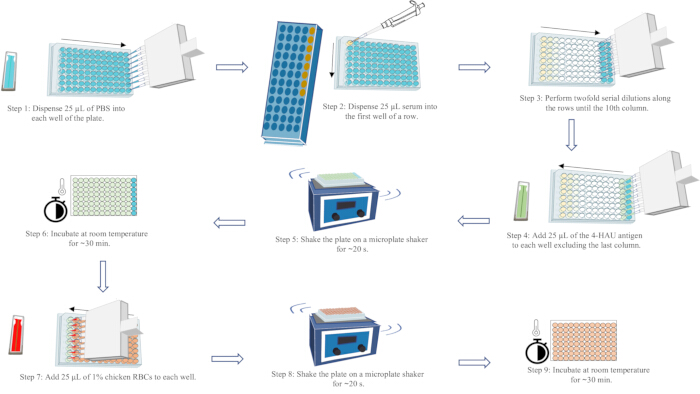
Şekil 5: Hemaglutinasyon testi test iş akışının şematik diyagramı. PBS mavi, serum sarı, 4-HAU antijen çözeltisi yeşil ve %1'lik tavuk RBC süspansiyonu kırmızı ile temsil edilir. Oklar, sıvı dağıtımının sırasını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Optimize edilmiş yöntem kullanılarak formüle edilen 4-HAU antijen çözeltisinin titresinin doğrulanması
Çalışma, HA titresini doğru bir şekilde belirlemek için antijen stok çözeltisinin çeşitli seyreltmelerini kullandı ve 4-HAU antijen çözeltisinin hazırlanması için seyreltme faktörünün hesaplanmasını kolaylaştırdı. Sonuçlar, optimize edilmiş yöntemin hem verimli hem de hassas olduğunu ve tekrarlanan geri titrasyon ve ayarlama prosed...
Tartışmalar
Bu makalede önerilen optimize edilmiş yöntem, 4-HAU antijen çözeltisinin doğru bir şekilde hazırlanması için bir yaklaşım sunmaktadır. OIE ve AB kılavuzları, HA titrasyonu için ilk seyreltmeleri önerse de, kullanılacak seyreltme oranlarıyla ilgili kesin ayrıntılar sağlamaz veya belirli metodolojiler sunmaz1,12. Ayrıca, FAO ve OIE, 4-HAU'nun doğruluğunu arttırmanın bir yolu olarak geri titrasyonu önermesine rağmen, net bir...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
CC, Taicang Teknoloji programı (TC2021JC16) ve Suzhou Chien-shiung Teknoloji Enstitüsü İnovasyon Ekibi Fonları (2023JXKYTD01) tarafından desteklenmiştir. HY, Taicang Teknoloji programı (TC2021JC11) tarafından desteklenmiştir. Her ikisi de Suzhou Chien-Shiung Teknoloji Enstitüsü Yeni Doktora Araştırmacıları için Başlangıç Fonu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
Referanslar
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır