È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ottimizzazione della preparazione dell'antigene per il test di inibizione dell'emoagglutinazione della sierologia del virus della malattia di Newcastle
In questo articolo
Riepilogo
Questo articolo presenta un metodo semplificato per la preparazione di 4 unità di emoagglutinazione dell'antigene per i test sierologici del virus della malattia di Newcastle. Determinando con precisione il titolo di emoagglutinazione dell'antigene, combinato con un metodo di titolazione inversa più rigoroso e un processo di aggiustamento ben definito, migliora l'efficienza del test, riduce i falsi positivi e migliora la sorveglianza della malattia nel pollame.
Abstract
Una valutazione accurata dei titoli anticorpali del virus della malattia di Newcastle (NDV) è fondamentale per un efficace controllo e sorveglianza della malattia del pollame. Questo articolo introduce un metodo ottimizzato per la preparazione di una soluzione di antigene a 4 unità di emoagglutinazione (4-HAU), un componente chiave del saggio di inibizione dell'emoagglutinazione (HI) utilizzato nella rilevazione sierologica NDV. A differenza dei metodi convenzionali, che comportano fasi di titolazione e regolazione indefinite e dispendiose in termini di tempo, questo approccio semplifica questo processo misurando accuratamente il titolo di HA utilizzando una serie iniziale di diluizioni (1:3, 1:5, 1:7 e 1:9). Forniamo anche un metodo specifico per la regolazione o la riformulazione in base ai risultati della titolazione inversa, riducendo la necessità di ripetute titolazioni inverse. Inoltre, abbiamo valutato l'effetto dell'accuratezza della soluzione di antigene 4-HAU sul titolo sierico di HI e abbiamo scoperto che quando il titolo dell'antigene 4-HAU era inferiore a 3, risultava la comparsa di campioni di HI falsi positivi. Fornendo un metodo accurato e riducendo al minimo le attività computazionali, questo approccio aumenta l'efficienza e l'affidabilità dei test, contribuendo a migliorare la sorveglianza e il controllo delle malattie nelle popolazioni avicole.
Introduzione
La malattia di Newcastle (ND) è una malattia diffusa e grave del pollame riconosciuta a livello globale 1,2,3. Si manifesta con vari sintomi come febbre alta, distress respiratorio, dissenteria, disturbi nervosi ed emorragia delle mucose4. L'agente eziologico, il virus della malattia di Newcastle (NDV), ha resistito per quasi un secolo, affliggendo più di 200 specie aviarie, tra cui polli, anatre, oche e piccioni5. La trasmissione avviene principalmente attraverso il contatto diretto o indiretto con uccelli infetti, con pollame, piccioni e uccelli liberi che fungono da potenziali serbatoi6. Nonostante il sierotipo singolo dell'NDV, la sua diversità genetica pone sfide significative alla gestione della malattia e agli sforzi di controllo 3,7.
La vaccinazione funge da strategia primaria per il controllo della ND, integrata da rigorose misure di biosicurezza 5,8. Vari vaccini commerciali sono disponibili a livello globale per il pollame, provocando robuste risposte anticorpali sieriche dopo l'immunizzazione9. Questi anticorpi svolgono un ruolo fondamentale nel mitigare la gravità dei sintomi in seguito all'esposizione a ceppi virulenti e nel frenare la trasmissione tra gli ingombri10. I protocolli standard di rivaccinazione, che in genere prevedono vaccini vivi attenuati somministrati ogni 6-12 settimane, sono una pratica standard nelle regioni endemiche della ND9. Il monitoraggio di routine dei titoli anticorpali post-vaccinazione negli allevamenti avicoli commerciali è essenziale per valutare l'efficacia del vaccino 11,12,13. Bassi titoli anticorpali dopo la vaccinazione possono indicare il fallimento del vaccino, richiedendo misure correttive tempestive come la vaccinazione supplementare o l'indagine su potenziali fattori immunosoppressivi che influenzano la risposta immunitaria14.
Vengono utilizzate diverse tecniche per rilevare gli anticorpi sierici contro NDV, tra cui il test di immunoassorbimento enzimatico, l'inibizione dell'emoagglutinazione (HI) e il test di neutralizzazione 9,13,15,16. Ogni metodo presenta vantaggi e limitazioni unici in termini di sensibilità, specificità ed economicità.
Questo articolo delinea un protocollo passo dopo passo basato sul protocollo dell'Organizzazione Mondiale per la Salute Animale (OIE) per l'esecuzione dell'HI per quantificare i titoli anticorpali specifici del siero contro NDV11. L'emoagglutinazione (HA), un fenomeno indotto da alcuni virus avvolti come l'NDV, comporta l'aggregazione dei globuli rossi (RBC)9. La proteina emoagglutinina-neuraminidasi (HN) sulla superficie NDV interagisce con i globuli rossi, provocando l'aggregazione cellulare e la formazione di reticoli2. Il test HI è preferito come metodo sierologico per la sua capacità di valutare la specificità degli anticorpi sierici nei confronti della proteina HN di NDV 8,9. Inoltre, la sua economicità e l'indipendenza da strumentazione specializzata lo rendono accessibile e pratico per l'uso di routine.
Per migliorare l'efficienza del test, abbiamo perfezionato il flusso di lavoro del protocollo OIE11, con l'obiettivo di ottenere titoli antigenici HA più accurati e di offrire regolazioni dettagliate per la soluzione antigenica a 4 unità di emoagglutinazione (4-HAU). Inoltre, attraverso l'analisi comparativa, abbiamo valutato l'impatto dell'accuratezza 4-HAU sui risultati HI, fornendo preziose informazioni per i professionisti sul campo. Questo approccio non si limita al test degli anticorpi NDV, ma si estende al rilevamento di sottotipi virali e altri virus emoagglutinanti, tra cui morbillo, poliomavirus, parotite e rosolia.
Protocollo
L'approvazione del protocollo è stata concessa dal comitato istituzionale locale per la cura e l'uso degli animali. Tutte le procedure che hanno coinvolto antigeni virali vivi e campioni di siero clinico sono state eseguite in un laboratorio di Biosicurezza di Livello 2, in conformità con i protocolli di sicurezza stabiliti.
1. Preparazione della sospensione di globuli rossi di pollo all'1%
- Aggiungere 3 mL di soluzione di Alserver (anticoagulante) in una provetta da centrifuga conica sterile da 15 mL.
- Raccogliere 1 ml di sangue dalla vena alare di ciascuno dei tre polli non immuni (senza anticorpi NDV). Trasferire immediatamente il sangue nella provetta contenente l'anticoagulante e mescolare delicatamente.
- Riempire la provetta con 1 soluzione salina tamponata con fosfato sterile (PBS, pH 7,2-7,4) fino a un volume totale di 12 mL e mescolare delicatamente. Centrifugare a 500 × g per 10 min utilizzando un rotore orizzontale.
- Rimuovere con cautela il surnatante e lo strato di globuli bianchi. Ripetere i passaggi 1.3 e 1.4 2 volte per ottenere il pellet RBC.
- Pipettare 1 mL di pellet di globuli rossi in 99 mL di PBS sterile, per preparare una sospensione di globuli rossi all'1%.
NOTA: Il volume richiesto della sospensione di globuli rossi di pollo all'1% è stimato in 3 ml/piastra (25 μl/pozzetto x 96 pozzetti x 1,25 = 3,0 ml; dove 1,25 tiene conto degli sprechi di pipettaggio per garantire un volume sufficiente).
2. Ricostituzione dell'antigene o del siero liofilizzato
- Aggiungere 2 ml di PBS sterile alla fiala contenente l'antigene liofilizzato o il siero. Agitare delicatamente la fiala e lasciarla riposare per 2-3 minuti per ridurre al minimo le bolle e garantire la completa dissoluzione.
NOTA: Seguire le istruzioni specifiche del produttore, poiché in questo studio non sono stati confrontati diversi tipi di materiali liofilizzati. - Aliquotare la soluzione ricostituita in provette da centrifuga da 1,5 mL e congelare a -20 °C fino al momento dell'uso.
NOTA: Rideterminare il titolo di HA ogni volta che l'antigene viene scongelato e utilizzato, o quando viene preparata una nuova sospensione di globuli rossi.
3. Titolazione HA di antigeni
- Erogare rispettivamente 40, 80, 120 e 160 μl di PBS in quattro pozzetti adiacenti di una piastra monouso per microtitolazione con fondo a V da 96 pozzetti, quindi aggiungere 20 μl di antigene a ciascun pozzetto e miscelare pipettando su e giù 10 volte per ottenere diluizioni di 1:3, 1:5, 1:7 e 1:9, rispettivamente. Un diagramma schematico dell'operazione di diluizione è mostrato nella Figura 1.
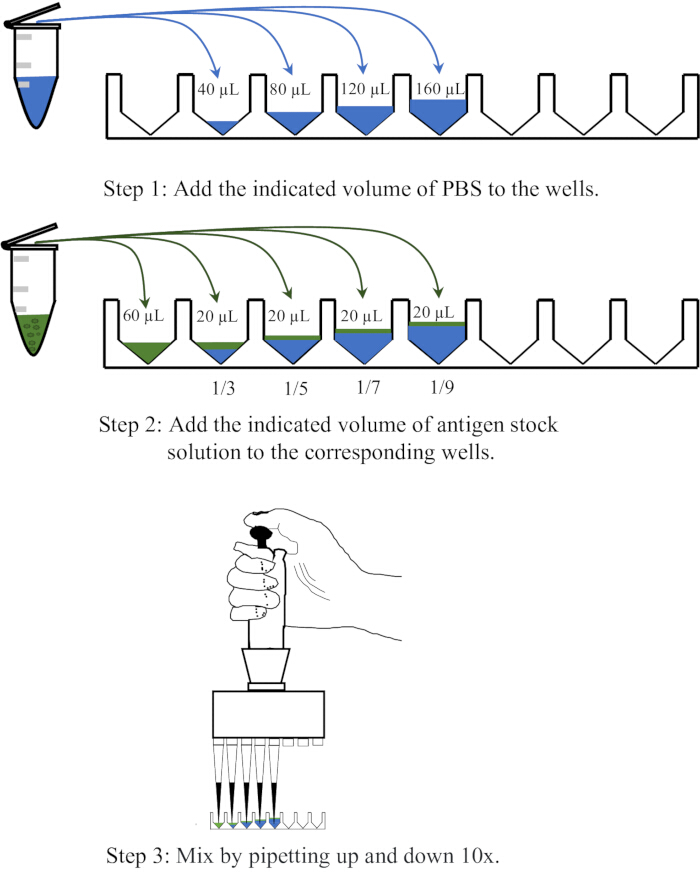
Figura 1: Diagramma schematico che illustra la procedura per diluire la soluzione di antigene nel saggio di emoagglutinazione. La soluzione di antigene viene diluita in PBS in rapporti rispettivamente di 1:3, 1:5, 1:7 e 1:9. La PBS nei pozzetti o nelle provette da centrifuga è rappresentata in blu, mentre gli antigeni sono mostrati in verde. Clicca qui per visualizzare una versione più grande di questa figura.
- Etichettare una nuova piastra per microtitolazione. Aggiungere 25 μl di PBS in ciascun pozzetto nelle file 1-5.
- Posizionare 25 μl di soluzioni di antigene diluite nei primi pozzetti delle file 1-5 utilizzando una pipetta multicanale e mescolare pipettando su e giù almeno 5 volte.
- Trasferire 25 μl dal primo pozzetto di ogni fila al secondo pozzetto, mescolando accuratamente. Continuare a trasferire da un pozzetto all'altro, fino all'11a colonna, per creare diluizioni seriali doppie (da 1:2 a 1:2048). Scartare 25 μl dopo l'11a colonna.
- Aggiungere 25 μl di PBS a ciascun pozzetto, iniziando dai pozzetti contenenti la concentrazione di antigene più bassa.
- Aggiungere 25 μl di sospensione di globuli rossi di pollo all'1% in ciascun pozzetto, sempre iniziando dai pozzetti contenenti la concentrazione di antigene più bassa.
- Agitare la piastra su un agitatore per micropiastre per ~20 s per mescolare accuratamente.
- Lasciarlo indisturbato sul banco di lavoro a temperatura ambiente (20-25 °C) per ~30 minuti fino a quando l'RBC della 12a colonna non si è completamente stabilizzato. Per la disposizione delle piastre fare riferimento alla Figura 2.
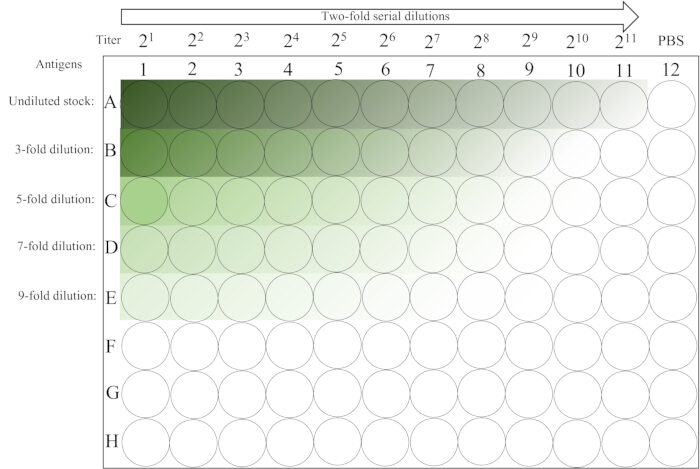
Figura 2: Layout schematico di una micropiastra utilizzata nel saggio di emoagglutinazione. La prima colonna delle righe 1-5 contiene varie diluizioni iniziali non diluite della soluzione di antigene, seguite da una doppia diluizione seriale da sinistra a destra fino alla colonna 11. Il controllo PBS viene posizionato nell'ultima colonna. Il gradiente da scuro a chiaro indica una diminuzione della concentrazione di antigene. Clicca qui per visualizzare una versione più grande di questa figura.
- Leggi e registra i risultati. L'HA viene determinato inclinando la piastra di 90° per ~25 s e osservando la presenza o l'assenza di flusso a forma di lacrima dei globuli rossi. La diluizione più alta che mostra un'emoagglutinazione completa (senza flusso), rappresenta 1 unità HA. I pozzetti nella 12a colonna fungono da controlli RBC (negativi).
- Calcolare il titolo di HA di ciascuna riga utilizzando la Tabella 1, il cui massimo viene utilizzato per la preparazione della soluzione di antigene 4-HAU. Ad esempio, se a, b, c, d ed e sono uguali rispettivamente a 9, 8, 7, 6, 6, allora 3 x 28 = 768 è il valore massimo ed è il titolo HA dello stock di antigene.
| Antigeni | Colonna di diluizione più alta dell'HA completo | Titolo HA di stock non diluito |
| Stock non diluito | un | 2un |
| Diluizione in 3 volte | b | 3 x 2b |
| Diluizione 5 volte | c | 5 x 2c |
| Diluizione 7 volte | d | 7 x 2d |
| Diluizione 9 volte | e | 9 x 2e |
Tabella 1: Risultati del dosaggio dell'acido ialuronico e calcolo del titolo di HA della soluzione madre.
4. Preparazione della soluzione di antigene 4-HAU
- Calcolare il fattore di diluizione per la preparazione della soluzione di antigene 4-HAU:
 . Determinare il volume totale di 4-HAU necessario: V = 3 ml x Numero di micropiastre. Quindi, calcolare i volumi richiesti della soluzione madre dell'antigene:
. Determinare il volume totale di 4-HAU necessario: V = 3 ml x Numero di micropiastre. Quindi, calcolare i volumi richiesti della soluzione madre dell'antigene: 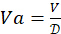 , e PBS: Vp = V - Va.
, e PBS: Vp = V - Va.
NOTA: I volumi sono misurati in millilitri. Stimare 3 mL per piastra per microtitolazione del 4-HAU (25 μL/pozzetto x 96 pozzetti x 1,25 = 3 mL). - Pipettare il volume calcolato di PBS in un contenitore, quindi aggiungere il volume corrispondente di soluzione madre di antigene e mescolare bene per ottenere la soluzione di antigene 4-HAU.
NOTA: La soluzione di antigene 4-HAU deve essere utilizzata il prima possibile.
5. Titolazione inversa della soluzione di antigene 4-HAU
- Erogare 25, 50, 75, 100, 125 e 150 μl di PBS in sei pozzetti adiacenti di una piastra per microtitolazione, quindi aggiungere 25 μl della soluzione di antigene 4-HAU a ciascun pozzetto e mescolare pipettando su e giù 10 volte.
NOTA: Diluire la soluzione dell'antigene 4-HAU con PBS a diluizioni di 1:2, 1:3, 1:4, 1:5, 1:6 e 1:7. Un diagramma schematico dell'operazione di diluizione è mostrato nella Figura 3.
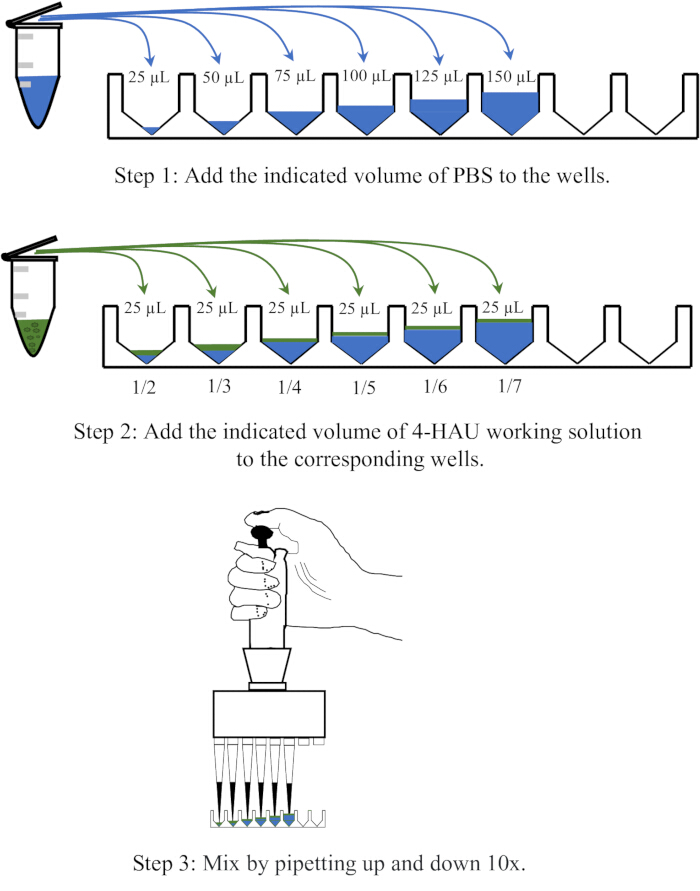
Figura 3: Diagramma schematico della procedura di diluizione della soluzione di 4 unità di emoagglutinazione in retrotitolazione. La soluzione di lavoro 4-HAU è diluita con PBS in rapporti di 1:2, 1:3, 1:4, 1:5, 1:6 e 1:7. La PBS è raffigurata in blu e gli antigeni in verde. Clicca qui per visualizzare una versione più grande di questa figura.
- Trasferire 25 μl di ciascuna soluzione di antigene diluita nei pozzetti di un'altra fila utilizzando una pipetta multicanale. Aggiungere 25 μL di PBS a un pozzetto extra come controllo negativo.
- Aggiungere 25 μL di PBS in ciascun pozzetto, quindi aggiungere 25 μL di RBC di pollo all'1% in ciascun pozzetto.
- Agitare la piastra su un agitatore per micropiastre per ~20 s per mescolare.
- Lasciarlo indisturbato sul banco di lavoro a temperatura ambiente (20-25 °C) per ~30 minuti fino a quando i globuli rossi del controllo negativo non si sono completamente stabilizzati.
- Leggi e registra i risultati.
NOTA: Il pozzetto del controllo negativo non dovrebbe mostrare HA. Idealmente, la diluizione 1:4 è esattamente la diluizione più alta con l'HA completo. Se il titolo della soluzione di 4-HAU è superiore a 4, la diluizione massima può essere 1:5, 1:6 o 1:7; se inferiore, può essere 1:2 o 1:3. Nella Figura 4 è mostrato uno schema schematico della titolazione inversa e i risultati rappresentativi.
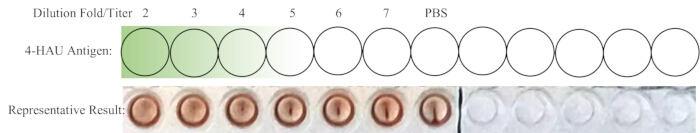
Figura 4: Layout schematico dei pozzetti per la titolazione inversa e risultato rappresentativo. La soluzione di lavoro 4-HAU diluita viene trasferita su una nuova fila, con l'aggiunta di un ulteriore controllo PBS. Il gradiente dal verde scuro al verde chiaro indica la concentrazione dell'antigene da alta a bassa. Risultati rappresentativi dimostrano che la diluizione 1:4 è la diluizione più alta che mostra un'emoagglutinazione completa. Clicca qui per visualizzare una versione più grande di questa figura.
- Se necessario, regolare o riformulare la soluzione dell'antigene 4-HAU.
NOTA: Se il volume della soluzione di antigene 4-HAU utilizzata nella titolazione inversa è ≤1% del volume totale (il volume della soluzione di antigene 4-HAU ≥ 15 ml), fare riferimento alla Tabella 2 per gli aggiustamenti specifici. Ad esempio, se la diluizione più alta con l'HA completo è 1:2, il titolo della soluzione di antigene 4-HAU è ora 2 e deve essere aggiunto un volume di antigene uguale a quello della precedente preparazione della soluzione di antigene 4-HAU. Al contrario, se la diluizione più alta dell'HA completo è 1:6, il titolo è ora 6 e metà del volume di PBS dovrebbe essere reintegrato.
Se il volume utilizzato nella titolazione inversa supera l'1% del totale (il volume della soluzione di antigene 4-HAU < 15 mL), riformulare la soluzione di antigene 4-HAU utilizzando il fattore di diluizione corretto. Fare riferimento alla Tabella 3 per le correzioni specifiche. Ad esempio, se la diluizione più alta dell'HA completo è 1:2, il titolo della soluzione di antigene 4-HAU è ora 2 e il fattore di diluizione deve essere regolato a 1/2 dell'originale. Al contrario, se la diluizione più alta dell'HA completo è 1:6, il titolo della soluzione di antigene 4-HAU è ora 6 e il fattore di diluizione viene regolato a 3/2 dell'originale.
| Titolo HA della titolazione inversa | Rifornimento di antigene o PBS |
| 1:2 | Va |
| 1:3 | Va/3 |
| 1:5 | Vp/4 |
| 1:6 | Vp/2 |
| 1:7 | 3Vp/4 |
Tabella 2: Tabella di riferimento per la regolazione della concentrazione di 4-HAU in base ai risultati della titolazione inversa. Va e Vp rappresentano rispettivamente i volumi di antigene e PBS utilizzati nella formulazione della soluzione di antigene 4-HAU.
| Titolo HA della titolazione inversa | Correzione del fattore di diluizione |
| 1:2 | D/2 |
| 1:3 | 3D/4 |
| 1:5 | 5D/4 |
| 1:6 | 3D/2 |
| 1:7 | 7D/4 |
Tabella 3: Tabella di riferimento della correzione del fattore di diluizione per la ripreparazione dell'antigene 4-HAU. D rappresenta il fattore di diluizione precedentemente utilizzato nella preparazione dell'antigene 4-HAU.
6. Preparazione del siero
- Raccogliere ~1 ml di sangue dalle ali di pollo senza utilizzare un anticoagulante.
- Trasferire il sangue in una provetta da centrifuga da 1,5 mL e incubare a 37 °C per ~2 ore. Centrifugare a 3.000 x g per 10 minuti e aspirare con cura il surnatante in una nuova provetta.
7. Saggio HI
- Etichettare le piastre per microtitolazione in base al layout del saggio. Aggiungere 25 μl di PBS a ciascun pozzetto nelle colonne 1-11 e 50 μl ai pozzetti nella colonna 12, utilizzando una pipetta multicanale.
- Aggiungere 25 μl di siero al primo pozzetto di ogni fila, comprese le righe di controllo del siero positive e negative. Miscelare accuratamente pipettando su e giù almeno 5 volte.
- Trasferire 25 μl dal primo pozzetto di ogni fila al secondo pozzetto e mescolare accuratamente. Continuare a trasferire e mescolare dal secondo pozzetto al terzo, e così via, fino alla 10° colonna. Scartare 25 μl di liquido dal pozzetto nella 10a colonna dopo la miscelazione.
- Aggiungere 25 μl di antigene 4-HAU a ciascun pozzetto nelle colonne 1-11 nella direzione della concentrazione sierica da bassa ad alta.
- Agitare la piastra su un agitatore per micropiastre per ~20 s. Lasciarlo indisturbato sul piano di lavoro per ~30 minuti.
- Aggiungere 25 μl di globuli rossi di pollo all'1% in ciascun pozzetto nella direzione di una concentrazione sierica da bassa ad alta.
- Agitare la piastra su un agitatore per micropiastre per ~20 s per mescolare accuratamente. Lasciarlo indisturbato sul banco di lavoro per ~30 minuti fino a quando i globuli rossi dei pozzetti di controllo PBS non si sono completamente stabilizzati.
- Leggi e registra i risultati.
NOTA: Il titolo HI è la più alta diluizione sierica che inibisce completamente l'emoagglutinazione dell'antigene 4-HAU. Il flusso a forma di lacrima di globuli rossi può essere osservato nell'ultima colonna di ogni fila, inclinando la piastra di 90° per 25 s. L'HA completo (senza flusso) può essere osservato nel penultimo pozzetto dalla fine di ogni fila. I risultati validi del test richiedono che il titolo HI del controllo sierico positivo sia entro una diluizione del titolo HI noto; il titolo HI del controllo sierico negativo deve essere ≤ 2 log2; e l'assenza di auto-HA del controllo RBC. Per un diagramma schematico del flusso di lavoro del saggio HA, vedere la Figura 5.
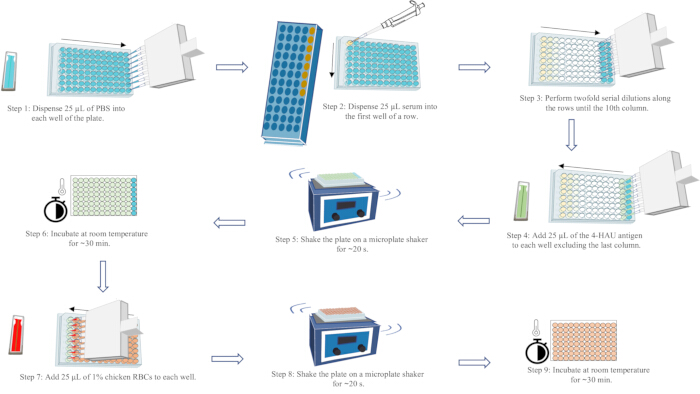
Figura 5: Diagramma schematico del flusso di lavoro del saggio di emoagglutinazione. La PBS è rappresentata in blu, il siero in giallo, la soluzione dell'antigene 4-HAU in verde e la sospensione di globuli rossi di pollo all'1% in rosso. Le frecce indicano l'ordine di erogazione dei liquidi. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Validazione del titolo della soluzione di antigene 4-HAU formulata con il metodo ottimizzato
Lo studio ha impiegato varie diluizioni della soluzione madre dell'antigene per determinare con precisione il titolo di HA, facilitando il calcolo del fattore di diluizione per la preparazione della soluzione antigenica 4-HAU. I risultati rivelano che il metodo ottimizzato è efficiente e preciso, riducendo il numero di procedure ripetitive di titolazione e regolazione inversa...
Discussione
Il metodo ottimizzato proposto in questo articolo presenta un approccio per preparare accuratamente la soluzione dell'antigene 4-HAU. Sebbene le linee guida dell'OIE e dell'UE suggeriscano diluizioni iniziali per la titolazione dell'HA, non forniscono dettagli precisi sui rapporti di diluizione da utilizzare né offrono metodologie specifiche11,12. Inoltre, sebbene la FAO e l'OIE raccomandino la titolazione inversa come mezzo per migliorare l'accurat...
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
C.C. è stato supportato dal programma Taicang Technology (TC2021JC16) e dai fondi del team di innovazione del Suzhou Chien-shiung Institute of Technology (2023JXKYTD01). H.Y. è stato supportato dal programma Taicang Technology (TC2021JC11). Entrambi sono stati sostenuti dallo Start-up Fund for New Ph.D. Researchers del Suzhou Chien-Shiung Institute of Technology.
Materiali
| Name | Company | Catalog Number | Comments |
| Sterile Centrifuge Tube (15 mL) | Labshark | 130201030 | |
| Air-cooled Low-speed Tabletop Centrifuge | Titan | LDC-5 | |
| Alserve's Solution | Sangon Biotech | E607058 | |
| Centrifuge | DLAB | 9032002121 | |
| Disposable Pasteur Pipette | Titan | SWXG-004 | |
| Disposable Sterile Syringe(1 mL) | Beyotime | FS801-30PCS | |
| Disposable V-bottom Microtiter Plate(96-well) | Labshark | 130207001 | |
| Microplate Shaker | Jiangsu Xinkang Medical Equipment Co., Ltd | XK96-3 | |
| NDV HI Negative Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Positive Sera | Qingdao Regen Diagnostics Development Center | ||
| NDV HI Test Antigen | Qingdao Regen Diagnostics Development Center | ||
| PBS Solution (1x) | Adamas Life | C8020 | |
| Sterile Centrifuge Tube (1.5 mL) | Labshark | 130201012 |
Riferimenti
- Ayllon, J., García-Sastre, A., Martínez-Sobrido, L. Rescue of recombinant Newcastle disease virus from cDNA. J Vis Exp. (80), e50830 (2013).
- Chen, Y., et al. The HN protein of Newcastle disease virus induces cell apoptosis through the induction of lysosomal membrane permeabilization. PLoS Pathog. 20 (2), e1011981 (2024).
- Miller, P. J., Decanini, E. L., Afonso, C. L. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infect Genet Evol. 10 (1), 26-35 (2010).
- Terregino, C., Capua, I. Clinical traits and pathology of Newcastle disease infection and guidelines for farm visit and differential diagnosis. Avian Influenza and Newcastle Disease: A Field and Laboratory. , 113-122 (2009).
- Dimitrov, K. M., Afonso, C. L., Yu, Q., Miller, P. J. Newcastle disease vaccines—A solved problem or a continuous challenge. Vet Microbiol. 206, 126-136 (2017).
- Sheng, W., et al. Molecular characteristics and phylogenetic analysis of pigeon paramyxovirus type 1 isolates from pigeon meat farms in Shanghai (2009-2012). Sci Rep. 14 (1), 10741 (2024).
- Yates, J. G. E., et al. Production of high-titer recombinant Newcastle disease virus from allantoic fluid. J of Vis Exp. (183), e63817 (2022).
- van Boven, M., et al. Herd immunity to Newcastle disease virus in poultry by vaccination. Avian Pathol. 37 (1), 1-5 (2008).
- Oberländer, B., et al. Evaluation of Newcastle disease antibody titers in backyard poultry in Germany with a vaccination interval of twelve weeks. PloS One. 15 (8), e0238068 (2020).
- Bhattacharya, S., et al. Spillover of Newcastle disease virus to Himalayan Griffon vulture: a possible food-based transmission. Virus Genes. 60 (4), 385-392 (2024).
- World Organisation for Animal Health (OIE). Newcastle disease (Infection with Newcastle disease virus). Manual of diagnostic tests and vaccines for terrestrial animals. , (2024).
- Council of European Union. Council Directive 92/66/EEC of 14 July 1992 Introducing Community measures for the control of Newcastle disease. Document 31992L0066. L260, 1-20 (1992).
- Grimes, S. E. . A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. 2002/22, 1-129 (2002).
- Dortmans, J. C. F. M., Peeters, B. P. H., Koch, G. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application. Vet Microbiol. 160 (1-2), 17-22 (2012).
- De Sousa, R. L. M., Montassier, H. J., Pinto, A. A. Detection and quantification of antibodies to Newcastle disease virus in ostrich and Rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol. 7 (6), 940-944 (2000).
- Chumbe, A., Izquierdo-Lara, R., Calderón, K., Fernández-Díaz, M., Vakharia, V. N. Development of a novel Newcastle disease virus (NDV) neutralization test based on recombinant NDV expressing enhanced green fluorescent protein. Virol J. 14 (1), 232 (2017).
- Webster, R., Cox, N., Stöhr, K. WHO animal influenza manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon