Method Article
التصوير المقطعي بالإصدار البوزيتروني قبل السريري مع قوالب حيوانية مطابقة للجسم لتحليل الصور الآلي المستند إلى السحابة في الفئران
In This Article
Summary
يصف هذا البروتوكول إجراء إجراء التصوير المقطعي بالإصدار البوزيتروني في الجسم الحي على الفئران باستخدام قوالب المطابقة للجسم (BCAMs) في ماسح التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب G8. يتم توفير التفاصيل الفنية حول إعداد الفأر ، بما في ذلك زرع الورم المناسب ، وتحديد المواقع المثلى ، والحصول على صور التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب بمساعدة BCAM ، وتحليل البيانات.
Abstract
التصوير المقطعي بالإصدار البوزيتروني (PET) هو طريقة تصوير جزيئي يمكن استخدامها للتحقيق في العديد من الأسئلة الدوائية ، مثل تعديل المؤشرات الحيوية ، وإشغال المستقبلات ، والتوزيع الحيوي للمركبات ذات الأهمية. في دراسات التوزيع الحيوي ، غالبا ما يتم تصوير الأشخاص التجريبيين طوليا بعد تلقي مقالة الاختبار. ثم يتم تحليل الصور لاشتقاق ملف توزيع المركب في أجهزة مختلفة في نقاط زمنية مختلفة. ويشكل ذلك خطوة حاسمة في تطوير المخدرات لفهم توزيع مركب التحقيق وملفه الشخصي المحتمل. ومع ذلك ، فإن الطرق القياسية / اليدوية لتحليلات التوزيع الأحيائي القائمة على التصوير المقطعي بالإصدار البوزيتروني تتطلب عمالة كثيفة وتستغرق وقتا طويلا وغالبا ما ترتبط بتباين كبير بين المشغلين. علاوة على ذلك ، من الصعب الحفاظ على اتساق مواقف عبر نقاط زمنية مختلفة. لمعالجة أوجه القصور هذه ، تم استخدام سلسلة من قوالب المطابقة لجسم الفئران (BCAMs) لتمكين تحديد المواقع الصلبة والمتسقة للحيوانات أثناء الحصول على التصوير المقوم بالإصدار البوزيتروني / التصوير المقطعي المحوسب. علاوة على ذلك ، تم استخدام منصة البرمجيات كخدمة (SaaS) التي تتكون من خريطة احتمالية الأعضاء المستندة إلى السحابة (OPM) وأداة تجزئة مدعومة بالذكاء الاصطناعي لتمكين القياس الكمي الموثوق والآلي لبيانات التصوير المقطعي بالإصدار البوزيتروني في الجسم الحي. يتضمن سير العمل المقدم هنا (1) تحضير الفئران للتصوير باستخدام BCAMs ، بما في ذلك الزرع المناسب للأورام تحت الجلد لتكون متوافقة مع القوالب ، (2) الحصول على صور PET / CT باستخدام BCAMs باستخدام الماسح الضوئي G8 ، و 3) إجراء تجزئة الأعضاء الآلي وتحليل التوزيع الحيوي باستخدام SaaS المستند إلى السحابة. [18فهرنهايت]تم استخدام FDG كتتبع نموذجي هنا ، ولكن يمكن تكييف المؤشرات الحيوية الأخرى و / أو المركبات ذات العلامات الراديوية بسهولة في سير العمل. يمكن تنفيذ هذا الإجراء بدقة وفعالية مع الحد الأدنى من التدريب ، وأسفر التحليل الآلي لبيانات التصوير المقطعي بالإصدار البوزيتروني عن نتائج مرضية تتفق مع الطريقة اليدوية.
Introduction
تعد تقنيات التصوير الجزيئي في الجسم الحي أدوات مهمة في تطوير الأدوية لتسهيل تقييم جميع الركائز الثلاث لعلم الأدوية - التوزيع الحيوي ، والمشاركة المستهدفة ، وتعديل الديناميكا الدوائية1،2،3. يعد التصوير المقطعي بالإصدار البوزيتروني (PET) ، مع قابليته للترجمة السريرية وحساسيته العالية ، من بين طرق التصوير الجزيئي الأكثر استخداما في كل من العيادة ومجال البحث والتطوير قبل السريري. يعد المجال المزدهر للتصوير المبثوني قبل السريري والعلاج الحراري الإشعاعي ذا قيمة لتطوير كل من العلاجات الجوهرية للورم والعلاجات المستهدفة بالإضافة إلى علاجات الأورام المناعية الجديدة (IO). إن الظهور والتطوير المستمر لأجهزة التتبع الإشعاعي المناعية PET الجديدة لديه القدرة على التأثير على أنظمة أدوية IO محددة وتحديد المستجيبين مقابل غير المستجيبين4،5،6. وفي الوقت نفسه ، يمكن لأجهزة التتبع الإشعاعي الخاصة بالتمثيل الغذائي ، مثل [18F] FDG و [18F] FLT ، مراقبة استجابة الورم للعلاج ويمكنها على التوالي إلقاء الضوء على ما إذا كان الورم يتكاثر بنشاط أو يستهلك الجلوكوز7 ، أو إذا كانت الخلايا السرطانية تخضع لتوقف دورة الخلية عن طريق التثبيط8،9.
يقدم التصوير غير الجراحي في الجسم الحي مزايا متعددة مقارنة بالتجارب الدوائية التقليدية غير التصويرية. على سبيل المثال ، يسمح التصوير بالتقييم المنهجي والشامل لتوزيع الدواء و / أو التأثير الدوائي في الموضوع بأكمله ، مما يتيح ليس فقط مراقبة الفعالية في الموقع المستهدف ، ولكن أيضا اكتشاف الأنشطة غير المتوقعة خارج الموقع. نظرا لطبيعتها غير الغازية ، يمكن تقييم نفس المجموعة من طوليا عبر نقاط زمنية مختلفة و / أو باستخدام مؤشرات حيوية مختلفة لمعالجة الأسئلة البيولوجيةالمتميزة 10. لا يؤدي هذا إلى تقليل عدد اللازمة للدراسة بشكل كبير فحسب ، بل يوفر أيضا تحكما متعامدا عبر النقاط الزمنية ، وبالتالي يساعد على تحسين الارتباطات وتقليل التقلبات الفردية. على الرغم من هذا التطور الواعد للمؤشرات الحيوية للتصوير ، إلا أن الحاجة إلى تقييم المركبات الاستقصائية في الجسم الحي من خلال دراسات التوزيع الحيوي القائمة على التصوير المبثوني ، مع ذلك ، يتم تلبيتها بنقص العمليات الآلية الفعالة للتحليل. تولد دراسات التوزيع الحيوي للبوزيتروني معلومات قيمة عن حركية المركب وتراكم الأنسجة والارتباط والتمثيل الغذائي. يعد الحصول على بيانات كمية قابلة للتكرار بدرجة عالية أمرا بالغ الأهمية لتطوير العلاجات الصيدلانية.
لتلبية هذه الاحتياجات غير الملباة في التحليل الآلي لصور PET ، صممت InVivo Analytics مجموعة من قوالب المتوافقة مع جسم الماوس (BCAMs) 11. هذه قوالب بلاستيكية مطبوعة ثلاثية الأبعاد تحمل رأس الفأر وجذعه (والأعضاء الداخلية) والذيل والأطراف في أوضاع صلبة ومحددة مسبقا. يمكن اختيار قوالب مختلفة الأحجام بناء على وزن جسم ، ويمكن إنشاء قواطع في مناطق معينة ، مثل الكتف أو الجناح السفلي ، للسماح للأورام تحت الجلد بالبراز. صور التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب التي تم الحصول عليها باستخدام BCAMs هذه موحدة للغاية ويمكن تحليلها على دفعات بواسطة منصة التجزئة الآلية المستندة إلى السحابة للشركة11. تقدم هذه المقالة سير عمل آلي لتحليل التوزيع الحيوي في الجسم الحي مدعوم من خلال الحصول فعليا على الصور باستخدام BCAMs وإجراء تجزئة الصور وتحليلها بواسطة SaaS.
Protocol
اتبعت جميع الإجراءات التي تم إجراؤها على اللوائح والمبادئ التوجيهية المعمول بها وتمت مراجعتها والموافقة عليها من قبل لجنة رعاية واستخدامها المؤسسية في شركة فايزر أو من خلال عملية مراجعة أخلاقية. تم إجراء دراسة التصوير المقطعي بالإصدار البوزيتروني باتباع جميع بروتوكولات السلامة الإشعاعية المؤسسية. تم استخدام إناث الفئران C57BL / 6 ، التي تتراوح أعمارها بين 10 و 12 أسبوعا ، وأوزان الجسم التي تتراوح من 18 إلى 26 جم ، في هذه الدراسة. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. تحضير وتنظيمها
ملاحظة: تتضمن هذه الخطوة تحديد لتصوير التصوير المقطعي بالإصدار البوزيتروني باستخدام زرع الورم الموجه بقالب BCAM.
- قبل زرع الخلية ، احلق فراء الفئران في المنطقة المرغوبة من نمو الورم.
- قم بإعداد محطة التخدير وقم بتوصيل قالب BCAM بالحجم المناسب بالمشبك المسبق مع قلب الجزء العلوي 90 درجة. سيكون هذا بمثابة قاعدة زرع الورم (الشكل 1 أ).
- تخدير في صندوق حثي مناسب مع 2.0٪ إيزوفلوران و 98٪ أكسجين بمعدل تدفق 0.5-1.5 لتر / دقيقة.
ملاحظة: جميع أنظمة التخدير متغيرة.- استخدم نظاما معايرا واختبره قبل الاستخدام. ضع فأرة مخدرة على القاعدة وقم بتمديد أطرافها (الشكل 1 ب).
- ضع قالب حقن ورم BCAM برفق (الشكل 1 ج) على الجانب الظهري للفأر (الشكل 1 د).
- قم بإنشاء علامة مرجعية دائرية مؤقتة بعناية في موقع القطع المطلوب (على سبيل المثال ، الكتف أو الجناح ، اليسار أو اليمين) بعلامة (الشكل 1 د). قم بإزالة قالب القالب.
- جهز الخلايا للحقن عن طريق رسم الحجم المطلوب في حقنة. قم بتوصيل إبرة 27 جم بالمحقنة واملأ مساحة الحجم الميتة. يوصى بحجم 0.1-0.2 مل لكل تلقيح.
- ارفع الجلد بالأصابع أو الملقط باستخدام العلامات المؤقتة من الخطوة 1.5 كمرجع لإنشاء خيمة ، وإدخال الإبرة ببطء ، وحقن الخلايا تحت الجلد في المكان المطلوب. تخلص من الإبرة في حاوية أدوات حادة بيولوجية.
- مراقبة نمو الورم. كان متوسط حجم الورم عند التسجيل في هذا المثال 200-300 مم3.
ملاحظة: تجنب استخدام المكونات المعدنية مثل علامات الأذن أو الرقائق الدقيقة لمنع القطع الأثرية للتصوير المقطعي المحوسب.
2. رسم الجرعات المشعة
- باتباع جميع بروتوكولات السلامة الإشعاعية المؤسسية ، قم بإعداد جرعة مستهدفة من [18فهرنهايت] FDG في حدود 70-80 ميكرو Ci تقريبا في حقنة معقمة مناسبة للحقن في الوريد.
ملاحظة: يعد النطاق 70-80 μCi مثاليا لتناسب النطاق الديناميكي للماسح الضوئي Sofie G8 PET. قد يكون للصورات الأخرى نطاقات ديناميكية مختلفة تتطلب جرعة مستهدفة مختلفة. - قم بقياس الجرعة المشعة بعناية في معاير الجرعة عن طريق وضع المحقنة في حجرة البئر وخفض القطاس. انتبه إلى اختيار النظير أو رقم المعايرة المناسب قبل القياس.
- خذ قراءة مستقرة. سجل التاريخ والوقت. اضبط الجرعة إذا لزم الأمر.
- (اختياري) استخدم محلول ملحي معقم ليصل حجم الجرعة النهائية إلى 0.1-0.2 مل.
ملاحظة: قد يختلف حجم الحقن المطلوب. - الجرعة جاهزة للإدارة.
3. إعطاء الجرعة الوريدية
- باتباع بروتوكولات IACUC والسلامة الإشعاعية المؤسسية ، قم بإعداد ذيل الفأر للحقن الوريدي عن طريق توسيع الوريد الذيلي. في هذه الدراسة ، تم توسيع الوريد الذيل عن طريق وضع قفص أو غرفة الحث على جهاز تسخين منزلق تم ضبطه عند 42 درجة مئوية.
ملاحظة: قد يستغرق الأمر ما يصل إلى 10 دقائق من الاحترار حتى يتمدد وريد الذيل بالكامل. - قبل الحقن ، سجل وزن الفأر. سيحدد هذا BCAM الخاص بالوزن الذي يجب استخدامه لتصوير التصوير المقطع بالإصدار البوزيتروني / التصوير المقطعي المحوسب.
- بمجرد أن تصبح جاهزا ، انقل الماوس إلى أداة تقييد مناسبة (على سبيل المثال ، تم استخدام منصة حقن وريد الذيل في هذه الدراسة) وحدد موقع وريد الذيل.
- تعامل بعناية مع المحقنة المشعة وحقن الجرعة الوريدي في فأر واعي. سجل وقت الحقن.
- ضع المحقنة جانبا بعناية ونظف قطرات الدم الزائد من الذيل بالشاش. قم بإزالة الماوس من الأداة ووضعه مرة أخرى في الغلاف المناسب.
- ضع المحقنة بعناية مرة أخرى في غرفة معايرة الجرعة وسجل أي قراءات متبقية لحسابات الجرعة المناسبة. سجل تاريخ ووقت قراءة النشاط المتبقي.
- بمجرد اكتمال الحقن ، توخي الحذر وضع مجموعات من الفئران خلف حاويات الرصاص و / أو بعيدا عن الموظفين ، باتباع ممارسات الإشعاع الآمنة للمؤسسة. لاحظ أن جميع المواد المستخدمة معرضة للتلوث الإشعاعي الطفيف. راقب جميع المناطق باستخدام عداد جيجر معاير ونظف وفقا لإرشادات السلامة من الإشعاع.
4. تخدير ووضعها لتصوير التصوير المقطعي بالإصدار البوزيتروني
- في الوقت المناسب (على سبيل المثال ، قبل 10-15 دقيقة من نهاية فترة امتصاص التتبع) ، قم بتشغيل جميع معدات التخدير وأدوات تدفئة المطلوبة لكل من تحريض التخدير والتصوير المبوهني بالإصدار البوزيتروني. يمكن ضبط التخدير على 2.0٪ -2.5٪ إيزوفلوران في 98٪ أكسجين (قد تختلف الإعدادات باختلاف سلالة الفأر ونموذج المرض).
- تأكد من تشغيل جميع المحولات والصمامات وأن معدل تدفق الغاز هو 0.5-1.0 لتر / دقيقة. قد تختلف معدلات التدفق المحددة بين أنظمة التخدير وأنظمة التصوير.
- ضع () المناسبة في صندوق الحث وانتظر حتى يصل الموضوع إلى عمق التخدير الصحيح.
- ضع مرهم تشحيم العين على كل عين.
- انقل الماوس إلى BCAM بحجم مناسب بناء على وزن الجسم.
- التقط الماوس برفق من مؤخرة العنق ، وأدخل الذيل في فتحة الذيل ، ولفه تحت BCAM. ضع الذيل على منصة الذيل والشريط لتأمين الموضع. تأكد من أن العمود الفقري مستقيم. أغلق BCAM برفق (الشكل 2 أ ، ب).
- ضع الأطراف الأربعة بعناية لتستقر على كل منصة مخلب BCAM. استخدم الشريط اللاصق حسب الحاجة لتأمين الكفوف على كل منصة (الشكل 2 ب).
- قم بتثبيت BCAM برفق في مكوك سرير التصوير عن طريق إدخال الواجهة الأمامية أولا (الشكل 2C). يجب أن يكون المكوك متصلا بالفعل برصيف التحميل G8 مع تدفق التخدير (الشكل 2 د). اضغط لأسفل على الجزء الخلفي من BCAM ، وستشير نقرة واحدة إلى أنه مثبت على مكوك G8.
ملاحظة: حافظ على إمدادات التخدير بحيث يظل في مستوى التخدير المطلوب أثناء التصوير.
5. الحصول على الصور
- افتح برنامج الحصول على G8 PET. يمكن إنشاء مجلدات الدراسة ومعلمات المسح ومعرفات الموضوعات مسبقا.
- أدخل تفاصيل الدراسة في البرنامج: وزن الماوس ، والتاريخ / الوقت ومقدار الجرعة الأولية المسحوبة ، وتاريخ / وقت الحقن ، وتاريخ / وقت ومقدار قراءة النشاط المتبقي.
- أدخل المكوك بالماوس في فتحة الماسحة الضوئية. سيشير ضوء المؤشر الأزرق إلى الإرساء المناسب للنظام.
- حدد معلمات التصوير المقطعي بالإصدار البوزيتروني/التصوير المقطعي المحوسب المناسبة. الحصول على بيانات التصوير.
ملاحظة: في هذه الدراسة ، تم إجراء فحص PET ثابت لمدة 7 دقائق 18F ، متبوعا بفحص التصوير المقطعي المحوسب الافتراضي لمدة 70 ثانية ، وتم تطبيق خوارزمية إعادة بناء ثلاثية الأبعاد لتعظيم التوقعات ذات الاحتمالية القصوى (الخيار الافتراضي والوحيد في الماسح الضوئي G8) لإعادة بناء البيانات12. - عند اكتمال الاستحواذ ، سيعود المكوك إلى وضع البداية الأولي. قم بإزالة المكوك بالماوس وأدخله في قفص الاتهام. اضغط على الجزء الخلفي من علامة التبويب الرأسية BCAM لإزالتها من مكوك G8 ، واسحب BCAM برفق وقم بإزالته باستخدام الماوس.
- اضغط على علامتي التبويب المثبتتين للقلب لأعلى وفتح الجزء العلوي من BCAM.
- قم بإزالة الماوس برفق. تأكد من أن الماوس قد تعافى تماما من التخدير وأنه مشرق ويقظ وسريع الاستجابة (BAR) قبل العودة إلى قفص المنزل.
- استمر في الإجراء على فترات زمنية محددة لفحص المجموعة / مجموعة الفئران بأكملها.
6. تحميل الصور إلى SaaS
- قم بتسجيل الدخول إلى app.invivo.ax وإنشاء مشروع.
- انقر فوق علامة تبويب التحميل الحمراء في أعلى يمين النافذة. حدد نظام التصوير والمبلغ المستخدم في دراسة التصوير (على سبيل المثال ، [18فهرنهايت] FDG). حدد المجلد الذي يحتوي على بيانات التصوير.
- انتقل إلى علامة تبويب التعليقات التوضيحية داخل مجلد المشروع. انقر فوق التعليق التوضيحي لإضافة معلومات المسح ذات الصلة (اسم الموضوع والجنس وحجم BCAM ووزن الموضوع واسم المجموعة والنقطة الزمنية وقيمة الجرعة المحقونة). سيتم ملء معظم البيانات الوصفية تلقائيا.
7. تحليل البيانات الآلي
- داخل مجلد المشروع ، يجب ملء جميع عمليات الفحص. انقر فوق عمليات المسح الضوئي للتنقل من مستويات المشروع والمجموعة والموضوع الفردي. حدد تحليل في أعلى يسار الصفحة.
- في الجزء العلوي الأيمن من نافذة شريط التحليل، ضمن المشروع، حدد رمز الجمع وحدد عائد استثمار خريطة احتمالية الجهاز. خريطة احتمالات الأعضاء (OPM) هي أطلس إحصائي لأعضاء الفأر يشمل العديد من الأعضاء والأنسجة المحددة مسبقا. اختيار الأجهزة الفردية ذات الاهتمام بناء على الاحتياجات البحثية.
ملاحظة: في هذا المثال، تم إجراء التجزئة والتحليل اليدوي باستخدام VivoQuant، باستخدام أداة الشريحة المتبوعة بالاستيفاء داخل عامل العائد على الاستثمار ثلاثي الأبعاد. تمت مقارنة نتائج التحليل الآلي بنتائج التجزئة اليدوية كمعيار مرجعي.
النتائج
بمجرد التحميل ، يمكن عرض بيانات PET على موقع SaaS كلوحة من الصور الإكليلية والسهمية والعرضية المتراكبة مع عائد الاستثمار للأعضاء المحدد الذي تمليه OPM (الشكل 3 أ). لا يمكن للبرنامج تحميل الصور الفردية فحسب ، بل يمكن عرض العديد من الفئران من مجموعة أو دراسة كاملة في وقت واحد كصورة واحدة مطوية. ضمن نافذة التحليل هذه ، هناك خيارات لتخصيص ألوان عائد الاستثمار وكثافة شريط المقياس والمعلمات الشائعة الأخرى. بمجرد تحديد المقاييس التحليلية المثالية ، يقوم SaaS بإنشاء رسم بياني لشريط التوزيع الحيوي القابل للتنزيل للأعضاء المحددة (الشكل 3 ب).
لتقييم أداء منصة SaaS القائمة على OPM ، تمت مقارنة نتائج التحليل الآلي بتلك التي اشتقها محلل تصوير متمرس كمعيار ذهبي. تم إجراء الانحدار الخطي المناسب على قيم امتصاص [18F] FDG من الدماغ والقلب والكلى (اليمين) والطحال. وتجدر الإشارة إلى أن المنصة تقدم قائمة شاملة بالأعضاء للمستخدمين للاختيار من بينها ، بما في ذلك الهيكل العظمي والدماغ والمثانة والقلب والكلى (اليمين واليسار) والكبد والطحال والرئتين وعضلات الفخذ (اليمين واليسار). تم اختيار الأجهزة الأربعة المذكورة أعلاه في هذه الدراسة لأغراض التوضيح فقط. علاوة على ذلك ، نظرا لتغير حجم الأورام المزروعة وشكلها وعمقها / موقعها ، لم يتم تضمين الورم كعضو في OPM ، وبالتالي يتم استبعاده من هذا التحليل المقارن. كما هو موضح في الشكل 4 ، أسفر التحليل الآلي والتحليل اليدوي عن نتائج متسقة بشكل عام ، حيث أظهر الدماغ أعلى ارتباط (ص2 = 0.8466). هذا متوقع بسبب الحجم الكبير للعضو والوضع الثابت للغاية للدماغ داخل الجمجمة. أظهرت الكلية اليمنى والقلب أيضا قيم r2 معقولة تبلغ 0.6874 و 0.4849 على التوالي. في المقابل ، أنتج تحليل الارتباط للطحال قيمة r2 تبلغ 0.3922 ، وهي الأدنى بين الأعضاء المختبرة. هذا ليس مفاجئا لأن الطحال متداخل في البنكرياس والأنسجة الدهنية التي تفتقر إلى مورفولوجيا محددة وتفترض نفس كثافة الأنسجة الرخوة في التصوير المقطعي المحوسب. لذلك ، يصعب تقسيم الطحال يدويا ، وقد يقدم OPM وسيلة أكثر دقة لترسيم هذا العضو (أي التفوق على المعيار الذهبي). يظهر أيضا المنحدر وتقاطع Y لتحليلات الارتباط هذه في الشكل 4. تمشيا مع قيم r2 ، كان للدماغ ميل أقرب إلى 1 (أي ارتباط مثالي بين OPM والنتائج اليدوية) وأصغر تقاطع Y (أي الحد الأدنى من التحيز الجهازي) ، بينما أظهرت الأعضاء الأخرى انحرافا أكبر ومتغيرا عن الارتباط المثالي.

الشكل 1: BCAM وزرع الورم الموجه بالقالب. (أ) يتم توصيل المشبك المسبق (1) بالقطعة السفلية من قالب BCAM (2) بخط تخدير متصل (3). هذا بمثابة قاعدة زرع الورم. (ب) يتم وضع فأر مع حلق موقع الزرع المستهدف (في هذه الحالة ، الكتف الأيمن) على القاعدة تحت التخدير قبل حقن الخلية. (ج) قالب زرع الورم (4) مع قواطع محددة مسبقا لتوجيه وضع تلقيح الخلايا السرطانية. (د) وضع علامة مرجعية مؤقتة قبل حقن الخلية مع وضع قالب القالب على الجانب الظهري للماوس. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
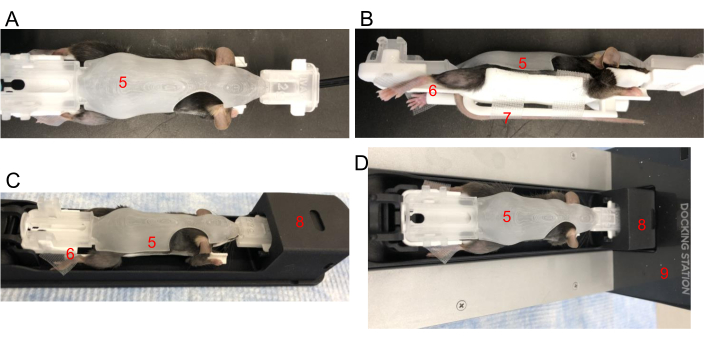
الشكل 2: وضع الماوس في BCAM. (أ) العرض العلوي - ضع الماوس بإحباط في BCAM بحجم مناسب (5). (ب) منظر جانبي - يستخدم الشريط لتأمين الكفوف الخلفية بالمنصات (6). يتم تأمين الذيل بشريط لاصق على منصة الذيل (7) أسفل الماوس مباشرة. (ج) يتم إدخال الفأر ، في BCAM ، في مكوك التصوير (8). (د) يتم توصيل الماوس و BCAM والمكوك بمحطة إرساء تعمل بالتخدير (9). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
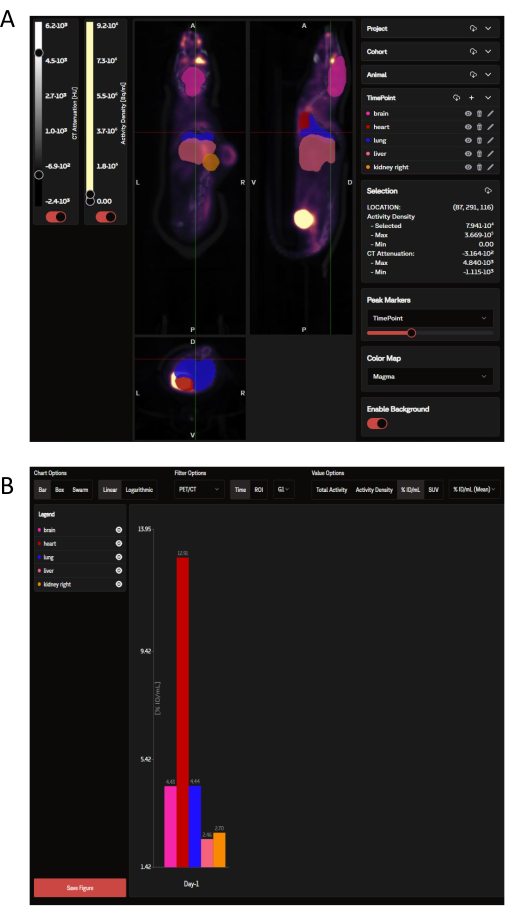
الشكل 3: الصور التمثيلية ومخرجات البيانات كما تم عرضها وتحليلها بواسطة أداة SaaS ، على التوالي. (أ) الصور التمثيلية كما يتم عرضها على موقع SaaS. المناظر الإكليلية والسهمية والعرضية لصورة التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب متراكبة مع عائد استثمار الأعضاء المحدد من خريطة احتمالات الأعضاء (OPM). الوردي: الدماغ. الأحمر: القلب. الأزرق الداكن: الرئة. سمك السلمون: الكبد. البرتقالي: الكلى (يمين). لا يتم تعريف الورم بواسطة OPM. (ب) رسم بياني تمثيلي قابل للتنزيل تم إنشاؤه من التحليل الآلي. يمكن رؤية قائمة بالأعضاء المحددة في اللوحة اليسرى العليا. يتم الإبلاغ عن البيانات هنا في ٪ID/mL. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
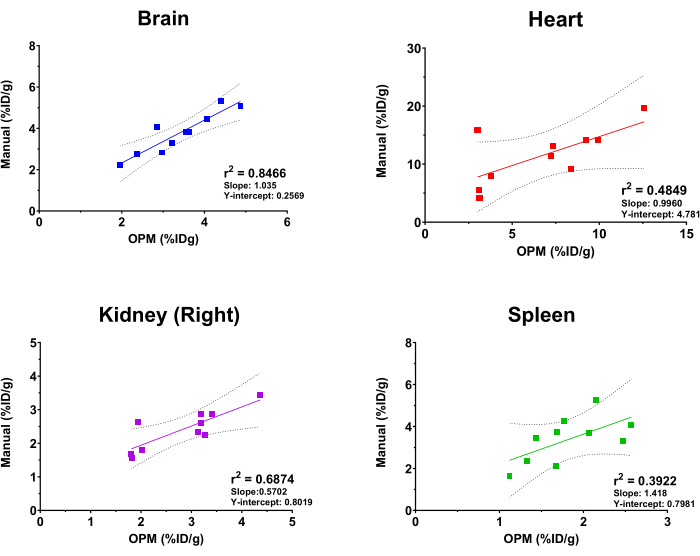
الشكل 4: تحليل الانحدار الخطي الذي يقارن قيم امتصاص FDG المشتقة من التحليل اليدوي وسير عمل الأتمتة المستند إلى OPM. تم استخدام عشرة فحوصات بالإصدار البوزيتروني / التصوير المقطعي المحوسب لإناث الفئران C57BL / 6. يتم عرض قيم r2 وخطوط الثقة بنسبة 95٪ والميل واعتراضات Y على الرسم البياني لكل عضو مشار إليه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا التقرير إجراء إجراء تصوير الماوس في الجسم الحي PET باستخدام قوالب BCAM وتحليل البيانات باستخدام أداة SaaS الآلية. يتم توفير إرشادات خطوة بخطوة حول إعداد الماوس والحصول على الصور ومعالجة البيانات. أسفر سير عمل الأتمتة هذا أيضا عن بيانات متوافقة مع التحليل اليدوي. يتم تسليط الضوء أدناه على بعض الاعتبارات الفنية الرئيسية.
على الرغم من أن الورم ليس أحد الأعضاء التي يحددها OPM ، إلا أن الخطوة الحاسمة في هذا البروتوكول هي الزرع المناسب للأورام تحت الجلد لضمان المحاذاة المثلى لجميع أعضاء الفئران داخل تجويف الجسم و BCAM. يمكن ل OPM إنتاج بيانات دقيقة فقط عندما يكون العمود الفقري للفأر مستقيما نسبيا ويتم وضع الأعضاء الداخلية بشكل محايد. يمكن أن تؤثر الأورام الكبيرة أو في غير محلها على وضعية الفأر وتضغط على تجويف جسمه ، وبالتالي تغيير الأعضاء الداخلية. سيؤدي هذا التحول بدوره إلى تحريف التحليل الكمي الناتج من خوارزمية OPM. أبلغ آخرون عن تأثير العمود الفقري غير المستقيم على محاذاة الأعضاء الداخلية باستخدام طرق التصوير المختلفة وخوارزميات التجزئة13،14. لذلك ، من الأهمية بمكان استخدام القالب لتوجيه زرع الورم ومراقبة نمو الورم عن كثب لضمان وضع الأورام بشكل صحيح وفي نطاق الحجم المثالي.
مجال آخر للانحراف المحتمل هو اختيار BCAM بحجم مناسب. يتم إنشاء BCAMs في تكاملات 2 جم ، بنطاق يتراوح من 18 إلى 26 جم. ومع ذلك ، نظرا لأن الفئران ذات تركيبات الجسم المختلفة (على سبيل المثال ، المزيد من العضلات مقابل المزيد من الدهون) قد يكون لها نفس وزن الجسم ولكن بأحجام جسدية مختلفة ، فمن المهم اختيار BCAM الأنسب أثناء استخدام وزن الجسم كمرجع عام. رفع المستوى أو خفضه عن طريق التجربة والخطأ ، ضع في اعتبارك أن المحاذاة الصحيحة أمر بالغ الأهمية. سيؤدي اختيار BCAM كبير جدا إلى "غرق" الأعضاء الداخلية للفأر بالقرب من قاع السرير ، مما سيؤثر بشكل خاص على دقة تحليل الأعضاء الظهرية مثل الكلى والعمود الفقري. في المقابل ، فإن وضع فأر في BCAM صغير جدا يمكن أن يضغط على تجاويف الجسم ، ويحرف وضع الأعضاء ، ويحتمل أن يسبب صعوبة في التنفس. سيساعد استخدام الشريط اللاصق لضمان تأمين الأطراف على منصات الكفوف في الإعداد وتحديد المواقع.
على الرغم من أن سير العمل المبلغ عنه يتيح تحليل صور PET القياسي والآلي ، إلا أنه من الجدير بالذكر أن OPM الحالي تم إنشاؤه بناء على سلالة الفئران C57BL / 6 ذات الكفاءة المناعية والفئران السليمة. قد تقدم السلالات والحالات الصحية الأخرى للفئران ميزات تشريحية مختلفة تتطلب تعديلا إضافيا وتحسينا والتحقق من صحة الخوارزمية. على سبيل المثال ، السلالات التي تعاني من نقص المناعة مثل NSG أو NCG لها طحال أصغر. وبالمثل ، قد يكون للفئران التي تحمل غرسات الورم تقويم العظام أحجام وأشكال ومواقع مختلفة للأعضاء الداخلية اعتمادا على حالة مرضها. هناك قيد آخر لسير العمل هذا وهو الإنتاجية الإجمالية أثناء مرحلة الاستحواذ على التجربة. هذا يرجع بشكل أساسي إلى الوقت الإضافي المطلوب لإعداد الماوس بشكل صحيح في BCAM. يمكن أن يزيد التدريب والممارسة من كفاءة المشغل في التنسيب المناسب. يمكن أن تؤدي إضافة محطة إرساء ثانية أيضا إلى زيادة الإنتاجية الإجمالية ، حيث يمكن أن يعمل أحد الرصيفات لإعداد BCAM ، ويمكن أن يعمل الآخر لإزالة الماوس إلى قفص الاسترداد. ومع ذلك ، حتى مع زيادة الوقت المطلوب لإعداد BCAM قبل المسح ، فإن الاستثمار في الوقت يؤتي ثماره من خلال توفير الوقت في نهاية تحليل البيانات. على سبيل المثال ، في الدراسة الحالية ، استغرق الأمر أقل من 10 دقائق حتى يقوم OPM بتحليل عشر صور (مع 4 عائد استثمار) ، بينما استغرق الأمر من 3 إلى 4 ساعات حتى يقوم المحلل ذو الخبرة العالية بتقسيم وتحليل نفس مجموعة الصور وعائد الاستثمار يدويا. سيتطلب المحلل عديم الخبرة مزيدا من الوقت للتحليل اليدوي. تسمح منصة SaaS بتحليل عمليات مسح التصوير المقطعي بالإصدار البوزيتروني على دفعات كبيرة ، حيث يمكن إكمال تحليل التوزيع الحيوي الكامل في الجسم الحي في غضون دقائق بعد تحميل البيانات. هذه ميزة مفيدة للغاية عند التعامل مع كميات كبيرة من البيانات من مجموعات متعددة و / أو عبر عدة نقاط زمنية ، كما هو موضح أدناه.
يمكن أن يستغرق التجزئة اليدوية للأعضاء لموضوع واحد وقتا طويلا ، وعادة ما يتطلب تدريبا مقدما كبيرا للمشغل. حتى مع التدريب الكافي ، تواجه التحليلات اليدوية حتما تقلبات بين المشغلين ، والتي يمكن أن تحرف النتائج الكمية15 ، 16. في المقابل ، يمكن للتجزئة الآلية وتحليل البيانات تحديد التوزيع الحيوي الكلي للتتبع الإشعاعي بدقة وكفاءة والقضاء على الاختلافات المتجذرة في العمليات البشرية. وقد شوهدت فوائد الأتمتة هذه في كل من تحليل الصور السريرية وفي الفضاء قبل السريري. على سبيل المثال ، Sluis et al. أظهر أن الفحص الفردي يتطلب 4 ساعات لتقسيم الأعضاء ذات الأهمية مقارنة ب 30 دقيقة بواسطة الطرق المستندة إلى السحابة من الذكاء الاصطناعي17. دراسة أخرى من Nazari et al. ذكرت أيضا أن التحليل القائم على الخوارزمية للكبد والكلى أظهر نتائج دقيقة في حدود 7.0٪ عند مقارنتها باثنين من علماء الفيزياء الطبية البشرية18. أظهرت البيانات الواردة في الشكل 4 أيضا بوضوح موثوقية سير عمل تحليل التصوير PET المستند إلى SaaS ، وأن التحليل الآلي أسفر عن نتائج متسقة عند مقارنتها بالتحليل اليدوي.
باختصار ، توضح هذه المقالة سير عمل استخدام قوالب BCAM لتسهيل الحصول على صور التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب قبل السريرية بالإضافة إلى التحليل الآلي لبيانات التصوير المقطعي بالإصدار البوزيتروني الذي يدعم SaaS. لقد ثبت أن تقنية النظام الأساسي هذه سهلة الاستخدام نسبيا ، وأن جودة البيانات التي تم إنشاؤها بواسطة الأتمتة تتوافق مع التحليل اليدوي ولكنها تتميز بمزايا كبيرة لتوفير الوقت. لذلك ، يمكن أن يوفر سير العمل هذا للباحثين مئات الساعات في وقت تحليل البيانات ويساعد في توحيد وتقليل التباين بين المشغلين. يمكن أن يساعد هذا الإجراء في تطوير العديد من مركبات الأدوية عبر الطرائق والمؤشرات. على وجه الخصوص ، يمكن تصنيف طرائق الجزيئات الكبيرة مثل الأجسام المضادة العلاجية ، وتفاعلات الخلايا المناعية ثنائية الأجسام المضادة ثنائية النوعية ، واقتران الأجسام المضادة والأدوية ، وحتى الجسيمات النانوية بسهولة بالمعادن المشعة (على سبيل المثال ، Zr-89 ، Cu-64) لتمكين تقييم التوزيع الحيوي بوساطة التصوير المقطعي بالإصدار البوزيتروني19،20. وبالمثل ، يمكن أن تساعد تقنية المنصة هذه في تحديد قياس جرعات العلاجات الراديوية الجديدة في الفئران21. سيكون تطبيق هذا الإجراء قيمة مضافة كبيرة لتطوير الأدوية.
Disclosures
جميع المؤلفين هم موظفون حاليون أو سابقون في شركة Pfizer، Inc.
Acknowledgements
شكر خاص لأبحاث الطب المقارن والموظفين الفنيين في شركة فايزر لا جولا.
Materials
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
References
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved